蟲草素對D-半乳糖與三氯化鋁聯合誘導阿爾茨海默病小鼠認知功能的改善作用及機制探討
彭達,趙爽,宋潤蔚,公元,韓冷,宗閏喆,王浩,田華,2,張繼國
1 山東第一醫科大學藥學院,山東泰安 271016;2 山東中醫藥大學藥學院,山東濟南 250355
阿爾茨海默病(AD)是一種以行為異常、漸進性認知功能障礙為主要臨床表現的中樞神經系統退行性疾病[1]。隨著社會人口老齡化加劇,AD發病率逐漸升高,嚴重威脅人類健康。但目前,臨床還未有有效的AD治療藥物,主要應用的化學合成藥物或多肽類化合物不僅價格昂貴,而且長期應用還具有明顯的不良反應。因此,人們越來越多地將注意力轉向天然化合物[2]。蟲草素,又稱3'-脫氧腺苷,是蛹蟲草核苷酸的衍生物,也是天然中藥材冬蟲夏草的活性成分之一,具有抗菌、抗炎、抗病毒、抗腫瘤和免疫調節等多種藥理活性[3]。近年研究發現,蟲草素可減輕東莨菪堿所致小鼠記憶障礙,可改善海馬CA1、CA3區腦缺血損傷,并可通過增強膽堿能神經系統功能、減少海馬神經元損傷、抑制小膠質細胞炎癥因子的產生,進而對神經退行性疾病產生一定的保護作用[4]。目前雖然已有研究發現蟲草素對AD具有一定改善作用[5],但對其確切的作用和機制仍未完全明了。本研究擬以D-半乳糖(D-gal)聯合三氯化鋁(AlCl3)誘導小鼠AD模型,通過Morris水迷宮檢測小鼠認知功能,觀察蟲草素對AD的改善作用,并從抗炎、抗氧化角度對其作用機制進行初步探討。
1 材料與方法
1.1 材料
1.1.1 實驗動物 3月齡雄性C57BL/6J小鼠54只,體質量20~25 g,均為SPF級,由濟南朋悅實驗動物繁育有限公司提供[SCXK(魯)20190003]。于SPF級實驗室進行飼養,室溫(22±1)℃,濕度45%~60%,光照周期為12 h/12 h(光照時間早8點至晚8點),自由飲食、水。實驗方案經山東第一醫科大學動物實驗倫理委員會批準[SYXK(魯)20190022]。
1.1.2 實驗試劑和儀器 蟲草素(CAS#73-03-0)購自上海源葉生物科技有限公司,鹽酸多奈哌齊購自江蘇豪森藥業集團有限公司,D-gal購自北京索萊寶科技有限公司,AlCl3購自天津市大茂化學試劑廠,以上試劑均用生理鹽水溶解配置成所需濃度;β-淀粉樣蛋白(Aβ)1-40(Aβ1-40)、Aβ1-42與IL-6試劑盒均購自上海酶聯生物科技有限公司;丙二醛(MDA)、過氧化氫酶(CAT)、過氧化物酶(POD)、超氧化物歧化酶(SOD)試劑盒購自南京建成生物工程研究所。儀器:Morris水 迷 宮(Top Scan,美 國);Infinite F200型Tecan Infinite酶標儀(TECAN,瑞士);UV1810S型紫外可見光分光光度計(上海佑科儀器儀表有限公司)。
1.2 實驗分組及給藥 將C57BL/6J小鼠隨機分為6組,分別為空白組、模型組、蟲草素高劑量組、蟲草素中劑量組、蟲草素低劑量組、多奈哌齊組,每組9只。除空白組給予等劑量溶劑外,其余各組腹腔注射D-gal 120 mg/kg同時灌胃給予AlCl3200 mg/kg誘導AD模型,給藥共9周。上述給藥4周后,蟲草素高、中、低劑量組分別灌胃40、20、10 mg/kg蟲草素;多奈哌齊組灌胃0.9 mg/kg鹽酸多奈哌齊;空白組和模型組灌胃等劑量溶劑,灌胃給藥5周。D-gal聯合AlCl3給藥的第9周,開始Morris水迷宮實驗(MWM),檢測小鼠的學習記憶功能。行為學結束,取小鼠腦組織,分離皮質和海馬,檢測相應指標。
1.3 小鼠學習記憶能力檢測 采用MWM實驗[6],包括定位航行實驗和空間探索實驗。定位航行實驗連續5 d,記錄小鼠的逃生潛伏期。60 s內小鼠尋找到平臺,記錄其實際找到平臺的潛伏期;大于60 s未找到平臺者,潛伏期以60 s計。第6天進行空間探索實驗,撤去逃生平臺,在平臺所在象限的對側象限放入小鼠,記錄小鼠在1 min內穿越原平臺所在區域的次數。用TOPSCAN軟件記錄并分析其行為學軌跡。
1.4 大腦皮質和海馬Aβ1-40、Aβ1-42和IL-6水平檢測 采用ELISA法。行為學結束后,處死各組小鼠,分離大腦皮質和海馬,加入生理鹽水分別制備皮質和海馬組織勻漿,4 ℃、2 500 r/min離心10 min,取上清,使用ELISA檢測試劑盒,按說明書步驟操作分別對大腦皮質和海馬內Aβ1-40、Aβ1-42和IL-6水平進行測定,于酶標儀450 nm處測定光密度值。
1.5 大腦皮質氧化指標檢測 取各組小鼠大腦皮質,按照說明書操作制備腦組織勻漿,離心、取上清,采用TBA法測定MDA水平,同時采用羥胺法、比色法和紫外法分別測定SOD、POD和CAT活力,具體步驟按照試劑盒說明書操作。
1.6 統計學方法 采用GraphPad Prism8.0統計軟件。計量資料以±s表示,組間比較采用單因素方差分析,兩兩比較采用Dunnett檢驗。P<0.05為差異有統計學意義。
2 結果
2.1 蟲草素對D-gal聯合AlCl3誘導AD小鼠學習記憶能力的影響 在定位航行實驗中,隨著實驗天數的增加,各組小鼠的逃生潛伏期縮短;從第2天起,與空白組相比,模型組逃生潛伏期延長(P均<0.05);而與模型組相比,蟲草素各劑量組和多奈哌齊組逃生潛伏期大都從第3天開始下降(P均<0.05);結果見表1。在空間探索實驗中,空白組、模型組、蟲草素高劑量組、蟲草素中劑量組、蟲草素低劑量組、多奈哌齊組平臺穿越次數分別為(2.26±0.25)、(0.94±0.20)、(0.89±0.38)、(1.88±0.45)、(2.00±0.33)、(1.62±0.18)次/分;與空白組相比,模型組平臺穿越次數減少(P<0.05);與模型組相比,蟲草素中、高劑量組和多奈哌齊組平臺穿越次數增加(P均<0.05)。
表1 各組小鼠定位航行實驗逃生潛伏期比較(s,±s)
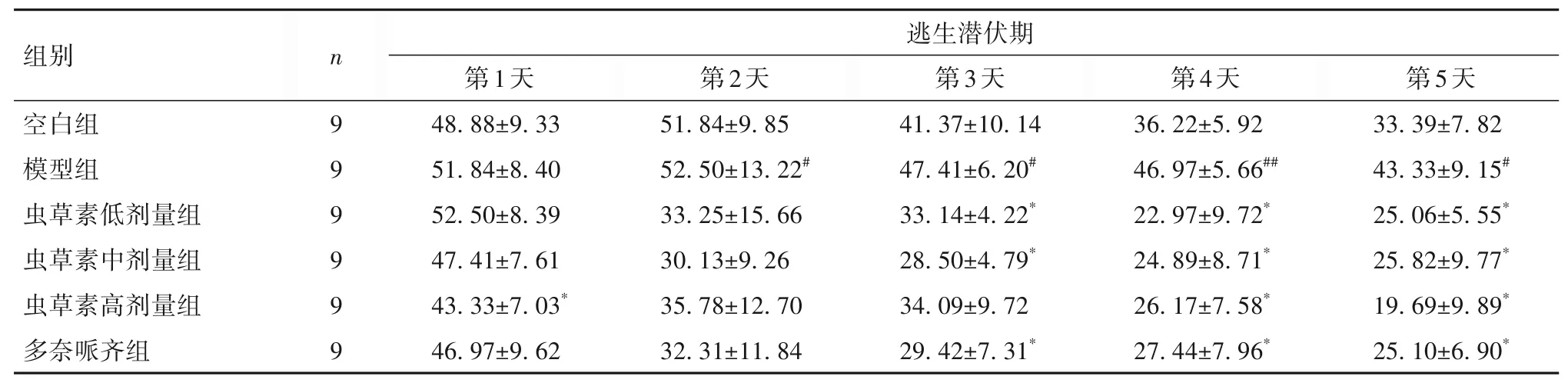
表1 各組小鼠定位航行實驗逃生潛伏期比較(s,±s)
注:與空白組相比,#P<0.05,##P<0.01;與模型組相比,*P<0.05。
?
2.2 蟲草素對D-gal聯合AlCl3誘導AD小鼠腦組織中Aβ1-40和Aβ1-42水平的影響 與空白組相比,模型組大腦皮質與海馬組織中Aβ1-40水平升高;與模型組相比,蟲草素低、高劑量組與多奈哌齊組海馬組織中Aβ1-40水平降低(P均<0.05),蟲草素中、高劑量組與多奈哌齊組大腦皮質中Aβ1-40水平降低(P均<0.05)。與空白組相比,模型組大腦皮質與海馬組織中Aβ1-42水平升高(P均<0.05);與模型組相比,蟲草素中、高劑量組與多奈哌齊組大腦皮質及海馬組織中Aβ1-42水平降低(P均<0.05)。見表2。
表2 各組小鼠腦組織中Aβ1-40和Aβ1-42水平比較(pg/mg protein,±s)
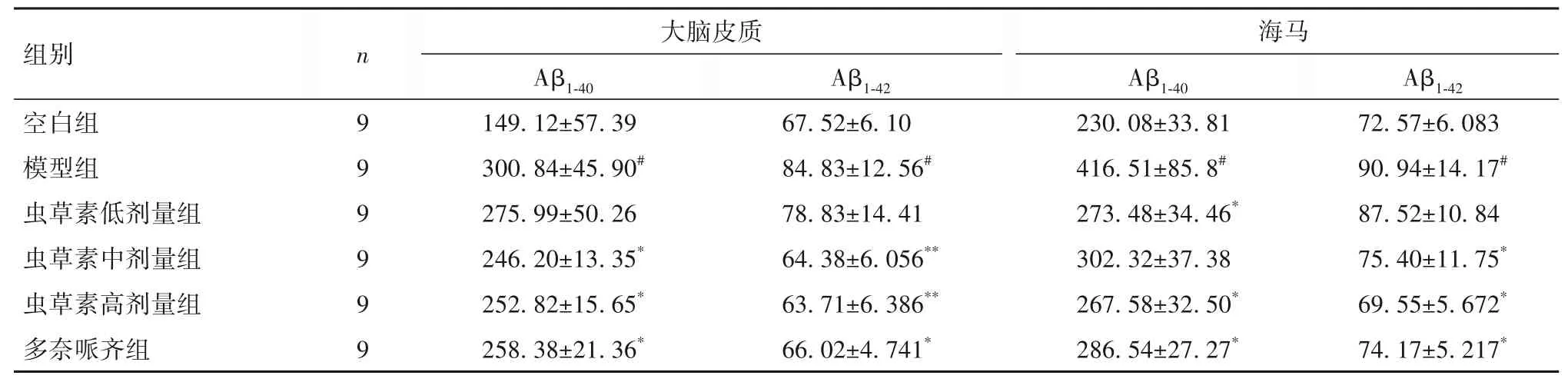
表2 各組小鼠腦組織中Aβ1-40和Aβ1-42水平比較(pg/mg protein,±s)
注:與空白組相比,#P<0.01;與模型組相比,*P<0.05,**P<0.01。
?
2.3 蟲草素對D-gal聯合AlCl3誘導AD小鼠腦組織中IL-6水平的影響 與空白組相比,模型組大腦皮質和海馬組織中IL-6水平升高(P均<0.05);與模型組相比,蟲草素中、高劑量組與多奈哌齊組大腦皮質和海馬組織中IL-6水平降低(P均<0.05)。見表3。
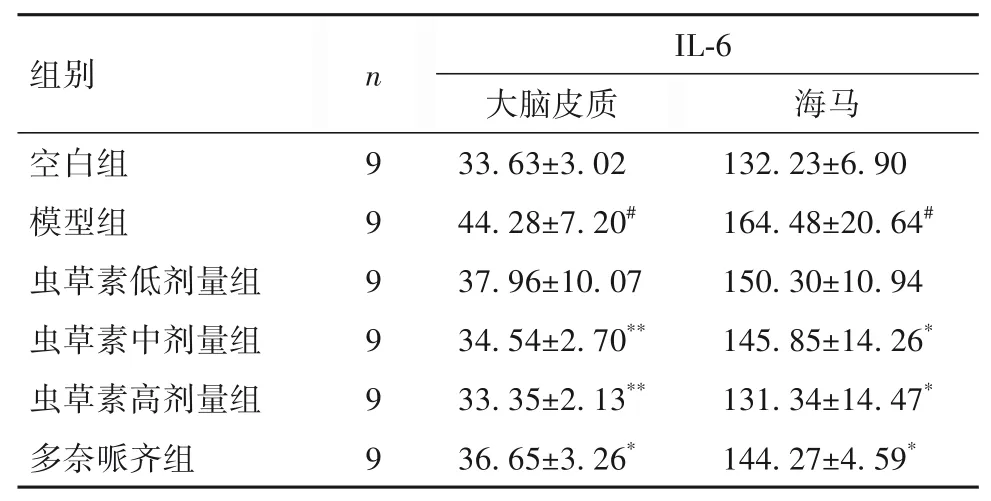
表3 各組小鼠腦組織中IL-6水平比較(pg/mg protein,-x±s)
2.4 蟲草素對D-gal聯合AlCl3誘導AD小鼠腦組織氧化應激的影響 與空白組相比,模型組MDA水平升高,SOD、POD和CAT水平降低(P均<0.05);與模型組相比,蟲草素高劑量組MDA水平降低,CAT活力升高(P均<0.05);與模型組相比,蟲草素中、低劑量組SOD、POD和CAT活力均升高(P均<0.05);與模型組相比,多奈哌齊組MDA水平降低,SOD、POD和CAT活力均升高(P均<0.05)。見表4。
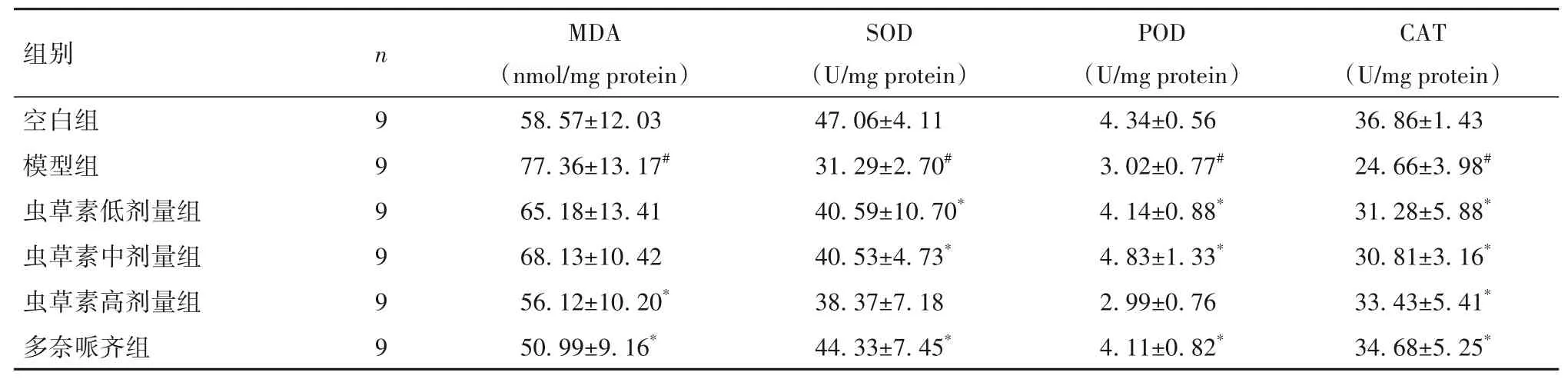
表4 各組小鼠腦組織氧化應激指標比較(-x±s)
3 討論
蟲草素具有顯著的抗氧化和抗炎作用,可以改善腎缺血再灌注損傷、對抗脂多糖誘導的肺損傷等[7]。近年有研究報道,蟲草素通過抗氧化、抗炎也具有神經保護作用[8]。蟲草素(24 mg/kg)能明顯改善糖尿病小鼠的認知功能,并減輕腦組織的氧化應激損傷[9]。D-gal具有神經毒性,在腦組織中大量聚積,能使細胞滲透壓升高,細胞內活性氧增多,腦功能退化,誘導亞急性衰老模型[10]。鋁是天然存在的有毒微量元素,慢性長期給予AlCl3可致機體腦內乙酰膽堿酯酶活性增加,誘導氧化損傷,導致認知功能障礙[11]。AlCl3和D-gal聯用能明顯增強兩者的神經毒性,為國內外廣泛認可的、良好的AD模型誘導方法[12]。本研究以此方法誘導小鼠AD模型,探討蟲草素在AD中的確切作用和機制。本研究發現,9周后,模型組小鼠的認知功能下降,AD造模成功。給予與文獻相似劑量的蟲草素[9]干預的小鼠認知功能明顯改善,從而確認了蟲草素對AlCl3聯合D-gal誘導AD的保護作用。Aβ沉積形成的老年斑是AD的特征性病理學改變之一。“β淀粉樣假說”認為,Aβ沉積是AD發病的主要因素[13]。D-gal和AlCl3聯用可使小鼠體內β-分泌酶(BACE)和γ-分泌酶水平升高,兩種酶可作用于APP產生Aβ,而Aβ可以與乙醇脫氫酶反應產生活性氧,使線粒體功能異常,活性氧可通過激活各種信號通路,進一步使APP代謝異常,導致Aβ異常產生和積累[14]。雖然已有實驗證實,蟲草素可減輕Aβ或Aβ聯合D-gal誘導的神經損傷[5,15],但對蟲草素是否調控Aβ的水平還未見報道。本實驗中,模型組Aβ1-40與Aβ1-42水平較空白組高,表明二者聯用誘導了Aβ在小鼠腦組織中的異常累積。應用蟲草素后,部分Aβ1-40與Aβ1-42水平下降,說明蟲草素可能不僅能減輕Aβ誘導的神經毒性,也可調控其表達,但具體的機制還有待進一步研究。
神經炎性反應被認為是AD發病的重要因素之一,炎癥因子還可誘導氧化應激,促進神經元損傷,從而加速AD病情進展[16]。D-gal和AlCl3聯用可通過異常累積的Aβ激活神經小膠質細胞,釋放大量炎癥因子,包括IL-1、TNF-α、IL-6、補體等,促進AD腦內的炎癥反應。其中IL-6參與了AD患者腦內老年斑的形成,在AD發病過程中發揮重要作用[17]。本研究發現,模型組小鼠大腦皮層和海馬中的IL-6炎癥因子水平升高,蟲草素中、高劑量組IL-6水平降低,說明蟲草素的抗AD作用可能與其抗炎、降低IL-6水平有關。
眾所周知,氧化應激能增強Aβ介導的神經毒性,促進AD發生[18-19]。本研究結果顯示,D-gal和AlCl3聯合處理可誘導小鼠氧化應激,明顯升高氧化損傷產物——MDA水平,而抗氧化標志物——SOD、CAT和POD活力下降,這與文獻[20]結果一致。給予蟲草素處理后,氧化應激生物標志物的不平衡則被逆轉,小鼠大腦皮質中的MAD水平降低,SOD、CAT、POD水平均有不同程度升高。表明蟲草素可降低D-gal聯合AlCl3誘導AD小鼠的氧化應激損傷,從而發揮神經保護、改善AD的作用。
多奈哌齊是第二代膽堿酯酶抑制劑,是目前臨床應用的AD治療藥物,因此本實驗選用該藥物作為陽性對照。結果顯示,蟲草素與多奈哌齊具有相似的改善AD小鼠認知的作用。多奈哌齊通過提高患者腦組織中乙酰膽堿的水平、減輕Aβ的神經毒性、抗氧化和抗炎等多種機制發揮對神經元的保護作用[21]。本研究結果顯示,蟲草素在降低Aβ水平、抗氧化、抗炎方面與多奈哌齊相似。這進一步證實了蟲草素良好的改善AD的作用。但本實驗中一些指標未呈現明顯的劑量依賴關系,這可能與本實驗所應用的蟲草素劑量跨度偏小、不同劑量發揮的作用可能存在差異有關,具體的機制還有待進一步研究。
綜上,蟲草素能改善D-gal聯合AlCl3誘導AD小鼠的認知功能,其機制可能與抗炎、抗氧化、降低Aβ水平有關。可見,蟲草素具有潛在的抗AD作用,具有良好的藥用開發前景。
利益聲明所有作者聲明不存在利益沖突
作者貢獻聲明彭達,趙爽:實驗設計及實施,論文撰寫;宋潤蔚,公元,韓冷,宗閏喆:參與實驗實施;張繼國,田華:指導實驗設計;王浩:指導論文的撰寫

