銅渣復合硅錳水淬渣后的改質提鐵研究
鄭 彬,蔣 亮,韓鳳蘭,馬鴻儒,祁志宏,蘇 輝
(1.北方民族大學材料科學與工程學院,寧夏銀川 750021;2.北方民族大學機電工程學院,寧夏銀川 750021)
截止2021年12月,中國銅材和鐵合金累計產量分別達到了 2.123 5 Mt和 34.755 Mt[1]。隨著 1 t精銅和1 t硅錳鐵合金的產出,會產生約2.2 t銅渣、1.2 t硅錳渣[2-3]。目前銅渣和硅錳渣等冶金渣存量大,卻缺乏有效的循環利用手段,綜合利用率不足30%[4]。冶金渣的長期堆存不僅大量占用土地資源,而且其中的重金屬元素隨雨水滲入土壤后會對環境造成進一步污染。銅渣不僅含金、銀等貴金屬[5],而且還包括銅、鋅等有價金屬,其中鐵的質量分數更是在40%以上,遠高于一般的鐵礦石品位[6],Fe2SiO4是銅渣中的富鐵相,不僅粒度微細且與其他礦物相嵌布錯雜而難于回收[7]。硅錳水淬渣中硅酸鹽含量豐富,具有相對較高的堿度,合理回收利用后能被添加到建筑材料中使用。
國內外學者對銅渣和硅錳渣的循環利用進行了一系列研究:CHOI等[8]以83%的硅錳渣和17%的硅酸鹽水泥為原料合成了托貝莫來石板,但因成本過高,故不適合大規模生產;PAN等[9]用硅錳渣制備出了高強度的微晶玻璃,缺點是在生產過程中能耗偏高;SEMYKINA等[10]用氧化焙燒磁選法對銅渣進行改質,獲得了鐵品位更高的精礦。當前,銅渣和硅錳渣的利用方式多為傳統模式,如回收有價金屬[11]、代替砂石[12]、制備水泥[13]和其他建筑材料[14]等,其他方向還不多見[4,13]。氧化焙燒磁選法和直接焙燒還原法常被用于回收銅渣中的有價金屬鐵,兩種方法均可獲得高品位的鐵精礦,但是反應過程需利用“C、CO2、CO、H2”等營造弱氧氛圍,這不僅增加了溫室氣體的排放,還因CO有毒、H2易燃易爆等氣體安全使用問題而使實驗過程變得復雜繁瑣[12]。將銅渣和硅錳渣破碎后制備砂石、水泥和建筑材料時,渣料中的重金屬元素會因為周圍環境的改變而被釋放出來導致環境污染[15],另外銅渣和硅錳渣只能作為摻合料部分代替建材使用而使得經濟效益提升有限[8]。
為有效回收銅渣中的鐵,本文按以廢治廢的思路并結合Fe2SiO4的焙燒氧化原理,將工業銅渣與硅錳水淬渣混合后按一定比例添加CaO及MnO進行改質處理,改質在有效回收銅渣中鐵元素的同時,還能最大化利用硅錳水淬渣中富集的錳、鎂元素。在改質過程中,硅錳水淬渣中含量較高的硅鈣組分可以為目標相(尖晶石相和硅酸鹽相)的形成提供堿性環境,此外添加一定比例的CaO對堿度進行調整,其原因是CaO可以將銅渣中的Fe2SiO4離解成FeO和Ca2SiO4,被置換出來的FeO進一步氧化成Fe3O4和Fe2O3。在此基礎上提高MnO的含量,促使Fe2O3更好地同錳、鎂反應轉變成強磁性(Mg,Mn,Fe)Fe2O4尖晶石相[16],同時樣品中的其余元素在焙燒過程中固溶到了硅酸鹽相中。尖晶石相可通過磁選工藝分離,磁選后的尾渣中存在較多的Ca2SiO4可用在膠凝材料和混凝土中[17],解決了二次尾渣的利用問題[12]。相比在氧化焙燒磁選法中出現的因焙燒的溫度、時間難于掌控以及過度氧化等原因造成一部分Fe3O4轉變成Fe2O3導致回收率下降的問題[6,18],本文則致力于利用Fe2O3同硅錳水淬渣中富集的錳、鎂反應生成(Mg,Mn,Fe)Fe2O4尖晶石相,尖晶石相的出現既提升了樣品的易磨性又提高了鐵回收率[19]。與直接焙燒還原法需要在弱氧氛圍中反應相比[20],改質在空氣中焙燒,不僅有效降低了溫室氣體的排放,而且操作簡單易實現。
1 實驗原料和實驗裝置
1.1 實驗原料
實驗中使用的銅渣及硅錳水淬渣分別由煙臺恒邦集團有限公司和寧夏寶利源特種合金有限公司提供,經密封式制樣粉碎機(GJ100-4)粉磨用在本次實驗中。采用激光粒度分布儀(Bettersize2000)測得銅渣及硅錳水淬渣的D50分別為0.686 μm和20.17 μm,相較于銅渣,硅錳水淬渣的區間粒徑分布較寬,粒度分布見圖1。
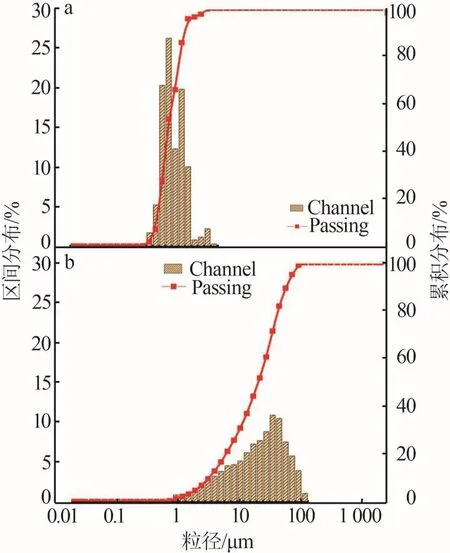
圖1 粒度分布圖Fig.1 Particle size distribution
銅渣及硅錳水淬渣經全分析和電感耦合等離子發射光譜儀(ICP-7000)測試獲得的化學成分見表1。由GB/T 203—2008《用于水泥中的粒化高爐礦渣》質量系數公式得出,硅錳水淬渣堿度為0.89、銅渣為0.6,兩種渣料均為酸性合金渣。銅渣中的硅鐵總量占比高達78%,若將銅渣直接投入高爐煉鐵會引發焦比升高、爐況不順等問題。硅錳水淬渣中的硅鈣含量豐富、鐵含量較低,可摻入水泥中使用。
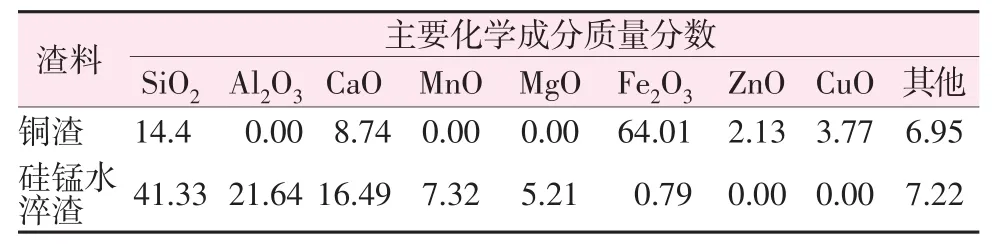
表1 實驗用渣料化學成分Table 1 Chemical compositions of slag for experiments %
銅渣和硅錳水淬渣的X射線衍射結果如圖2所示。從圖2a看出,銅渣的礦物相以富鐵相為主,其中部分弱磁性含鐵礦物相較多,卻難以磁選分離。從圖2b看出,硅錳水淬渣的礦物相以包峰為主,其原因是水淬渣為高溫爐渣浸入冷卻池后經急冷產生,結晶度差,此外含有部分晶相,如:CaMnSi2O6、SiO2等。Mn離子的存在對于硅錳渣用作混凝土摻合料而言嚴重影響其水化反應,既限制了混凝土強度的提升[21],也浪費了硅錳渣中富集的錳。
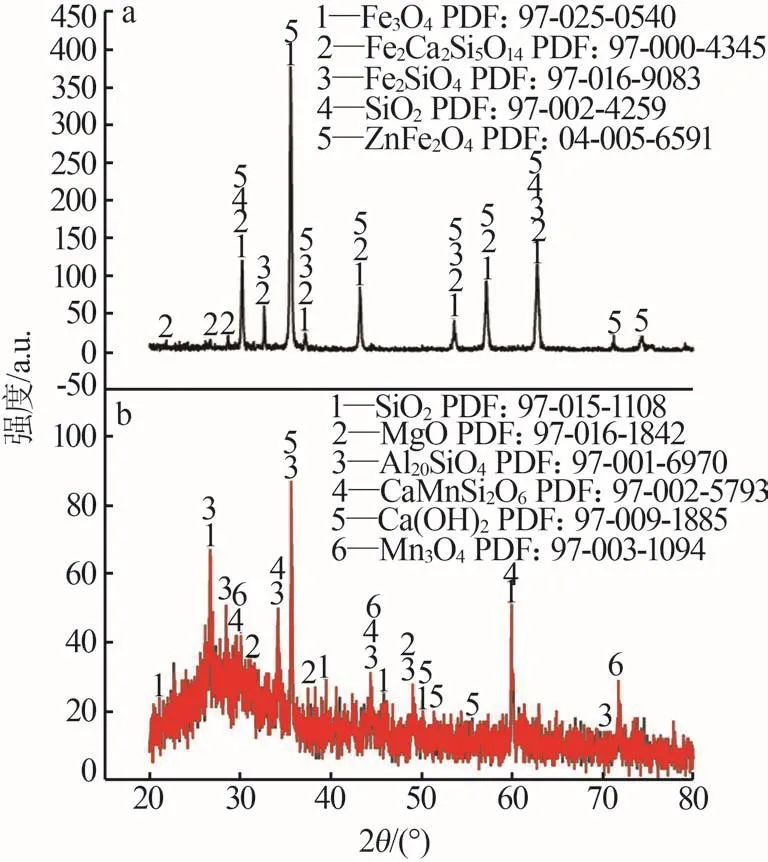
圖2 X射線衍射譜圖Fig.2 X-ray diffraction
實驗中使用了 CaO(AR,98%)和 MnO(AR,99%)以及純度為95%的氧化鎂坩堝。
1.2 熱力學計算
采用FactSage7.1中的Equlip模塊計算改質后的樣品在不同溫度下的熱力學平衡狀態[22-23],依據礦物相隨化學組分變化的規律設計配比。計算發現:當MnO質量分數增加到8%,CaO質量分數增加到19%、22%、25%后,尖晶石相變化明顯。工業銅渣復合硅錳水淬渣改質的配比方案如表2所示。Fact?Sage參數設置:溫度為1 000~1 500 ℃;氧分壓p(O2)=0.21×105Pa;環境總壓力為 1.01×105Pa;數據庫為FactPS、FToxid。
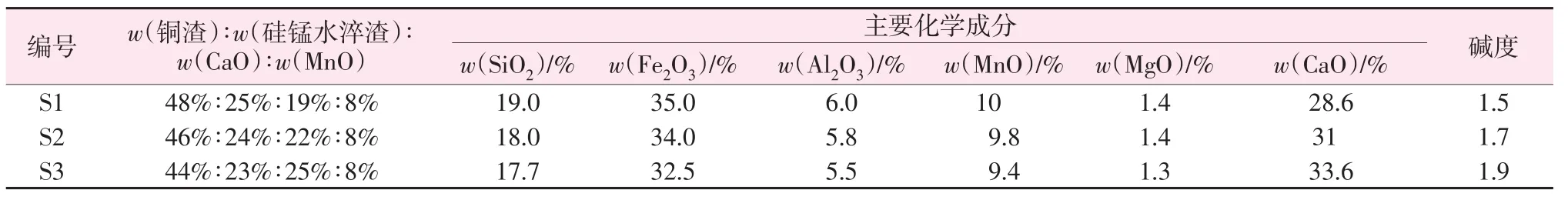
表2 工業銅渣復合硅錳水淬渣改質的配比Table 2 Proportion of industrial copper slag compounded with silicon?manganese water quenching slag
1.3 改質工藝
稱取20 g原料置于球磨罐內,按球料質量比為2.5∶1添加研磨珠,加入無水乙醇(AR,99%)至罐體3/4處。行星式球磨機(QM-3SP04)以200 r/min的轉速混料12 h,混料結束后烘干、研磨至粒徑<75 μm。將原料置于φ20 mm鋼制模具中,成型機以190 MPa保壓30 s后制成圓柱狀試樣。將圓柱狀試樣置于氧化鎂坩堝后放入馬弗爐(KSL-1700X)內在空氣環境下焙燒,首先以10 ℃/min的速率升溫至1 400 ℃后保溫60 min,保溫階段結束后以1 ℃/min的速率降溫至1 170 ℃后立即出爐水冷。
1.4 物相分析
將改質后的樣品制備成巖相光片試樣,試樣經預磨、拋光、噴金,通過熱場發射掃描電子顯微鏡(SIGMA 500)觀察組織形貌,同時采用EDS測定微區元素及含量。將改質后的樣品用密封式制樣粉碎機粉磨1 min,采用X射線衍射儀(XRD-6000)進行礦物相分析。X射線衍射儀參數設定:Cu靶,衍射角度為20~80°,步進掃描,步進角度為0.02°。
1.5 磁選工藝
磁選分離是廣泛應用的從銅渣中回收鐵的有效方法,樣品經破碎、磁選可分別獲得高品位精礦和用作建筑材料的尾渣[24]。采用濕式磁選管(XCGS-50)將樣品在225 mT的磁場強度下磁選10 min,磁選后分別稱量精礦和尾渣的質量并計算磁選率。采用DZG 20.01—1991《巖石礦物分析》重鉻酸鉀滴定法分析全鐵含量并計算回收率。
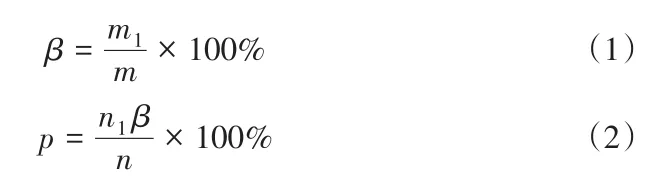
式中:β為磁選率;m1為精礦質量;m為原礦質量;p為回收率;n1為精礦中的全鐵含量;n為原礦中的全鐵含量。
2 結果與討論
2.1 熱力學分析
采用FactSage對原料中礦物相隨溫度的變化趨勢進行熱力學計算,結果見圖3。由圖3可見,改質后樣品的高溫相均以尖晶石相(Fe3O4、MnFe2O4)和硅酸鹽相(β-Ca2SiO4)為主,其中高溫相的組成隨堿度變化各有不同。溫度低于1 050 ℃時,相比于S1中殘留的Fe2O3而言S2和S3中Fe2O3的利用比較充分,其原因是S2和S3中CaO的含量高于S1,這就使得一部分Fe2O3與CaO反應形成了Ca2Fe2O5,少量Ca2Fe2O5的存在解決了尾渣中若存在游離態CaO其在用作混凝土摻合料時易發生體積不穩定性的隱患[25]。S3相較于S1和S2,尖晶石相的質量分數最低,其原因是堿度增加后反應物中原子的擴散能力下降,這使得尖晶石相的生成和長大變得困難,此外堿度增加后同一溫度區間的液相量減少,晶粒遷移、聚集和長大的條件惡化,最終導致尖晶石相的晶粒變得細小[14]。S2和S3中β-Ca2SiO4的質量分數遠高于S1,其原因是堿度增加后改質樣品中的硅酸鹽與CaO結合生成了硅酸鈣且SiO2和CaO之間的親和性遠遠高于同FeO之間的親和性,CaO從Fe2SiO4中置換FeO生成Ca2SiO4的反應是一個可以自發進行的放熱反應[22,26]。
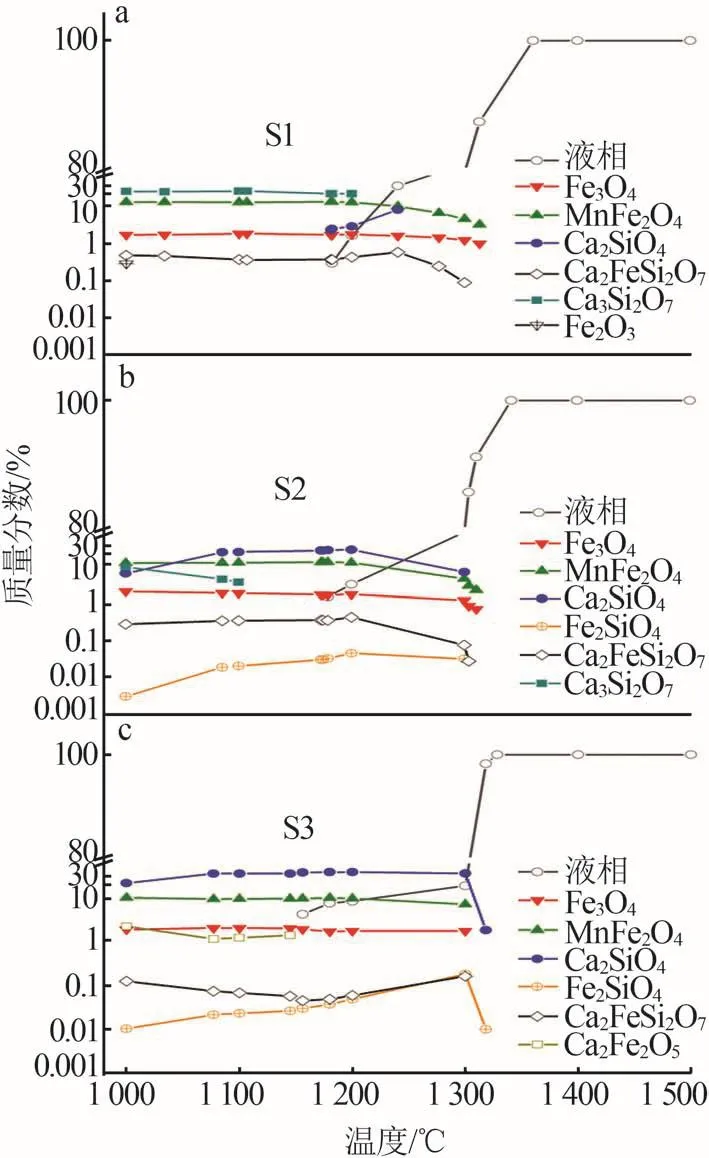
圖3 不同堿度下混合渣料礦物相隨溫度的變化Fig.3 Variation of mineral phase of mixed residue with temperature at different alkalinity
2.2 物相分析
改質后樣品的礦物相變化如圖4所示。由圖4可見,改質后樣品的礦物相均以尖晶石相和硅酸鹽相為主,S1~S3的礦物相組成隨堿度變化略有不同。在晶面(220)(311)(222)(400)(422)(511)(440)處均可見Fe3O4和MnFe2O4的衍射峰,隨著堿度上升,Fe3O4和MnFe2O4的衍射峰不斷減弱,Ca2SiO4的衍射峰不斷增強,其原因是增加CaO后Ca2SiO4變多使得黏度也隨之升高,黏度升高給Mn2+/Fe2+越過界面反應生成尖晶石相提高了難度[27]。S3和S2與S1相比,Ca2SiO4衍射峰強度較高而Fe3O4和MnFe2O4衍射峰強度較低,其原因是CaO在改質過程中起到了促進和抑制兩種不同的作用,CaO可以破壞Fe2SiO4的晶體結構,進而起到促進FeO釋放和Ca2SiO4形成的作用,但CaO增多后易與SiO2反應生成高熔點的2CaO·SiO2,2CaO·SiO2的出現提高了改質后樣品的固相率,固相率變大給晶粒的聚集與長大帶來了不良影響[28]。實驗結果與FactSage理論計算相互對應的是僅在S3中出現了少量的Ca2Fe2O5,因其具有弱磁性故可以通過磁選工藝分離。CaO的選擇必須適當,既可以起到促進Fe2SiO4離解的需要,又不能影響粒子在液相中的遷移效果。
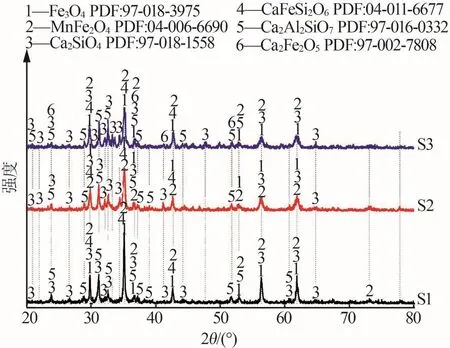
圖4 改質后樣品X射線衍射譜圖Fig.4 X-ray diffraction of modified samples
2.3 組織形貌分析
改質后樣品的微觀形貌如圖5所示,主要特征相的EDS分析結果見表3。結合XRD和SEM/EDS綜合分析,a和b的礦物相以尖晶石相為主,而c中尖晶石相分布較少、硅酸鹽相分布較多。圖5中的尖晶石相(Spinel)是以MnFe2O4為主并摻雜其他成分如 FeAl2O4、MgFe2O4等的固溶體。MnFe2O4除由Mn2O3和Fe2O3反應生成外,還因Mn2+和Fe2+的離子半徑非常接近,當溫度超過1 000 ℃以后,Mn2+以固態擴散的方式進入Fe3O4晶格中替換掉部分Fe2+,形成置換固溶體。SEM中呈現出的礦物相分布情況與X射線衍射結果吻合,即堿度變大后Ca2SiO4開始增多但尖晶石相減少,其原因是CaO焙燒后可以分解為Ca2+和O2-,O2-在將混合渣料中復雜的硅酸鹽相離解為簡單的SiO44-的同時釋放出了 Fe2+[29],這使得熔渣黏度降低從而有利于尖晶石相的生成和長大,被置換出來的FeO進一步氧化成Fe3O4和Fe2O3,Fe2O3同錳、鎂反應后生成了(Mg,Mn,Fe)Fe2O4尖晶石相,但隨著2Ca2++SiO44-=Ca2SiO4反應的進行,Ca2SiO4對CaO的表層形成包裹,阻礙了CaO=Ca2++O2-的反應,O2-濃度降低導致Fe2SiO4的離解受限,造成尖晶石相的含量減少[30]。

圖5 不同堿度下樣品的顯微組織形貌Fig.5 Microstructure and morphology of samples at different alkalinity
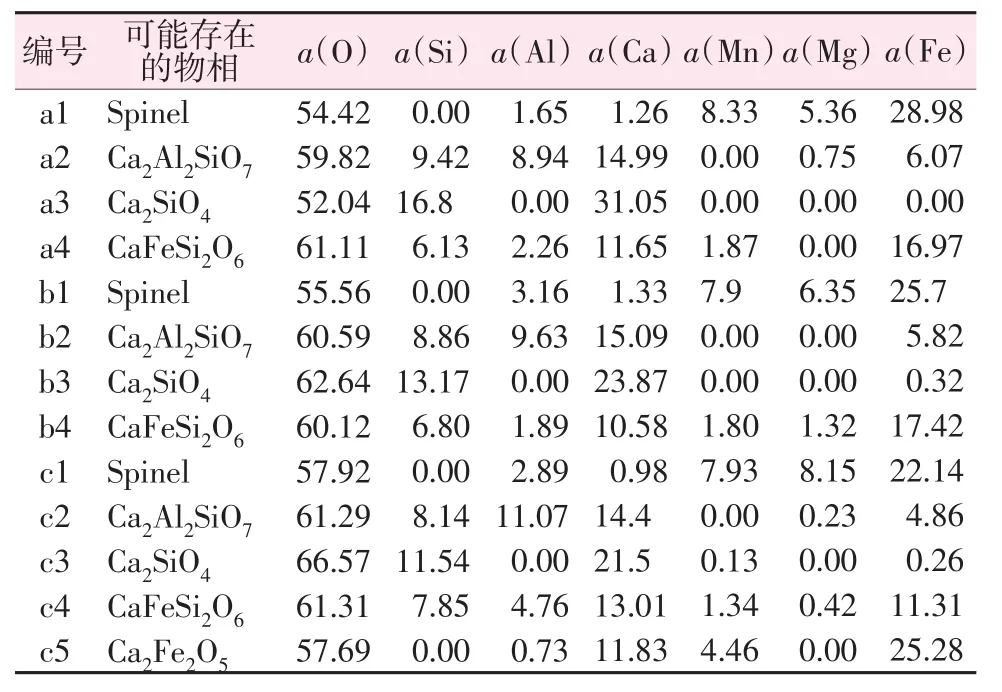
表3 圖5中主要特征相的EDS分析結果Table 3 EDS of main characteristic phases in Fig.5 %
3 反應機理
通過推理在改質過程中發生的化學反應,可以詮釋礦物相的形成轉變機理[31]。在改質過程中MnO與Fe2O3反應生成了MnFe2O4,如式(3):
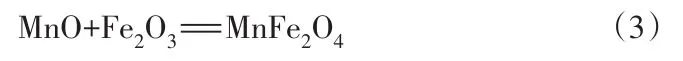
MnO隨溫度升高后轉變成了MnO2、Mn2O3及Mn3O4,新出現的 MnO2、Mn2O3和 Mn3O4在與 Fe2O3反應生成 MnFe2O4的同時釋放出了 O2,如式(4)(5)(6):
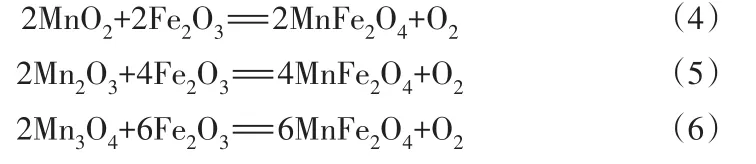
式(4)(5)(6)所釋放出的O2為Fe2O3的形成提供了有利的條件[6]。
由X射線衍射結果中Fe2SiO4的衍射峰完全消失可知,1 400 ℃保溫60 min后Fe2SiO4已經完全分解為FeO和Ca2SiO4,新出現的 FeO在高溫下進一步轉變成了 Fe2O3[32],Fe2O3與改質后樣品中的堿性氧化物發生反應形成Ca2Fe2O5,如式(7):
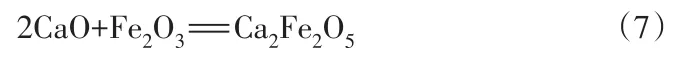
式(7)理論上可以發生,但實際中出現的概率很低,其原因是其熱力學趨勢遠小于式(8),即使溫度升高也會因式(5)的競爭使得Ca2Fe2O5很難存在,此結論佐證了僅在S3的X射線衍射結果中出現了Ca2Fe2O5衍射峰的原因。
溫度低于1 000 ℃時,改質后樣品中的堿性氧化物與SiO44-反應形成了Ca2SiO4,如式(8):
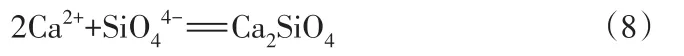
依據FeO-SiO2-CaO三元相圖[33],CaO質量分數超過30%后2CaO·SiO2會大量出現,2CaO·SiO2因自身熔點較高導致熔渣黏度偏高造成反應動力學條件變差,分子活動速率減慢后尖晶石相的含量減少[20],此結論指出了尖晶石相衍射峰強度隨堿度增加而下降的原因。
在焙燒過程中,CaO與Fe2SiO4中的SiO2反應后生成了CaSiO3,提高了FeO的活度使得Fe2+濃度變大[34],隨后FeO進一步轉變成了Fe3O4,如式(9):

適當增加CaO的含量可以提高Fe3O4的轉化效果[32],其原因是CaO與SiO2反應生成了穩定的硅酸鈣,使得FeO不再與SiO2反應形成Fe2SiO4而是轉化成了 Fe3O4[35],但過量的 CaO 與 Fe、Si反應形成了CaFeSi2O6[29],這就給出了 X 射線衍射結果中出現CaFeSi2O6衍射峰和EDS中出現CaFeSi2O6相的原因,此外CaO過量還會造成熔化性變差、液相量減少,不利于Fe3O4的長大與粗化,這也是導致SEM中尖晶石相細化的原因。
圖6是改質過程中吉布斯自由能隨溫度變化的曲線圖,式(3)(4)(5)(6)(7)(8)熱力學趨勢較好,而式(9)隨溫度升高后熱力學穩定性逐漸下降。根據熱力學平衡態圖和吉布斯自由能隨溫度變化圖,在1 200 ℃水冷既能保留高溫時的平衡相,又可以將Fe2SiO4等有害物控制在一定范圍內。

圖6 吉布斯自由能隨溫度變化曲線Fig.6 Gibbs free energy variation curves with temperature
綜上所述,改質具備了生成MnFe2O4的熱力學條件,然而只有當晶粒尺寸足夠大時,才會有利于后續磁選工作的進行。MnFe2O4長大是通過Fe3+和Mn3+擴散進行的,該進程可通過菲克第一定律進行描述[36],如式(10)。

式中:JA為擴散通量;D為擴散系數;D可通過斯托克斯-愛因斯坦方程計算,如式(11)。

式中:KB為玻爾茲曼常數;T為反應的熱力學溫度;r為離子半徑;η為黏度。
根據熔渣離子結構理論,CaO可以置換出基體相中與硅氧復合陰離子相結合的Fe2+,原渣中Fe3O4含量少成核速度小,Fe2+濃度變大后Fe3O4含量也隨之增加,異相形核能力增強,形核速率增加[37]。晶核形成以后,溫度、黏度和過冷度決定了晶體的生長速率[25],黏度增加會阻礙原子的擴散和分子結構的重排,延緩結晶的發生[38]。改質渣的黏度隨溫度的變化見表4。在改質過程中,黏度隨CaO增加變大,粒子的擴散速度減慢。此外JA也可以表征反應物的擴散能力[39],結合式(11)可知η與D成反比例關系,CaO的增加導致了JA減小,反應物的擴散能力下降使得尖晶石相長大變得困難,此結論給出了低堿度有利于尖晶石相生成但不利于硅酸鹽相形成的原因。
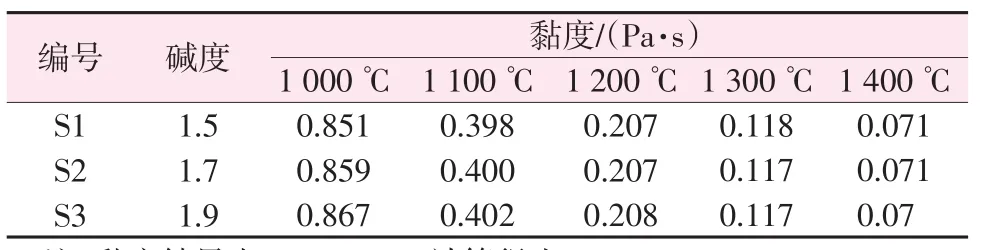
表4 改質渣的黏度隨溫度變化Table 4 Viscosity of modified slag varies with temperature
4 磁選工藝
磁選結果如圖7所示。由圖7可見,堿度增加后,鐵回收率由95%下降到87%,鐵品位由44%下降到39%(質量分數)。由于鐵回收率和鐵品位均隨堿度的增加出現了不同程度的下降,因此S1具有較好的綜合改質效果。
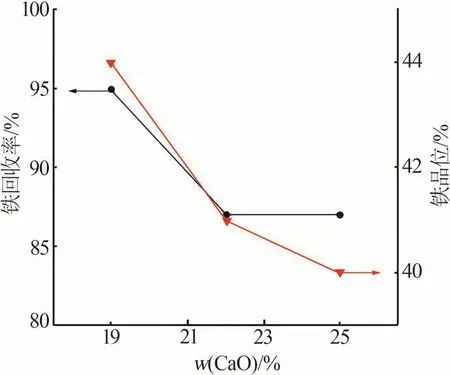
圖7 不同堿度改質渣的磁選結果Fig.7 Magnetic separation results of modified slag at different alkalinity
磁選后精礦和尾渣的X射線衍射譜圖如圖8所示。由圖8看出:磁選出的精礦以強磁性(Fe3O4/MnFe2O4)為主,可用于回爐冶煉;磁選后剩余的尾渣是以Ca2SiO4為主的硅酸鹽相,其水化性好,可用作建筑材料[17]。
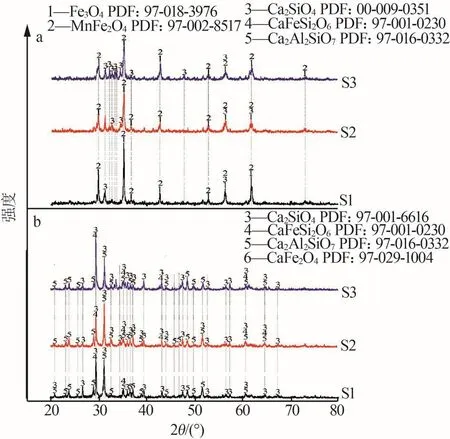
圖8 磁選后X射線衍射譜圖Fig.8 X-ray diffraction after magnetic separation
5 結論
1)將工業銅渣與硅錳水淬渣混合后按一定比例添加CaO及MnO進行成分改質,改質實現了對兩種渣料的綜合利用,CaO從Fe2SiO4中置換出來的FeO氧化成Fe2O3后同錳、鎂反應生成了(Mg,Mn,Fe)Fe2O4尖晶石相,同時改質樣品中的其余元素在焙燒過程中固溶到了硅酸鹽相中。2)在實驗范圍內,低堿度有利于尖晶石相的生成但不利于硅酸鹽相的形成。3)鐵回收率計算結果表明,混合渣料的堿度為1.5時改質最好,其鐵品位為44%(質量分數)、回收率為95%。

