機械活化法強化鋰輝石礦相重構過程研究
祝 悅,裘晟波,劉程琳,2,于建國,2
(1.華東理工大學國家鹽湖資源綜合利用工程技術研究中心,上海 200237;2.華東理工大學鉀鋰戰略資源國際聯合實驗室,上海 200237)
鋰輝石制備鋰鹽的工藝可分為兩大類:一類需要先將α-鋰輝石在1 000~1 100 ℃轉型焙燒轉化為β-鋰輝石,再進行后續鋰的分離與提純工藝,如硫酸法[1]、氯化焙燒法[2]、壓煮法[3]、堿焙燒法[4]等;另一類則直接利用α-鋰輝石與化學試劑反應提鋰,如氟化銨法[5]、混合酸法[6]、氫氧化鈉法[7-8]等。第一類方法中的硫酸法,是目前工業上普遍使用的方法,但仍存在焙燒溫度高、酸性氣體排放等問題;第二類的工藝流程雖然少了轉型焙燒的工序,但也存在渣量大、含鋰母液成分復雜不易分離、工業化應用困難等問題。
QIU等[9-10]最新提出了一種鋰輝石礦相低溫重構-直接浸出技術,該技術在250 ℃將鋰輝石礦相重構為一種易與酸反應的中間產物偏硅酸鋰(Li2SiO3),偏硅酸鋰再經低溫酸解獲得雜質較少且鋰濃度較高的浸出液,并用于制備碳酸鋰,工藝路線如圖1所示。鋰輝石與NaOH反應生成Li2SiO3的主要反應如方程式(1)所示。但該浸出過程所需時間較長,限制了該技術的工業化應用。
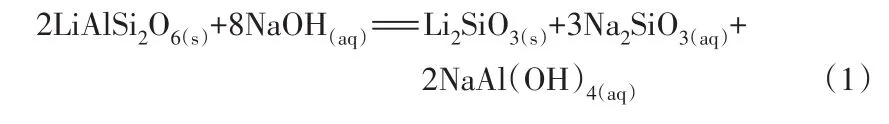
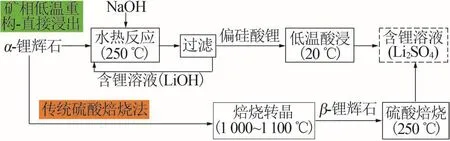
圖1 硫酸焙燒法與礦相低溫重構-直接浸出法的對比Fig.1 Comparison of sulfuric acid roasting method with low?temperature reconstruction of mineral phase?direct leaching method
機械力可以使礦物發生破碎或變形而產生晶格缺陷,由此激活礦物的化學活性,使通常在高溫下才能發生的反應可在較低溫度下進行。BERGER等[11]機械活化處理β-鋰輝石后,加入氧化鈣進行浸出,其浸出溫度由原來的190~200 ℃降低至95 ℃,且鋰浸出率超過90%。VIECELI等[12]先采用機械活化處理鋰云母,后將其與硫酸在165 ℃焙燒4 h,再用水浸出,得到的鋰浸出率超過85%,顯著降低了鋰云母的焙燒分解溫度。還有研究者探究了礦物反應浸出與機械活化同時進行的技術。李洪桂等[13-14]采用邊磨邊浸的活化方式強化黑鎢礦的堿浸過程,取得了良好的效果,并成功進行了工業生產實踐。李運姣等[15]對一水硬鋁石型鋁土礦采用邊磨邊浸的活化方式,發現相同條件下的浸出率比未活化礦樣提高了18%。呂國志等[16]采用邊磨邊浸的活化方式處理三水鋁石礦,大幅度降低了擴散控制的影響,在相同浸出時間下,機械活化后礦物中氧化鋁的浸出率比直接浸出提高了5%以上。在機械活化強化礦物浸出的動力學研究方面,張有新等[17]研究了機械活化強化磁黃鐵礦浸出的動力學,發現相同條件下,機械活化后的磁黃鐵礦浸出表觀活化能由未活化的150 kJ/mol降低至58 kJ/mol,浸出率更高,反應速率更快。WANG等[18]探究了含鈮的礦化物在氫氧化鉀堿性水熱體系中的浸出動力學,采用Avrami-Erofeev模型進行擬合,發現機械活化時間分別為10 min與30 min時,反應活化能從未活化的45.6 kJ/mol分別降低至32.2 kJ/mol和21.9 kJ/mol,說明機械活化能有效降低反應活化能并加快反應速率。張燕娟等[19]采用Avrami模型描述銦鐵酸鋅在硫酸溶液中的溶解動力學,發現機械活化不僅降低了反應的表觀活化能,還改變了反應的控制步驟,該過程由未活化時的化學反應控制轉變為混合步驟控制。
針對鋰輝石礦相低溫重構-直接浸出新技術,本研究希望利用機械活化法,強化鋰輝石礦相重構過程,提高反應浸出速率,縮短反應時間。通過研究浸出混合方式、浸出溫度對浸出過程的影響,分析機械活化強化后鋰輝石的浸出動力學,以期提供一種有效的強化技術,為鋰輝石礦相低溫重構-直接浸出技術的強化過程提供工藝參數,為鋰輝石堿性浸出反應器設計提供參考。
1 實驗
1.1 實驗原料與試劑
實驗所用鋰輝石精礦來自澳大利亞馬里恩礦區,經破碎、球磨和篩分獲得礦粉(粒徑≤75 μm),其Li2O質量分數為5.28%,其他化學組成如表1所示。實驗所用試劑氫氧化鈉、鹽酸和硝酸均為分析純,所有溶液均用去離子水配制。鋰輝石精礦的XRD譜圖如圖2所示,鋰輝石精礦中主要含有α-鋰輝石(LiAlSi2O6,PDF#71-1063)、石英(SiO2,PDF#70-3755)、鐵韭閃石[NaCa2(Fe,Mg)4Al(Si6Al2)O22(OH)2,PDF#85-1423]和鈉長石(NaAlSi3O8,PDF#01-0739)等。
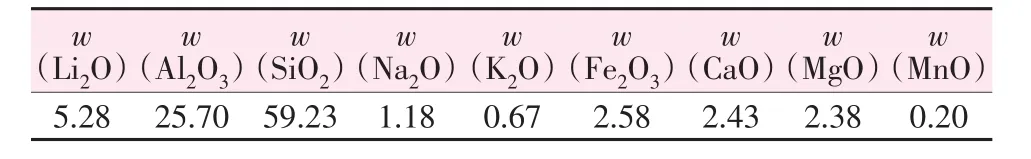
表1 鋰輝石精礦的化學組成Table 1 Chemical composition of spodumene concentrate %
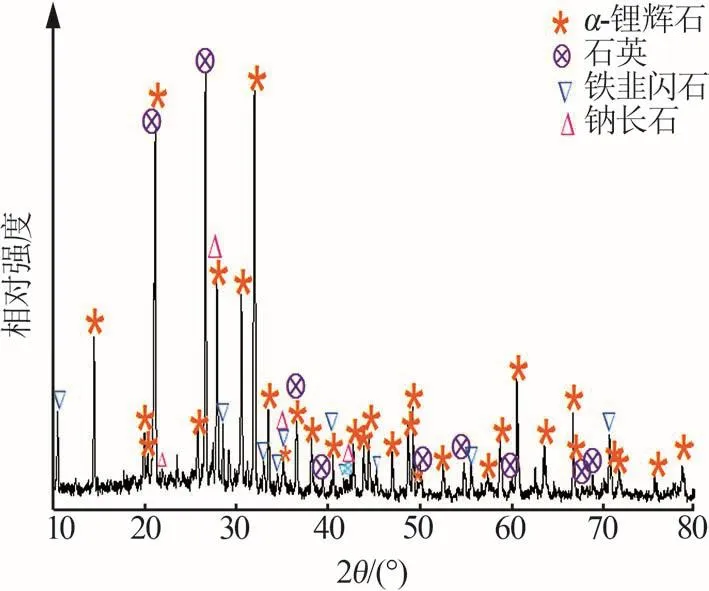
圖2 鋰輝石精礦的XRD譜圖Fig.2 XRD pattern of spodumene concentrate
1.2 實驗步驟
實驗主要設備為自主設計制造的多位臥式水熱磨浸反應器,其結構包括電機、軸承、傳動帶、反應釜、控制柜等,如圖3所示。定量稱取氫氧化鈉、去離子水和不銹鋼磨球于250 mL水熱反應釜內,加入一定質量鋰輝石礦粉,所有試劑和原料稱量誤差為±0.001 g。將水熱反應釜密封后放入多位臥式水熱磨浸反應器中,開啟攪拌電機和控溫系統。溫度升至預設溫度時計為反應起始時間。反應結束后,關閉加熱和攪拌。待水熱反應釜降至常溫后,取其中物料離心分離獲取固相和液相。固相用去離子水洗滌兩次,洗液和浸取液共同轉移至容量瓶中定容,分析浸出至液相的鋰濃度;固相在110 ℃下烘干12 h。稱取0.100 g固相加入50 mL 2 mol/L HCl溶液,60 ℃下反應4 h,所得酸浸液在100 mL容量瓶中定容,分析酸浸液中的鋰濃度,從而得到轉化為酸溶性偏硅酸鋰的提取率。鋰的總提取率X由液相中鋰提取率XL和固相中鋰提取率XS組成,公式如下:
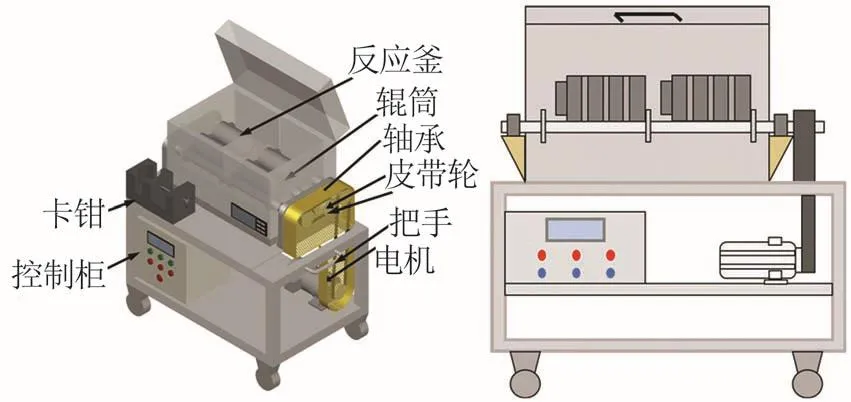
圖3 多位臥式水熱磨浸反應器示意圖Fig.3 Schematic diagram of multi?station horizontal hydrothermal reactor
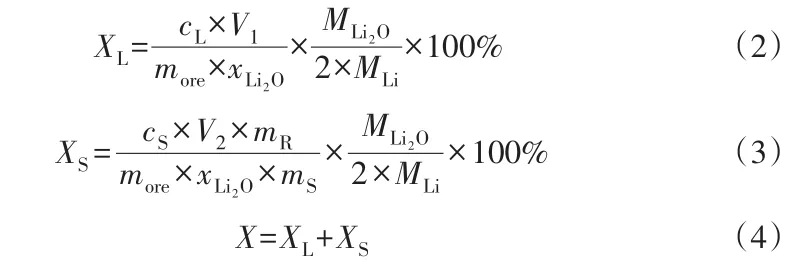
式中,cL和cS分別為堿浸液和酸浸液中的Li質量濃度,g/L;V1和V2分別為堿浸液和酸浸液的體積,L;more為堿浸所用的鋰輝石礦粉質量,g;xLi2O為鋰輝石中的Li2O質量分數,%;MLi和MLi2O分別為Li和Li2O的摩爾質量,g/mol;mS為與HCl反應的固相的質量,g;mR為堿浸后的固相總質量,g。
1.3 分析方法
分別采用X射線熒光光譜儀(XRF,ARL ADVANT′X 3600型)和電感耦合等離子體發射光譜儀(ICP-OES,ARCOS FHS12型)分析礦物的元素組成和礦物中Li元素的含量。采用X射線衍射儀(XRD,D8 Advance型)分析原礦和礦渣的礦物組成,測試條件為銅靶Kα輻射、掃描范圍為10~80°、步長為0.02°、掃描時間為0.12 s/步。采用掃描電鏡(SEM,Quanta FEG 650型)與X射線能譜儀(EDS,QUANTAX XFlash 6|30型)表征樣品形貌與分析樣品成分。
2 結果與討論
2.1 混合方式的影響
在鋰輝石粒度小于75 μm、NaOH質量分數為25%、堿礦質量比為1.5∶1、反應溫度為523.15 K、反應釜轉速為100 r/min反應條件基礎上,分別對不加磨球直接浸出和加磨球邊磨邊浸的兩種浸出反應方式進行研究,探究機械活化方式對鋰輝石中鋰浸出過程的影響。
兩種浸出方式下的鋰提取率隨反應時間的變化如圖4所示。未加磨球時,鋰總提取率的變化在12 h時開始趨于平緩,此時總提取率僅為72.24%。而邊磨邊浸時,總提取率隨時間快速增加,并在8 h時達到平衡,為90.18%,比相同條件下不加磨球時得到的總提取率高出34.42%。
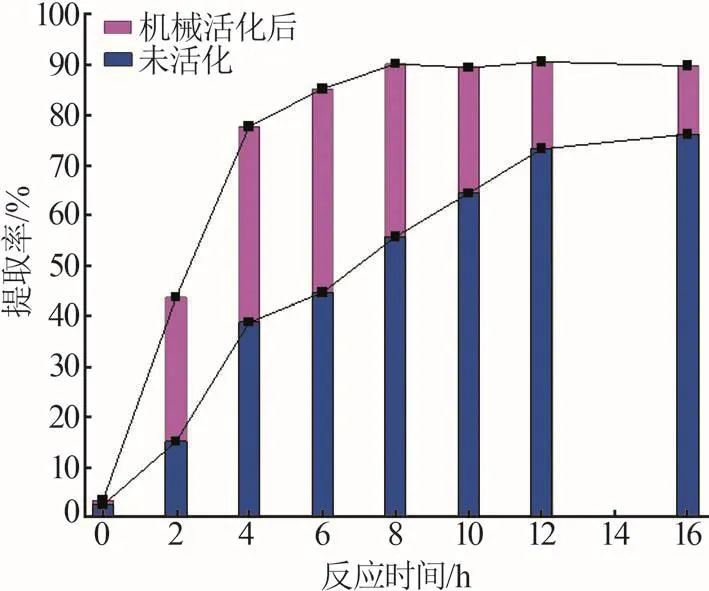
圖4 兩種反應方式鋰提取率隨反應時間的變化Fig.4 Variation of lithium extraction efficiency with reaction time using two reaction methods
圖5是固相的XRD譜圖,對比了不加磨球和邊磨邊浸兩種浸出方式在反應8 h后得到的礦渣成分。兩者主要成分均為α-鋰輝石、偏硅酸鋰(Li2SiO3,PDF#29-0828)、堇青石(Mg2Al4Si5O18,PDF#09-0326)、八面沸石(Na14Al12Si13O51·6H2O,PDF#28-1036)和羥基鈣霞石[Na8Al6Si6O24(OH)2·2H2O,PDF#46-1457]。其中,不加磨球方式下得到的礦渣XRD譜圖中,在2θ=14.52、20.38、27.99、30.65、48.86、60.73、66.88、70.85°處存在α-鋰輝石的特征峰,而在邊磨邊浸方式得到的礦渣中未發現這些特征峰,說明相同反應時間里,邊磨邊浸方式能促進原礦中α-鋰輝石的溶解,且礦渣中出現新的含鋰相偏硅酸鋰,偏硅酸鋰易被酸溶解,因此說明實驗通過低溫酸浸礦渣得到的鋰提取率來自于偏硅酸鋰。
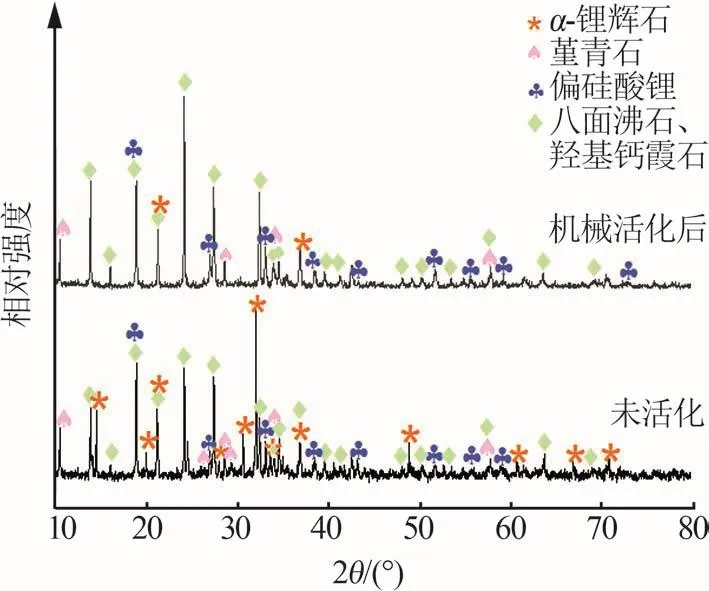
圖5 浸出時間為8 h時兩種浸出方式所得固相的XRD分析Fig.5 XRD analysis of residues with and without activation after leaching for 8 h
上述實驗結果表明邊磨邊浸的機械活化方式能夠促進鋰輝石礦的溶解和偏硅酸鋰的生成,在相同反應時間內顯著提高鋰提取率,有效加快鋰輝石在堿性水熱條件下的礦相重構過程,是一種適用于該反應過程的強化手段。
2.2 反應溫度對礦相重構的影響
溫度是影響礦石分解浸出的重要因素。在鋰輝石粒度小于75 μm、NaOH質量分數為25%、堿礦比為1.5∶1、反應時間為8 h、反應釜轉速為100 r/min的條件下,考察溫度為478.15~538.15 K時對鋰提取率的影響,結果如圖6所示。由圖6可知,在堿性水熱條件下鋰輝石中的部分Li被浸出至堿性溶液中,部分轉化為礦渣中易被酸溶的新晶相(偏硅酸鋰),在圖中分別用黃色柱與藍色柱表示。鋰輝石中的鋰主要轉化到新晶相中,且固相轉化率隨溫度的上升而不斷上升,使得鋰的總提取率也不斷增加。478.15 K下反應8 h后,鋰的總提取率僅為42.91%,其中從新晶相偏硅酸鋰中得到的提取率為37.04%,堿浸液中的提取率為5.87%;溫度為523.15 K時,總提取率達到了90.18%,新晶相偏硅酸鋰的轉化率為85.85%,堿浸液中的提取率為4.33%。說明溫度的升高有利于鋰輝石的反應分解和偏硅酸鋰的形成,從而提高鋰總提取率。但當溫度高于523.15 K后,總提取率變化并不明顯,溫度為538.15 K時,總提取率為90.42%,其中偏硅酸鋰轉化率為85.70%,堿浸液中得到4.72%的鋰提取率。因此綜合考慮鋰總提取率與能耗,選擇523.15 K為最優溫度。
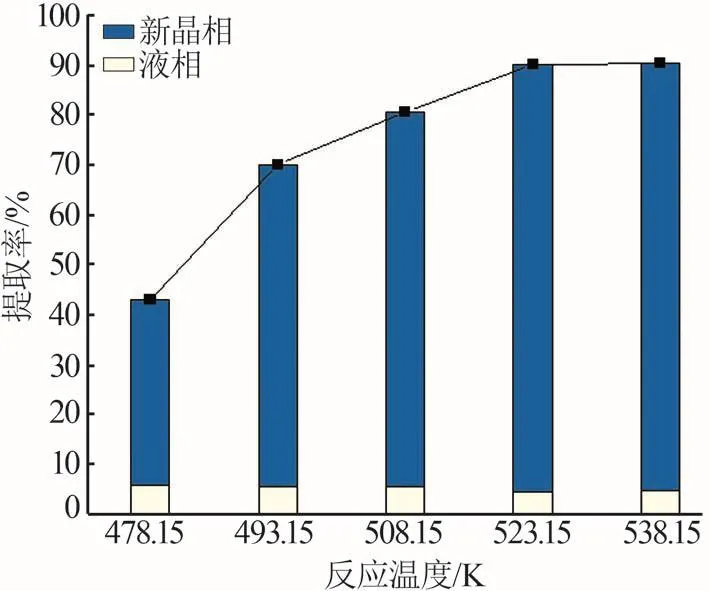
圖6 邊浸邊磨時浸出溫度對鋰輝石中鋰提取率的影響Fig.6 Effect of leaching temperature on lithium extraction efficiency from spodumene with leaching and grinding
2.3 堿濃度對礦相重構的影響
在反應溫度為523.15 K、堿礦比為1.5∶1、反應時間為8 h、反應釜轉速為100 r/min條件下,考察堿濃度對鋰提取率的影響,結果如圖7所示。當堿質量分數從15%上升到25%時,鋰總提取率明顯增大,從51.93%增大至90.18%,其中新晶相的轉化率大幅提高,從46.42%上升至85.85%,而液相浸出率變化并不明顯;堿質量分數從25%增大至45%時,鋰總提取率的變化趨于平緩,具體表現為:液相浸出率隨堿濃度的增加而增大,從4.33%提高至12.44%;新晶相中得到的鋰提取率卻在下降,從85.85%下降至75.30%。說明NaOH質量分數達到25%后,堿濃度的繼續提高并不利于鋰輝石礦相重構過程。基于以上實驗結果,本文選取25%為最優的堿濃度。
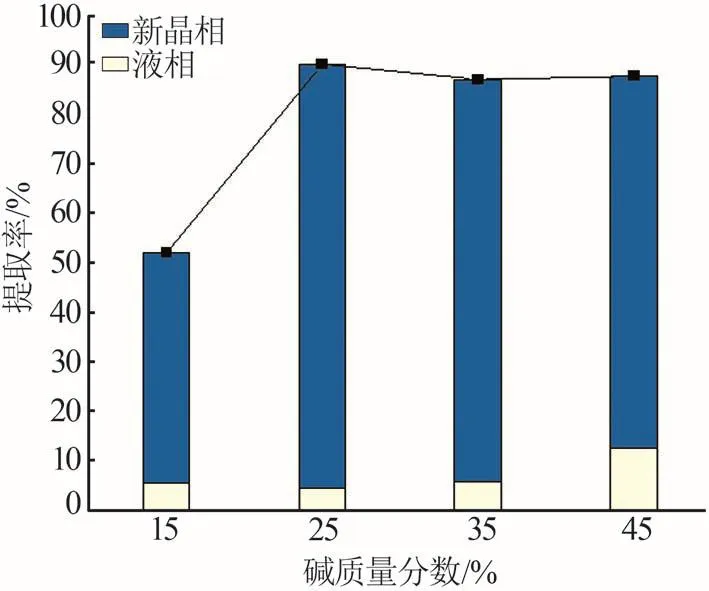
圖7 邊浸邊磨時浸出堿濃度對鋰輝石中鋰提取率的影響Fig.7 Effect of NaOH concentration on lithium extraction efficiency from spodumene with leaching and grinding
2.4 堿礦比對礦相重構的影響
固定堿質量分數為25%,堿礦比越大意味著液固比越大,因此探究堿礦比對鋰提取率的影響有助于獲得高提取率所需的較低液固比。圖8展示了反應溫度為523.15 K、堿質量分數為25%、反應時間為8 h、反應釜轉速為100 r/min條件下鋰提取率隨堿礦比的變化情況。堿礦比從1∶1增大至1.5∶1時,鋰總提取率不斷升高,從60.93%升高至90.18%;堿礦比大于1.5∶1時,雖然總提取率沒有明顯變化,但其中偏硅酸鋰的轉化率從85.84%減小至83.00%。堿礦比的增加使得液相提取率不斷增加,這使得鋰元素更多地以游離態存在于液相中,而不是生成偏硅酸鋰;而較低的堿礦比使得反應母液較濃稠從而影響了傳質,得到的鋰總提取率不高。基于上述實驗結果,堿礦比優選為1.5∶1。
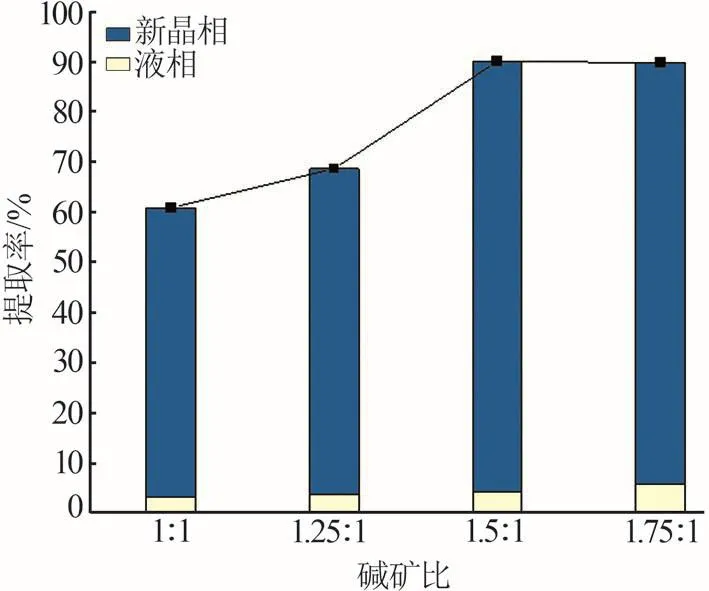
圖8 邊浸邊磨時堿礦比對鋰輝石中鋰提取率的影響Fig.8 Effect of alkali?ore ratio on lithium extraction efficiency from spodumene with leaching and grinding
2.5 機械活化強化浸出動力學
基于鋰輝石在堿性水熱條件下的浸出過程,探究了機械活化強化過程中鋰的浸出動力學。縮核模型是常用于固液反應體系的動力學模型,該模型假設參與反應的固體物質為球形顆粒,且為單一粒徑,但在本實驗的磨浸過程中難以得到單一粒徑,且反應有新固相偏硅酸鋰的生成。本文采用Avrami-Erofeev方程[20]作為機械活化強化鋰輝石堿性水熱浸出的動力學模型,其表示為:

兩邊取對數后得:
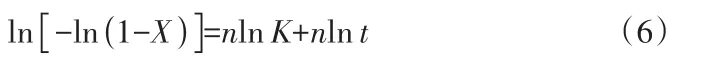
式中,X為浸出率;K為反應常數,min-1;t為反應時間,min;指數n通常為1、2、3,分別代表一維、二維與三維結晶生長模型。
將鋰的總提取率隨反應時間的變化數據分別代入式(5),以lnt為橫坐標、ln[-ln(1-X)]為縱坐標作圖,如圖9所示。擬合結果如表2所示,其擬合相關系數R2均大于0.98。結果得到n為0.87~1.01,平均值為1,意味著偏硅酸鋰是一維線性生長。圖10展示了反應8 h后礦渣中偏硅酸鋰的形貌,呈細小針狀,與一維線性生長模型相對應,進一步說明Avrami-Erofeev模型符合本文介紹的鋰輝石礦相重構過程。
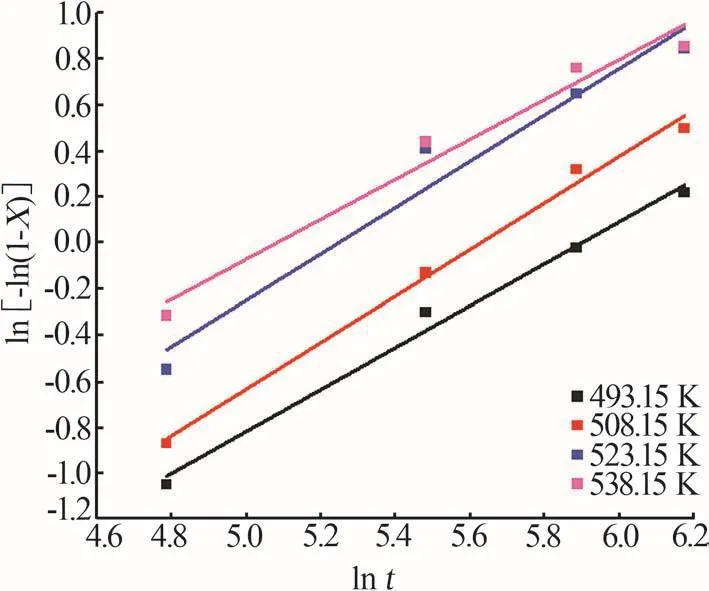
圖9 不同浸出溫度下ln[-ln(1-X)]與ln t的關系Fig.9 Relationship between ln[-ln(1-X)]and ln t at different leaching temperatures
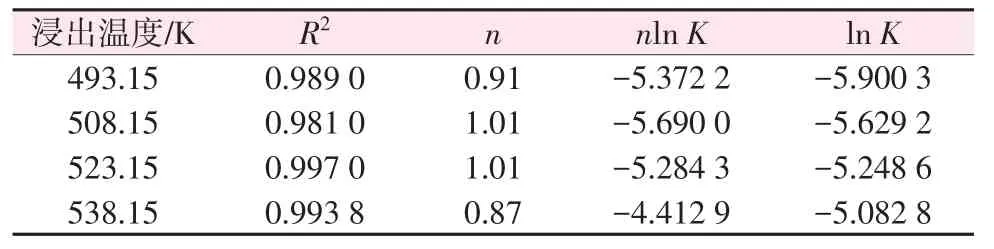
表2 不同溫度下的模型擬合參數Table 2 Model fitting parameters at different temperatures

圖10 偏硅酸鋰的SEM形貌圖及表面能譜分布Fig.10 SEM images and EDS results of lithium metasilicate
根據Arrhenius方程,

式中,A為頻率因子,min-1;Ea為表觀反應活化能,J/mol;R為理想氣體常數,8.314 J/(mol·K);T為溫度,K。兩邊取對數可得:

以1 000/T為橫坐標、lnK為縱坐標作圖,如圖11所示。帶入式(7)可得到在機械活化方式下α-鋰輝石在NaOH溶液中的浸出表觀活化能Ea為41.739 kJ/mol。對比QIU等[10]得到的鋰輝石在堿性水熱體系中發生礦相重構的反應動力學結果,采用邊磨邊浸的機械活化強化技術,大幅降低了反應活化能,并提高了反應速率。
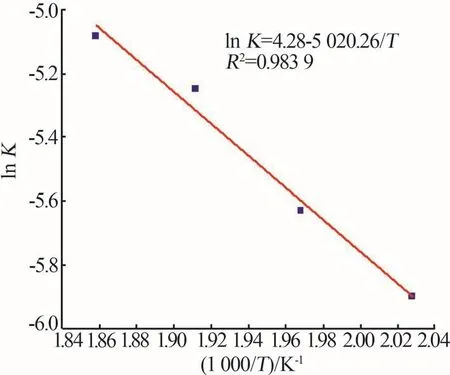
圖11 ln K與1 000/T的阿倫尼烏斯曲線Fig.11 Arrhenius curve of ln K and 1 000/T
3 結論
本文針對機械活化強化鋰輝石浸出過程及影響反應速率的主要因素進行了研究,得到以下結論:
1)在粒度小于75 μm、NaOH質量分數為25%、堿礦比為1.5∶1、反應溫度為523.15 K、反應時間為8 h、反應釜轉速為100 r/min條件下,澳大利亞馬里恩礦區鋰輝石礦的鋰提取率可達到90.18%。2)采用Avrami-Erofeev動力學經驗模型對機械活化強化鋰輝石浸出過程進行了較好的擬合,反應的表觀活化能為41.739 kJ/mol。3)本文基于鋰輝石低溫礦相重構-直接浸出工藝,提出機械活化強化浸出過程的可行性,邊磨邊浸的機械活化方式能促進鋰輝石礦的溶解,提高反應浸出速率,為開發一種綠色經濟的鋰輝石提鋰工藝提供了一定的理論指導。

