LncRNA ABHD11-AS1在Erastin誘導的胰腺癌細胞鐵死亡中的作用及其機制
徐春暉, 王慧之, 劉雅雯, 李政, 龔愛華, 徐岷
(1. 江蘇大學附屬醫(yī)院消化科,江蘇 鎮(zhèn)江 212001; 2. 江蘇大學醫(yī)學院,江蘇 鎮(zhèn)江 212013)
胰腺癌發(fā)病隱匿,進展快,預(yù)后差,生存期短[1],5年生存率不足10%。目前治療早期胰腺癌的最有效方案是手術(shù)切除后輔助化療[2],但腫瘤易對傳統(tǒng)化療藥物耐藥。其中,細胞凋亡抵抗是耐藥產(chǎn)生的重要機制[3]。
長鏈非編碼RNA(long non-coding RNA,lncRNA)是指長度超過200個堿基對,同時缺乏蛋白編碼能力的RNA。據(jù)報道,lncRNA在人類細胞中廣泛表達,可以通過與DNA、RNA和蛋白質(zhì)的相互作用,調(diào)控細胞信號轉(zhuǎn)導,維持腫瘤惡性表型,促進腫瘤細胞增殖、遷移、侵襲以及耐藥等[4-5]。α/β-水解酶結(jié)構(gòu)域蛋白11的反義鏈1(α/β-hydrolase domain containing protein 11-antisense strand 1,ABHD11-AS1)基因位于7號染色體,其在胰腺癌[6]、結(jié)直腸癌[7]和卵巢癌[8]等多種腫瘤中呈高表達,促進腫瘤細胞增殖、遷移及侵襲。在胰腺癌中,ABHD11-AS1可作為潛在早期診斷標志物,與傳統(tǒng)腫瘤標志物CA19-9聯(lián)合檢測可獲得良好的診斷效果,并且ABHD11-AS1高表達患者往往預(yù)后不良[6]。
鐵死亡自2012年發(fā)現(xiàn)以來[9],被認為是細胞最廣泛的程序性死亡方式之一[9-10]。最新研究表明,聯(lián)合使用鐵死亡誘導劑可減弱吉西他濱化療的耐藥性[11],易產(chǎn)生耐藥性的癌細胞對可能鐵死亡特別敏感[12]。Erastin作為鐵死亡誘導劑,抑制胱氨酸谷氨酸轉(zhuǎn)運受體,阻礙胱氨酸吸收,導致谷胱甘肽過氧化物酶4(glutathione peroxidase 4,GPX4)活性降低,進而引起脂質(zhì)過氧化,導致細胞鐵死亡。已有動物實驗表明,Erastin在30~60 mg/kg劑量范圍內(nèi)有明確的抑癌作用且無明顯不良反應(yīng)[13]。90%以上的胰腺癌患者攜帶KRAS基因突變,而Erastin對于KRAS突變癌細胞的殺傷作用具有高選擇性和敏感性等特點[14],因此對于胰腺癌的治療,Erastin有很大潛在臨床可行性。近年來,已證實包括microRNA和circRNA在內(nèi)的lncRNA參與鐵死亡的生物學過程[15],從而影響了癌癥的進展和治療。因此,本研究擬探討lncRNA ABHD11-AS1對于Erastin引起胰腺癌細胞鐵死亡的影響及其作用機制。
1 材料和方法
1.1 生物信息學分析
通過基因表達在線分析平臺GEPIA(http://gepia.cancer-pku.cn/index.html)分析lncRNA ABHD11-AS1在胰腺癌組織和正常胰腺組織中的表達水平,篩選條件“gene:ABHD11-AS1”;“Datasets:PAAD”;“Matched Normal data:Match TCGA normal and GTEx data”;“Log Scale:Yes”;“Jitter Size:0.4”。
采用GEPIA分析ABHD11-AS1和胰腺癌患者生存率相關(guān)性,篩選條件“gene:ABHD11-AS1”“Methods:Overall Survival”;“Group Cutoff:Quartile”;“Cutoff-High:75%”;“Cutoff-Low:25%”;“Datasets Selection:PAAD”。取胰腺癌患者ABHD11-AS1表達量的四分位數(shù),表達量25%以下的為低表達組,75%以上的則為高表達組。
1.2 細胞、主要試劑和儀器
人胰腺癌PANC1、MIApaca-2、Patu8988細胞由江蘇大學醫(yī)學院2508實驗室于液氮罐中保存。DMEM高糖培養(yǎng)基、PBS、超敏ECL發(fā)光液購自美倫生物技術(shù)有限公司;胎牛血清購自美國Gibco公司;鐵死亡挽救劑Ferrostatin-1、壞死挽救劑Necrostatin-1、凋亡挽救劑Z-VAD-FMK和Erastin購于美國Med Chem Express公司;ABHD11-AS1質(zhì)粒和對照質(zhì)粒購自長沙優(yōu)寶生物科技有限公司;siRNA購自廣州銳博生物科技有限公司;Trizol購自日本TaKaRa公司;牛血清白蛋白購自德國Biofroxx公司;雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)、磷酸化mTOR(phosphorylated mTOR,p-mTOR)、GPX4抗體(兔抗人)購自美國Cell Signaling Technology公司;二抗(羊抗兔)購自美國Santa Cruz公司;2×SYBR Green Mix試劑、CCK8試劑購自南京諾唯贊科技生物股份有限公司;GSH、丙二醛檢測試劑盒購自南京建成生物工程研究所;BCA蛋白定量試劑盒購自北京雷根生物技術(shù)有限公司;Lipofectamine2000試劑、逆轉(zhuǎn)錄試劑盒購自美國Thermo Fisher公司;800 TS多功能酶標儀購自美國Bio Tek公司;超凈細胞操作臺購自蘇州凈化設(shè)備公司;SDS-PAGE電泳儀、熒光定量PCR儀購自美國Bio Rad公司;細胞恒溫培養(yǎng)箱購自上海醫(yī)療器械廠。
1.3 細胞培養(yǎng)
人胰腺癌PANC1、MIApaca-2、Patu8988細胞用含10%胎牛血清的DMEM,培養(yǎng)于37 ℃、5% CO2恒溫細胞培養(yǎng)箱中。常規(guī)傳代、凍存。
1.4 qRT-PCR檢測3種胰腺癌細胞中ABHD11-AS1相對表達量
取生長狀態(tài)良好的人胰腺癌PANC1、MIApaca-2和PaTu8988細胞,用Trizol提取細胞總RNA,按說明書使用逆轉(zhuǎn)錄試劑盒,合成相應(yīng)的cDNA。PCR反應(yīng)體系(10 μL)為4.1 μL DEPC水、5 μL 2×SYBR Green Mix和上、下游引物各0.2 μL、0.5 μL cDNA,加入8連管中。反應(yīng)程序:95 ℃ 5 min(預(yù)變性);95 ℃ 20 s(變性);56 ℃ 20 s(退火);72 ℃ 30 s(延伸),循環(huán)40次;4 ℃存放。引物由金斯瑞生物科技有限公司合成,序列如下:U6,上游引物5′-CTCGCTTCGGCAGCACA-3′,下游引物5′-AACGCTTCACGAATTTGCGT-3′;ABHD11-AS1,上游引物5′-TTGAGGGTAAGTGTTCTTCTGA-3′,下游引物:5′-CAGCAACATCAAAGCCGA-3′。以U6作為內(nèi)參,ΔCt(所測細胞)=CtABHD11-AS1-CtU6,ΔΔCt(所測細胞)=ΔCt所測細胞-ΔCtPANC1,對應(yīng)相對表達量即為2-ΔΔCt。后續(xù)實驗中,選取ABHD11-AS1低表達PANC1細胞進行過表達實驗,ABHD11-AS1高表達PaTu8988細胞進行干擾實驗。
1.5 CCK8法檢測并計算Erastin誘導不同胰腺癌細胞半數(shù)抑制濃度IC50
取處于對數(shù)生長期的人胰腺癌PANC1、MIApaca-2和PaTu8988細胞接種于96孔板,每孔4 000個細胞,每組設(shè)置3個復孔。次日細胞貼壁后,提前將Erastin用培養(yǎng)基稀釋成不同濃度,根據(jù)不同細胞系,PANC1細胞選取0、1、2、4、8 μmol/L,MIApaca-2細胞選取0、2、4、8、16 μmol/L,PaTu8988細胞選取0、4、8、16、32 μmol/L,每孔加入100 μL Erastin稀釋液,于培養(yǎng)箱培養(yǎng)72 h;棄培養(yǎng)基,每孔加入100 μL CCK8反應(yīng)溶液(90 μL無血清培養(yǎng)基+10 μL CCK8原液),同時設(shè)立空白組(空白孔100 μL CCK8反應(yīng)溶液),孵育1 h;用多功能酶標儀檢測450 nm波長處D值。當前濃度下細胞活力(%)=(D當前Erastin濃度-D空白組)/(D0 μmol/L Erastin組-D空白組)×100%。所得數(shù)據(jù)用GraphPad Prism 7.0進一步計算IC50。為篩選出不同細胞株合適的Erastin加藥濃度即IC50,初步分析IC50與ABHD11-AS1之間的關(guān)系,為下一步實驗作基礎(chǔ)。
1.6 質(zhì)粒轉(zhuǎn)染
將人胰腺癌PANC1細胞分為pcDNA3.1-ABHD11-AS1組和對照空載質(zhì)粒pcDNA3.1組。取對數(shù)生長期PANC1細胞接種于6孔板,每孔約5×105個細胞,孵育12 h;棄培養(yǎng)基,加入1 mL無血清培養(yǎng)基,將5 μL Lipofectamine2000試劑與100 μL無血清培養(yǎng)基混勻,將2 μg pcDNA3.1-ABHD11-AS1質(zhì)粒或者對照pcDNA3.1質(zhì)粒與100 μL無血清培養(yǎng)基混勻,將前兩步所得液體混勻后靜置20 min形成200 μL轉(zhuǎn)染復合物,隨后均勻滴入相應(yīng)的6孔板,4~6 h后換成含有10%胎牛血清培養(yǎng)基。
1.7 siRNA轉(zhuǎn)染
將人胰腺癌Patu8988細胞分為siControl、siRNA1和siRNA2 3組。取處于對數(shù)生長期的Patu8988細胞接種于6孔板,每孔約5×105個細胞,孵育12 h;棄培養(yǎng)基,加入1 mL無血清培養(yǎng)基,將5 μL Lipofectamine2000試劑與100 μL無血清培養(yǎng)基混勻,將3 μL siControl、siRNA1或siRNA2與100 μL無血清培養(yǎng)基混勻,將前兩步所得液體混勻后靜置20 min形成200 μL轉(zhuǎn)染復合物,隨后均勻滴入相應(yīng)的6孔板,4~6 h后換成含有10%胎牛血清的培養(yǎng)基。si-NC靶序列為GACTCAGGTACGGAGACCA,siRNA1靶序列為TGCTCCCTGGAGGTCCAAATA,siRNA2靶序列為CACCTGACAGCAACATCAAAG,其中siRNA1和siRNA2均為干擾ABHD11-AS1表達設(shè)計的siRNA,二者靶序列不同。
1.8 qRT-PCR檢測lncRNA ABHD11-AS1相對表達量
取“1.6”和“1.7”轉(zhuǎn)染后的細胞,培養(yǎng)箱中培養(yǎng)48 h后,qRT-PCR檢測轉(zhuǎn)染效率,具體方法同“1.4”。
1.9 CCK8法檢測PANC1、Patu8988細胞經(jīng)不同藥物處理后的細胞活性
取“1.6”和“1.7”轉(zhuǎn)染后48 h的細胞,予以對照(0 μmol/L Erastin)及Erastin(細胞IC50)處理;其中,pcDNA3.1-ABHD11-AS1組和siRNA1組額外予以Erastin+Ferrostatin-1、Erastin+Necrostatin-1、Erastin+Z-Vad-FMK處理,在培養(yǎng)箱中共孵育72 h;采用CCK8檢測細胞活性,方法同“1.5”。Ferrostatin-1、Necrostatin-1、Z-Vad-FMK濃度為1 μmol/L,PANC1和Patu8988細胞所加Erastin濃度分別為2.245、17.120 μmol/L。
1.10 ELISA法檢測丙二醛和GSH相對表達量
取“1.6”和“1.7”轉(zhuǎn)染后48 h的細胞,將pcDNA3.1組、pcDNA3.1-ABHD11-AS1組、siControl組、siRNA1組、siRNA2組共5組細胞予以對照(0 μmol/L Erastin)及Erastin(細胞IC50)處理,在培養(yǎng)箱中共孵育72 h;按照相應(yīng)檢測試劑盒說明書,檢測丙二醛和GSH相對值,采用BCA檢測試劑盒檢測蛋白濃度。實驗組丙二醛相對表達量=實驗組丙二醛值/對照組丙二醛值;實驗組GSH相對表達量=實驗組GSH值/對照組GSH值。
1.11 蛋白免疫印跡法檢測p-mTOR、mTOR和GPX4蛋白表達量
取“1.6”和“1.7”轉(zhuǎn)染處理并培養(yǎng)72 h的胰腺癌細胞,加入蛋白裂解液后刮取蛋白,100 ℃煮沸10 min;隨后12 000×g離心10 min,取上清液。配置10%SDS-PAGE電泳凝膠,每個泳道加入20 μL樣品;50 V電泳45 min,110 V電泳60 min;300 mA轉(zhuǎn)膜150 min將蛋白轉(zhuǎn)移至PVDF膜;5%牛血清白蛋白常溫封閉1 h;4 ℃兔抗人一抗(GPX4抗體、p-mTOR抗體、mTOR抗體、內(nèi)參β-微管蛋白,1 ∶1 000稀釋)孵育過夜;次日TBST漂洗3次,每次10 min;加入HRP標記的二抗常溫孵育1 h;TBST漂洗3次;用超敏ECL發(fā)光液將條帶在電子凝膠成像儀上顯影拍照,用Image J軟件計算條帶灰度值。
1.12 統(tǒng)計學分析
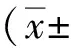
2 結(jié)果
2.1 ABHD11-AS1在胰腺癌中的表達和生存分析
從GEPIA分析TCGA和GTEx數(shù)據(jù)庫,其中胰腺癌患者179例,健康對照者171例;與正常胰腺組織相比,ABHD11-AS1在胰腺癌組織中表達明顯增高(P<0.05,圖1A)。在胰腺癌患者中,ABHD11-AS1高表達組總體存活率明顯低于低表達組(HR=2.5,P<0.05,圖1B)。由此可見,ABHD11-AS1過表達與胰腺癌患者不良預(yù)后相關(guān)。

A:GEPIA分析胰腺癌組織和正常胰腺組織中ABHD11-AS1相對表達量;B:ABHD11-AS1高表達組和低表達組生存曲線;*:P<0.05
2.2 不同胰腺癌細胞系中ABHD11-AS1表達量與Erastin誘導鐵死亡半數(shù)致死量
qRT-PCR結(jié)果顯示,ABHD11-AS1在人胰腺癌PaTu8988細胞中表達最高,MIApaca-2細胞次之,PANC1細胞中最低(F=34.13,P<0.05),見圖2A。由圖2B-D所示,通過GraphPad Prism 7.0可計算PANC1、MIApaca-2、Patu8988細胞的IC50分別為2.245、11.760、17.120 μmol/L,其對Erasin的抵抗程度與胰腺癌細胞系A(chǔ)BHD11-AS1表達量呈正相關(guān)。根據(jù)ABHD11-AS1相對表達量,選取PANC1細胞轉(zhuǎn)染pcDNA3.1和pcDNA3.1-ABHD11-AS1質(zhì)粒進行過表達實驗,對應(yīng)Erastin實驗濃度為2.245 μmol/L;選取PaTu8988細胞轉(zhuǎn)染siControl、siRNA1、siRNA2小干擾RNA進行干擾實驗,對應(yīng)Erastin實驗濃度為17.120 μmol/L。

A:qRT-PCR檢測ABHD11-AS1相對表達量;B-D:CCK8法檢測Erastin處理后PANC1、MIApaca-2、PaTu8988細胞活性;#:P<0.05,與PANC1細胞相比;*:P<0.05,與0 μmol/L Erastin組相比
2.3 上調(diào)ABHD11-AS1表達致胰腺癌PANC1細胞發(fā)生鐵死亡抵抗
qRT-PCR檢測結(jié)果顯示,與pcDNA3.1組相比,pcDNA3.1-ABHD11-AS1組ABHD11-AS1相對表達量顯著升高(t=3.636,P<0.05,圖3A)。如圖3B-D所示,經(jīng)Erastin處理后,與pcDNA3.1組相比,pcDNA3.1-ABHD11-AS1組細胞活性及GSH含量明顯增高,而丙二醛含量明顯降低(t=7.492,6.033,2.807,P均<0.05)。pcDNA3.1-ABHD11-AS1組經(jīng)Erastin處理后額外加入Z-VAD-FMK或Necrostatin-1,細胞活性無明顯差異(t=0.575,0.751,P均>0.05),而加入鐵死亡挽救劑Ferrostatin-1后,細胞活性明顯升高(t=8.432,P<0.01,圖3B),表明lncRNA ABHD11-AS1通過抵抗鐵死亡挽救Erastin處理的細胞活性,而非凋亡或者壞死。由此可見,ABHD11-AS1表達增高可對Erasin引起的鐵死亡產(chǎn)生抵抗。
2.4 干擾ABHD11-AS1表達致胰腺癌PaTu899細胞對鐵死亡敏感
如圖4A所示,與siControl組相比,siRNA1、siRNA2組細胞ABHD11-AS1相對表達量明顯降低(t=5.403,7.103,P均<0.05)。如圖4B-D所示,經(jīng)Erastin處理后,與siControl組相比,siRNA1、siRNA2組細胞活性及GSH含量明顯降低,而丙二醛含量明顯增高(P均<0.05)。siRNA1組經(jīng)Erastin處理后額外加入Z-VAD-FMK或Necrostatin-1,細胞活性無明顯差異(t=0.042,0.414,P均>0.05),而加入鐵死亡挽救劑Ferrostatin-1后,細胞活性明顯升高(t=19.010,P<0.05,圖4B),表明抑制lncRNA ABHD11-AS1表達可通過增敏鐵死亡導致Erastin處理的細胞活性降低,而非凋亡或者壞死。由此可見,抑制ABHD11-AS1表達可增敏胰腺癌細胞鐵死亡。

A:qRT-PCR檢測pcDNA3.1和pcDNA3.1-ABHD11-AS1組ABHD11-AS1相對表達量;B:CCK8檢測不同藥物處理后細胞相對活性;C:ELISA法檢測還原型谷胱甘肽含量;D:ELISA法檢測丙二醛含量;*:P<0.05

A:qRT-PCR檢測siControl、siRNA1和siRNA2組ABHD11-AS1相對表達量;B:CCK8檢測不同藥物處理后細胞相對活性;C:ELISA法檢測還原型谷胱甘肽含量;D:ELISA法檢測丙二醛含量;*:P<0.05
2.5 lncRNA ABHD11-AS1促進胰腺癌細胞p-mTOR和GPX4蛋白表達
蛋白印跡結(jié)果顯示,與pcDNA3.1組相比,pcDNA3.1-ABHD11-AS1組胰腺癌PANC1細胞p-mTOR、GPX4表達和p-mTOR/mTOR比值明顯升高(P均<0.05);與siControl組相比,siRNA1、siRNA2組胰腺癌PaTu899細胞p-mTOR、GPX4表達和p-mTOR/mTOR比值明顯降低(P均<0.05)。見圖5。siRNA1和siRNA2是ABHD11-A1不同靶序列的小干擾RNA,其中siRNA1擁有更高的干擾效率,其對應(yīng)的p-mTOR、GPX4表達和p-mTOR/mTOR比值較siRNA2更低,進一步佐證了ABHD11-AS1對p-mTOR和GPX4蛋白表達的調(diào)控。由此可見,ABHD11-AS1可促進胰腺癌細胞mTOR活化和鐵死亡關(guān)鍵抑制因子GPX4表達。

A:蛋白免疫印跡檢測pcDNA3.1和pcDNA3.1-ABHD11-AS1組p-mTOR、mTOR和GPX4相對表達量;B:蛋白免疫印跡檢測siControl、siRNA1和siRNA2組p-mTOR、mTOR和GPX4相對表達量;*:P<0.05,與pcDNA3.1組相比;#:P<0.05,與siControl組相比
3 討論
本文首先通過生物信息學結(jié)果發(fā)現(xiàn),胰腺癌組織中ABHD11-AS1表達水平明顯高于正常胰腺組織,ABHD11-AS1高表達組生存率明顯低于低表達組。由此可推斷,ABHD11-AS1在胰腺癌進展中起促癌作用。這也與相關(guān)研究[6]中ABHD11-AS1在胰腺癌中高表達并促進腫瘤的增殖侵襲相一致。
目前已有常見的鐵死亡誘導劑Erastin和RSL3廣泛用于實驗之中[16]。由于Erastin對于KRAS突變的腫瘤細胞更加敏感[12],而90%以上的胰腺癌存在KRAS突變,因此本研究以Erastin為鐵死亡誘導劑,由此選擇了3種KRAS突變的胰腺癌細胞PANC1、MIApaca-2、PaTu8988為實驗對象,并通過Erastin成功誘導了鐵死亡。國內(nèi)外分別有研究已通過Erastin誘導了人胰腺癌PANC1[17]、MIApaca-2[18]、PaTu8988[19]細胞的鐵死亡,本研究結(jié)果與其相符。在研究和評價藥物時IC50是最重要的指標之一,IC50越低表明該細胞株對此藥物更加敏感,同時IC50也是進一步實驗時的加藥濃度[20]。本研究采用IC50作為Erastin實驗濃度,結(jié)果顯示3種胰腺癌細胞IC50高低與ABHD11-AS1相對表達量趨勢一致,提示二者可能存在相關(guān)性。本研究中Erastin引起的pcDNA3.1-ABHD11-AS1組和siRNA1組細胞活性降低可被鐵死亡挽救劑抑制,而凋亡和壞死抑制劑無效,符合Erastin誘導鐵死亡的特征[16]。本研究結(jié)果顯示,與pcDNA3.1組相比,pcDNA3.1-ABHD11-AS1組細胞活性和還原型GSH含量明顯增高,丙二醛含量明顯降低,表明ABHD11-AS1高表達可抵抗Erastin引起的鐵死亡;與siControl組相比,siRNA1和siRNA2組細胞活性和還原型GSH含量明顯降低,丙二醛含量明顯增高,表明抑制ABHD11-AS1表達可增敏Erastin引起的鐵死亡。然而在上述過程中,胰腺癌細胞對Erastin鐵死亡的敏感是否主要由ABHD11-AS1調(diào)控還有待證實。
鐵死亡在多種藥物的抗腫瘤過程中起重要作用,例如索拉非尼[21]、磺胺吡啶[22]、他汀類藥物[23]和青蒿素[24]等藥物通過引起鐵死亡發(fā)揮作用。GPX4作為鐵死亡的關(guān)鍵調(diào)控因子,可通過消耗谷胱甘肽從而降低質(zhì)膜中的復合過氧化物[25]。GPX4一旦失效,即引發(fā)磷脂過度氧化,質(zhì)膜破裂,細胞死亡[14]。本研究中ABHD11-AS1過表達可激活mTOR磷酸化并引起下游GPX4表達增高,干擾則相反。這可以從一定程度上解釋ABHD11-AS1引起Erastin耐藥的原因,但完整的機制還有待進一步挖掘。
綜上所述,lncRNA ABHD11-AS1通過促進p-mTOR和GPX4表達,在人胰腺癌PANC1、PaTu8988細胞中引起鐵死亡抵抗。然而,在上述過程中,ABHD11-AS1是否是影響胰腺癌細胞鐵死亡的最主要因素還有待證實,且明確的調(diào)控機制還待進一步探索;對于低表達ABHD11-AS1且存在傳統(tǒng)藥物耐藥的患者,可予以Erastin抗癌治療。

