瓜類細菌性果斑病菌拮抗細菌的篩選及其抑菌作用
張玲 張榮意 劉盛科 譚志瓊
(海南大學生命科學學院,海口 570228)
哈密瓜為葫蘆科植物,口味清爽、甘甜多汁,有“瓜中之王”的美稱。隨著19世紀20年代哈密瓜無土栽培技術的推廣,哈密瓜逐漸成為了海南省的重要經濟作物。在哈密瓜的生長過程中會伴隨著多種病害的發生,其中細菌性果斑病(bacterial fruit blotch,BFB)又稱細菌性果腐病,是一種由西瓜噬酸菌(Acidovorax citrulli)引起的毀滅性病害。我國新疆、內蒙古、海南、云南、福建等地均有該病害發生的報道,其主要危害哈密瓜的葉片(子葉及真葉)和果實(幼果和成熟果),對哈密瓜種植業造成了極其嚴重的影響[1]。
目前,瓜類細菌性果斑病的防治主要以化學防治為主,如利用1%的鹽酸、200 倍的15%過氧乙酸[2]或300 mg/L 的3%噻霉酮WP[3]處理種子后,可有效除去種子表面的病原菌。在出苗后可采用90%新植霉素可溶性粉劑和3%噻霉酮、47%春雷·王銅對哈密瓜苗期進行噴霧[4],可有效地防治細菌性果斑病的發生。在日常生產中,使用化學農藥防治病害十分普遍,但卻很難做到科學合理地施用化學農藥,且長期施用化學農藥會帶來環境污染、農藥殘留以及病原菌產生抗藥性等一系列問題,威脅人畜健康,亟需探索生物防治措施[5]。
生物防治因具有環境友好、無毒無殘留、不傷害非靶標微生物、防病持效期長等優點,備受學者關注,是植物病害防治新的研究熱點。BFB 生物防治常用菌株為酵母菌(Pichia anomala Kurtzman)、熒光假單胞菌工程菌株(Pseudomonas fluorescence)和芽孢桿菌(Bacillus)等,國內研究防治BFB 的生防菌以芽孢桿菌居多。武芳等[6]使用篩選出的芽孢桿菌在哈密瓜種植區域進行拮抗菌株對哈密瓜植株促生、防效等研究,結果顯示,每株拮抗菌對哈密瓜植株不僅有促生作用,而且均能不同程度地預防細菌性果斑病的發生,防治效果可達到 19.98%-50.42%。謝心悅等[7]篩選出解淀粉芽孢桿菌BJ-10,其對甜瓜白粉病和甜瓜細菌性果斑病均具有較高的防效。芽孢桿菌以其優秀的定殖[8]、抗逆以及能抑制多種植物病害的能力成為生物防治的重要材料[9]。目前對于真菌性病害的研究較多,而細菌性病害研究較少。已有研究表明,不同的菌株其生長特性不同,如溫度、pH 以及營養條件等因素均會顯著影響芽孢桿菌的生長情況[10-11],從而影響其對病原菌的拮抗效果。因此,明確菌株的生長條件以及廣譜性,更有利于菌株的田間應用以及開發出適用于海南熱帶地區的生物菌制劑。
近年來,隨著海南哈蜜瓜種植面積擴大,哈密瓜細菌性果斑病發生愈發嚴重,化學農藥用量的增加,導致哈密瓜生產食品安全隱患愈發突出,生物防治措施亟待完善。本研究通過試驗篩選出對細菌性果斑病效果較好的生防菌,并確定菌株的最佳培養條件、抑菌活性以及防治效果,為菌株后續的開發利用提供理論參考。
1 材料與方法
1.1 材料
1.1.1 供試樣品 實驗樣品采集自海南省昌江、東方、三亞和陵水等哈密瓜大棚的根際土壤,用密封袋密封后于4℃保存,48 h 內對土壤細菌進行分離。
1.1.2 供試菌株 西瓜噬酸菌A.citrulli、荔枝霜疫霉Peronophythoralitchii、火龍果炭疽病病菌Colletotrichum gloeosporioides、黃瓜葉斑病病菌Pseudonwnas cichorii、小麥赤霉病病菌Fusarium graminearum、甜瓜蔓枯病病菌Didymella bryoniae,由海南大學微生物資源開發與利用實驗室提供。
1.1.3 培養基 牛肉膏蛋白胨培養基:牛肉膏3 g,蛋白胨10 g,NaCl 5 g,水1 000 mL,pH 7.2。LB 培養基:酵母提取物5 g,胰蛋白胨10 g,NaCl 10 g,水1 000 mL,pH 7。NB 培養基:聚蛋白胨5 g,酵母提取物1 g,牛肉浸膏3 g,蔗糖15 g,水1 000 mL,pH 7.0。KB 培養基:蛋白胨20 g,甘油10 mL,K2HPO41.5 g,MgSO4·7H2O 1.5 g,水1 000 mL,pH 7.2。PDB 培養基:土豆200 g,葡萄糖20 g,水1 000 mL。固體培養基:上述液體培養基+18 g 瓊脂。
1.2 方法
1.2.1 土壤細菌的分離 采用平板稀釋法[12]進行分離,稱取5 g 土樣,加入45 mL 無菌水中,振蕩培養30 min,靜置5 min 后,吸取100 μL 的土壤懸浮液于900 μL 的無菌水中,依次進行梯度稀釋(102、103、104),分別吸取稀釋倍數為102、103和104的土樣懸浮液100 μL 到牛肉膏平板中,用無菌涂布棒涂布,28℃恒溫培養2 d,挑取形態、大小、顏色不同的菌落多次純化后保藏備用。
1.2.2 拮抗菌的篩選 以西瓜噬酸菌為指示菌,篩選有拮抗作用的生防菌[13]。在融化并冷卻至50℃的LB 培養基中加入3 mL 濃度為1×108CFU/mL 病菌菌液,混勻后倒平板,將分離出的細菌等距離接種于平板上,28℃恒溫培養,2 d 后觀察有無抑菌圈生成,采用十字交叉法測量抑菌圈直徑。篩選出抑菌作用強的菌株接種至斜面試管培養基中,4℃下保藏菌種。
1.2.3 拮抗菌的鑒定
1.2.3.1 形態特征和革蘭氏染色反應 采用平板劃線法將獲得的具有抗細菌性果斑病菌的菌株131、791 接種于牛肉膏培養基上,28℃恒溫培養24 h 至長出單菌落,觀察菌落形狀,顏色和大小等。挑取培養至14 h 的兩株菌株,進行革蘭氏染色,并在光學顯微鏡下觀察其形態和染色反應。
1.2.3.2 生理生化特征測定 參考《常見細菌系統鑒定手冊》[14]的方法進行接觸酶、氧化酶、明膠液化、V-P 試驗、碳氮源利用等生理生化實驗測定。
1.2.3.3 16S rRNA 和gyrB 基因特征 使用EZNA?Bacteria DNA Kit(Omega)提取兩株細菌的基因組DNA,提取的基因組DNA 經1%瓊脂糖凝膠電泳檢測后用于PCR 擴增。PCR 的引物及反應條件見表1[15-16]。PCR 產物經1%瓊脂糖凝膠電泳檢測符合要求,送往生工生物工程(上海)股份有限公司進行測序。測序結果在NCBI 數據庫中進行Blast 比對,下載相似性高的序列,使用MEGA 7.0 軟件利用鄰接法(neighbor-joining method)構建系統發育樹,Bootstrap 為1 000[17]。
1.2.4 生長曲線測定 將菌株131、791 分別刮取單個菌落,接種至牛肉膏液體培養基,恒溫培養12 h,作種子液備用。將種子液分別接種至牛肉膏液體培養基,在28℃、180 r/min 的條件下振蕩培養24 h。每隔2 h 取樣,用分光光度計測量其OD600的值,重復3 次,并繪制生長曲線。
1.2.5 生長條件的測定
1.2.5.1 最佳培養基的篩選 按2%的接種量將種子液分別加入100 mL 的牛肉膏、LB、NB、KB、PDB培養基中,在28℃、180 r/min 的條件下搖培至對數生長期,分別測量其OD600值。
1.2.5.2 最佳pH 的篩選 按2%的接種量將種子液分別加入100 mL pH 梯度為3、4、5、6、7、8、9、10 的牛肉膏培養基中,28℃、180 r/min 搖培至對數生長期,分別測量其OD600值。
1.2.5.3 最佳培養溫度的篩選 按2%的接種量將種子液分別加入100 mL 溫度梯度為25、28、31、34、37 和40℃牛肉膏培養基中,180 r/min 搖培至對數生長期,分別測量其OD600值。
1.2.5.4 最佳接種量的篩選 將0.2%、0.5%、1%、2%、10%的種子液分別接種至100 mL 牛肉膏培養基中,在28℃、180 r/min的條件下搖培至對數生長期,分別測量其OD600值。
1.2.6 防病試驗
1.2.6.1 離體葉片防病試驗 采用針刺接種法[18],挑取生長狀況一致的哈密瓜葉片,表面消毒后洗凈晾干,用無菌針頭在葉片背后葉脈兩邊各刺3 處接種點,用注射器從葉片的針刺部位緩慢注射接種菌液,實驗分為兩組處理:(1)先接種131 菌液,后接種BFB 菌液;(2)先接種791 菌液,后接種BFB菌液。以只接種BFB 菌液和只接種水為對照組,葉片置于水瓊脂平板上培養,3 d 后開始逐日觀察發病情況,于處理后的第7 天統計并計算防效。

1.2.6.2 室內盆栽防病試驗 選取若干長至2-3 片真葉的哈密瓜盆栽幼苗,采用葉面噴施法分別接種A.citrulli、菌株131、791,清水處理為空白對照。處理組1:先將1×108CFU/mL 生防菌株菌液噴施于真葉的正反面,1 h 后噴施同等濃度的病菌菌液。處理組2:只噴BFB 菌液,平行試驗3 次,噴施后逐日觀察發病情況,于處理后的第7 天統計并計算防效。病情分級標準參考李新宇等[19]方法并略作修改,分級標準如表2所示。
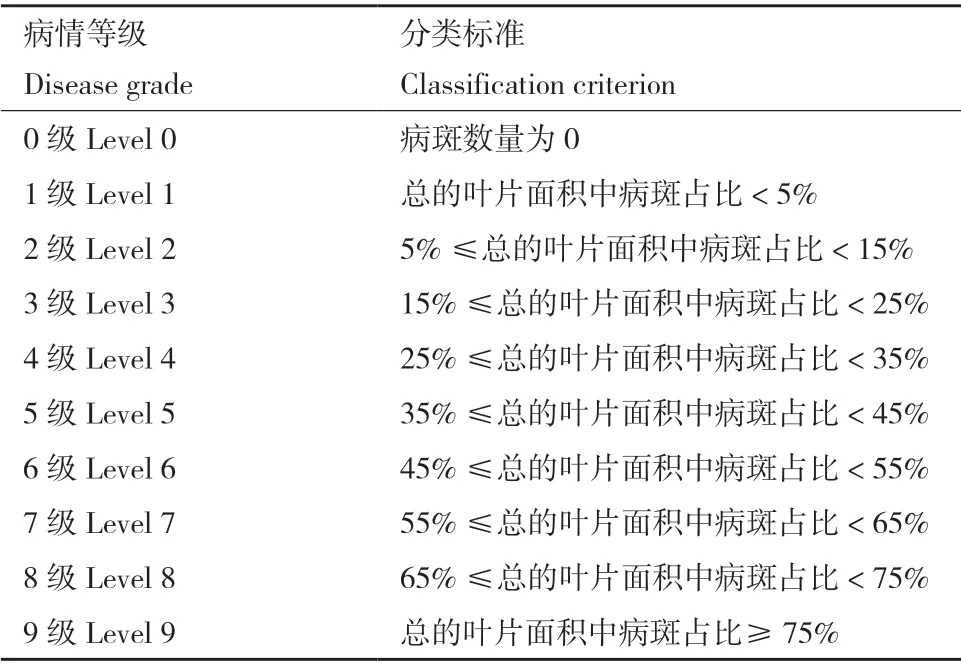
表2 病情等級分級標準Table 2 Classification criteria of disease grade

1.2.7 抑菌作用測試 采用平板對峙法[20]測定菌株131、791 對荔枝霜疫霉、火龍果炭疽病病菌、黃瓜葉斑病病菌、小麥赤霉病病菌、甜瓜蔓枯病病菌等5 種病原真菌的拮抗效果,將直徑7 mm 的病原真菌菌餅倒扣至PDA 平板中央,距離菌餅2.5 cm 處接種待測細菌,每個處理重復4 次,以只接病原真菌的平板作對照,28℃恒溫培養至病菌長滿對照組的培養皿,十字交叉法測量病原真菌的對照組菌落直徑、處理組直徑,并計算抑菌率。

1.2.8 數據統計與分析 采用Excel 進行數據處理、作圖,采用SPSS 軟件進行差異顯著性分析。
2 結果
2.1 拮抗菌的篩選
從土樣中共分離出196 株細菌,通過平板對峙法篩選出具有明顯抑制圈的拮抗菌株共20 株,其中編號為131、791 的兩株細菌對哈密瓜果斑病菌具有較強的平板拮抗效果,平板抑菌直徑分別為(19.03±0.13)mm,(17.55±0.29)mm(圖1)。
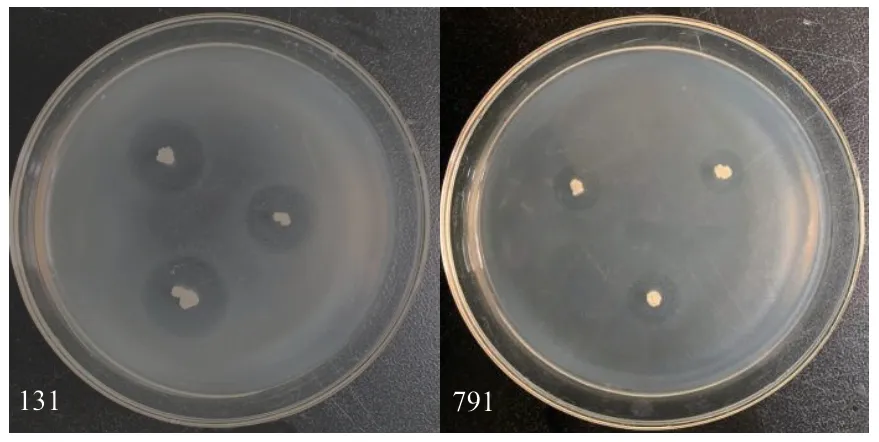
圖1 兩株拮抗菌對西瓜噬酸菌的抑制效果Fig.1 Inhibitory effects of two strains on A.citrulli
2.2 形態學觀察和生理生化鑒定
圖2為菌株131、791 的菌落形態圖及革蘭氏染色圖。菌株131 在牛肉膏培養基上菌落為白色,不透明,菌落邊緣呈波浪狀,頂端光滑凸起,中心呈淡黃色。菌體呈藍紫色、桿狀,為革蘭氏陽性菌株。菌株791 在牛肉膏培養基上菌落呈乳白色、有黏性、不透明、邊緣不規則、表面光滑。菌體呈藍紫色、桿狀,革蘭氏染色結果為陽性。
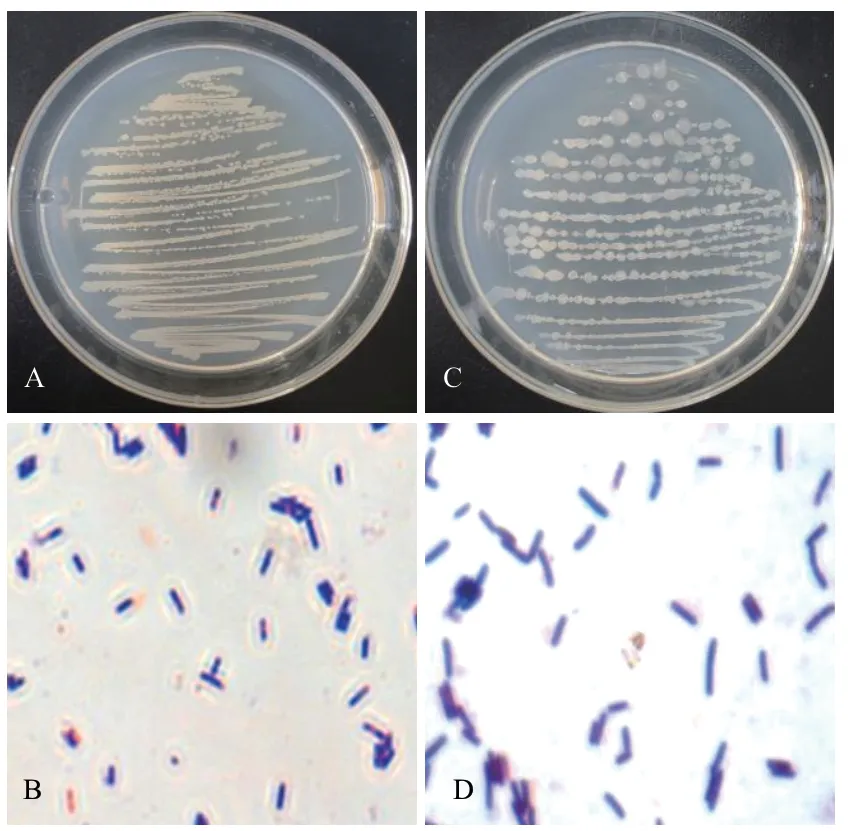
圖2 菌株131、791 的菌落圖及革蘭氏染色圖Fig.2 Colony and Gram stain of strain 131 and 791
表3結果表明,菌株131、791 均為好氧菌,接觸酶、氧化酶、明膠液化、淀粉水解、MR 和V-P試驗等生理生化測定結果均為陽性,兩株菌株均可在2%-10%的NaCl 培養液中生長,綜合形態學和生理生化結果與《常見細菌系統鑒定手冊》進行對照,將菌株131、791 初步判定為芽孢桿菌屬細菌。

表3 菌株131、791 的生理生化鑒定結果Table 3 Physiological and biochemical identification results of strain 131 and 791
2.3 16S rRNA基因和gyrB基因鑒定
菌株131、791 的16S rRNA 基因序列長度分別為1 453 bp、1 453 bp,gyrB 基因序列長度分別為1 187 bp、1 189 bp(圖3)。圖4、圖5分別為菌株131、791 的16S rRNA 基因和gyrB 基因的聯合系統發育樹。通過blast 比對,菌株131 與沙福芽孢桿菌(Bacillus safensis)相似度為99%,在16S rRNA 基因和gyrB 基因的進化樹上也都與B.safensis位于同一分支。菌株791 與貝萊斯芽孢桿菌(B.velezensis)相似度為98%,與B.velezensis在進化樹中位于同一分支,且分支值高達98。綜合形態學、生理生化和16S rRNA 基因、gyrB 基因等多方面特征結果,將菌株131 鑒定為沙福芽孢桿菌,菌株791 為貝萊斯芽孢桿菌。
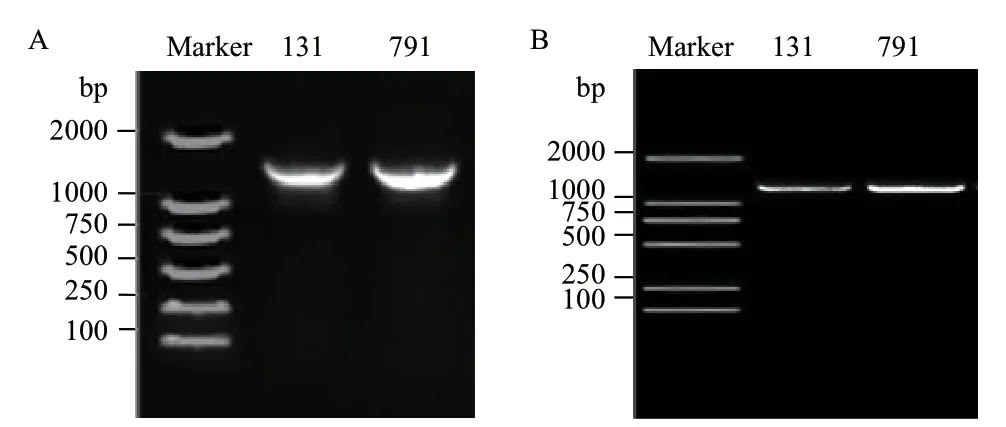
圖3 菌株131、791 的16S rRNA 基因電泳圖(A)和gyrB 基因電泳圖(B)Fig.3 16S rRNA gene electropherogram (A) and gyrB gene electropherogram (B) of strain 131 and 791
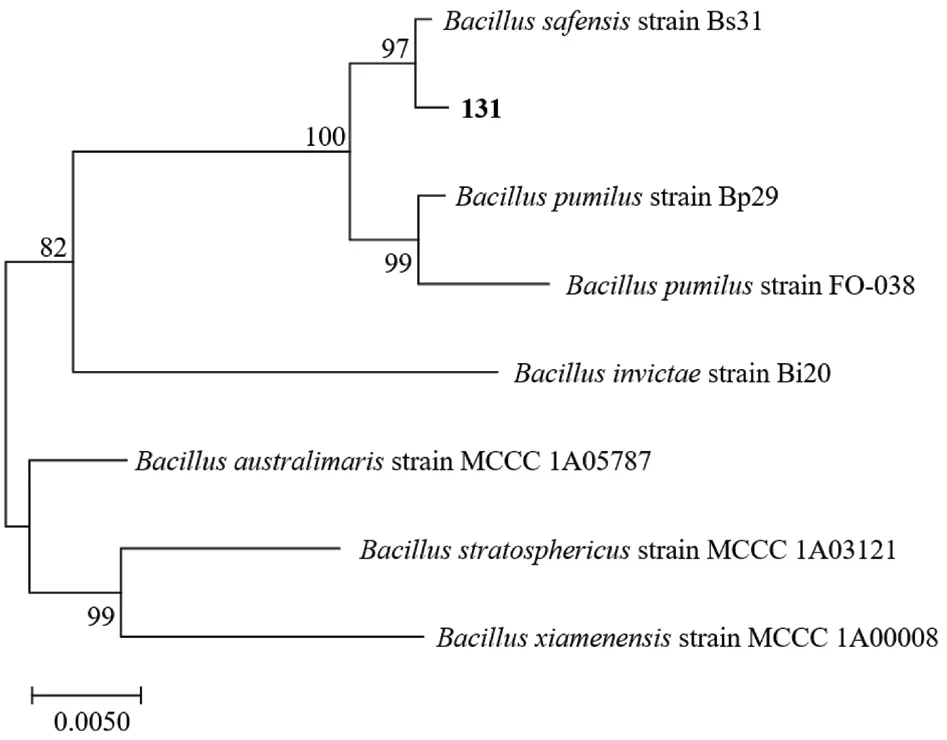
圖4 菌株131 基于16S rRNA 基因和gyrB 基因的系統發育樹Fig.4 Phylogenetic tree of strain 131 based on 16S rRNA genes and gyrB genes
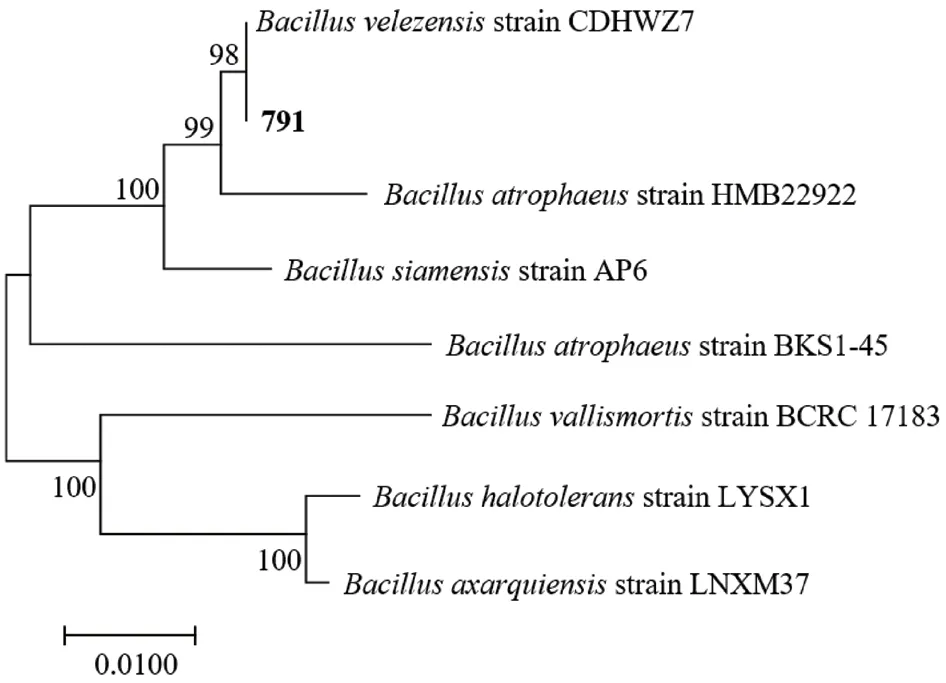
圖5 菌株791 基于16S rRNA 基因和gyrB 基因的系統發育樹Fig.5 Phylogenetic tree of strain 791 based on 16S rRNA genes and gyrB genes
2.4 生長曲線
菌株131、791 在前6 h 為延緩期,在8-12 h 生長迅速,處于對數生長期,到18 h 菌量均到達最大值并進入穩定期(圖6)。
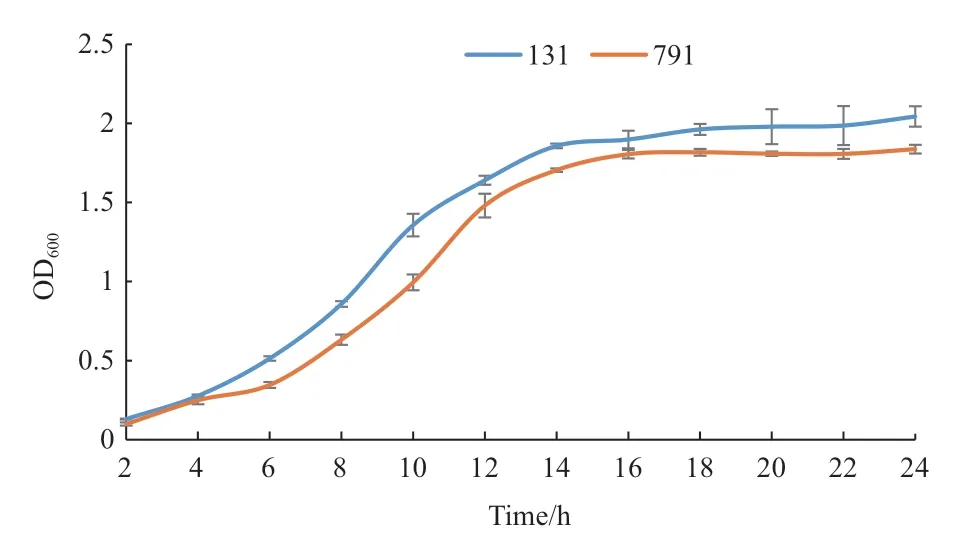
圖6 菌株131、791 的生長曲線Fig.6 Growth curves of strain 131 and 791
2.5 生長條件的測定
菌株131 在NB 培養基中生長量最大,OD600值可高達1.76;菌株791 在KB 培養基中生長狀況最好,OD600值為1.43(圖7-A)。菌株131 在pH 3-5的時候生長量小,在pH 7 時達到最大值;菌株791的pH 生長范圍為pH 5-9,且在pH 為6 時,菌量達到最大值(圖7-B)。菌株131、791 在25-40℃時均可生長,且最適生長溫度均為37℃(圖7-C)。菌株131 在接種量為2%時生長最好,菌株791 在接種量為1%時生長量最大(圖7-D)。
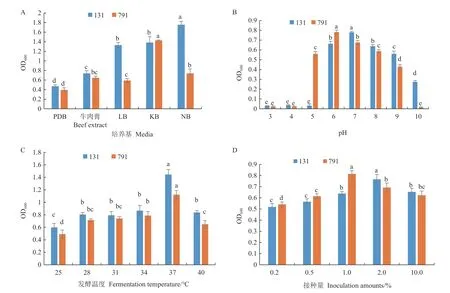
圖7 菌株131、791 在不同條件下的生長狀況Fig.7 Growth status of strain 131 and 791 under different conditions
2.6 防病試驗
如圖8所示,只接種BFB 菌液的葉片從第3天開始出現病斑,病斑面積約占整個葉片面積的49.26%,而接種了生防菌液的葉片,從第5 天才開始出現病斑,且病斑明顯減少,其對哈密瓜細菌性果斑病的防效分別為83.33%和87.53%。

圖8 兩株生防菌對哈密瓜細菌性果斑病的離體葉片效果Fig.8 Effects of two biocontrol bacteria on the isolated leaves of bacterial fruit blotch of cantaloupe
2.7 室內盆栽防效
盆栽試驗結果如表4和圖9所示,只接種BFB菌液的處理組哈密瓜幼苗真葉及子葉出現明顯的水漬狀壞死斑,嚴重時出現葉緣干枯萎縮,植株生長明顯較CK 差,經統計分析得到病情指數為77.41,發病較嚴重。同時接種生防菌菌液和BFB 菌菌液處理組幼苗葉片無明顯的壞死斑點,少數葉片存在水漬狀小斑點,葉緣無干枯壞死現象,葉片伸展正常,經統計分析,分別同時接種131、791 和BFB 病菌處理組的病情指數依次為23.33、17.04,較只接種BFB 菌菌液處理組,植株發病情況明顯改善。上述結果表明,BFB 病原菌對哈密瓜幼苗的生長具有明顯的危害,癥狀為水漬狀壞死斑,嚴重時呈干枯狀壞死,接種生防菌菌液后,植株病情指數明顯降低,發病情況得到抑制,在室內盆栽中,菌株131、791具有較好的防治哈密瓜果斑病的效果,盆栽防效分別達69.86%、77.99%。

圖9 兩株菌株對細菌性果斑病的盆栽防治效果Fig.9 Control efficacy of two strains against BFB in potting
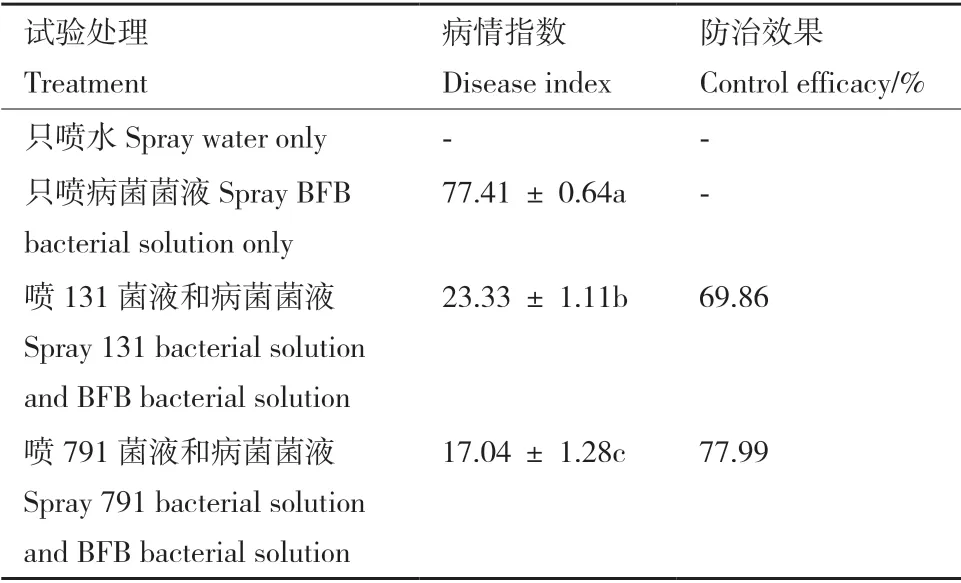
表4 菌株131 和791 的盆栽防病效果Table 4 Control efficacy of strain 131 and 791 in potting
2.8 兩株拮抗菌對其它植物病原菌的抑菌作用
菌株131 和菌株791 對供試的5 株農業病原菌的抑菌結果見表5。經測定,所有對照組菌落直徑均為85.00 mm。菌株131 對荔枝霜疫霉、火龍果炭疽病病菌、黃瓜葉斑病病菌表現出抑菌作用,其中對荔枝霜疫霉的抑制效果最好,抑菌直徑為12.00 mm,抑菌率為14.12%,對其他病菌無活性。菌株791 對5 株農業病原菌均表現出不同程度的抑菌活性,其中對黃瓜葉斑病病菌的抑菌效果最好,抑菌直徑可達21.25 mm,抑菌率為25.00%。
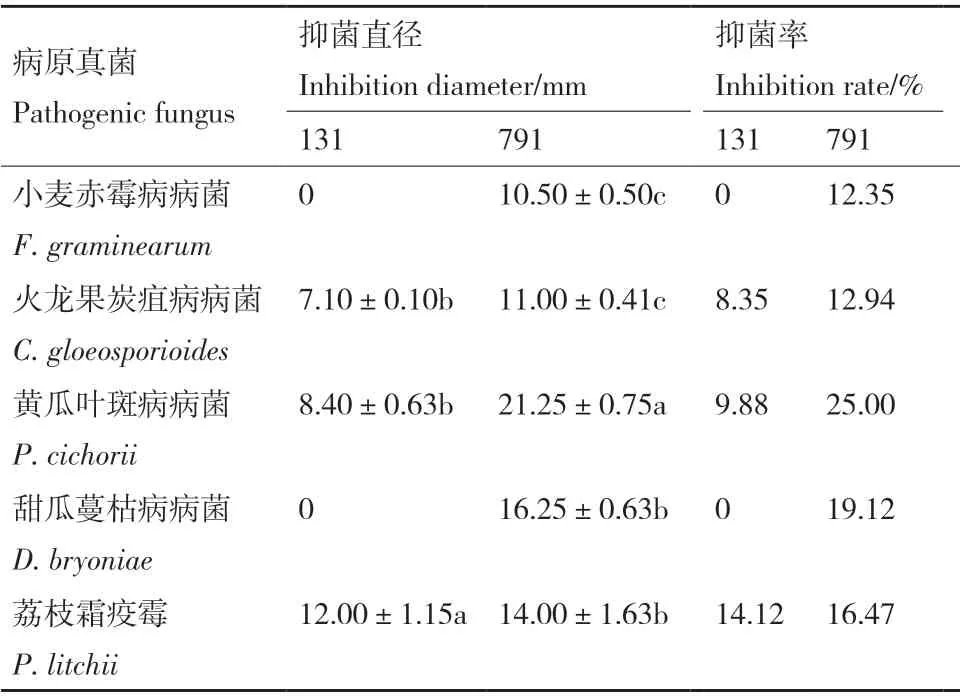
表5 菌株131、791 對其它病原菌的抑菌作用Table 5 Inhibition percentage of strain 131,791 against other pathogen
3 討論
3.1 芽孢桿菌分離篩選的重要性
芽孢桿菌屬(Bacillus)是植物表面、根際和土壤中重要的微生物種群,能夠產生抗逆性孢子,是研究人員制成生物制劑的第一選擇,有著促進生長和有效拮抗多種病害的作用[21]。枯草芽孢桿菌(B.subtilis)、解淀粉芽孢桿菌(B.amyloliquefaciens)、短小芽孢桿菌(B.pumilus)等均已用于防治細菌性果斑病,但關于貝萊斯芽孢桿菌對BFB 防治還鮮有研究,貝萊斯芽孢桿菌是近年來芽孢桿菌屬的一株新種,既有促生作用、又有生防作用,還能產生多種酶類和抑菌活性物質[22],如表面活性素(surfactin)、伊枯草菌素(iturin)、芬薺素(fengycin)等具有廣譜抑真菌活性的脂肽類物質[23-24]。已有研究發現,貝萊斯芽孢桿菌對黃瓜灰霉病菌Botrytis cinerea[25]、花生白絹病菌Sclerotium rolfsii、玉米黑曲霉病Aspergillus niger[26]、梨灰霉病菌Botrytis cinerea和青霉病菌Penicillium expansum[27]均有顯著的抑菌效果。本試驗以哈密瓜細菌性果斑病病原菌作為靶向菌,篩選出2 株拮抗作用較強的細菌,其盆栽防效分別為69.86%、77.99%,其中菌株791 對BFB 的離體葉片防治效果最佳且具有良好的穩定性,對荔枝霜疫霉、火龍果炭疽病病菌和黃瓜葉斑病病菌等病菌都有很強的拮抗效果,說明菌株791 不僅能產生可以有效拮抗植物病原真菌的脂肽類物質,還能產生有效防控細菌性植物病害的活性物質,極具開發成微生物農藥的潛力。
3.2 芽孢桿菌鑒定的可靠性
芽孢桿菌屬種主要根據生理生化特性和16S rRNA 基因序列分析進行鑒定,但是由于沙福芽孢桿菌(B.safensis)和貝萊斯芽孢桿菌(B.velezensis)無論從表型還是系統發育來說與枯草芽孢桿菌(B.
subtilis)、解淀粉芽孢桿菌(B.amyloliquefaciens)親緣關系都非常接近。對該類菌株準確鑒定的難度越來越大,因此將傳統鑒定方法與分子生物學方法相結合,才能對該類菌株進行準確的鑒定[28],本研究采用形態學觀察、生理生化特性測定與16S rRNA 基因以及gyrB 基因序列分析相結合的方法,最終將菌株131 鑒定為沙福芽孢桿菌,菌株791 鑒定為貝萊斯芽孢桿菌。
3.3 不同條件對芽孢桿菌生長的影響
發酵培養基中的營養物質是微生物菌群生長以及繁殖的必須條件,并且為其代謝產物提供了原料。研究表明,最適的培養條件可以增加菌量,從而產生更多的活性物質來提高防效[29],因此,為生防菌提供合適的營養物質,并提供最適的生長條件是非常有必要的。在本研究中已明確了兩株菌株的最佳生長條件,為后續菌株化合物的分離實驗提供一定的參考價值,但菌株的最佳生長條件能否等于菌株產生抑菌物質的優化條件,還需要進一步驗證[30]。梁艷瓊等[31]以菌量和無菌發酵液的抑菌活性作為指標,采用單因素和正交試驗對菌株JNC2 進行發酵條件優化,結果顯示,該菌株的最佳生長條件等于產生活性物質的最佳發酵條件。而洪鵬等[32]在優化解淀粉芽孢桿菌B.amyloliquefaciensHF 01 的發酵過程中發現,培養基成分中不同的無機鹽對菌體生長和活性物質的產生的影響不同,MgSO4能使菌量達到最大值,CaCl2能使抑菌圈直徑達到最大值,說明每株菌株都有自己的生長特性,后續需對生長條件進行優化試驗,希望在今后的實驗中能進一步對其活性物質進行分離純化,并且開展田間防治研究等。
4 結論
從哈密瓜根際土壤中分離得到196 株細菌,其中菌株131、791 具有較好拮抗BFB 病原菌效果,其抑菌直徑分別為(19.03±0.13)mm,(17.55±0.29)mm。經鑒定,菌株131 為沙福芽孢桿菌(Bacillus safensis),菌株791 為貝萊斯芽孢桿菌(Bacillus velezensis)。菌株131、791 對BFB 室內盆栽防效分別為69.86%、77.99%,還對黃瓜葉斑病病菌等5 種病原真菌具有較好的抑菌效果。

