防風根際真菌的分離鑒定及其生防潛力評價
孫卓 王妍 韓忠明 王云賀 趙淑杰 楊利民
(吉林農業大學中藥材學院 省部共建生態恢復與生態系統管理國家重點實驗室,長春 130118)
尖孢鐮刀菌(Fusarium oxysporum)和木賊鐮刀菌(F.equiseti)隸屬于鐮刀菌屬(Fusarium),均為世界性分布、危害性較大的土傳病原真菌,其擁有廣泛的寄生宿主,可引起農業類、設施園藝類、藥用植物類等百余種作物病害的發生[1-2]。防風(Saposhnikovia divaricata(Turcz.)Schisck.)作為我國重要的藥用植物資源之一,主要分布于中國東北、河北等地區[3],由于地理環境原因,易受尖孢鐮刀菌及木賊鐮刀菌的越冬孢子侵染而誘發防風枯萎病、根腐病,年發病率15%-20%以上,嚴重影響防風藥源的產量及品質[4]。利用化學途徑可有效防控植物真菌性病害,且以化學農藥為主導仍是目前植物病害的主要防控策略,但其引發的環境污染、抗藥性增強等問題日趨凸顯。利用益生微生物防控植物病害具有作用良好、生態安全性高及經濟效益顯著等優點,符合綠色、安全的植物保護理念,是目前降低化學農藥使用、提高農業生產可持續性的一種理想替代手段[5],而挖掘具有生防潛質的微生物資源也成為了目前植物保護領域的重要研究方向[6]。
植物根際是植物根系與土壤進行物質交流的重要區域,植物體在生長發育過程中向土壤中釋放的根系分泌物對土壤微生物具有富集趨化作用[7]。相較于植物非根際區域,根際土壤中微生物的相對豐度及多樣性更高,而活躍于植物根系表面及根際土壤的有益微生物通過活化土壤養分,調控植物土壤微生態等機制,顯著影響植物生長發育和質量形成,最終實現對植物體生長的正向促進作用[8]。此外,根際有益微生物可通過空間和營養競爭、重寄生作用、拮抗作用以及誘導植物抗病性等方式,抑制植物病原微生物的生長[9]。因此,利用植物根際有益微生物防控植物真菌性病害的研究備受科研工作者的關注[10-11]。楊茉等[12]從辣椒根際土壤中分離篩選獲得5 株對立枯絲核菌(Rhizoctonia solani)、尖孢鐮刀菌(F.oxysporum)、辣椒疫霉菌(Phytophthora capsiciLeonian)及辣椒炭疽菌(Colletotrichum capsicibulterg)具有生防潛力的植物根際促生菌。Khalil等[13]研究證實,篩選自植物根際的醋酸鈣不動桿菌(Acinetobacter calcoaceticus)、暹羅芽胞桿菌(Bacillus siamensis),可通過產生鐵載體、生物膜、蛋白酶、內切葡聚糖酶和吲哚乙酸等,實現對番茄枯萎病的防控作用及對番茄植株的促生作用。Silva等[14]研究發現,根際真菌哈茨木霉(Trichoderma harzianum)ESALQ-1306 和棘孢木霉(T.asperellum)BRM-29104 可通過調控內生菌群多樣性,改變大豆內生菌群的群落組成,協助大豆抵御核盤菌侵染,有效降低大豆菌核病造成的作物減產。此外,枯草芽孢桿菌(B.subtilis)[15]、哈茨木霉[16]等作為優質的生防菌源均已被開發為生物制劑,廣泛應用于作物病害田間管理。但有關防風枯萎病、根腐病等真菌性病害的生物防控研究國內外鮮有報道。
為發掘防風根際土壤中的有益微生物資源,獲取對防風枯萎病、根腐病具有較好抑菌作用的生防菌源,本研究以防風健康根際土壤為研究對象,從中分離純化篩選獲得1 株對尖孢鐮刀菌、木賊鐮刀菌均具有顯著抑菌活性的拮抗真菌MR-43,基于形態學觀察,結合ITS 基因序列分析確立其分類學地位。通過室外盆栽試驗方法對拮抗真菌MR-43 的土壤定殖能力、防病效果及植物促生效果進行系統評價,以期為防風枯萎病、根腐病等真菌性病害生物制劑的開發提供優質生防菌源,為藥用植物病害的生物防控研究提供理論依據。
1 材料與方法
1.1 材料
1.1.1 土樣采集 2020年6月于吉林省長春市吉林農業大學防風栽培實驗田(43°48'24″N、125°24'59″E,海拔251 m),以五點采樣法結合抖落法,采集健康防風植株根際土壤(距離主根及須根根軸表面0-3 mm 土壤),收集土樣經均勻混合后置于無菌自封袋內并編號為MR,4℃保存、備用。
1.1.2 供試病原真菌 尖孢鐮刀菌(F.oxysporum)Fox201、木賊鐮刀菌(F.equiseti)Feq112 分別為防風枯萎病、根腐病致病菌,均由吉林農業大學植物病理研究室提供。
1.1.3 供試培養基 馬鈴薯葡萄糖瓊脂(potato dextrose agar,PDA):去皮馬鈴薯200 g,葡萄糖20.0 g,瓊脂17.0 g,去離子水1 000 mL。馬鈴薯葡萄糖水(potato dextrose broth,PDB):去皮馬鈴薯200.0 g,葡萄糖20.0 g,去離子水1 000 mL。
1.1.4 供試試劑 代森錳鋅可濕性粉劑(70% W/W,mancozeb,WP),四川潤爾科技有限公司;多菌靈可濕性粉劑(50% W/W,carbendazim,WP),江蘇豐山集團股份有限公司;哈茨木霉T-22(有效活菌數50 億/g),山東綠隴生物科技有限公司;枯草芽孢桿菌BSn5(有效活菌數200 億/g),山東奧豐生物科技有限責任公司;利福平(≥97% W/W,rifampicin,Reagent grade),上海麥克林生化科技有限公司;DNA Marker 和 PCR 擴增試劑盒,日本TaKaRa 公司;PCR 產物純化試劑盒及ITS 合成引物,生工生物工程(上海)股份有限公司。
1.2 方法
1.2.1 根際真菌的分離、純化及保存 于無菌條件下,采用稀釋平板法對根際土壤真菌進行分離[17]。取供試土樣與無菌水按照1∶9 比例混合于無菌錐形瓶中,充分振蕩 10 min 后靜置。將所得土壤懸濁液梯度稀釋至103、104、105倍,備用。分別吸取不同梯度溶液200 μL 稀釋液涂布于PDA 中,于25℃恒溫倒置培養5-7 d 后,挑取具有真菌特征的菌落于PDA 平板上純化,編號為MR,-20℃保藏備用。
1.2.2 拮抗真菌的篩選 采用對峙培養法[18],于無菌條件下,將經過活化培養后的供試根際真菌、尖孢鐮刀菌及木賊鐮刀菌分別用打孔器制成直徑為 8 mm 的菌餅,2 種病原真菌分別接種于直徑為 90 mm PDA 平板中央,根際真菌接種于距平板中心 30 mm處的對稱點,以單接病原菌為對照,每處理重復3 次,置于21-25℃恒溫培養7 d,觀察記錄抑菌情況,計算抑菌率[19]。
抑菌率(%)=(RC-RP)/RC×100%
其中,RC 為對照趨勢半徑,RP 為處理趨勢半徑。
1.2.3 拮抗真菌的鑒定
1.2.3.1 形態學觀察 于無菌條件下,將活化后的拮抗真菌制成8 mm 的菌餅,接種于PDA 培養基平板中央,3 次重復,置于25℃恒溫倒置暗培養,逐日觀察拮抗真菌的菌落形態、顏色等特征。挑取培養物進行制片,顯微觀察菌絲、分生孢子等形態特征[20]。
1.2.3.2 分子鑒定 將活化后的拮抗真菌接種于PDB 培養液中,25℃、150 r/min 振蕩培養5 d,收集菌絲,采用TaKaRa MiniBEST Universal Genomic DNA Extraction Kit Ver.5.0 試 劑 盒(TaKaRa Bio,Japan)提取真菌基因組DNA,通過1%的瓊脂糖凝膠電泳檢測DNA 質量。
1.2.3.3 DNA 擴增 基于ITS-PCR 對拮抗真菌DNA 進行擴增[21-22],引物為ITS1(5'-TCCGTAGGTGAACCTGCGG-3')和ITS4(5'-TCCTCCGCTTATTGATATGC-3'),反應體系:Master Mix 12.5 μL、ITS1 1 μL、ITS4 1 μL、rDNA 2 μL、ddH2O 8.5 μL,擴增程序:94℃ 3 min;94℃ 30 s,55℃ 30 s,72℃ 1 min,30個循環;72℃延伸5 min,4℃保存。PCR 擴增產物交由上海生工進行測序。
1.2.3.4 序列同源性比較和聚類分析 將拮抗真菌測序結果提交NCBI 核苷酸數據庫并進行BIAST 比對分析,利用MEGA 5.2 軟件(https://www.megasoftware.net/megamac.php,Arizona State University)進行Clustal W 多重比對,并以鄰近法(neighbor-joining)構建系統發育樹。
1.2.4 MR-43 利福平(Rif)標記菌株的篩選及土壤定殖能力評價
1.2.4.1 利福平標記菌株篩選 對拮抗真菌MR-43進行利福平抗性誘變,將MR-43 依次接種于含50、100、200、300、350、400 μg/mL Rif 的PDB 中進行逐級培養,培養條件為25℃,170 r/min 振蕩培養5 d。當菌株MR-43 可在含400 μg/mL Rif 的PDB 中穩定生長,且形態學指標及對木賊鐮刀菌抑菌活性無明顯變化時,即得拮抗真菌MR-43 的利福平標記菌株,將其編號為MRRif-43,-20℃保存備用。
1.2.4.2 菌株MRRif-43 孢子懸液制備 將MRRif-43菌株在PDA 平板上25℃培養7 d 后,用無菌水洗脫其分生孢子,并配制為1×108CFU/mL 孢子懸液,4℃保存備用。
1.2.4.3 菌株MR-43 的土壤能力評價 將供試MRRif-43 孢子懸液與防風栽培土壤按照1∶10 比例均勻混合后放入育苗盆缽中,每處理10 次重復,室溫下放置,每隔7 d 回收分離1 次土壤中的菌株MRRif-43,統計并記錄其在土壤中的定殖菌量。
1.2.5 拮抗真菌 MR-43 的防病效果
1.2.5.1 病原菌孢子懸液的制備 將尖孢鐮刀菌、木賊鐮刀菌菌株分別在PDA 平板上25℃培養10 d后,用無菌水洗脫2 種病原真菌的分生孢子,并分別配制為1×108CFU/mL 孢子懸液,4℃保存備用。
1.2.5.2 盆栽防病試驗 參考Gholami 等[23]研究方法。土壤基質(農田土壤∶蛭石=2∶1)已分別用尖孢鐮刀菌、木賊鐮刀菌孢子懸液進行預先感病。選取長勢一致、根系發達的1年生健康防風植株,共設計2 個實驗小區,分別為尖孢鐮刀菌防病區和木賊鐮刀菌防病區,每小區均設置5 個處理,分別為無處理對照(水)、農藥處理組(5.0 g/L 多菌靈50%可濕性粉劑用于尖孢鐮刀菌引起的防風枯萎病,0.18 g/L 代森錳鋅70%可濕性粉劑用于木賊鐮刀菌引起的防風根腐病)、枯草芽孢桿菌菌懸液(含菌量1×107CFU/mL)、哈茨木霉孢子懸液(含菌量1×107CFU/mL)、MR-43 孢子懸液(含菌量1×107CFU/mL)。
各實驗小區獨立且完全隨機分布,每個處理進行20 個重復。常規農業管理70 d 后,調查防風枯萎病、根腐病發病情況,計算病情指數及防病效果。防風枯萎病和根腐病發病程度分為9 級(表1)。
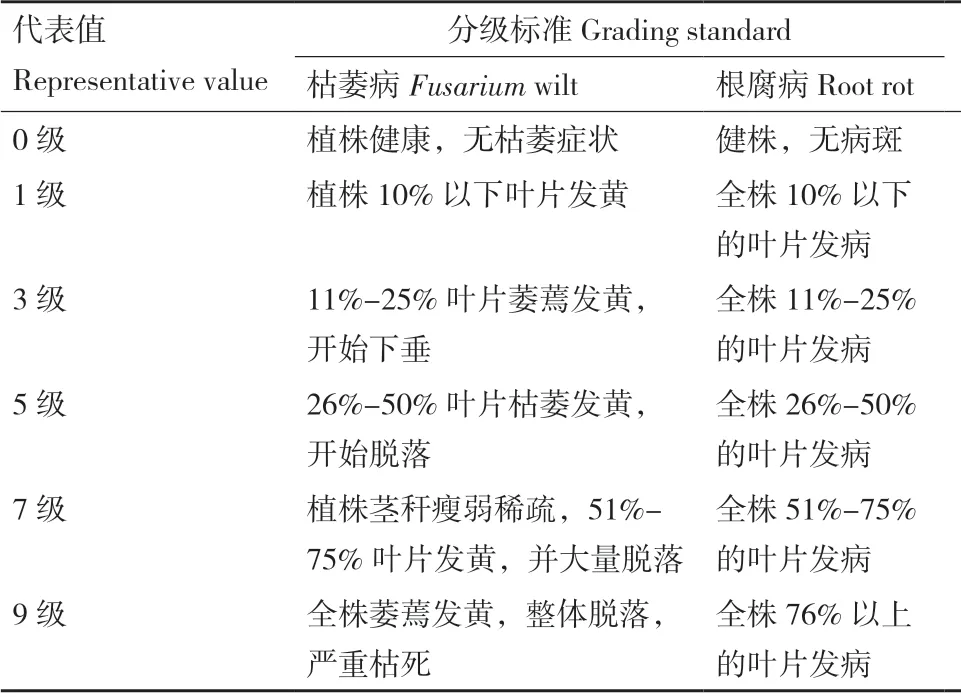
表1 防風枯萎病和根腐病發病程度分級標準Table 1 Disease grading standard of Fusarium wilt and root rot of S.divaricata
病情指數=[∑(病級株數×代表值)/(總株數×最高病級代表值)]×100
防病效果(%)=(對照病情指數-處理病情指數)/對照病情指數×100%
1.2.6 拮抗真菌MR-43 的促生能力評價 土壤基質(農田土壤∶蛭石=2∶1)已預先進行消毒滅菌。選取長勢一致、根系發達的1年生健康防風植株,共設置4 個處理,分別為無處理對照(水)、枯草芽孢桿菌菌懸液(含菌量1×107CFU/mL)、哈茨木霉孢子懸液(含菌量1×107CFU/mL)、MR-43 孢子懸液(含菌量1×107CFU/mL)。實驗小區為完全隨機分布,每個處理進行15 個重復。常規農業管理60 d 后,隨機抽取9 株防風植株,測定并記錄防風的全株長度、根長、全株鮮重、全株干重、根鮮重、根干重等生物量指標。
1.2.7 數據分析 實驗數據采用SPSS ver.13.0(SPSS,Inc.,Chicago,USA)統計分析,采用鄧肯氏新復極差法進行差異顯著性分析。
2 結果
2.1 根際土壤真菌的抑菌活性
本研究于防風根際土壤中共分離純化104 株真菌。如表2所示,7 株根際真菌對尖孢鐮刀菌和木賊鐮刀菌均具有拮抗作用,抑菌率為9.91%-61.85%。菌株MR-43、MR-38 對尖孢鐮刀菌的抑菌率達56%以上,且MR-43 菌株的抑菌活性顯著高于余下6 種拮抗真菌,抑菌率為59.63%(P<0.05)。與尖孢鐮刀菌相比,7 株拮抗真菌對木賊鐮刀菌的拮抗作用更為明顯,MR-24、MR-70、MR-43 等6 株拮抗真菌對木賊鐮刀菌的抑菌率均達55%以上,其中菌株MR-24 抑菌率為61.85%,差異顯著(P<0.05)。但菌株MR-24 對尖孢鐮刀菌的抑菌率僅為22.36%,其對供試2 種病原真菌的平均抑菌率為42.11%,而MR-43 菌株對尖孢鐮刀菌和木賊鐮刀菌的平均抑菌率為58.34%,由此說明,MR-43 更為有效地控制了2 種病原真菌生長擴繁(圖1)。經多次驗證,菌株MR-43 的抑菌活性穩定,因此將其作為候選菌株用于后續研究。
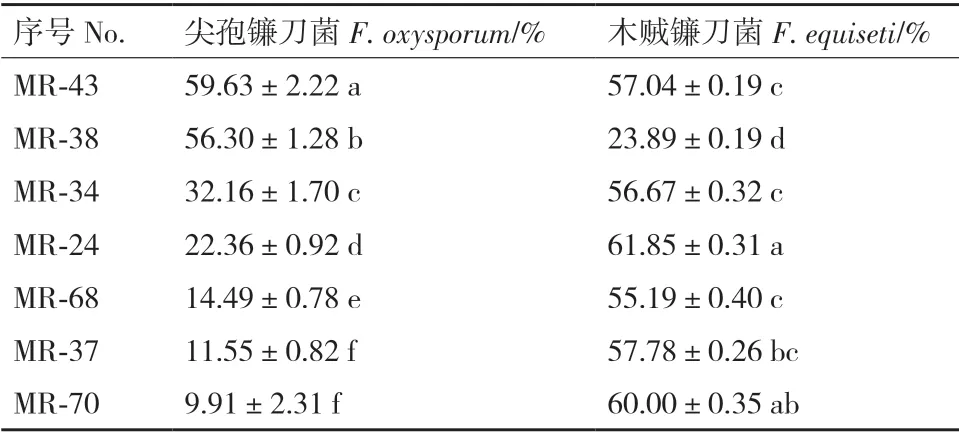
表2 根際真菌對防風病原真菌的抑制作用Table 2 Antifungal activities of selected rhizospheric fungi against fungal pathogens of S.divaricata
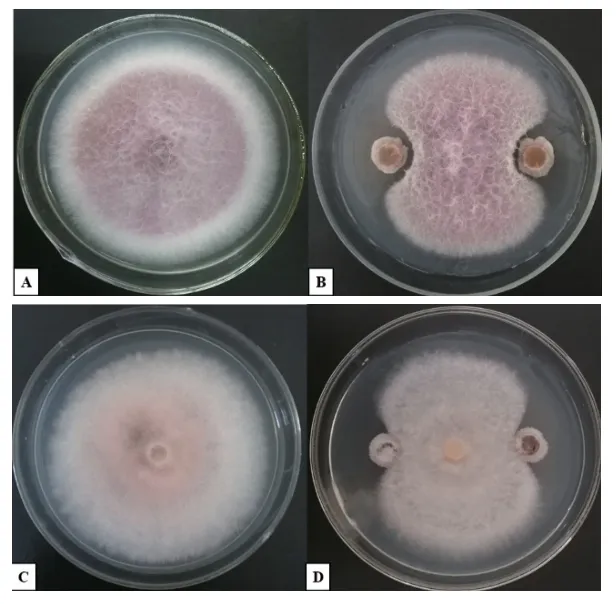
圖1 菌株MR-43 對尖孢鐮刀菌、木賊鐮刀菌生長的影響Fig.1 Effects of MR-43 on F.oxysporum and F.equiseti during the dual culture assay
2.2 拮抗菌株MR-43的分類學鑒定
2.2.1 形態學鑒定 MR-43 菌落在PDA 平板上25℃倒置暗培養7 d 后,菌落平鋪、密實,有分泌物滲入PDA 中,邊緣不規則,菌落正面呈粉白色(圖2-A),菌落背面有放射狀褶皺,呈橙紅色(圖2-B)。分生孢子橢圓形(5-7)μm ×(2-4)μm(圖2-C),分生孢子梗直或略彎(圖2-D、E),產孢瓶體單孢、輪生,每輪3-10 個產孢瓶體,底部漸細,頂端略膨大,瓶體(9-14)μm ×(2-4)μm(圖2-F)。結果表明,菌株MR-43 的形態與葡萄穗霉科真菌相近。
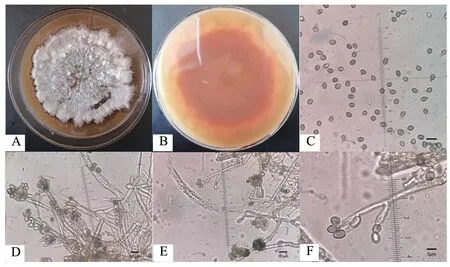
圖2 菌株MR-43 菌落形態及顯微形態特征Fig.2 Microscopic morphology characteristics and the colony morphology of strain MR-43 isolate
2.2.2 分子生物學鑒定 菌株MR-43 的ITS 基因序列經PCR 擴增,由上海生工公司測序,獲得大小為540 bp 的堿基序列,GenBank 登陸號為OK287148.1。序列上傳至NCBI 經BLAST 比對,與Sirastachys castanedae(KU846661.1)的同源性達99% 以上,與S.pseudolongispora(KU846674.1)、S.longispora(AF081482.1)、S.parvispora(KX690114.1)的同源性為97%-98%。基于系統發育樹的構建,結果(圖3)顯示,菌株MR-43 與S.castanedae(MW793377.1)表現了高度同源性并處于同一分支。
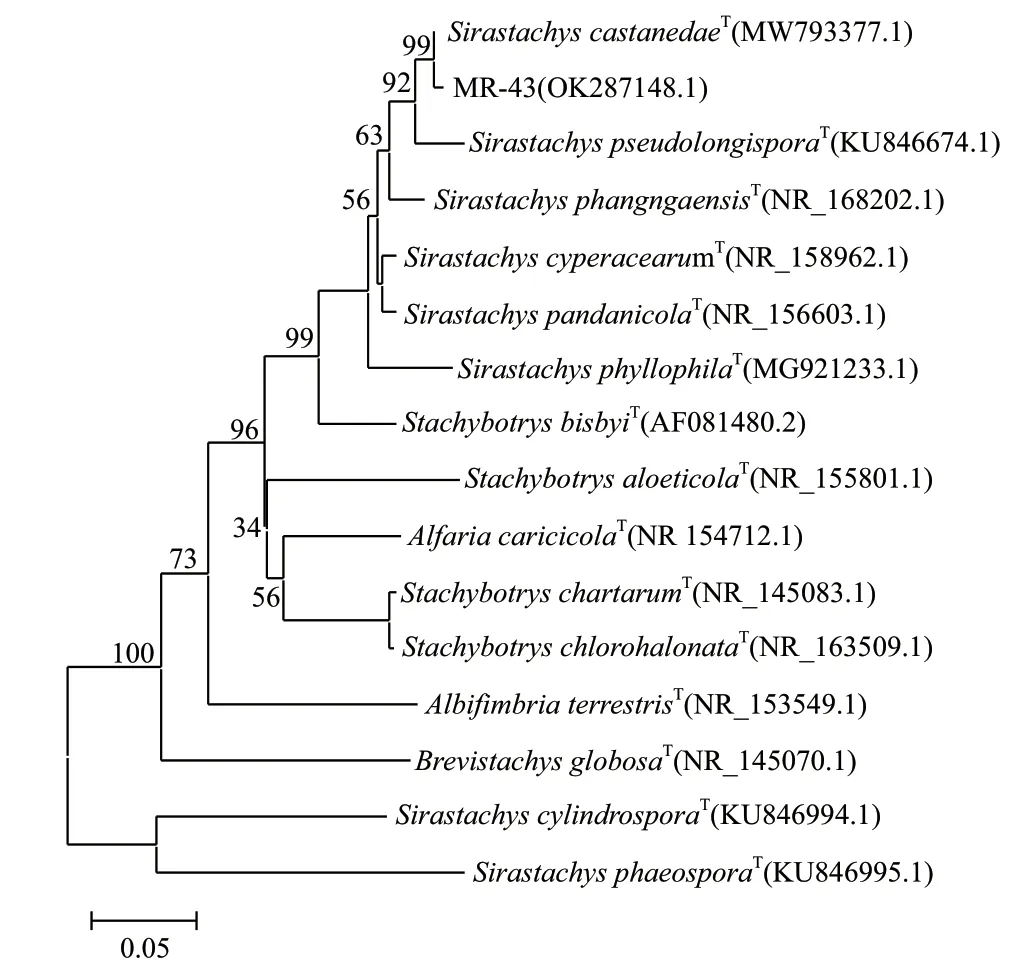
圖3 基于ITS 序列構建MR-43 近緣關系的系統發育樹Fig.3 Phylogenetic tree of MR-43 isolate and closely related taxa based on ITS sequences
結合形態學、分子生物學鑒定結果,將分離自防風根際土壤的菌株MR-43 確定為S.castanedae。這是首次發現并報道該菌種可宿生于植物根際土壤。
2.3 菌株MR-43的土壤定殖能力
菌株MRRif-43 經傳代培養10 代后仍可在含400 μL/mg 利福平的PDA 平板上穩定生長,且較菌株 MR-43 的形態無明顯變化。菌株MRRif-43 對尖孢鐮刀菌、木賊鐮刀菌的抑菌活性與菌株MR-43 相比無顯著差異,抑菌率仍可保持約60%,結果表明,菌株MRRif-43 具有遺傳穩定性且對病原真菌仍保持較好抑菌活性。土壤定殖試驗周期為35 d,未接種標記菌株的供試土壤經檢測,其所含微生物無法在含有400 μg/mL 利福平的PDA 平板生長,由此說明,該濃度下的抗生素選擇培養基可用于MRRif-43 菌株的有效回收。如圖4所示,土壤中菌株MRRif-43的菌量變化呈明顯波動趨勢。接種14 d,MRRif-43的土壤含菌量降至1.85×106CFU/g 土;第21 天,MRRif-43 實現擴繁,其土壤含菌量上升至5.36×106CFU/g 土,增幅為190%,差異顯著(P<0.05);第28 天,菌株MRRif-43 的定殖菌量出現小幅下降,至35 d,MRRif-43菌株的土壤含菌量回升至5.38×106CFU/g 土,與28 d 相比差異顯著(P<0.05),定殖菌量較為可觀。結果表明,菌株MR-43 具有良好的土壤定殖能力。
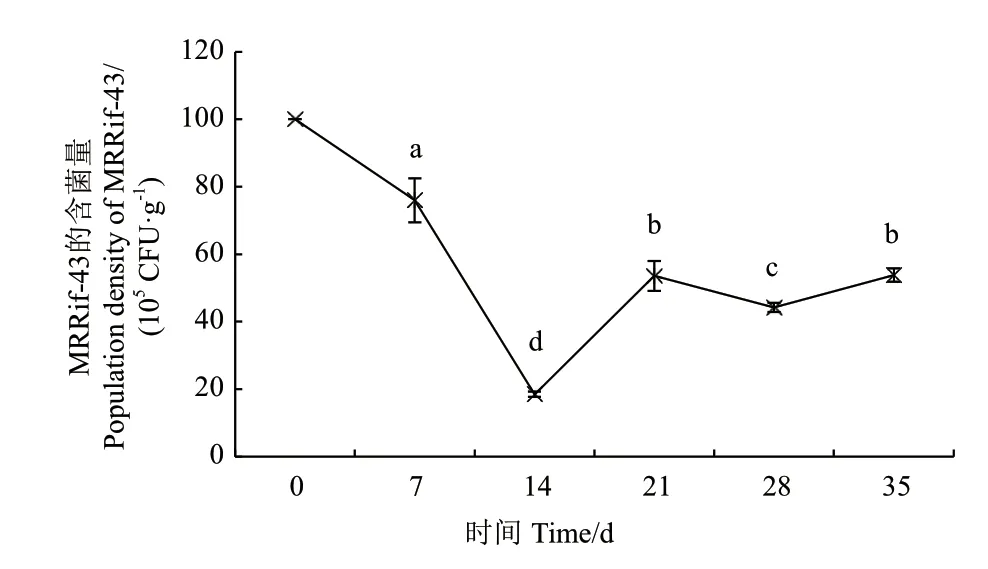
圖4 菌株MRRif-43 在防風土壤中的定殖情況Fig.4 Colonization of MRRif-43 in the soil of S.divaricata
2.4 菌株MR-43對防風枯萎病及根腐病的防控效果
篩選自防風根際土壤的菌株MR-43,其孢子懸液回施于防風栽培土壤后,可有效緩解防風枯萎病、根腐病病害的發生,降低病害危害。接種MR-43 70 d 后,對照組防風植株枯萎病、根腐病均發生嚴重,病情指數分別為50.59、64.14,而經多菌靈、代森錳鋅農藥處理,以及枯草芽孢桿菌、哈茨木霉和MR-43 孢子懸液處理后防風病害均得到了不同程度地控制。其中,MR-43 對枯萎病、根腐病的防效可達63%以上,平均防效為68.51%,與農藥處理組相比差異不顯著(P>0.05);菌株MR-43 防效顯著高于枯草芽孢桿菌、哈茨木霉(表3,圖5)。

圖5 MR-43 對防風根腐病、枯萎病的防控效果Fig.5 Biocontrol effects of MR-43 against the root rot and Fusarium wilt disease of S.divaricata
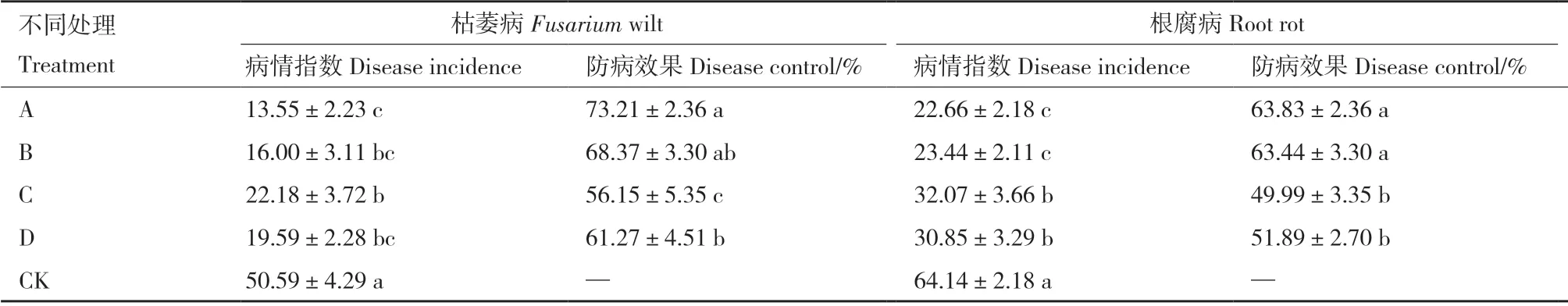
表3 MR-43 孢子懸液對防風真菌性病害的防效Table 3 Control effect of the MR-43 spore suspension on fungal disease of S.divaricata
2.5 菌株MR-43對防風植株生長的影響
將菌株MR-43 接種于防風植株后,其葉片、莖梗及根須等部位未出現致病引發的霉爛或病斑,表明S.castanedaeMR-43 對藥用植物防風無致病力。如表4所示,菌株MR-43、B.subtilis菌懸液及T.harzianum孢子懸液均可不同程度的促進防風植株生長。經MR-43 處理后的防風整株長度、根鮮重及根干重指標均顯著高于其他處理組(P<0.05)。與CK組(清水處理)相比,MR-43 組防風整株長度、整株鮮重等6 項指標平均增加33.44%,防風根鮮重及根干重提高44%以上。結果表明,菌株MR-43 可促進防風生長,具有根際促生真菌(plant growthpromoting fungi,PGPF)屬性,可作為增產有益菌源進一步研究開發。
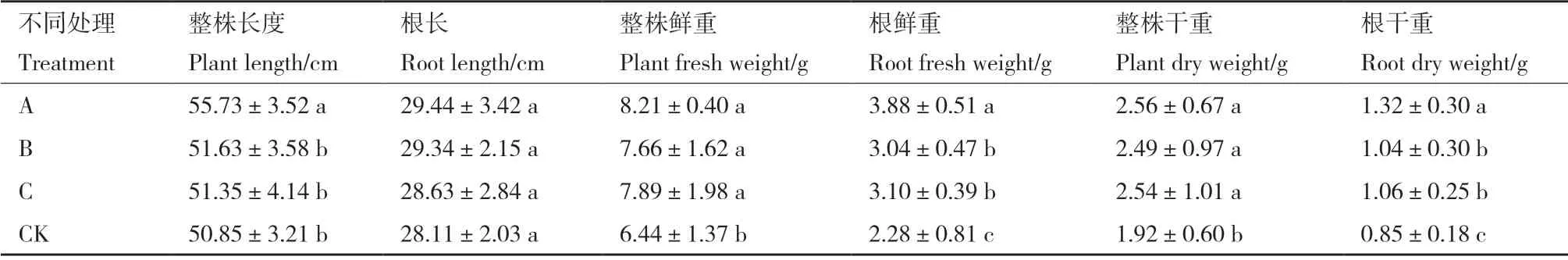
表4 MR-43 對防風植株的促生效果Table 4 Effects of MR-43 on the promoting growth of S.divaricata
3 討論
葡萄穗霉科(Stachybotryaceae)真菌是土壤中普通存在的腐生菌成員之一[24],雖然部分該科真菌可引起人類疾病[25-26],但其作為較早被發現并命名的真菌物種之一,在植物病害防控方面擁有較高的研究價值[27],作為生防菌源具有一定的開發潛力[28]。本研究在開展吉林長春防風栽培基地土壤有益微生物資源調查的研究中,篩選獲得1 株對防風常見真菌性病害致病菌尖孢鐮刀菌、木賊鐮刀菌具有較強拮抗作用的根際真菌MR-43,基于培養特性、顯微形態特征及分子生物學手段,將菌株MR-43 鑒定為Sirastachys castanedae,首次發現該菌種可作為土著真菌宿生于植物根際土壤。S.castanedae隸屬于子囊菌門(Ascomycota),盤菌亞門(Pezizomycotina),糞殼菌綱(Sordariomycetes),肉座菌亞綱(Hypocreomycetidae)肉座菌目(Hypocreales),葡萄穗霉科(Stachybotryaceae),Sirastachys組進化分支中,在1964年首次發現于加拿大安大略省的阿伯福伊爾地區種植的北美香柏土壤,目前S.castanedae僅在中國及西班牙等個別國家有資源調查及分布的報道[29-31]。
生防真菌對植物病原菌具有多種直接或間接的抑菌機制,包括生態位競爭、真菌寄生、抗性物質溶菌及誘導植物抗性等[32]。研究發現,葡萄穗霉科真菌可通過產生β-1,3-葡聚糖酶、幾丁質酶等物質有效抑制植物病原真菌的生長[29]。本研究發現,經菌株MR-43 作用后的尖孢鐮刀菌及木賊鐮刀菌,其菌落邊緣均變薄且趨于清晰,氣生菌絲溶解消亡。由此推測S.castanedaeMR-43 可通過產生某些次生代謝物質破壞病原真菌菌絲胞壁或胞膜結構,實現抑制病原真菌生長的作用機制,由此暗示S.castanedae胞外次生代謝產物具有植物病害生防制劑的開發潛質。但S.castanedaeMR-43 產生抑菌效應的具體物質尚不明確,仍需開展后續工作挖掘研究。
拮抗微生物的定殖能力強弱直接影響其生防作用有效性及穩定性,同時也是評估生防菌源應用潛力的重要指標[33]。本研究基于抗生素標記法,證實S.castanedaeMR-43 對防風栽培土壤環境的適應力強,可實現穩定地擴繁增殖,具有較好的土壤定殖能力。后續會進一步評價MR-43 在防風等植株體內的定殖效果。
目前,植物病害生物防控研究中普通存在生防菌源室內抑菌效果明顯,但室外盆栽或田間防效偏低的問題[34]。本研究利用MR-43 孢子懸液,證實了S.castanedae可有效防控防風枯萎病、根腐病,其室外盆栽防病效果與室內抑菌效果相比仍保持較高水平,且與常規化學農藥的病害管理效果持平。此外,本研究發現S.castanedaeMR-43 對防風植株的生長具有促進作用,效果優于已進行農藥登記注冊的B.subtilis和T.harzianum。有研究者稱,將非土著性外源微生物大量引入土壤,易受到來自于習居優勢微生物的競爭或其他環境因子的影響,其生長繁殖受限導致生防效果不理想,且非土著性微生物對土壤小環境的習居微生物可能存在取代作用,由此改變土壤微生物群落結構特征,影響土壤原有的微生態平衡[35]。土著群落的多樣性及結構對群落功能的發揮具有重要作用,外源微生物的過分干擾,可能會導致宿主植物與土壤微生物的互作受到直接或間接的影響[36]。本研究中,枯草芽孢桿菌、哈茨木霉作為外源微生物,并非源自防風栽培土壤固有的微生態平衡體系,引入土壤后可能與土著微生物存在生態位重疊,土著微生物的功能多樣性發生變化導致土壤代謝功能下降,最終影響了外源生防微生物對植物促生效果的發揮。綜上所述,分離篩選自防風根際土壤的S.castanedaeMR-43 在防風生態友好型病害防控及作物增產方面具有開發及應用潛力。
4 結論
本研究于防風根際土壤中分離篩選1 株葡萄穗霉科(Stachybotryaceae)真菌S.castanedaeMR-43,發現該菌種可宿生于植物根際土壤。S.castanedaeMR-43 可在防風栽培土壤中穩定擴繁,具有良好的定殖能力,且其病害防控能力及對防風植株的促生能力均較為突出。由此說明,S.castanedaeMR-43 作為防控防風真菌性病害的候選生防菌源具有開發應用潛力。

