ZLY18通過抑制TGF-β1/Smads通路改善血管緊張素Ⅱ誘導的心肌纖維化
馬定虎,周宗濤,李 政,張淯涬,路 靜,劉培慶,
(1.暨南大學藥學院,廣東 廣州 510632;2.廣東藥科大學藥學院,廣東 廣州 510008,3.中山大學藥學院,廣東 廣州 510275)
心肌纖維化是指在心肌組織結構中膠原纖維大量積聚、細胞外基質(extracellular matrix,ECM)明顯升高或其成分發生改變,該病理過程減弱了心肌舒張及收縮功能,是導致心力衰竭發生的重要原因之一[1-2]。研究已證實心肌纖維化與心房顫動、室性心動過速、心室顫動的發生發展密切相關[3]。抗纖維化治療有望成為治療心律失常的新型手段。
心肌纖維化主要是由心肌成纖維細胞的激活所介導的,這是一個由成纖維細胞通過增殖和收縮等方式轉化為肌成纖維細胞的過程,在此過程中基因表達增加,如ACTA2(編碼α-平滑肌肌動蛋白,α- SMA)。此外,肌成纖維細胞還通過產生和分泌基質金屬蛋白酶(matrix metalloproteinases,MMPs) 和基質金屬蛋白酶組織抑制劑(tissue inhibitor of metalloprotein-ase,TIMPs)來驅動組織間ECM重構,轉化生長因子β(transforming growth factor β,TGF-β)表達水平升高等[4-5]。TGF-β蛋白家族在成纖維細胞激活和ECM產生中起著關鍵作用[5-6]。Smads是TGF-β蛋白家族中表征最好的細胞內效應子,TGF-β1能夠明顯激活Smads依賴性信號級聯反應,在纖維化的發生發展中起著關鍵作用[7]。迄今為止,尚無臨床治療方法能有效阻斷心肌纖維化且無副作用,其具體病理機制仍需要待進一步闡明。
我們前期研究發現,ZLY18是一種新型的四聯FFA1/PPAR-α/γ/δ激動劑,在調節脂質合成、氧化應激、炎癥和纖維化相關基因表達方面具有明顯的作用,如ZLY18能夠明顯抑制TGF-β1、TIMP-1和1型膠原蛋白α (type 1 collagen,COL1A1)等纖維化相關基因的表達。此外,ZLY18對非酒精性脂肪性肝炎(NASH)引起的脂肪肝和纖維化具有明顯的改善作用,并且對四氯化碳(CCl4)誘導的肝纖維化的預防作用強于吡非尼酮[8]。基于此,本研究旨在探究ZLY18對AngⅡ誘導的心肌纖維化的作用及其調控機制,為心肌纖維化導致的心臟疾病提供新治療策略。
1 材料與方法
1.1 材料
1.1.1細胞與實驗動物 本實驗所采用的心肌成纖維細胞均為從成年雄性Sprague Dawley(SD)大鼠分離所得。SD大鼠購自中山大學實驗動物中心,雄性C57BL/6小鼠,6~8周齡,體質量(20±2)g,用于構建Ang Ⅱ誘導的心肌纖維化動物模型,購自廣東省醫學實驗動物中心。動物質量合格證(No.44007200085381)。所有的實驗操作均在中山大學動物中心屏障環境內實施完成。所有動物實驗流程均嚴格按照《Guide for the Care and Use of Laboratory Animals》執行。
1.1.2試劑 BCA蛋白定量試劑盒(Pierce,23227);胎牛血清(Gibco,10270106);α-Tubulin 抗體(Sigma,F2168-.2ML);4%多聚甲醛 (武漢博士德,AR1069);RIPA裂解液 (武漢博士德,AR0105-10);PMSF (Sigma,10837091001);一抗稀釋液 (廣州勵德生物,PN1810);分子量Marker #26616(Thermo,26616);ECL化學發光檢測試劑盒(Tanon,180-5001);Fibronectin抗體(Abcam,ab45688);Collagen I抗體(武漢博士德,BA0325);α-SMA抗體(武漢博士德,BM0002);Alexa Fluor 488-conjugated anti-rabbit IgG (Proteintech,SA00006-2);Alexa Fluor 594-conjugated anti-rabbit IgG (Proteintech,SA00006-4);Alexa Fluor 488-conjugated anti-mouse IgG (Proteintech,SA00006-1);Alexa Fluor 594-conjugated anti-mouse IgG (Proteintech,SA00006-3);Smad2/3抗體 (Abcam,ab202445);phospho-Smad3抗體(Abcam,ab118825);TGF-β1抗體(Abcam,ab215715)。
1.2 方法
1.2.1原代心肌成纖維細胞的分離 在無菌條件下開胸取SD大鼠心臟,浸于預冷PBS溶液中,重復沖洗干凈血污后置于干凈玻璃皿中,修剪多余組織后將心臟對稱剪碎至1~3 mm3小塊,轉移至15 mL離心管中用PBS再次洗滌,棄PBS加入0.1%Ⅱ型膠原酶(0.22 μm微孔濾膜濾過除菌)在37 ℃恒溫水浴消化30 min,然后用0.25%胰蛋白酶消化3次每次5 min,接著重復用Ⅱ型膠原酶消化2~3次至消化完全。吸取上清至預冷的15 mL離心管中(提前加入含有胎牛血清的DMEM培養基),終止消化。細胞懸液1 000轉離心10 min,棄上清后重懸細胞懸液,置于37 ℃、5% CO2孵育箱中孵育60 min,差速貼壁法棄去未貼壁細胞,重新加入含10%胎牛血清的 DMEM 培養基。取傳代2~4代的心肌成纖維細胞,按實驗需求進行不同處理。
1.2.2免疫印跡檢測(Western blot) 細胞總蛋白提取:心肌成纖維細胞經傳代、加藥處理后,棄培養基用PBS洗滌干凈加適量RIPA裂解液,在冰上將細胞全部刮下,轉移至提前預冷1.5 mL離心管中冰上孵育 30 min,隔5 min渦旋一次,使細胞充分裂解。得到的細胞裂解液離心15 min (4 ℃、12 000×g),取蛋白上清定量、分裝、變性制成樣品;組織總蛋白提取:取一定質量的心臟組織剪碎、用PBS洗滌干凈后離心棄上清,加入適量RIPA裂解液重懸,冰上充分超聲均勻,然后離心15 min (4 ℃、12 000×g),取蛋白上清定量、分裝、變性制成樣品,然后用適宜濃度的SDS-PAGE 凝膠電泳分離,經電泳,電轉,5%脫脂牛奶封閉60 min,一抗孵育過夜(4 ℃過夜),二抗室溫孵育60 min,然后顯影。
1.2.3實驗小鼠隨機分為對照組和模型組,每組各6只。模型組小鼠皮下注射Ang Ⅱ(2.5 mg·kg-1·d-1),持續4周,對照組給予相同體積生理鹽水。
1.2.4超聲心動檢測 用異氟烷經小動物麻醉機將C57BL/6小鼠麻醉,剔除胸部毛發并用蒸餾水洗干凈避免損傷探頭,將其四肢固定在于含傳感器的恒溫板上,用Vevo 2000超聲心動儀檢測C57BL/6小鼠的各項心功能指標。
1.2.5免疫熒光(immunofluorescence,IF) 心肌成纖維細胞種于激光共聚焦小皿中,細胞結束處理后,棄去培養基,用1 mL PBS洗2次;加200 μL 4%多聚甲醛室溫固定30 min,加入1 mL PBS,置于搖床上洗2次(每次5 min);加入200 μL 1% Triton(PBS配制)溶液,室溫透膜處理10 min,加入1 mL PBS,置于搖床上洗2次(每次5 min);用150 μL山羊血清室溫封閉30 min,棄去山羊血清(免洗)加入 1 ∶100稀釋的一抗,4 ℃孵育過夜;加入1 mL PBS洗去未結合的抗體,5 min×3 次;加150 μL Alexa Flour 594 兔熒光二抗,避光孵育 1 h(1 ∶200,山羊血清稀釋),傾去二抗,加入PBS,避光,置脫色搖床上洗脫,5 min×3次;加入100 μL DAPI(1 ∶5 000,PBS 稀釋)染核10 min,加入1 mL PBS,置搖床上洗脫,5 min×3次。在超高分辨率激光掃描顯微鏡下進行拍攝。
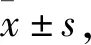
2 結果
2.1 建立AngⅡ誘導的心肌成纖維細胞纖維化模型使用AngⅡ(10-7mol·L-1)誘導心肌成纖維細胞纖維化模型,每隔12 h補加一次,孵育36 h。如Fig 1A所示,AngⅡ處理后模型組纖維化相關指標Fibronectin、Collagen Ⅰ和α-SMA呈現明顯上調的趨勢,提示成功構建AngⅡ誘導的心肌成纖維細胞纖維化模型。
2.2 建立Ang Ⅱ 誘導的心肌纖維化動物模型在C57BL/6小鼠皮下注射AngⅡ(2.5 mg·kg-1)誘導心肌纖維化動物模型,每天給藥連續4周,對照組給予相同體積的生理鹽水。實驗結果表明:與對照組相比,AngⅡ處理后,小鼠心臟體積明顯增大(Fig 1B),心臟系數即心質量體質量比(HW/BW)、心質量脛骨長比(HW/TL)明顯上調(Fig 1C-D)。為進一步觀察小鼠心臟的改變,心臟組織切片HE染色(Fig 1E,F)結果顯示,AngⅡ處理引起小鼠心肌細胞排列紊亂,心肌細胞體積增大,胞質出現空泡化,提示心臟發生病變。采用PSR染色(Fig 1G)觀察心肌細胞纖維化情況,結果顯示,AngⅡ組小鼠心臟細胞發生了明顯的膠原纖維化。進一步檢測組織蛋白分子生物學指標,Western blot結果顯示,AngⅡ處理后,小鼠心臟組織中Fibronectin、Collagen Ⅰ和α-SMA明顯上調(Fig 1H)。以上結果提示,心肌纖維化動物模型成功建立。
2.3 ZLY18對AngⅡ誘導的心肌成纖維細胞纖維化的影響化合物ZLY18的結構式如Fig 2A所示,在心肌成纖維細胞中,以Ang Ⅱ(10-7mol·L-1)誘導心肌成纖維細胞纖維化,每隔12 h補加一次AngⅡ,孵育36 h,模擬心肌纖維化模型。藥物組分為ZLY18(L)組、ZLY18(M)組和ZLY18(H)組,分別給予不同劑量的ZLY18 1 μmol·L-1、2 μmol·L-1和5 μmol·L-1,孵育24 h,研究其對心肌纖維化的作用。Western blot結果顯示,與對照組相比,給予不同劑量ZLY18均能改善由Ang Ⅱ所誘導的纖維化相關標志蛋白Fibronectin、Collagen Ⅰ和α-SMA的上調,并且改善作用具有一定的劑量依賴性(Fig 2B)。進一步免疫熒光實驗結果表明與Western blot結果具有相同趨勢(Fig 2C)。以上結果提示,ZLY18在細胞水平上能夠明顯改善由Ang Ⅱ誘導的心肌成纖維細胞纖維化。
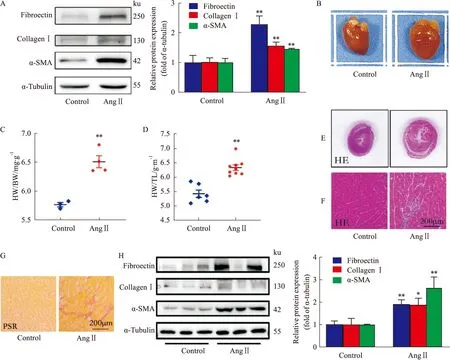
Fig 1 Ang Ⅱ-induced cardiac fibrosis in vitro and in or 6)A:Cardiac fibroblasts were incubated with Ang Ⅱ (10-7 mol·L-1) for the indicated durations;B:C57BL/6 mice were submitted to the subcutaneous injection of angiotensin Ⅱ;C,D:Postmortem measurements of HW/BW and HW/TL were performed;E,F:HE stained transections of the left ventricle were shown;G:Transverse views of left ventricle with PSR staining were shown.*P<0.05,**P<0.01 vs control group.
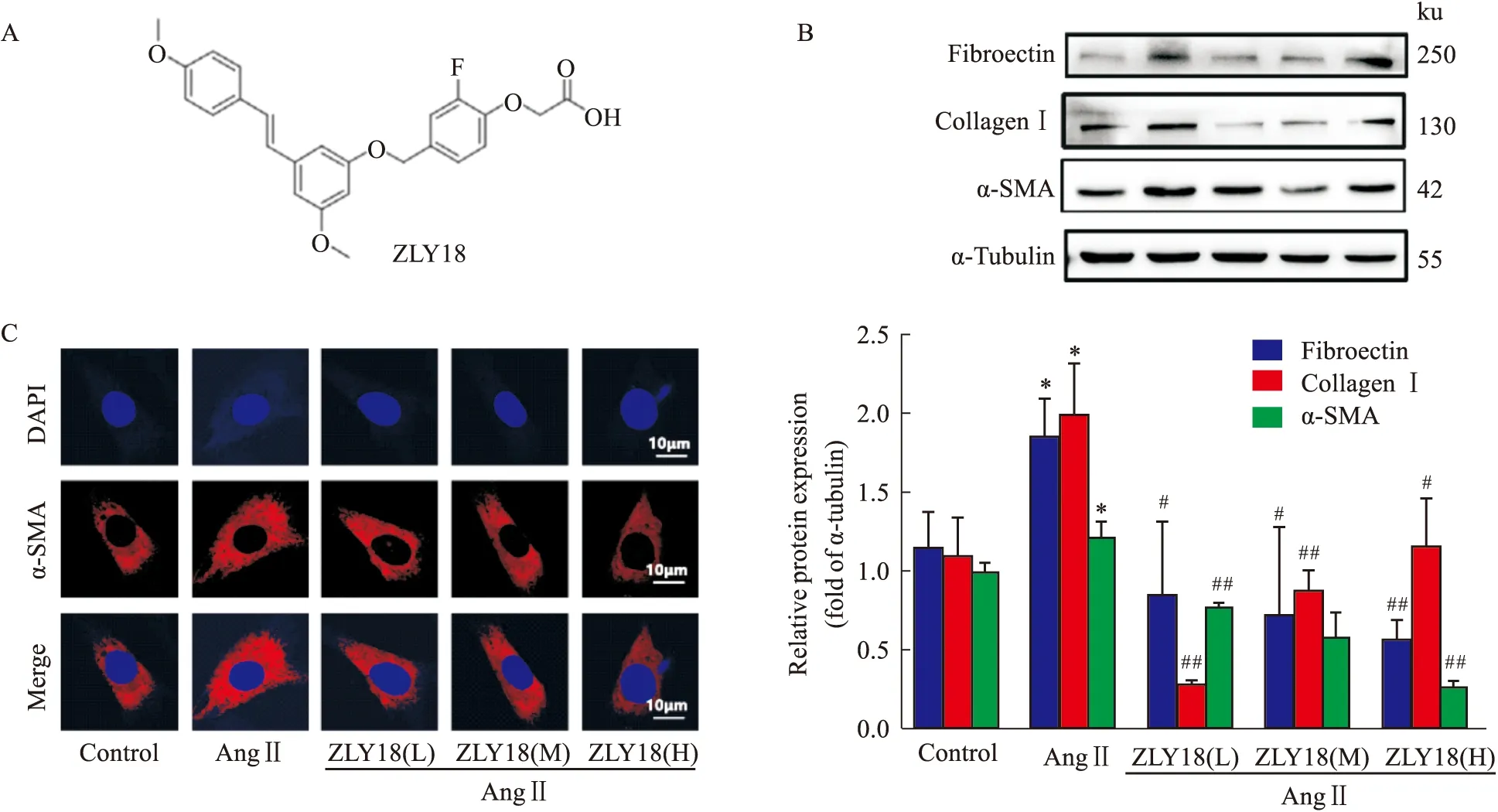
Fig 2 Effect of ZLY18 on Ang Ⅱ-induced cardiac fibroblasts A:Chemical structural formula of ZLY18;B:The protein expression of Fibronectin,Collagen Ⅰ and α-SMA;C:The protein expression of α-SMA in cardiac fibroblasts.*P<0.05 vs Control group,#P<0.05,##P<0.01 vs Ang Ⅱ group.
2.4 ZLY18對AngⅡ誘導的心肌纖維化動物模型的保護作用探究首先,小鼠超聲心動圖結果如Fig 3A所示,進一步對超聲心動結果分析,如Fig 3B-I所示,與對照組相比,Ang Ⅱ組小鼠超聲心動射血分數 (ejection fraction,EF)、左室短軸縮短率 (fraction shortening ,FS)等參數明顯下降,左室前壁厚度(LVAW)、左室后壁厚度 (LVPW)、左室內徑(Diameter)等超聲心動參數均明顯增高,說明Ang Ⅱ 組的小鼠心功能下降,造模成功。而ZLY18處理后EF、FS明顯上調,LVAW、LVPW、Diameter明顯下調,并且具有一定的劑量依賴性。提示藥物組均能夠有效的改善由AngⅡ誘導的EF、FS下降,并一定程度上下調由AngⅡ誘導的LVAW、LVPW和Diameter的增高。
進一步觀察大鼠心臟的改變,心肌組織形態學結果顯示(Fig 4A-C),與對照組相比,AngⅡ組小鼠心臟體積明顯增大,心肌細胞排列紊亂,心肌細胞體積增大,胞質出現空泡化,提示心臟發生病變,而化合物ZLY18處理均能夠明顯的改善AngⅡ誘導的心肌細胞排列紊亂,心肌細胞體積增大,胞質出現空泡。此外,與對照組相比,AngⅡ組HW/BW、HW/TL明顯上調,表明小鼠心功能異常,而ZLY18處理均能夠明顯的改善AngⅡ引起的HW/BW、HW/TL上調(Fig 4D,E)。
心臟發生纖維化病變往往伴隨著大量ECM沉積,它主要由膠原蛋白、糖蛋白、蛋白聚糖以及某些細胞因子、MMPs等組成。如Fig 5A-B所示,與對照組相比,Ang Ⅱ組小鼠膠原水平明顯增加,藥物組處理后小鼠膠原水平均明顯減少。進一步Western blot結果表明,AngⅡ處理后,C57BL/6小鼠心臟組織中Fibronectin、Collagen Ⅰ和α-SMA明顯上調,而給予不同劑量ZLY18均能下調由Ang Ⅱ誘導的纖維化標志蛋白的表達,具有一定的劑量依賴性(Fig 5C-D)。以上結果表明,ZLY18不同劑量均能夠發揮良好的抗纖維化作用。
2.5 ZLY18通過抑制TGF-β1/Smads信號通路改善心肌纖維化如Fig 6A所示,在AngⅡ刺激下,TGF-β1、Smad3的磷酸化水平升高;相比AngⅡ組,給予不同劑量ZLY18下調了TGF-β1、Smad3的磷酸化水平。如Fig 6B所示,ZLY18能夠明顯抑制AngⅡ誘導的TGF-β1、Smad3磷酸化水平增加。以上結果表明,ZLY18在體內、外實驗中均能抑制AngⅡ介導TGF-β1/Smads通路的激活。
Fig 3 The echocardiography results of C57BL/6 mice treated with A:Echocardiography parameters were presented;B:Ejection fraction was detected and calculated;C:Fractional shortening was calculated;D,E:Left ventricular anterior wall thickness was detected and calculated;F,G:Left ventricle posterior wall thickness was detected and calculated;H,I:Both left ventricular internal dimensions at end-diastole and at end-systole were detected and calculated.**P<0.01 vs control group,#P<0.05,##P<0.01 vs Ang Ⅱ group.
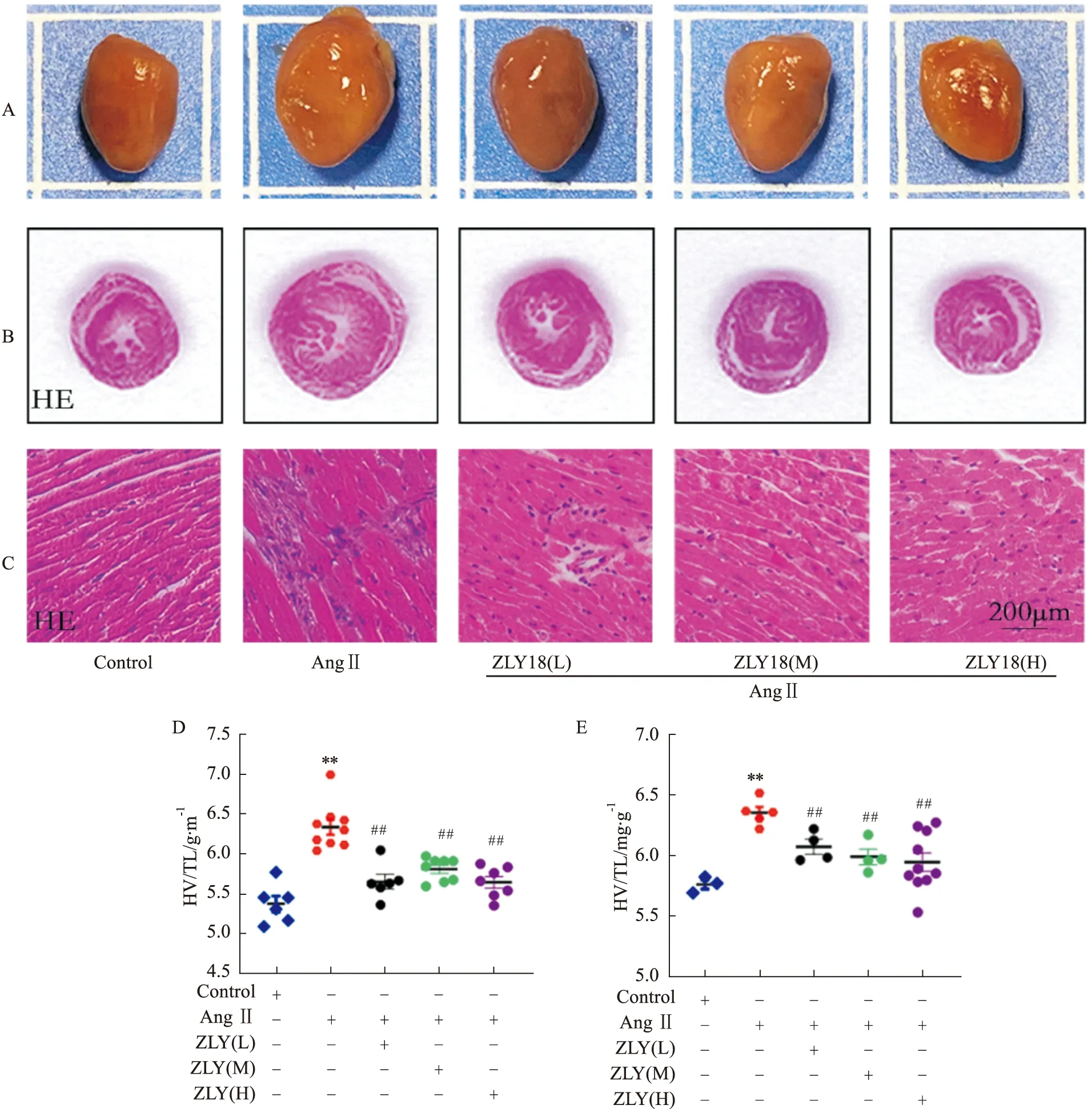
Fig 4 Effect of ZLY18 on Ang Ⅱ-induced cardiac fibrosis A:The control group animals received saline;B,C:HE-stained transections of the left ventricle were shown;D,E:Postmortem measurements of HW/BW and HW/TL were performed.**P<0.01 vs Control group;##P<0.01 vs Ang Ⅱ group.
磷酸化的Smad2/3可與Smad4形成復合物,轉位入核進而調節下游纖維化基因的表達[9],同時給予AngⅡ、ZLY18共處理,處理完成后,通過IF實驗檢測Smad2/3在胞質、胞核分布情況。Fig 6C顯示,正常組Smad2/3在胞核胞質中分布均勻,在AngⅡ刺激下,Smad2/3在細胞核的分布增加,相比AngⅡ組,ZLY18低中高劑量處理均能減少Smad2/3在胞核的分布。以上結果提示:ZLY18通過下調TGF-β1水平,減少Smad2/3入核來抑制AngⅡ介導TGF-β1/Smads通路的激活。
3 討論
心肌纖維化廣泛存在于各類心臟疾病的發生發展過程中,其具體發病機制仍需要進一步闡明。在不同心臟疾病中,心肌纖維化所發揮的作用和具體機制各不相同,心肌纖維化的發生發展伴隨著心功能的下降,最終發展為難治性心衰,成為心臟病患者死亡的主要原因之一[10],因此,預防與延緩心肌纖維化已是目前治療各種心臟疾病的重要策略。
TGF-β1/Smads信號通路激活在心肌纖維化中扮演重要角色,AngⅡ通過調節TGF-β1/Smads信號通路[11]、PPAR γ信號通路[12]等多途徑激活心肌纖維化的發生發展。
腎素-血管緊張素-醛固酮系統(RAAS)在血容量、血壓和鈉穩態的生理調節中具有重要的作用[13]。鑒于這一關鍵作用,RAAS信號傳導也與高血壓、心力衰竭、細胞外基質重塑和纖維化等幾種重要臨床疾病的發病機制密切相關[14]。AngⅡ是一種多功能分子,在幾乎所有身體組織中以內分泌/自分泌/旁分泌的方式起作用,與多種心臟疾病的發生發展密切相關[15]。心肌細胞損傷后,心臟局部RAAS成分明顯升高,AngⅡ增強心肌成纖維細胞與各種ECM蛋白的結合,促進纖維化相關蛋白的表達,從而導致心肌纖維化[16]。本研究采用AngⅡ建立心肌纖維化體內體外模型,給予化合物ZLY18處理后,實驗結果提示ZLY18可能通過抑制RAAS的異常激活,改善由Ang Ⅱ誘導的心肌纖維化,其具體機制仍需要進一步實驗證實。
TGF-β1是調節心肌組織纖維化的關鍵介質之一,且主要通過激活其下游受體Smads信號導致纖維化的發生發展。大量研究表明,TGF-β1通過直接激活Smads信號傳導來引發促纖維化基因過表達。TGF-β1/Smads通路的失常是導致組織纖維化的重要致病機制,而Smad2/3和Smad3則是促進TGF-β1介導的組織纖維化的兩個主要下游調節因子[17]。在病理條件下TGF-β1大量表達并激活TGF-β1/Smads通路,TGF-β1通過與轉化生長因子β受體II(TGF-β RII)相互作用時被激活,然后TGF-βRII磷酸化轉化生長因子β受體I(TGF-β RI),其又磷酸化細胞質介質Smad2/3和Smad3,并且與Smad4形成復合物,易位到細胞核中調節基因轉錄,從而促進心肌纖維化的發生發展[18]。我們的實驗發現,在Ang Ⅱ 誘導的心肌纖維化模型下,化合物ZLY18能夠明顯下調TGF-β1、Smad3磷酸化水平和Smad2/3入核增加,抑制了TGF-β1/Smads信號通路異常激活,提示化合物ZLY18可以明顯改善由Ang Ⅱ誘導的心肌纖維化。
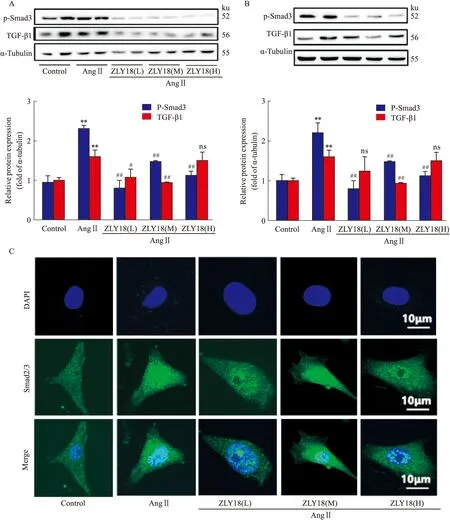
Fig 6 ZLY18 involved in inhibition of Smad3 phosphorylation and nucleus transfer of Smad2/3 by A,B:The protein level of p-Smad3 was analyzed by Western blot in vivo and in vitro;C:The nucleus transfer of Smad2/3 in primary myocardial fibroblasts was detected by IF assay.**P<0.01 vs Control group;#P<0.05,##P<0.01 vs Ang Ⅱ group.
此外,我們前期研究發現,ZLY18通過激活FFA1/PPAR-α/γ/δ信號通路在高脂、高糖飲食聯合CCl4誘導的非酒精性脂肪肝模型中明顯抑制了纖維化相關基因的表達,與抗纖維化劑吡非尼酮相比,ZLY18對肝纖維化導致的炎癥細胞浸潤、肝細胞壞死和靜脈間膠原橋形成減弱作用優于吡非尼酮[10]。因此,我們猜想化合物ZLY18發揮抗纖維化作用是否與FFA1/PPAR-α/γ/δ信號通路激活有關?這種可能性需要進一步實驗證實。
綜上所述,ZLY18可以通過抑制TGF-β1/Smads信號通路來改善由Ang Ⅱ誘導的心肌纖維化。但是,化合物ZLY18對Ang Ⅱ誘導的心肌纖維化的保護作用是否優于吡非尼酮尚不清楚,其抑制RAAS的異常激活仍須進一步探究。

