一貫煎通過調節Parp-1的翻譯后修飾保護肝細胞DNA
張宇佳,葉杰,盧艷琳,3,閆曉風,李 華,王曉玲
(1.上海中醫藥大學基礎醫學院生物教研室,上海 201203;2.蘇州衛生職業技術學院臨床醫學院,江蘇 蘇州 215009;3.上海中醫藥大學附屬龍華醫院腫瘤科,上海 200032)
“感受-修復-恢復”模型是機體對內、外源性DNA損傷后做出的一系列反應。DNA損傷修復是保障基因組穩定的關鍵[1]。當DNA損傷時,聚腺苷二磷酸核糖聚合酶-1(poly ADP-ribose polymerase 1,Parp-1)作為最明顯的DNA損傷“感受器”被募集到損傷處,無論是對單鏈還是雙鏈DNA斷裂損傷都有快速應答能力,在DNA損傷后幾秒到幾分鐘之內就被募集到損傷區[2]。Parp-1被損傷的DNA激活后,首先將腺苷二磷酸核糖單體轉移到底物蛋白包括自身上,催化合成多聚腺苷二磷酸核糖(poly ADP-ribose,Par)聚合物,此聚合物大分子作為平臺募集其它DNA損傷修復相關酶,共同參與DNA損傷修復。Parp-1過度活化可導致DNA碎片化,進而引起細胞死亡,被認為是一個關鍵的細胞死亡介導者[3],但過度抑制Parp-1活性也將導致細胞凋亡,如腫瘤治療中采用Parp-1抑制劑引發癌細胞凋亡[4]。因此,在DNA損傷修復過程中,Parp-1的活性調節對細胞存活或死亡至關重要。
肝細胞是肝臟組織中含量最為豐富的實質細胞,約占肝質量的80%以及肝臟細胞總量的80%左右。藥物、酒精、病毒感染以及自身免疫等因素均可能導致肝細胞損傷,甚至死亡。肝細胞死亡造成數量減少既是各種因素所致肝病的病理表現,也是影響疾病預后的重要因素。氧化應激是致肝細胞損傷、死亡的重要因素之一[5],可通過損傷細胞膜、溶酶體、DNA等引發細胞損傷和死亡[6-7]。
一貫煎(Yiguanjian decoction,YGJ)是中醫滋陰柔肝的名方,出自清代醫家魏之琇的《續名醫類案》。方中重用生地黃滋陰養血、補益肝腎為君,內寓滋水涵木之意。當歸、枸杞養血滋陰柔肝;北沙參、麥冬滋養肺胃,養陰生津,意在佐金平木,扶土制木,四藥共為臣藥;佐以少量川楝子疏肝理氣。既往研究發現,YGJ治療慢性肝病的主要作用靶標在肝細胞,其修復了損傷的肝細胞,所以沒有造成肝細胞數量減少[8]。在此基礎上,本文研究過氧化氫(H2O2)誘導肝細胞DNA損傷修復時,YGJ通過調節Parp-1活性保護肝細胞的作用機制。
1 材料與方法
1.1 材料
1.1.1一貫煎制備 YGJ(北沙參9 g、麥冬9 g、當歸身9 g、生地黃30 g、枸杞子12 g、川楝子5 g)由上海中醫藥大學附屬曙光醫院國家中醫藥管理局中藥制劑中心一次制備成濃縮液,水浴干燥成流浸膏后由上海中醫藥大學中藥學院真空干燥成干粉,冷藏保存,每克藥粉含生藥2.196 g。稱取0.5 g凍干粉+5 mL DMEM配制成母液,0.45 μm濾膜過濾,分裝,-80 ℃保存。臨用時,先以無血清DMEM培養液配制成100 g·L-1生藥濃度,再以無血清培養液配制成使用濃度。
1.1.2細胞 小鼠胚胎來源肝細胞系BNL CL2(ATCC?TIB-73TM)購自中國科學研究院上海細胞庫。
1.1.3 試劑胎牛血清(Gibco),DMEM高糖培養液(Hyclone),過氧化氫(H2O2)和HRP-羊抗兔二抗購自凱基生物;一抗:γ-H2AX(ab11174)、Parp1(#227244)、Sirt-1(ab189494)、兔多克隆抗體GAPDH(ab00073877)購自abcam公司,Par(CST,83732s),EdU細胞增殖檢測試劑盒(碧云天)。Cy3-標記羊抗兔熒光二抗(威奧,WH1123),兔抗小鼠一抗Acetylated-Lysine(1 ∶1 000,CST,#9441S),二抗為羊抗兔HRP-linked二抗(1 ∶5 000,CST,#7074)。
1.2 方法
1.2.1EDU摻入檢測細胞增殖及γ-H2AX檢測細胞DNA損傷 1×104個細胞種于激光共聚焦皿,培養24 h,加入H2O2或YGJ刺激。干預后,每孔加入2 μL EDU原液,繼續培養2 h,以4%多聚甲醛(4 ℃預冷)室溫固定細胞。洗滌后,0.3% Triton-X-100 PBS冰浴透膜15 min。加入200 μL Click反應液,室溫避光30 min。γ-H2AX檢測時,收集細胞洗滌后,加入含10%羊血清的PBS封閉液30 min,γ-H2AX一抗(1 ∶500)4 ℃孵育過夜。洗滌后,Cy3-標記羊抗兔熒光二抗(1 ∶200),37 ℃,避光孵育2 h。Hoechst33342(1 ∶1 000),室溫避光孵育6 min標記細胞核。加入抗熒光淬滅劑,ZEISS激光共聚焦成像系統成像,隨機視野成像5張,以IPP軟件,紅色相對熒光強度(relative fluorescence intensity,RFI)記作γ-H2AX表達量,同時檢測Hochest記作總細胞數,檢測綠色熒光值記作EDU陽性細胞,EDU陽性細胞率/%=陽性細胞數/總細胞數×100%。
1.2.2Annexin V/PI流式細胞術檢測細胞凋亡 細胞按5×105個/皿接種至60 mm培養皿中,50 mg·L-1YGJ預處理細胞,然后按不同時間點加入終濃度500 μmol·L-1H2O2收集細胞。PBS洗滌細胞,0.25%胰蛋白酶(不含EDTA)消化細胞,離心后,將細胞重懸在1×Annexin V binding buffer中(確保細胞濃度1×106L-1),加入5 μL Annexin V和5 μL PI,室溫避光孵育15 min,置冰上,輕輕混勻,1 h內上機檢測。
1.2.38-OhdG比色法檢測細胞DNA氧化損傷 細胞按5×103個/孔接種于96孔細胞培養板中。依據試劑盒說明操作,酶標儀波長650 nm測讀。
1.2.4Western blot檢測細胞蛋白質 細胞接種于10 cm培養皿中,培養48 h后,加入500 μmol·L-1H2O2處理細胞,H2O2/YGJ用藥組分別按50 mg·L-1YGJ作用不同時間,棄上清,收集細胞,測定蛋白質濃度,與SDS上樣緩沖液混合,95 ℃變性5 min;制膠,上樣,電泳,切膠,恒壓70 V轉膜1.5 h,將蛋白質轉移至PVDF膜上。5%BSA/TBST封閉液室溫封閉1.5 h。一抗:Parp1(1 ∶1 000)、Par(1 ∶1 000)、GAPDH(1 ∶5 000),4 ℃孵育過夜,分別加入相應的HRP標記二抗(1 ∶2 000-1 ∶20 000),室溫孵育1 h,ECL反應后用全自動凝膠成像系統成像。
1.2.5免疫沉淀(immunoprecipitation,IP) 細胞接種于10 cm培養皿中,經藥物處理后,RIPA裂解細胞,測定蛋白質濃度,加入兔抗小鼠Parp1一抗(1 ∶200),另取正常對照組樣本一份,加入兔源IgG(1 μg,碧云天,A7016)作為IgG對照組,3D搖床100 r·min-1混勻過夜。
將beads液加入樣本混合,4 ℃,水平搖床混勻,洗滌、煮沸、離心,取上清做Western blot,一抗為兔抗小鼠Acetylated-Lysine一抗(1 ∶1 000),二抗為羊抗兔HRP-linked二抗(1 ∶5 000)。
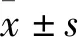
2 結果
2.1 一貫煎對H2O2誘導肝細胞凋亡的影響加入H2O2作用不同時間,選取3、6、12和24 h時間點觀察,晚期凋亡的肝細胞均較正常對照組(19.6%)增加明顯,分別上升到44.5%、56.0%、32.2%和27.8%,YGJ作用后相應地分別下降到38.5%、50.5%、29.3%和22.9%,這些結果顯示H2O2在作用3~6 h細胞凋亡達到高峰,隨后凋亡細胞減少但仍高于正常對照組;YGJ可減少細胞凋亡,保護作用從3 h一直持續到24 h(Fig 1)。
2.2 一貫煎對H2O2損傷肝細胞增殖的影響EDU綠色熒光細胞陽染代表細胞增殖。0 h對照組細胞綠色熒光細胞陽染率為19.01%±3.19%,加入500 μmol·L-1H2O2作用6 h、12 h和24 h后分別為10.92%±0.48%(P<0.01)、13.39%±1.46%(P<0.05)和17.60%±1.65%;而加入50 mg·L-1YGJ作用6 h、12 h和24 h,細胞陽染率分別恢復為16.22%±0.65%(P<0.05)、18.25%±0.23%(P<0.05)和18.35%±1.85%,與相應時間點H2O2組比較,6和12 h組差異明顯。這些結果提示,H2O2可明顯抑制肝細胞增殖,至6 h增殖能力達到最低,隨后逐漸恢復,24 h幾乎恢復至正常水平;YGJ在整個實驗觀察時間點都可以明顯促進細胞增殖(Fig 2)。
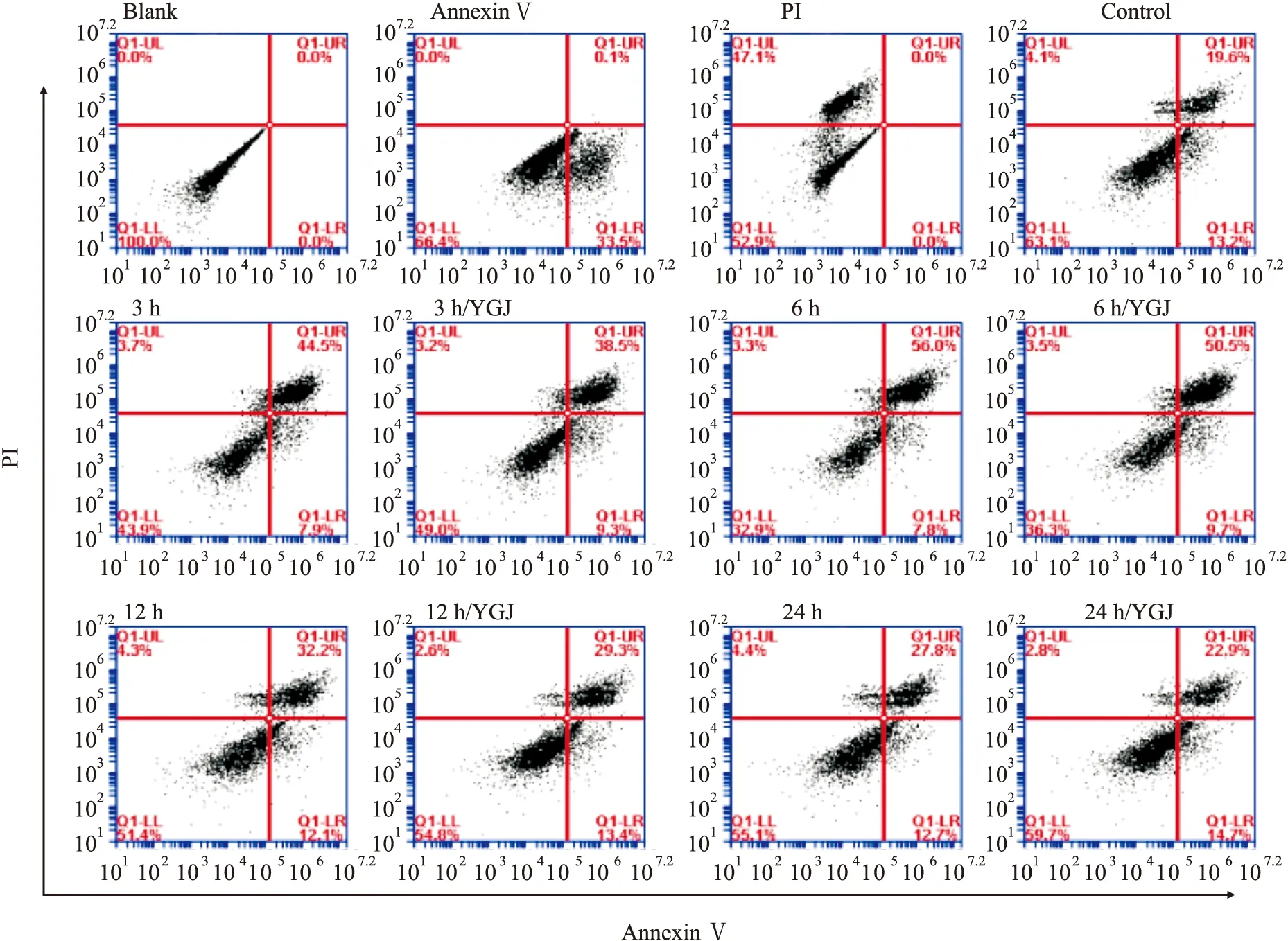
Fig 1 Time effects of Yiguanjian decoction on apoptosis of H2O2-induced hepatocytes
2.3 一貫煎對H2O2誘導肝細胞DNA氧化損傷的影響比色法檢測肝細胞8-羥基脫氧鳥苷(8-OhdG)含量,結果顯示0 h對照組8-OhdG的吸光度值為0.08±0.02,加入H2O2作用不同時間,選取3 h、6 h、12 h和24 h時間點觀察,吸光度值分別上升至0.24±0.01(P<0.01)、0.26±0.00(P<0.01)、0.27±0.02(P<0.01)和0.29±0.02(P<0.01),顯示H2O2可導致DNA氧化損傷,且持續存在于整個實驗過程。加入50 mg·L-1YGJ作用6、12和24 h后,細胞吸光度值分別下降至0.24±0.00(P<0.05vs6 h H2O2)、0.24±0.00和0.26±0.01。結果可見,YGJ在6 h即可明顯降低8-OhdG含量,12 h和24 h有下降趨勢(Fig 3)。
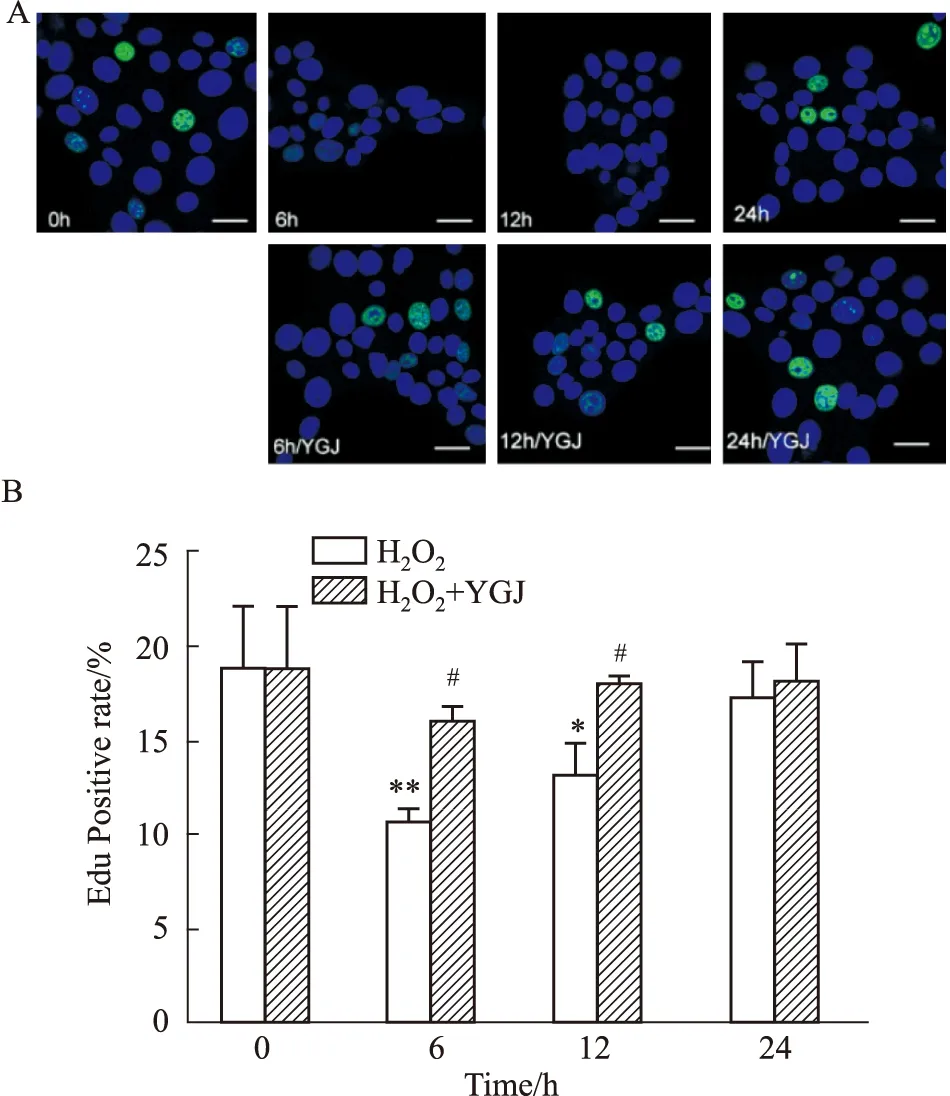
Fig 2 Time effects of Yiguanjian decoction on proliferation of *P<0.05,**P<0.01 vs 0 h H2O2 group;#P<0.05 vs H2O2 group.Scale bar=10 μm.
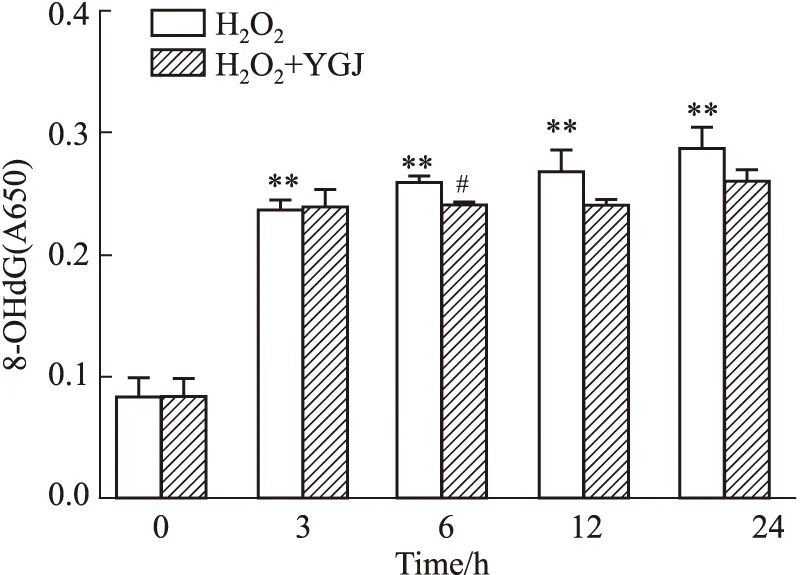
Fig 3 Time effects of Yiguanjian decoction on inhibiting H2O2**P<0.01 vs 0 h H2O2 group,#P<0.05 vs H2O2 group.
2.4 一貫煎對H2O2誘導的肝細胞內γ-H2AX的影響紅色相對熒光強度(Relative fluorescence intensity,RFI)記作γ-H2AX表達量。0 h對照組細胞γ-H2AX含量為1.88±3.25,500 μmol·L-1H2O2作用6、12和24 h后,γ-H2AX含量分別為27.31±1.51(P<0.01)、15.77±2.56(P<0.01)和5.32±0.31,結果顯示,H2O2在整個觀察時間點均可明顯提高細胞內γ-H2AX含量;加入50 mg·L-1YGJ后6 h、12 h和24 h,γ-H2AX含量分別為5.41±0.81(P<0.01)、6.51±1.26(P<0.01)和2.65±1.53,與相應時間點單獨H2O2作用比較,在6和12 h差異有統計學意義,24 h有下降趨勢,表明YGJ在各對應的時間點均可明顯減少H2O2誘導的肝細胞γ-H2AX含量(Fig 4)。
2.5 一貫煎對H2O2誘導肝細胞內Parp-1含量和Par化修飾的影響500 μmol·L-1H2O2作用3、6、12和24 h后,Parp-1含量分別為0.76±0.09、1.31±0.00(P<0.01)、1.21±0.20(P<0.05)和1.25±0.04(P<0.01),與0 h對照組(0.79±0.10)比較,從6 h起各時間點均具有統計學意義;加入50 mg·L-1YGJ作用3 h、6 h、12 h和24 h,Parp-1含量分別為1.27±0.13(P<0.01)、1.21±0.20、1.03±0.12和1.04±0.09(P<0.05),在3 h明顯升高,而24 h明顯降低。以上結果顯示,H2O2作用6 h后細胞內Parp-1含量明顯增加且持續至24 h,而YGJ作用3 h后細胞內Parp-1含量增加,12 h后逐漸降低,提示YGJ可使細胞內Parp-1的表達提前(Fig 5A,B)。

Fig 4 Time effects of Yiguanjian decoction on γ-H2AX **P<0.01 vs 0 h H2O2 group,##P<0.01 vs H2O2 group.Scale bar=10 μm.
H2O2作用3、6、12和24 h后,Parp-1的Par化修飾分別為0.50±0.02、0.95±0.04(P<0.01)、0.7±0.05(P<0.01)和0.74±0.03(P<0.01),與0 h對照組(0.52±0.02)比較,除3 h外,其余組均具有統計學意義;加入YGJ作用3、6、12和24 h后,Parp-1的Par化修飾分別為0.94±0.07(P<0.01)、1.05±0.02(P<0.05)、0.96±0.03(P<0.01)和0.84±0.05(P<0.05)。這些結果表明,H2O2作用6 h后Parp-1的Par化升高達到峰值,之后稍有下降,但與0 h對照組比較仍具有統計學意義;YGJ在3 h即可明顯增加Parp-1的Par化,同樣至6 h達到峰值,并均高于各觀察時間點單獨H2O2作用組,提示YGJ可明顯促進細胞內Parp-1的Par化修飾(Fig 5C,D)。
2.6 肝細胞內Sirt-1對Par化的影響采用不同濃度Sirt-1激動劑SRT1720作用細胞觀察Parp-1的Par化修飾,結果可知,與對照組(1.09±0.03)相比,0.01 μmol·L-1SRT1720、0.1 μmol·L-1SRT1720和1 μmol·L-1SRT1720分別為0.86±0.05(P<0.05)、0.43±0.01(P<0.01)和0.41±0.01(P<0.01),表明SRT1720可明顯降低Parp-1的Par化修飾(Fig 6A-B)。Sirt-1抑制劑EX527作用細胞觀察Parp-1的Par化修飾,結果顯示:與對照組(0.31±0.04)相比,0.5、1、2 μmol·L-1EX527分別為0.55±0.07、0.54±0.04(P<0.05)和0.60±0.06(P<0.05),表明EX527可明顯提高Parp-1的Par化修飾(Fig 6C-D)。這些結果表明,Sirt-1在Parp-1活性調節中發揮負性調控作用。
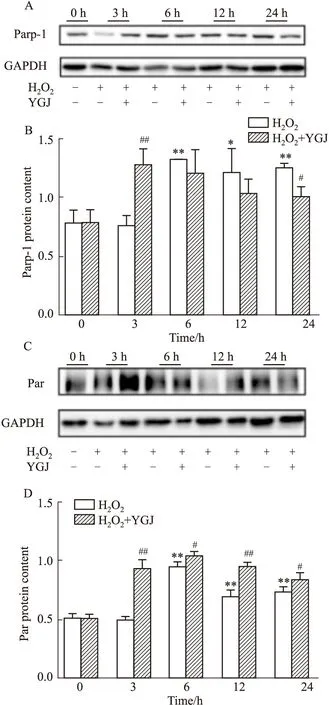
Fig 5 Effects of Yiguanjian decoction on Parp-1 and its PARylation in hepatocytes induced by n=3)*P<0.05,**P<0.01 vs 0 h H2O2 group,#P<0.05,##P<0.01 vs H2O2 group.
2.7 一貫煎對H2O2損傷肝細胞內Parp-1乙酰化的影響H2O2作用3、6、12和24 h后,乙酰化修飾的Parp-1分別為0.48±0.02、2.09±0.08(P<0.01)、1.67±0.11(P<0.01)和0.63±0.02(P<0.05),與0 h對照組(0.49±0.01)相比,從6 h開始Parp-1乙酰化修飾增加,且差異均具有統計學意義;加入50 mg·L-1濃度YGJ作用3、6、12和24 h后,乙酰化修飾的Parp-1分別為1.49±0.01(P<0.01)、0.78±0.02(P<0.01)、0.71±0.02(P<0.01)和0.43±0.04(P<0.05)。這些結果表明,H2O2作用后肝細胞內Parp-1的乙酰化修飾在6 h達峰值,隨后逐漸減低但仍高于0 h對照組;而YGJ作用后使其峰值提前至3 h且迅速下降,至6 h之后均低于相應時間點對照組。
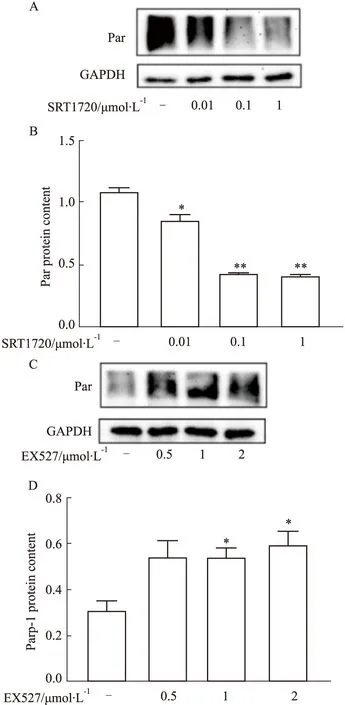
Fig 6 Effects of agonist and inhibitor of Sirt-1 on Parp-1 protein n=3)*P<0.05,**P<0.01 vs control.
3 討論
活性氧可誘發DNA中鳥嘌呤第8位碳原子上的氫原子羥基化(8-OhdG),是導致細胞內DNA損傷重要的因素之一[9]。本文中,肝細胞內8-OhdG含量隨H2O2作用時間延長而逐步升高;γ-H2AX是DNA雙鏈斷裂較為敏感的生物標志物[10],隨H2O2作用時間延長其含量也相應升高,表明H2O2可導致肝細胞DNA氧化和雙鏈斷裂等損傷、抑制細胞增殖,最終引發肝細胞凋亡;而YGJ可明顯拮抗H2O2誘導DNA損傷。

Fig 7 Effects of Yiguanjian decoction on Parp-1 acetylation induced by H2O2 in n=3)*P<0.05,**P<0.01 vs 0 h H2O2 group,#P<0.05,##P<0.01 vs H2O2 group.
細胞應對DNA損傷有一定的修復機制,Parp-1作為DNA損傷感受器,可快速應答DNA損傷,啟動修復過程。Parp-1自身的Par化修飾對DNA損傷修復至關重要。本研究表明,H2O2作用6 h即可明顯增加Parp-1含量以及Parp-1的Par化,表明H2O2誘導DNA損傷后肝細胞可迅速啟動修復機制;H2O2作用自6~24 h,Parp-1表達均處于高位,但Par化自6 h達到峰值后即降低,兩者不完全一致;YGJ干預結果顯示自3 h起即可明顯促進Parp-1表達,早于H2O2單獨作用,且Par化結果更顯示YGJ可迅速激活Parp-1活性,促進DNA修復且維持時間更持久。
去乙酰化酶Sirtuin 1(silent information regulator 1,Sirt-1)是NAD+依賴型的去乙酰化酶,能夠催化多種蛋白質的乙酰賴氨酸進行去乙酰化反應,在染色質重塑、基因調控、代謝、癌癥等相關疾病及延緩衰老等方面發揮重要作用[11]。Parp-1與Sirt-1都是參與DNA損傷修復的重要蛋白質,在細胞內彼此之間既相互協作又相互制約而維持DNA損傷后的平衡修復,避免Parp-1過度激活或過度抑制,造成細胞死亡[12]。Parp-1和Sirt-1發揮酶活性都需要以NAD+作為輔酶,Parp-1對NAD+的親和性較Sirt-1高5~10倍,持續消耗NAD+,會導致Sirt-1活性降低,反過來Sirt-1可以直接抑制Parp-1基因的啟動子,從而抑制Parp-1表達和活性[13-14];另一方面,Parp-1催化產生多聚ADP核糖鏈可招募Sirt-1到達損傷位點,使染色質重塑因子去乙酰化而增強ATPase活性,促進損傷位點附近核小體松散,推動DNA修復[15],Parp-1的乙酰化可競爭性抑制Parp-1泛素化,從而阻遏Parp-1降解,維持Parp-1穩定[16]。本研究中YGJ作用后Parp-1的乙酰化在6 h后降低,而其Par化反而升高,這解釋了Parp-1含量隨作用時間降低而活性卻不降低這一現象。Sirt-1抑制劑EX527可明顯提高Parp-1的Par化,而其激動劑可明顯抑制Parp-1的Par化,表明Sirt-1對Parp-1的活性呈負調控機制。
總之,H2O2誘導肝細胞DNA損傷可抑制DNA復制導致細胞增殖減少,細胞死亡增加,而YGJ可通過調節Parp-1修復損傷的DNA,維持肝細胞基因組的完整性從而促進肝細胞增殖及抵抗H2O2誘導肝細胞凋亡。

