瞬時受體電位錨蛋白亞型1受體在遠端創傷預處理保護心肌缺血/再灌注損傷中的作用
宋美先,吳 云,張 野
(安徽醫科大學第二附屬醫院麻醉與圍術期醫學科,安徽醫科大學麻醉與圍術期醫學安徽普通高校重點實驗室,安徽 合肥 230601)
缺血性心臟病已成為全球致死的首要原因,血流再灌注治療是拯救瀕臨梗死心肌的最有效方法,而減少血流恢復后存活心肌的繼發性損傷仍然是至今難以攻克的難題[1]。研究表明,腹部淺表手術切口的傷害性刺激對心肌缺血/再灌注損傷具有保護作用,這種心肌保護策略被稱為遠端創傷預處理(RPCT)[2]。RPCT具體的分子機制尚未明確,可能與皮膚痛覺信號的傳遞相關,因此,有必要研究疼痛信號相關的受體TRPA1與RPCT之間的關聯。
瞬時受體電位錨蛋白亞型1(transient receptor potential ankyrin 1,TRPA1)是機體感受傷害性刺激的主要感受器,針對外科手術切皮等傷害性刺激,TRPA1受體抑制劑可以從源頭處阻斷痛覺信號的傳遞,有望成為新型鎮痛藥物[3]。然而,除了調控痛覺信號,TRPA1受體同樣在心肌細胞中表達[4]。因此,明確TRPA1受體能否介導RPCT的心肌保護效應及其相關機制,將有利于提高臨床鎮痛過程中的心血管安全性。越來越多的證據表明,ALDH2是心臟保護作用的關鍵下游酶,ALDH2過表達可通過減少4-HNE的含量改善心肌缺血/再灌注損傷[5]。但RPCT的心肌保護作用是否與ALDH2的活性和表達相關,目前尚不清楚。本研究旨在探討TRPA1能否介導遠端創傷預處理的心肌保護作用以及其對心臟組織ALDH2的影響。
1 材料
1.1 動物健康♂ SD大鼠購于安徽醫科大學實驗中心,體質量(250~300) g,實驗動物合格證號為:SYXK(皖)2017-006。大鼠被飼養在清潔級動物房中,飲食水充足,環境溫度設置為(22 ± 1) ℃,濕度設置為(40 ± 15)%,晝夜周期為12/12 h。
1.2 主要試劑和儀器TRPA1抑制劑(TCS,貨號5861528)購自美國MCE公司;氯化三苯基四氮唑(TTC)和伊文思藍均購自美國Sigma公司;TUNEL染色試劑盒購自瑞士Roche公司;ALDH2活性試劑盒購自美國Abcam公司;組織裂解液、蛋白酶抑制劑和蛋白定量試劑盒等均購自碧云天科技研究所;兔抗ALDH2(DF6358)購自中國Affinity Biosciences公司;兔抗4-HNE(ab46545)、兔抗GAPDH(ab9485)均購自美國Abcam公司;山羊抗兔二抗購自美國Thermo公司。大鼠呼吸機購自成都泰盟公司;血流動力學數據采集系統購于澳大利亞AD公司;電泳儀購自美國Bio-RAD公司。
2 方法
2.1 心肌缺血/再灌注模型和遠端創傷預處理模型大鼠腹腔注射3%戊巴比妥鈉50 mg·kg-1,待其充分麻醉后放在保溫墊上。分離頸部肌肉,切開氣管,連接動物呼吸機。根據大鼠胸廓起伏程度設置呼吸頻率約為65~70次/min,潮氣量約為20~30 mL·kg-1。右頸總動脈和右頸內靜脈置管,用于監測血流動力學及給藥。在左側胸部平腋下肋間用撐開器撐開胸腔,撕開心包膜后顯露出心臟。用6-0帶針線在左心耳下緣進針,從肺動脈圓錐旁出針。隨后將結扎線的兩端依次穿過圓形橡膠墊和自制的阻斷器,心肌缺血時將血管鉗向下推移,使阻斷器和圓形橡膠墊壓向心肌表面并夾緊,即可壓迫冠狀動脈致血流中斷,松開血管鉗即可解除壓迫恢復血流。若MI/R模型建立成功,壓迫冠狀動脈后則可觀察到心尖組織變為蒼白或暗紫色,同時,心電圖ST段明顯抬高,解除壓迫后再灌注的心尖組織變為紅潤。大鼠遠端創傷預處理模型參照文獻[6],即在大鼠腹部中線水平,用手術刀劃開皮膚,做一長度為4 cm的橫行切口。
2.2 實驗分組大鼠隨機分為5組(n=10):假手術組(Sham組)、模型組(IR組)、遠端創傷預處理組(RPCT組)、TRPA1抑制劑+遠端創傷預處理組(TCS+RPCT組)和TRPA1抑制劑組(TCS組)。Sham組:僅穿線,不進行缺血/再灌注;IR組:阻斷冠狀動脈缺血30 min后再灌注120 min;RPCT組:缺血前15 min于腹部正中切開腹壁4 cm,隨后建立缺血/再灌注模型;TCS+RPCT組:遠端創傷預處理前 10 min靜脈注射TCS 1 mg·kg-1,其余處理同RPCT組;TCS組:缺血前25 min靜脈注射TCS 1 mg·kg-1,隨后進行缺血/再灌注損傷。
2.3 血流動力學監測頸總動脈插管成功后連接PowerLab系統,監測血流動力學,于結扎線縫好后平衡30 min(基礎值)、缺血15 min和再灌注完成3個時間點,記錄平均動脈壓(MAP)及心率(HR),并計算血壓心率乘積(RPP)。
2.4 心肌梗死面積的測量再灌注完成后,阻斷冠狀動脈血流,將3%伊文思藍約2 mL從頸內靜脈快速推入,當大鼠四肢皮膚染為藍色時,立即摘除心臟,剪去心房和右心室。將左心室結扎線以下的心肌組織切成5等分的心肌切片,隨后把切片置于1%TTC溶液里,37 ℃孵育20 min后以組織固定液固定。24 h后可觀察到缺血危險區中的活組織被染成紅色,梗死組織被染為白色,非缺血區被染成藍色。用刀片依次切下紅色、白色和藍色區域并稱質量,得到梗死區質量(IS,白色區)、缺血區質量(AAR,白色區+紅色區)以及結扎線下左心室質量(LV,白色區+紅色區+藍色區),并求出IS/AAR及AAR/LV比值。
2.5 TUNEL染色再灌注結束后取下大鼠心臟,PBS沖洗后進行固定、蔗糖梯度脫水、OCT包埋,隨后進行冷凍切片。切片在室溫復溫后,用PBS洗去包埋劑,加入透膜液通透2 min。再次用PBS洗去透膜液,滴加TUNEL反應液,置于37 ℃暗濕盒中孵育1 h。切片以PBS清洗后加入DAPI封片,熒光顯微鏡下觀察,計算視野中陽性細胞數/總細胞數。
2.6 ALDH2活性檢測再灌注完成后留取心臟組織,采用ALDH2活性檢測試劑盒測定ALDH2活性。按照說明書步驟進行操作,加入的蛋白質樣品濃度為0.1 g·L-1。最后避光孵育30 min,測量450 nm處的吸光度值。結果將Sham組ALDH2活性標準化為1,計算其余組ALDH2的相對活性。
2.7 Western blot取左心室心尖組織,加入RIPA裂解液,放在研磨器中研磨,離心后得到組織總蛋白。獲取的蛋白經蛋白濃度測定后按相應比例加入上樣緩沖液,100 ℃金屬浴10 min后取30 μg蛋白進行凝膠電泳。隨后進行切膠、轉膜,把膜放入快速封閉液中封閉15 min。按蛋白分子量裁出相應蛋白條帶,然后分別放入GAPDH(1 ∶2 000)、ALDH2(1 ∶1 000)和4-HNE(1 ∶2 000)的抗體稀釋液中,4 ℃搖床孵育過夜。TBST洗膜后加入二抗(1 ∶10 000)稀釋液,室溫孵育1 h。再次洗膜后滴加顯影劑反應1 min,最后在成像系統上顯出蛋白條帶。

Tab 1 Hemodynamic data in rats
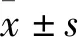
3 結果
3.1 血流動力學數據比較5組大鼠MAP、HR和RPP的基線值間無明顯差異(P>0.05)。相比于Sham組,其余4組的MAP、HR和RPP在缺血15 min和再灌注完成時刻均下降(P<0.05);與IR組相比,RPCT組在缺血15 min和再灌注完成時刻的MAP、HR和RPP均升高(P<0.05);而IR組、TCS+RPCT組和TCS組間的血流動力學無明顯差異(P>0.05)。見Tab 1。
3.2 心肌梗死面積的比較5組大鼠的AAR/LV比值間無明顯差異(P<0.05),說明結扎位置基本一致。與Sham組相比,其余各組出現白色梗死區;與IR組相比,RPCT組的IS/AAR百分比明顯減小(P<0.05);與RPCT組相比,TCS+RPCT組的IS/AAR百分比明顯增加(P<0.05)。結果表明,RPCT能有效地降低大鼠MI/R損傷后的心肌梗死面積,而TRPA1抑制劑消除了RPCT 的保護作用。見Fig 1。
3.3 心肌細胞凋亡水平的比較相比于Sham組,其余4組心肌細胞凋亡水平明顯增加(P<0.05);RPCT組相比于IR組,心肌凋亡細胞減少(P<0.05);與RPCT組相比,TCS+RPCT組的心肌凋亡細胞增加(P<0.05),說明預先給予TRPA1抑制劑使遠端創傷預處理減少心肌細胞凋亡的作用降低。見Fig 2,3。

Fig 1 Myocardial infarct size in rats A:Representative images for ischemic risk area for each experimental group.Infarcted tissue remains unstained (white) while viable tissue is stained red.B:Area at risk/left ventricle.C:The myocardial infarction area / ischemic risk area.*P<0.05 vs sham;#P<0.05 vs IR;△P<0.05 vs RPCT.

Fig 2 Representative images of TUNEL staining in each group

Fig 3 The statistical results of TUNEL staining *P<0.05 vs sham;#P<0.05 vs IR;△P<0.05 vs RPCT.
3.4 ALDH2活性和蛋白表達以及4-HNE蛋白表達情況與Sham組比較,IR組的ALDH2活性和蛋白表達降低,4-HNE含量增加(P<0.05);與IR組比較,RPCT組的ALDH2活性和表達升高,4-HNE含量減少(P<0.05);相比于RPCT組,TCS+RPCT組的ALDH2活性和表達降低,4-HNE含量增加(P<0.05),表明抑制TRPA1受體減弱了遠端創傷預處理升高心肌組織ALDH2活性和蛋白表達的作用。見Fig 4,5。

Fig 4 ALDH2 activity in each group n=6)*P<0.05 vs sham;#P<0.05 vs IR;△P<0.05 vs RPCT.

Fig 5 The protein expression of 4-HNE and ALDH2 *P<0.05 vs sham;#P<0.05 vs IR;△P<0.05 vs RPCT
4 討論
遠端創傷預處理是一種有效的心臟保護方法,由Ren等[7]于2004年首次報道,并在小鼠和大鼠心肌缺血/再灌注模型中得到證實[8-9]。本研究參照文獻[6]構建大鼠遠端創傷預處理模型和心肌缺血/再灌注模型。結果觀察到心肌缺血時心尖組織明顯發紺,心電圖ST段明顯抬高。而且,RPCT組較IR組的IS/AAR百分比、心肌細胞凋亡水平明顯減少,證明遠端創傷預處理降低了心肌缺血/再灌注損傷。
TRPA1受體屬于瞬時受體電位通道超家族,是細胞膜上的一種鈣通透性非選擇性陽離子通道,作為機體感受溫度、化學以及機械等傷害性刺激的主要感受器[10]。研究證實,心肌細胞中存在TRPA1,且TRPA1的激活介導了阿片類藥物的心肌保護作用[4]。本課題組前期研究發現缺血前于大鼠腹部涂抹冬青油(水楊酸甲酯,TRPA1激動劑)軟膏能夠減少心肌缺血/再灌注損傷[11]。這些結果強烈提示TRPA1在介導心肌保護作用中發揮著關鍵作用。TCS 5861528是一種選擇性TRPA1通道拮抗劑,可抑制AITC(TRPA1激活劑)誘導的鈣內流[12],被廣泛用于研究TRPA1功能實驗中。在本實驗中,為了研究TRPA1是否參與遠端創傷預處理對大鼠MI/R的保護作用,進行了TCS+ RPCT組實驗。結果發現,與RPCT組比較,TCS+RPCT組可明顯增加IS/AAR比值和心肌細胞凋亡水平,說明TRPA1受體拮抗劑TCS可消除遠端創傷預處理的心肌保護效應,提示TRPA1受體在遠端創傷預處理降低大鼠MI/R損傷的過程中發揮重要作用。
缺血心肌血流恢復后,生成活性氧簇(ROS),并通過脂質過氧化反應生成大量毒性醛如4-HNE,誘導細胞損傷[13]。ALDH2是醛脫氫酶家族成員,可以將脂質過氧化過程中產生的毒性醛分解為無毒的羧酸,降低細胞毒性和氧化損傷[14]。大量數據表明,ALDH2的活性和表達增加可以增強其代謝4-HNE的能力,導致4-HNE的含量減少,從而減輕心肌缺血/再灌注損傷[5,15]。Chaudhuri等[16]發現TRPA1可通過鈣調激酶信號通路激活核因子E2相關因子(Nrf2),Nrf2已被證實可調控ALDH2的表達[17]。因此,我們推測藥物抑制TRPA1受體可能會影響ALDH2的活性和表達。本研究觀察到心肌經歷缺血/再灌注損傷后ALDH2活性和表達下降,毒性物質4-HNE表達升高,而遠端創傷預處理可上調ALDH2的活性和表達,減少4-HNE含量。但當給予TRPA1受體特異性拮抗劑后,遠端創傷預處理上調ALDH2活性和表達的作用消失。該結果提示TRPA1受體可能是通過調控ALDH2活性和表達,影響4-HNE含量,從而介導了遠端創傷預處理對大鼠MI/R損傷的保護作用。
目前,關于TRPA1的研究主要集中在神經源性炎癥反應、慢性疼痛治療方面,TRPA1抑制劑未來有望成為新的臨床鎮痛藥物[3,18]。研究發現遠端的疼痛刺激能夠對缺血心肌產生保護作用,這說明疼痛信號通路與心臟保護之間存在關聯[2]。因此,在開發直接阻斷TRPA1通道的臨床用非麻醉性止痛藥之前,需考慮TRPA1在介導特異性心臟保護和一般器官保護方面的貢獻。本研究提示TRPA1受體在心肌保護中具有重要作用,這表明如果在圍術期通過阻斷TRPA1進行鎮痛治療,將可能對缺血性心臟病患者或是行心臟手術患者帶來安全隱患。
綜上所述,遠端創傷預處理可減輕大鼠心肌缺血/再灌注損傷,而藥物拮抗TRPA1受體阻斷了遠端創傷預處理的心肌保護作用,其機制可能與調控ALDH2活性和表達,影響4-HNE含量有關。

