不同面筋蛋白組分對小麥淀粉消化特性的影響機理
鄺吉衛,張 沖,黃峻榕,,蒲華寅,馬文慧,閔 聰,Youling L.XIONG
(1.陜西科技大學食品與生物工程學院,陜西 西安 710021;2.肯塔基大學動物與食品科學系,美國 萊克星頓 40546)
淀粉是糧食的最主要成分,也是日常飲食中最主要的能量來源。隨著人們對低血糖指數食品需求的增加,低消化率的淀粉基食品引起了大家廣泛的關注[1-2]。已有研究表明可以通過控制飲食中淀粉的消化率和血糖指數降低糖尿病并發癥的風險[3]。一般而言,淀粉的消化性不僅取決于淀粉本身的結構性質,還受到食品中其他組分的性質及其與淀粉/淀粉酶相互作用的影響[4-6]。因此,控制并降低食品體系中淀粉的消化率對于設計和開發低血糖指數食品具有重要意義。
食品的多組分體系中,淀粉和蛋白質往往共存。加工過程中,蛋白質與淀粉之間存在一定的相互作用,并且蛋白質會黏附在淀粉顆粒基質的周圍成為淀粉消化的屏障,這很大程度上降低了淀粉的消化率[7]。此外,蛋白質也會與α-淀粉酶相互作用降低酶的活性,阻礙淀粉酶與淀粉分子的結合,從而抑制淀粉的消化[8]。面筋蛋白作為小麥粉中僅次于淀粉的第二大宏量營養成分,主要由聚合體谷蛋白(含量30%~40%,分子質量105~107Da)和單體醇溶蛋白(含量40%~50%,分子質量3×104~8×104Da)組成[9]。谷蛋白肽鏈之間通過二硫鍵交聯形成面筋蛋白網絡的骨架結構,而醇溶蛋白則主要通過非共價作用力與谷蛋白相互作用,并填充在網絡結構中。已有研究表明,隨著面筋蛋白及其水解物的增加,淀粉的消化速率和程度逐漸下降。這主要是由于面筋及其水解物對α-淀粉酶活性的抑制作用,從而降低了α-淀粉酶與淀粉的結合程度[10]。此外,在面粉中添加額外的面筋蛋白也會降低α-淀粉酶對淀粉的水解,這主要是因為面筋蛋白會包裹更多的淀粉,及其對α-淀粉酶更強的抑制作用[11-12]。然而,目前尚不清楚面筋蛋白組分中的谷蛋白和醇溶蛋白如何與淀粉/α-淀粉酶相互作用從而影響淀粉的消化特性,這可以從組分學角度完善面筋蛋白影響淀粉消化特性的機理。
本研究旨在以小麥淀粉(wheat starch,WS)與不同面筋蛋白組分(面筋蛋白、谷蛋白及醇溶蛋白)混合物為研究對象,通過測定共混物流變特性、熱特性及微觀形態分布探討淀粉-蛋白質之間的相互作用;通過測定α-淀粉酶活性以及酶分布的可視化分析α-淀粉酶-蛋白質之間的相互作用。研究這些相互作用可以進一步了解不同面筋蛋白組分對淀粉的消化機理,以期通過改變面粉中不同面筋蛋白組分的比例控制淀粉的消化率,并對低血糖指數食品的開發提供一定理論指導。
1 材料與方法
1.1 材料與試劑
WS(水分含量11.4%,蛋白含量<0.3%,直鏈淀粉含量18.7%,支鏈淀粉含量75.8%) 上海禾煜貿易有限公司;面筋蛋白、醇溶蛋白、豬胰α-淀粉酶(11 U/mg)、對羥基苯甲酸酰肼(p-hydroxybenzoic acid hydrazide,PAHBAH)、氯化鈉、脲、溴化鉀、異硫氰酸熒光素(fluorescein isothiocyanate,FITC)、羅丹明B 上海源葉生物科技有限公司;麥谷蛋白 日本Tokyo Chemical Industry公司。
1.2 儀器與設備
UV 2900型紫外-可見分光光度計 上海舜宇恒平科學儀器有限公司;Haake-Mars 60型流變儀 德國賽默飛世爾科技公司;Q50型熱重分析儀 美國TA公司;Sephadex-DS10脫鹽柱 湖北省武漢晶誠生物科技股份有限公司;FV10l型激光共聚焦顯微鏡 日本Olympus公司。
1.3 方法
1.3.1 淀粉-不同面筋蛋白組分共混物的制備
共混物由WS與不同面筋蛋白組分(面筋蛋白、谷蛋白及醇溶蛋白)以恒定的質量比(淀粉∶蛋白=86∶14)制備而成。然后將0.6 g樣品分散于10 mL去離子水中,室溫下均勻混合10 min。沸水浴處理15 min后,不同的處理組分別標記為不添加蛋白的WS、WS+面筋蛋白、WS+谷蛋白、WS+醇溶蛋白。所有樣品在冷凍干燥后進行研磨粉碎處理,過80 目篩后備用。
1.3.2 淀粉消化率的測定
參考Xu Hanbin等[10]的方法并略作修改,將100 mg樣品分散在10 mL 0.01 mol/L磷酸鹽緩沖液中,添加豬胰α-淀粉酶(4.5 U/50 mg淀粉干基質量)混合均勻。分別在37 ℃水浴酶解5、10、15、20、30、40、60、80、100、120 min,提取200 μL等分試樣與800 μL 0.5 mol/L碳酸鈉溶液混合以停止酶解反應,10000×g離心3 min,取上清液。
使用PAHBAH法測定上清液中麥芽糖含量[13]。將一定質量的PAHBAH溶解在5 mL 0.5 mol/L鹽酸和45 mL 0.5 mol/L氫氧化鈉的混合溶液中制成質量分數為5% PAHBAH的顯色劑。分別取100 μL不同質量濃度的麥芽糖溶液(31.25、62.5、125、250、500 μg/mL)與3 mL 5% PAHBAH顯色劑混合,避光條件下沸水浴5 min,冷卻至室溫后在410 nm波長處測定吸光度,得到麥芽糖的標準曲線。樣品上清液的顯色方法與麥芽糖標準曲線的顯色制作方法相同。通過式(1)計算上清液中的麥芽糖當量含量,以麥芽糖釋放當量含量表示淀粉消化率。通過式(2)的一階動力學方程對消化過程進行模擬。所有樣品經過3 次平行測定。

式中:Ct為酶解t時的淀粉消化率/%;k/min-1為一階動力學反應的速率常數。
1.3.3 淀粉與不同面筋蛋白組分之間相互作用力的測定為了確定淀粉和不同面筋蛋白組分之間的相互作用力,將3 g樣品分散在50 mL 0.6 mol/L氯化鈉或脲溶液中,將樣品懸浮液在95 ℃、300 r/min糊化15 min,冷卻至室溫后進行流變學頻率掃描[14]。具體程序為:25 ℃保持2 min,間隙1 mm,恒定應變0.1%,頻率掃描范圍0.1~10 Hz,記錄彈性模量(G’)隨頻率的變化。通過式(3)計算彈性模量差值(ΔG’)的變化,反映共混物體系相互作用力的變化。
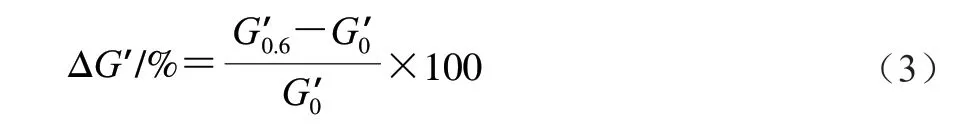
式中:為特定頻率掃描下含0.6 mol/L氯化鈉或脲的樣品G’;在特定頻率掃描下不含氯化鈉或脲的樣品G’。
1.3.4 淀粉-不同面筋蛋白組分共混體系熱特性的測定
準確稱量10 mg冷凍干燥后的樣品,以10 ℃/min的加熱速率從30 ℃加熱至600 ℃,并以50 mL/min的流速將氮氣用作吹掃氣體[15]。熱降解溫度和質量損失率通過TRIOS v4.4.1軟件進行分析計算。
1.3.5 淀粉-不同面筋蛋白組分共混體系激光共聚焦顯微鏡觀察
按照1.3.1節步驟,制備糊化后的樣品。使用冰凍切片機將樣品切為8 μm的薄片組織,固定于載玻片上。使用20 μL 0.02% FITC(mg/mL)和0.025%羅丹明B(mg/mL)混合染料避光染色切片10 min,然后通過pH 7.20.01 mol/L磷酸緩沖液清洗以除去多余染液。蓋上蓋玻片后,倒置于激光共聚焦顯微鏡于放大600 倍下觀察、拍照。FITC激發波長為488 nm,發射波長為518 nm;羅丹明B激發波長為568 nm,發射波長為625 nm[16]。
1.3.6α-淀粉酶活性的測定
取100 mL pH 60.2 mol/L醋酸鈉緩沖液添加到50 mg的面筋蛋白、谷蛋白及醇溶蛋白中,沸水加熱15 min。冷卻至室溫后,添加α-淀粉酶混合10 min,獲得0.5 U/mL混合液A。將1 mL醋酸鈉緩沖液和1 mL混合液A分別添加到20 mg糊化后的淀粉中,37 ℃下混合10 min。提取200 μL等分試樣沸水浴5 min以停止酶促反應。10000×g離心3 min,測定上清液中的還原糖含量,以麥芽糖當量表示。1 U的α-淀粉酶被定義為37 ℃下從淀粉中釋放1 mg麥芽糖所需酶的量[17]。
1.3.7 激光共聚焦顯微鏡觀察α-淀粉酶與蛋白的結合
FITC標記α-淀粉酶(FITC-AA):將FITC溶解于大量的pH 9.50.15 mol/L磷酸鹽緩沖溶液中,加入適量α-淀粉酶(FITC與α-淀粉酶物質的量比為10∶1),使用0.1 mol/L Na3PO4·10H2O溶液調節pH值為9.0,300 r/min轉速下避光反應1 h[18]。標記結束后,使用脫鹽柱將未與α-淀粉酶結合的FITC去除。將分離后得到的FITC-AA溶液冷凍保存備用。
分別稱取100 mg面筋蛋白、谷蛋白及醇溶蛋白分散到10 mL磷酸鹽緩沖液中混勻,沸水浴30 min。冷卻至室溫后,與適量的FITC-AA溶液混合,避光反應60 min。反應結束后,4000×g離心5 min,棄掉上清液,使用磷酸鹽緩沖液洗滌沉淀以去除沒有與蛋白質結合的FITC-AA[19]。參考1.3.5節的方法對所得的沉淀物進行激光共聚焦觀察。
1.4 數據處理
2 結果與分析
2.1 面筋蛋白、谷蛋白及醇溶蛋白對WS消化性的影響
由圖1A可知,所有樣品消化曲線的變化趨勢基本一致,淀粉消化率均在酶解60 min內迅速增大,隨后趨于平緩。與純WS相比,添加不同面筋蛋白組分后的WS在每個酶解時間的消化率均明顯降低。此外,添加谷蛋白對淀粉消化的抑制作用最強,其次是添加面筋蛋白和醇溶蛋白。這意味著蛋白的存在可能是抑制淀粉酶解最主要的原因。已有研究表明[11],粉碎后的蛋白-淀粉混合樣品的顆粒大小并不影響淀粉的消化速率與消化程度,這是由于面條樣品粉碎后的顆粒呈塊狀,其平均粒徑(340~580 μm)遠大于面粉粒徑(55~150 μm),并且觀察到面筋蛋白網絡也包裹著淀粉顆粒。因此,本實驗中樣品研磨粉碎處理對淀粉消化特性的影響基本被消除。
由圖1B可知,通過消化動力學方程擬合得到的酶解120 min時的淀粉消化率(C120)與實際所得數據之間差異不大,而且只有一個速率常數。這不同于顆粒態未蒸煮的淀粉樣品,它們在較高酶用量下的消化速率曲線呈現出兩個階段[12]。這說明整個消化過程可以完美擬合一級動力學方程,并且含淀粉的底物可能只包含一種特異的結構片段。這也意味著通過該消化動力學方程獲得k和C120值可靠[11]。WS樣品的k及C120值最大,均顯著高于添加不同面筋蛋白組分的樣品(P<0.05)。與WS相比,WS+面筋蛋白、WS+谷蛋白和WS+醇溶蛋白樣品的C120值分別下降了39.93%、49.48%和26.61%。這與Xu Hanbin等[10]在面筋蛋白-淀粉復合體系中觀察到的結果相似,他們發現添加了面筋蛋白的淀粉體系的C120值從62.2%下降到25.4%,這與面筋蛋白與淀粉/α-淀粉酶之間的相互作用有關。這些結果表明,不同面筋蛋白組分的添加顯著降低了WS的消化率;并且在相同添加量下,谷蛋白對WS消化的抑制作用明顯高于面筋蛋白和醇溶蛋白。有研究表明[10],蛋白質的存在顯著抑制了淀粉消化率,主要歸因于蛋白-淀粉/淀粉酶的相互作用;蛋白質的存在阻斷了淀粉與消化酶的結合位點并形成抑制淀粉消化的物理性屏障。此外,蛋白質也會抑制淀粉酶的活性,阻礙了淀粉酶與淀粉分子的結合[12]。已有研究表明[20],蛋白-淀粉混合體系的升糖指數與淀粉消化速率和消化率呈正相關。相比于面筋蛋白和醇溶蛋白,谷蛋白對淀粉消化更顯著的抑制作用可能與蛋白質的結構以及與淀粉/淀粉酶的結合強度有關。
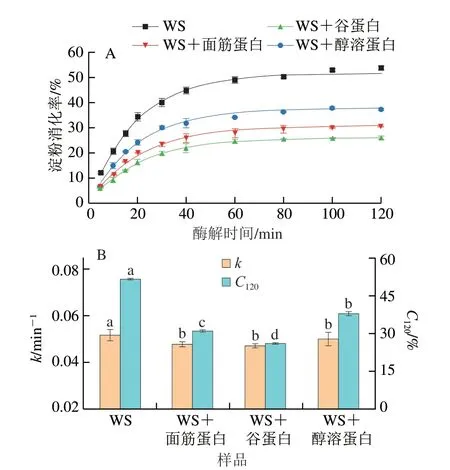
圖1 淀粉-不同面筋蛋白組分的消化曲線(A)及消化動力學方程擬合得到的k和C120(B)Fig.1 Digestograms of starch with various gluten proteins (A),and k and C120 obtained by fitting the digestion kinetics equation (B)
2.2 面筋蛋白、谷蛋白及醇溶蛋白與WS的相互作用分析
2.2.1 化學相互作用
氯化鈉(一種靜電相互作用破壞劑)和脲(一種氫鍵破壞劑)能夠破壞有助于形成或維持淀粉凝膠網絡結構的分子力[21]。如圖2所示,與未添加氯化鈉或脲的樣品相比,添加氯化鈉或脲后樣品的G’均明顯降低,這意味著凝膠體系中淀粉-淀粉或淀粉-蛋白之間的靜電相互作用和氫鍵被破壞。然而,這并不能完全解釋復合凝膠體系中淀粉與蛋白之間相互作用力的類型和強弱。

圖2 添加0.6 mol/L氯化鈉或脲的淀粉-不同面筋蛋白組分G’的變化Fig.2 Changes in G’ of starch with various gluten proteins added with 0.6 mol/L sodium chloride or urea
如圖3所示,添加了氯化鈉和脲的WS樣品ΔG’值均小于0,即樣品G’值降低,表明靜電相互作用和氫鍵是維持純淀粉糊化后凝膠形成的主要作用力。由圖3A可知,在氯化鈉作用下,面筋蛋白、谷蛋白及醇溶蛋白對淀粉ΔG’值的變化影響不大,這說明靜電相互作用基本上不參與不同面筋蛋白組分與淀粉之間的相互作用[16]。研究發現,Na+和淀粉上帶負電的羥基之間的靜電相互作用可以有效減少淀粉-水和淀粉-淀粉之間的相互作用,導致弱凝膠的形成,從而降低淀粉的G’[22-23]。即使添加帶正電荷的面筋蛋白組分也不會影響共混物體系中的靜電相互作用,這可能是由于在熱處理過程中蛋白質表面的電荷分布被改變,從而導致氯化鈉處理下共混物體系的ΔG’值差異不明顯。
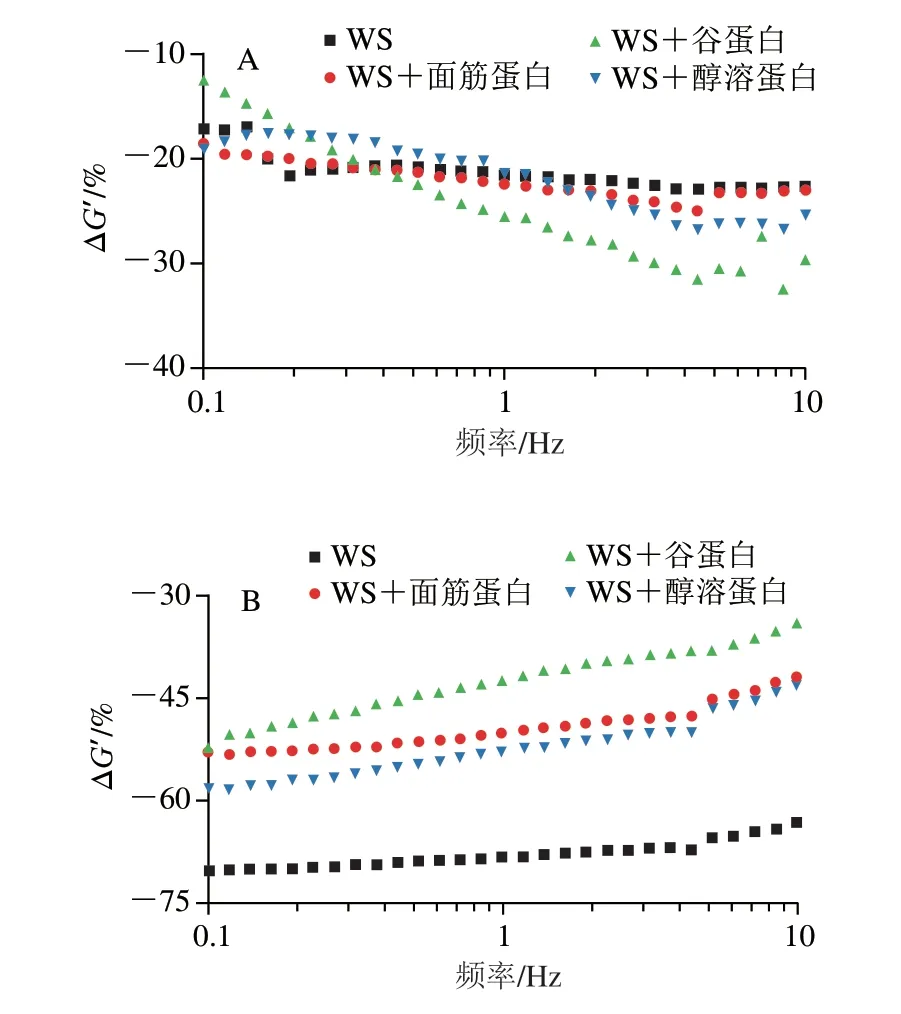
圖3 添加0.6 mol/L氯化鈉(A)或脲(B)的淀粉-不同面筋蛋白組分的ΔG’的變化Fig.3 Changes in ΔG’ of starch with various gluten proteins added with 0.6 mol/L sodium chloride (A) or urea (B)
由圖3B可知,在脲的作用下,WS樣品ΔG’值最小,其次是添加醇溶蛋白、面筋蛋白和谷蛋白的樣品。這表明不同面筋蛋白組分的添加均會影響淀粉分子間氫鍵的強度,并且醇溶蛋白對淀粉分子鏈之間氫鍵的抑制作用最明顯。蛋白質與水的相互作用及其對淀粉的包裹效應可能會限制淀粉與水的相互作用[24],這干擾了混合體系中氫鍵的形成,導致脲處理對共混物ΔG’值的影響比WS樣品小。此外,淀粉分子上C-6位的羥基與麥谷蛋白分子側鏈上酪氨酸的羰基之間可以形成氫鍵,谷蛋白的添加也會明顯降低WS凝膠形成過程中的氫鍵數量[25]。相對于強疏水性且易聚集的谷蛋白,具有高黏性的醇溶蛋白也會參與到與直鏈淀粉的相互作用并形成更多的分子間氫鍵[26],從而導致在脲的作用下ΔG’值明顯下降。因此,可以發現氫鍵在維持淀粉與不同面筋蛋白組分之間的相互作用中起主導作用,但這似乎并不能完全解釋為什么添加谷蛋白會更明顯抑制淀粉的消化。
2.2.2 熱特性
如圖4A所示,所有樣品的熱降解曲線的趨勢類似,且均分為兩個階段。在60~150 ℃時的初始質量損失是由于自由水和結合水隨溫度升高而流失,在這個階段所有樣品的質量損失差異不明顯。在高于150 ℃下的進一步降解主要涉及氨基酸殘基中共價肽鍵的斷裂、蛋白質分子中S—S、O—N和O—O鍵的斷裂以及淀粉中多羥基的消除,從而導致淀粉和蛋白質的分解[27]。通過一階導數曲線明顯地觀察到在300 ℃左右,樣品之間的熱降解質量損失差異明顯,并且WS樣品的熱重損失最大。
根據熱重分析曲線得到每個樣品的降解溫度,如圖4B所示,WS樣品的降解溫度和質量損失率分別為306.52 ℃和92.46%;不同面筋蛋白組分的添加對熱降解溫度沒有顯著影響,但顯著降低了質量損失率。WS+醇溶蛋白樣品(88.18%)的質量損失率顯著低于WS+面筋蛋白(89.79%)和WS+谷蛋白(90.64%)樣品(P<0.05)。質量損失率越低,表明樣品的熱穩定性越好。與谷蛋白多肽鏈分子間的二硫鍵相比,熱處理過程中醇溶蛋白分子內的二硫鍵更難斷裂[28],這可能是導致淀粉-醇溶蛋白共混物的質量損失率更低的主要原因。此外,也有研究表明,淀粉糊化過程中,WS與醇溶蛋白可以通過糖苷鍵結合形成更穩定的復合物。糖苷鍵的形成有利于復合物熱穩定性的提高,并且會更大程度地阻礙α-淀粉酶對淀粉的水解[29]。

圖4 淀粉-不同面筋蛋白共混物的熱性質分析Fig.4 Thermal properties of starch with various gluten proteins
2.2.3 形貌特征
WS樣品中(圖5A)的淀粉完全糊化,并形成致密且緊密結合的結構;添加不同面筋蛋白組分后體系由不連續的淀粉基質(綠色)和密集的蛋白質(紅色)組成。WS+面筋蛋白樣品中(圖5B),面筋蛋白主要以密集且連續的網絡結構黏附在淀粉基質的周圍基質,使體系結構復雜纏連;這種現象在WS+谷蛋白樣品中(圖5C)更為明顯,這表明谷蛋白網絡更大程度上促進了淀粉消化的屏障形成,這種阻礙作用被認為是導致淀粉消化降低的主要原因[30]。WS+醇溶蛋白樣品中(圖5D),醇溶蛋白的分布更為分散且結構更加開放,更多的淀粉并未被其完全包裹。與面筋蛋白和醇溶蛋白相比,谷蛋白致密的網絡結構更不利于α-淀粉酶對淀粉的水解。

圖5 淀粉-不同面筋蛋白組分共混物激光共聚焦顯微鏡圖Fig.5 CLSM images of starch with various gluten proteins
熱處理過程中,谷蛋白結構舒展,并進一步通過分子間二硫鍵、疏水相互作用等連接形成更加致密的網絡狀結構;而醇溶蛋白由于其熱凝固性,變性后分散程度下降,其高黏性特征更容易導致分子間疏水相互作用而聚集[31];這是導致谷蛋白和醇溶蛋白對淀粉消化產生差異的原因。熱處理后的蛋白質在體系中的結構比較致密,例如含有大量的谷蛋白,則淀粉更難被水解,這將導致淀粉的消化程度更低。之前的流變學研究發現[26],在重組面筋蛋白中增加谷蛋白的比例會使淀粉-蛋白共混體系的凝膠結構更強,而增加醇溶蛋白的比例則會產生相反的效果。面筋蛋白中,醇溶蛋白含量的增加會阻礙致密的谷蛋白網絡結構的形成,從而會弱化面筋蛋白網絡的強度,蛋白網絡狀態的改變可能會影響淀粉的消化率[32-33]。因此,相對單體醇溶蛋白,聚集的谷蛋白網絡結構形成的物理性屏障可以更大程度地包裹住淀粉,降低淀粉受到酶攻擊的可能性,從而延緩淀粉的酶解,這是導致淀粉-谷蛋白共混體系消化率顯著降低的主要原因。
2.3 面筋蛋白、谷蛋白及醇溶蛋白與α-淀粉酶的相互作用分析
2.3.1α-淀粉酶的抑制結果
由圖6可知,WS樣品的α-淀粉酶的活性為0.438 U,顯著高于添加不同面筋蛋白組分的樣品(P<0.05)。在WS+谷蛋白樣品中觀察到α-淀粉酶的活性最低,為0.092 U,顯著低于WS+面筋蛋白(0.101 U)和WS+醇溶蛋白(0.121 U)樣品。這些結果表明,面筋蛋白、谷蛋白及醇溶蛋白均能與α-淀粉酶相互作用并降低其活性。并且,谷蛋白與α-淀粉酶的結合程度最大,強于面筋蛋白和醇溶蛋白。
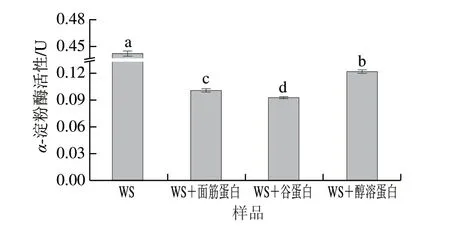
圖6 不同面筋組分對α-淀粉酶活性的影響Fig.6 Effect of various gluten proteins on the activity of α-amylase
不同面筋蛋白組分可能通過氫鍵、共軛作用和疏水作用力等與α-淀粉酶發生相互作用。有研究發現[34],蛋白分子鏈上的羥基可能通過氫鍵與α-淀粉酶的活性位點(Asp197、Glu233和Asp300)結合。同時,蛋白質分子通過電子云的離域與苯環形成更強的共軛作用,這可能會改變α-淀粉酶的構象,使淀粉不能與α-淀粉酶的活性位點結合,從而阻礙了α-淀粉酶對淀粉的水解[19]。麥谷蛋白經熱處理后,蛋白內部的疏水性基團大量暴露導致分子鏈間的疏水相互作用增強,這很大程度上促進了α-淀粉酶與谷蛋白分子鏈通過疏水相互作用結合,有效抑制了α-淀粉酶活性[35]。
2.3.2 蛋白與α-淀粉酶的結合程度
如圖7所示,添加面筋蛋白、谷蛋白和醇溶蛋白的樣品存在明顯的熒光現象,表明經過FITC標記過的α-淀粉酶與面筋蛋白、谷蛋白及醇溶蛋白之間發生了明顯的相互作用,并形成了比較穩定的復合物。此外,明顯地觀察到谷蛋白與α-淀粉酶結合程度更大,結合的蛋白部分呈現致密的網絡狀態且分布更加連續;而醇溶蛋白與α-淀粉酶結合程度較低,結合區域比較分散且不均勻。這種差異可能與不同面筋蛋白結構密切相關。谷蛋白各亞基進行緊密折疊并通過芳香族側鏈等疏水作用相互鍵合,呈現較為疏水的構象;而球狀的醇溶蛋白分子間通過氫鍵、靜電相互作用及疏水相互作用等非共價鍵連接,并形成穩定且緊湊的三維結構[9,34]。因此,相比醇溶蛋白,熱處理后谷蛋白分子構象的改變以及在共混體系中的分散行為是與α-淀粉酶更大程度結合的主要原因,這也為解釋谷蛋白對α-淀粉酶活性更強的抑制作用及其抑制機理提供了直接的證據。
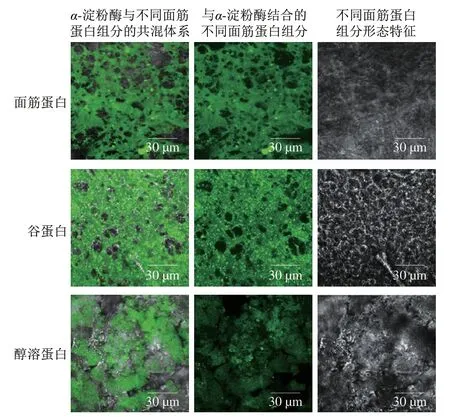
圖7 FITC標記過的α-淀粉酶與蒸煮后蛋白質結合的激光共聚焦顯微圖Fig.7 CLSM images of FITC-labeled α-amylase bound to cooked gluten proteins
2.4 淀粉消化的抑制機理
綜上所述,提出了不同面筋蛋白組分抑制淀粉消化的機理(圖8)。一方面,淀粉被面筋蛋白組分包裹以形成物理性屏障(并存在一定的非共價相互作用),這抑制了α-淀粉酶與淀粉的結合,導致淀粉的消化率降低。另一方面,不同的面筋蛋白可以與α-淀粉酶結合形成復合物,抑制了α-淀粉酶的活性,從而降低淀粉的酶解效率。
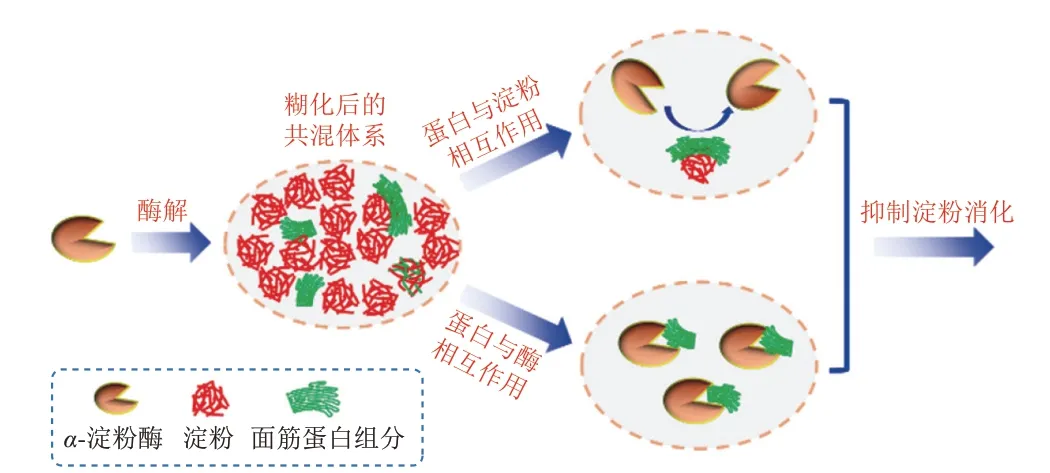
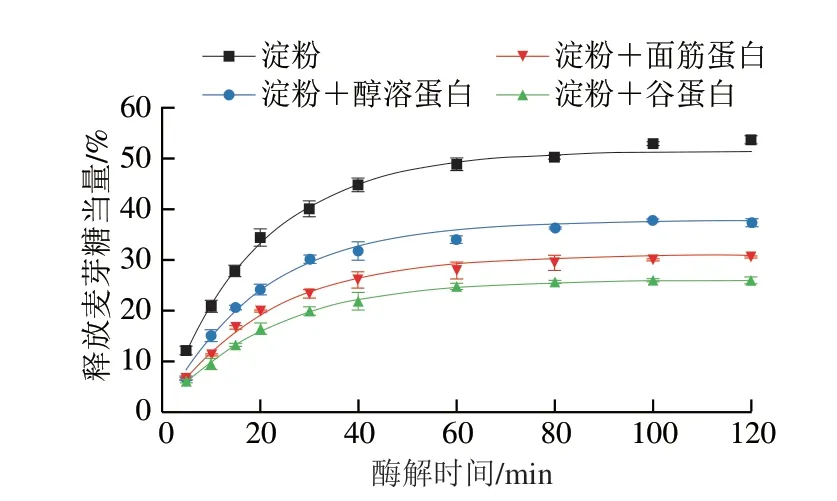
圖8 蛋白質影響淀粉消化特性的示意圖Fig.8 Schematic diagram of the effect of gluten on starch digestion
3 結論
分析了面筋蛋白、谷蛋白及醇溶蛋白對淀粉消化的影響及抑制機理。結果發現,添加不同面筋蛋白組分后C120顯著降低(P<0.05)。與添加面筋蛋白和醇溶蛋白的樣品相比,添加谷蛋白樣品的C120值降幅最大,為49.48%。氫鍵參與了淀粉-蛋白的相互作用,并提高了復合物的熱穩定性。谷蛋白在淀粉周圍形成的物理性屏障比面筋蛋白和醇溶蛋白更致密,這更大程度抑制了酶對淀粉的水解;此外,谷蛋白對α-淀粉酶活性的抑制率更高(約79%),與α-淀粉酶之間的結合程度更強。總之,不同面筋蛋白組分均能抑制淀粉消化,尤其是添加谷蛋白最為顯著。這些結果將有助于通過改變面筋蛋白中的谷蛋白和醇溶蛋白的比例控制淀粉消化率,也為低血糖淀粉基食品的開發提供一定理論指導。

