脫乙酰魔芋葡甘聚糖對豬肉肌原纖維蛋白結構及凝膠特性的影響
栗俊廣,張旭玥,王 昱,2,禹 曉,2,龐 杰,陳歷水,白艷紅,
(1.鄭州輕工業大學食品與生物工程學院,河南 鄭州 450000;2.河南省冷鏈食品質量與安全控制重點實驗室,河南 鄭州 450000;3.中原食品實驗室 鄭州輕工業大學,河南 漯河 462000;4.福建農林大學食品科學學院,福建 福州 350002;5.漯河市衛龍生物技術有限公司,漯河市食品安全與營養健康重點實驗室,河南 漯河 462000)
肉制品加工中,凝膠特性是決定其感官品質的重要功能特性[1]。其中,多糖類常被當作肌肉蛋白凝膠增強劑或者脂肪代替物[2],不僅可以改善肉制品的感官品質,還可以平衡膳食營養[3]。魔芋葡甘聚糖(konjac glucomannan,KGM)是從魔芋塊莖中提取的一種水溶性、非離子性、高分子質量的中性多糖[4],具有降低膽固醇、增強飽腹感、預防高血壓和降血脂的功效[5]。KGM由1∶1.6的D-葡萄糖和D-甘露糖殘基組成,在C-6位置約有5%~10%的乙酰基取代基。乙酰基與KGM的凝膠特性和增稠特性密切相關,沒有脫除乙酰基時,KGM只能形成熱可逆凝膠[6],且黏度較大,限制了其在食品加工中的應用。脫乙酰魔芋葡甘聚糖(deacetylated konjac glucomannan,DKGM)不但可以形成熱不可逆凝膠[7],還能改善KGM的黏彈性。Xu Lilan等[8]研究發現,DKGM可以提高雞肉糜的凝膠硬度,降低烹飪損失;Xu Yongxia等[9]報道DKGM可以與魚肌球蛋白交聯形成耐熱復合物,從而提高凝膠強度。因此,DKGM在肉制品加工中具有廣泛的應用價值。
肌原纖維蛋白(myofibrillar protein,MP)作為肌肉中最重要的蛋白質,不僅影響肉的嫩度,同時還決定著肉糜類制品的凝膠性能[10]。熱誘導凝膠過程中,MP結構和化學作用力變化是決定蛋白凝膠性能(如凝膠強度、持水力)的重要因素[11]。MP在加熱過程中去折疊化,引起蛋白質構象發生變化,暴露內部活性基團,活性基團間相互作用形成分子間作用力,從而使蛋白質交聯形成三維網狀結構,蛋白質三維網狀結構的形成是蛋白質之間相互吸引,維持平衡的結果,且凝膠的形成主要依靠分子間的氫鍵、離子鍵、二硫鍵以及疏水相互作用[11]。多糖被認為是改善低脂重組肉制品適口性的最有效和最經濟的脂肪替代品,因此,研究多糖與蛋白質之間的相互作用機制至關重要。近年來,大多數研究集中在多糖對凝膠品質的影響,而從結構和分子力的角度出發,探究DKGM對豬肉MP凝膠特性的影響機理還鮮有報道。
本實驗研究不同添加量DKGM對MP凝膠強度和持水力的影響,同時利用傅里葉變換紅外光譜、熒光光譜、冷場掃描電子顯微鏡等手段,分析DKGM對MP二級結構、微觀構像、水分分布及分子間作用力的影響,為DKGM在肉制品中的應用提供一定理論指導。
1 材料與方法
1.1 材料與試劑
豬后腿肉 鄭州某超市;KGM 上海源葉生物科技有限公司;所有試劑均為分析純。
1.2 儀器與設備
Ultra-turrax T25高速分散器 德國IKA公司;AB265-S分析天平 梅特勒-托利多儀器(上海)有限公司;Avanti J-26s XPI高速冷凍離心機 美國Beckman公司;Lab-1-50冷凍干燥機 北京博醫康實驗儀器有限公司;FE-SEM冷場掃描電子顯微鏡、F-7000熒光光度計日本日立公司;TU-1810紫外-可見分光光度計 北京普析通用儀器有限責任公司;TA-XT Plus質構分析儀 英國Stable Micro System公司;NM120低場核磁共振成像分析儀 上海紐邁電子科技有限公司;Vertex傅里葉變換紅外光譜儀 布魯克(北京)科技有限公司;Multiskan GO全波長酶標儀 美國賽默飛世爾科技公司;Well水浴恒溫搖床 江蘇省蘇州威爾實驗用品有限公司。
1.3 方法
1.3.1 DKGM制備
參考李晶[12]的方法并稍作修改。在蒸餾水中加入適量Na2CO3(Na2CO3與KGM質量比為0.12∶1),完全溶解后,加入KGM,使其質量濃度為4 g/100 mL。1500 r/min攪拌2 h,靜置2 h,用2 倍體積的75%乙醇溶液和蒸餾水(pH值調整到7左右)交替洗滌沉淀物,室溫揮干乙醇,冷凍干燥后得到DKGM。參照Du Xuezhu等[13]的方法,測得DKGM的脫乙酰度為92.87%。
1.3.2 豬肉MP提取
參照Li Junguang等[14]的方法。將新鮮豬肉絞碎后,先后分別與4 ℃、pH 7.0的提取緩沖液(含1×10-5mol/L Na2HPO4、2×10-6mol/L MgCl2、0.1 mol/L乙二醇雙(2-氨基乙基醚)四乙酸)和4 ℃、0.1 mol/L NaCl洗滌液按1∶4(g/mL)混合并均質,4 ℃、3000×g離心3 次,每次15 min,得到MP。用雙縮脲法測定MP質量濃度。
1.3.3 DKGM-MP混合凝膠制備
將不同添加量的DKGM(0%、0.125%、0.25%、0.5%、1%,m/m)加入到4 ℃、pH 7.0的磷酸鹽緩沖液(含0.6 mol/L NaCl、5×10-5mol/L Na2HPO4/NaH2PO4)中,攪拌均勻后加入MP(質量濃度30 mg/mL),10000 r/min勻漿30 s。將混合后的樣品以5 ℃/min的速率從20 ℃加熱到80 ℃,80 ℃維持20 min,得到DKGM-MP混合凝膠。
1.3.4 持水力的測定
將凝膠樣品放入離心管中,4 ℃、10000×g離心10 min,棄去上清液,按下式計算凝膠持水力:
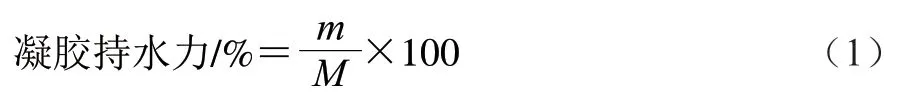
式中:m為離心后凝膠樣品的質量/g;M為離心前凝膠樣品的質量/g。
1.3.5 凝膠強度的測定
使用TA.XT.plus質構分析儀測定樣品的凝膠強度,條件設置如下:探頭為P/0.5,測試前、測試中、測試后速率分別為2、1、2 mm/s,壓縮比為40%,觸發力5 g。
1.3.6 水分分布測定
參照栗俊廣等[15]的方法。使用低場核磁共振儀對MP凝膠中的氫質子密度進行成像掃描,結果用Osiris軟件進行偽彩處理。
1.3.7 內源性熒光測定
根據Li Ke等[16]的方法并稍作修改。參數設置如下:激發波長280 nm、發射波長280~500 nm,狹縫寬度2.5 nm,掃描速率1200 nm/min。將MP懸浮液調節至0.1 mg/mL后進行掃譜并記錄其內源性熒光強度。
1.3.8 活性巰基含量測定
參照Ellman[17]的方法。將MP溶液稀釋至4 mg/mL,將1 mL MP溶液與4 mL pH 7.0緩沖液(含1×10-5mol/L Na2HPO4/NaH2PO4、0.6 mol/L NaCl)混合,加入100 μL 1×10-5mol/L 5,5’-二硫代雙(2-硝基苯甲酸),4 ℃避光條件下繼續反應1 h。在412 nm波長處測定吸光度。1.36×104作為摩爾消光系數,按下式計算MP活性巰基含量:
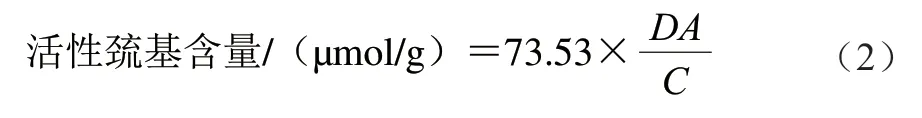
式中:D為稀釋倍數;A為MP溶液在412 nm處的吸光度;C為MP質量濃度/(mg/mL)。
1.3.9 傅里葉變換紅外光譜掃描
將凝膠樣品冷凍干燥并通過80 目篩,將1 mg樣品和100 mg干燥的KBr加入瑪瑙研缽并壓制成片。使用傅里葉變換紅外光譜儀上在4000~500 cm-1波數范圍內對樣品進行掃描,分辨率為4 cm-1。使用PeakFit v.4.12軟件分析蛋白質二級結構的變化。
1.3.10 凝膠分子力測定
參照王昱[18]的方法。5 種不同變性溶液:0.05 mol/L NaCl(S1)、0.6 mol/L NaCl(S2)、0.6 mol/L NaCl+1.5 mol/L尿素(S3)、0.6 mol/L NaCl+8 mol/L尿素(S4)以及0.6 mol/L NaCl+8 mol/L尿素+0.5 mol/Lβ-巰基乙醇(S5)。將切碎的凝膠樣品分別與5 種變性溶液按質量比1∶5混合,10000 r/min均質2 min,4 ℃保持1 h,10000×g離心15 min。取上清液,用Bradford法測定上清液中的蛋白質含量,計算離子鍵(S2和S1之差)、氫鍵(S3和S2之差)、疏水相互作用(S4和S3之差)和二硫鍵(S5和S4之差)的含量。
1.3.11 微觀結構觀察
參照Zhou Feibai等[19]的方法。升華時間為12 min,5 mA下濺射60 s后,在1 kV加速電壓下使用冷場掃描電子顯微鏡觀察MP凝膠結構,并在放大3000 倍下拍照。
1.4 數據處理
2 結果與分析
2.1 DKGM對MP凝膠持水力和凝膠強度的影響
如表1所示,添加DKGM后,凝膠的持水力先上升后下降,添加量為0.25%時達到最大值。研究表明,持水力與凝膠系統中的氫鍵含量密切相關,而持水力的小幅度增強可能是由于DKGM改善了凝膠系統中分子間的作用力[20],形成了更穩定的凝膠網絡結構,使其保持水分的能力增強,但去除乙酰基的KGM水溶性減小[21],DKGM可以使MP疏水性劇烈增加,導致蛋白質過度展開或聚集,從而導致MP凝膠的持水力不會大幅度增強。樣品的凝膠強度隨著DKGM質量分數的增加而增大,0.25%時達到峰值后略微減小,這與Yuan Li等[21]的研究結果類似,表明DKGM可以通過促進蛋白質的聚集從而增強魚糜的凝膠強度。凝膠系統中的蛋白質與多糖相互作用是提高凝膠變形和破裂力的原因[22],去除乙酰基的KGM不僅排除了空間位阻效應[23],同時也促進了MP的去折疊,暴露了更多的活性基團(疏水基團、活性巰基),改善了凝膠系統中多糖與蛋白質以及蛋白質間的相互作用,從而形成了更穩固的三維網絡結構。

表1 DKGM添加量對MP凝膠持水力和凝膠強度的影響Table 1 Effect of DKGM addition on water-holding capacity and gel strength of MP gels
2.2 DKGM對MP凝膠水分分布的影響
如圖1所示,通過低場核磁成像得到了凝膠內部的氫質子分布情況,從紅到藍依次代表水分含量的減少[24],氫質子密度與凝膠強度和持水力密切相關,對照組顯示出更強的氫質子密度,且分布最均勻,這與持水力和凝膠強度的結果一致。Li Zhiyu等[25]表示,DKGM作為一種“活性填料”,可以與蛋白發生非特異性相互作用,從而減緩水的流動性,并在凝膠系統中捕獲更多的水分子。

圖1 不同DKGM添加量的MP凝膠水分分布Fig.1 Moisture distribution of MP gels with different amounts of DKGM added
2.3 DKGM對MP內源性熒光的影響
300~450 nm波長處的熒光光譜可以表征MP分子中疏水殘基附近的微環境變化[26]。如圖2所示,添加DKGM后,最大熒光發射波長紅移,表明更多色氨酸殘基暴露于極性環境中[27],DKGM的加入改變了蛋白的三級結構,將先前掩埋的疏水基團和結合位點暴露在外。熒光強度與最大熒光發射波長的結果相似,對照組的熒光強度最小,表明DKGM與MP之間發生了一定的相互作用,在一定程度上改變了色氨酸環境的敏感程度,改變了蛋白質的空間構像,促進了蛋白質的展開,從而影響了MP凝膠特性。
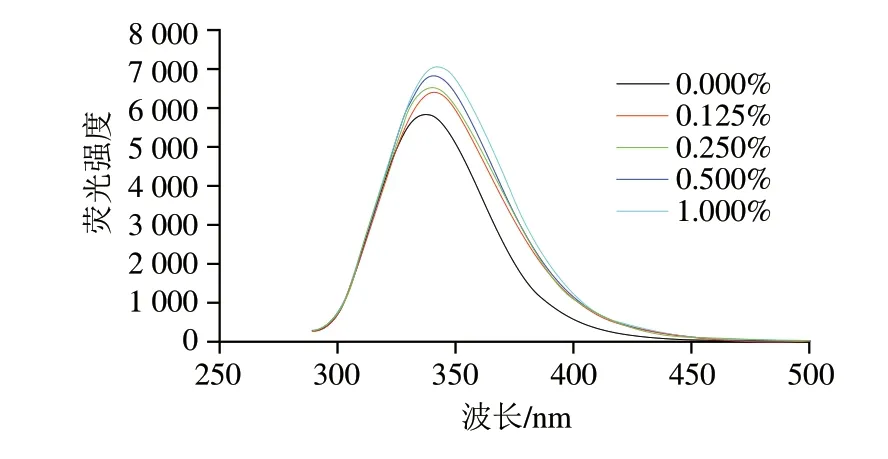
圖2 不同DKGM添加量的MP熒光光譜Fig.2 Endogenous fluorescence spectra of MP with different amounts of DKGM added
2.4 DKGM對MP活性巰基含量的影響
巰基含量常用于反映蛋白質的二硫鍵生成情況、折疊或空間構像的改變情況[28],大多數分布在肌球蛋白頭部,暴露的巰基基團是形成凝膠網絡結構的先決條件,在維持蛋白質的三級和四級結構中起重要作用。由圖3可知,添加DKGM后,MP的活性巰基含量顯著增加(P<0.05),表明DKGM可以促進MP的去折疊,使蛋白質展開,暴露內部的活性巰基,從而在加熱過程中氧化形成更多二硫鍵,穩定MP的凝膠網絡結構。DKGM質量分數超過0.25%時,活性巰基含量呈現下降趨勢,可能是由于完全展開的蛋白質更傾向于形成大的聚集體[22],從而使活性巰基重新被掩埋。
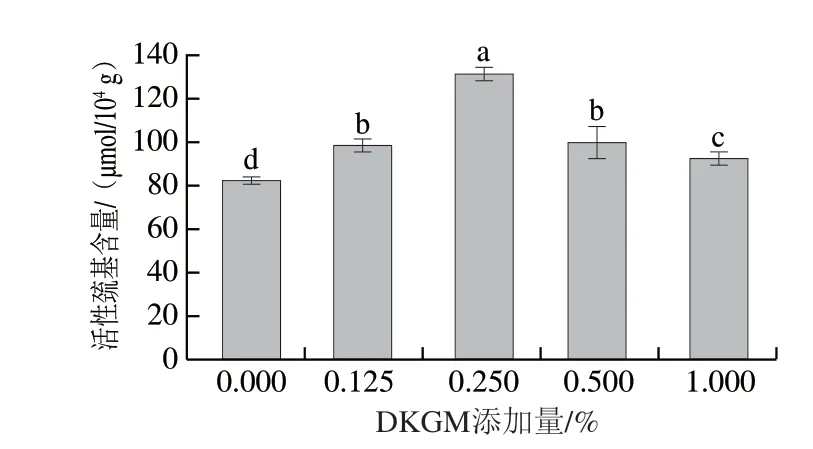
圖3 不同DKGM添加量的MP活性巰基含量Fig.3 Contents of active sulfhydryl groups in MP with different amounts of DKGM added
2.5 DKGM添加量對MP凝膠二級結構的影響
由圖4可知,加入DKGM后,α-螺旋相對含量顯著降低(P<0.05),α-螺旋主要由分子中羥基氧和羥基氫之間形成的氫鍵穩定[29]。β-折疊和β-轉角含量明顯升高,Liu Ru等[30]研究表明更多β-折疊和β-轉角可以提高凝膠的凝膠強度和儲能模量。DKGM可以促進α-螺旋向β-折疊的轉變,有益于凝膠的形成。這一結果也說明了DKGM可以促進α-螺旋結構的展開,誘導MP的去折疊反應,暴露更多疏水基團和活性巰基,從而影響其分子間作用力,形成更密集的三維網絡結構,這與三級結構的結果相呼應。

圖4 不同DKGM添加量的MP凝膠二級結構Fig.4 Secondary structure composition of MP gels with different amounts of DKGM added
2.6 DKGM對MP凝膠分子力的影響
蛋白質分子間的作用力對凝膠網絡的形成十分重要,其中包括離子鍵、氫鍵、疏水相互作用以及二硫鍵的作用。Xu Yongxia等[9]表明疏水相互作用是形成凝膠的主要驅動力,而氫鍵會對穩定的凝膠網絡結構產生不利影響。如圖5所示,疏水相互作用和二硫鍵是MP凝膠中的主要作用力,DKGM的添加不會影響凝膠系統中離子鍵的相對含量,而氫鍵的相對含量減小。α-螺旋由氫鍵穩定,DKGM的加入加速了α-螺旋向β-折疊的轉變,因此破壞了凝膠系統中的氫鍵。添加DKGM后疏水相互作用相對含量顯著提高(P<0.05)。這是由于乙酰基的去除增加了DKGM的疏水性,促使MP中疏水基團的暴露,從而促進MP熱誘導凝膠過程中蛋白質的展開,導致蛋白質-蛋白質間以及蛋白質和DKGM間的疏水相互作用增強[8],而過量的DKGM可能會導致MP表面疏水性劇烈增加從而導致蛋白質重新聚集,在加熱過程中疏水相互作用減小。二硫鍵的結果與活性巰基的結果相呼應,MP的去折疊化使活性巰基暴露,導致加熱過程中氧化形成了更多二硫鍵,二硫鍵和疏水相互作用的共同作用使MP形成了更好的凝膠網絡結構。
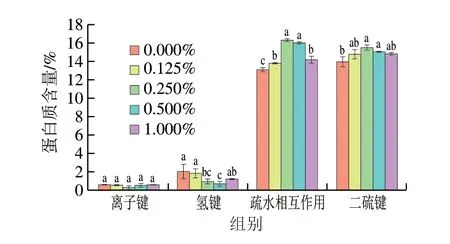
圖5 不同DKGM添加量的MP凝膠分子力Fig.5 Molecular forces of MP gels with different amounts of DKGM added
2.7 DKGM對MP凝膠微觀結構的影響
如圖6所示,所有樣品都具有三維網狀結構,表明凝膠具有彈性行為。圖中黑色孔徑代表水分通道[31]。放大3000 倍后,對照組的孔徑較大,且孔徑分布不均勻;添加DKGM后,凝膠的三維網狀結構更加致密且均勻。且添加量為0.25%時,凝膠壁厚增加,DKGM均勻分布在三維網狀結構中。添加量達到0.5%時,雖然網狀結構更加致密,但斷裂較多,壁厚減小;添加量達到1%時,網狀結構大片斷裂,水分通道再次增大,凝膠的持水能力與水分通道的分布有關,水分通道越小,結構斷裂越少則持水力越好[32],這與持水力的結果一致。加熱過程中,蛋白質展開并發生相互作用,從而形成三維網狀結構,這一結果說明DKGM促進了蛋白質的展開,從而促進了蛋白質分子間以及蛋白質和DKGM之間的相互交聯,且DKGM可以充當“基質”填充在三維網狀結構中,但DKGM添加量過多時,DKGM會破壞原有的三維網狀結構,且可能由于蛋白質過度展開從而導致其更傾向于重新聚集,對凝膠網狀結構造成負面影響。
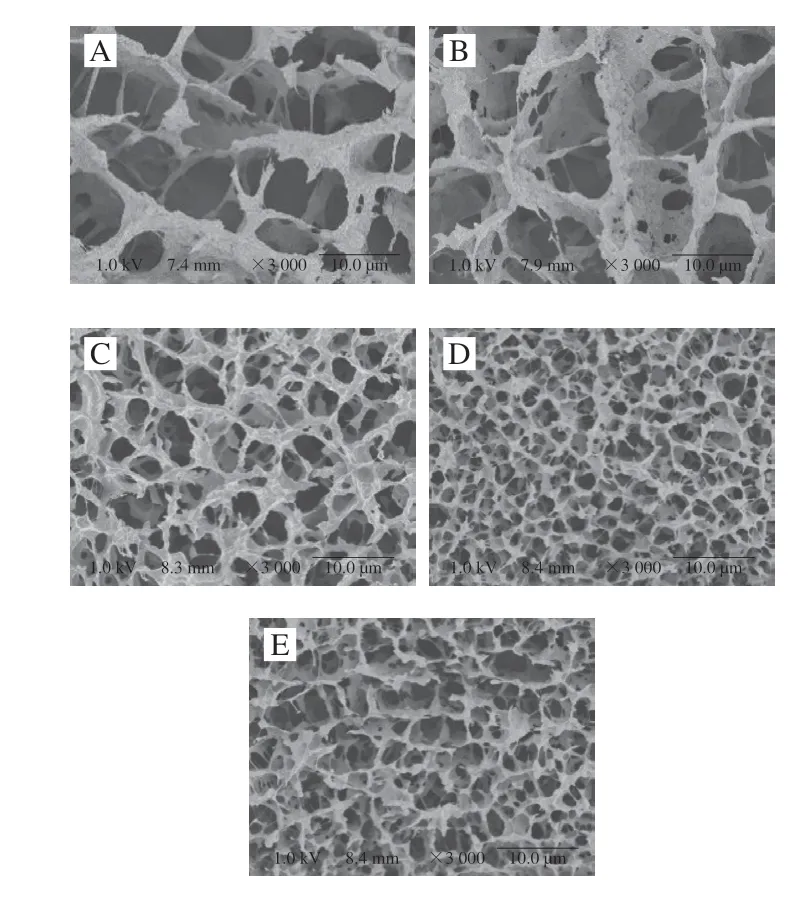
圖6 不同DKGM添加量的MP凝膠的冷場電鏡掃描圖Fig.6 Cold-field scanning electron micrographs of MP gels with different amounts of DKGM added
3 結論
研究不同添加量DKGM對MP凝膠強度和持水力的影響,同時利用傅里葉變換紅外光譜、熒光光譜、冷場掃描電子顯微鏡等手段,分析DKGM對MP二級結構、微觀構像、水分分布及分子間作用力的影響。結果表明,DKGM可以通過改善MP的結構特性影響分子間作用力,從而增強其凝膠強度和持水力,且在質量分數為0.25%時效果最佳;DKGM的添加可以加速MP的去折疊,導致疏水基團的暴露和活性巰基的增加;二級結構結果顯示,DKGM可以誘導加熱過程中更多α-螺旋向β-折疊的轉變;分子力結果顯示,添加DKGM后MP凝膠中氫鍵的相對含量減少,二硫鍵和疏水相互作用的相對含量增加;DKGM通過改善MP的結構特性使MP凝膠水分通道減小,形成了更加致密的凝膠網絡結構,但DKGM添加量過大時,MP原有的網狀結構被破壞,且蛋白的過度變性可能致使其重新聚集,導致凝膠強度和持水力下降。

