外源蛋白對白鰱魚糜肌原纖維蛋白結構及其結合特征腥味物質能力的影響
嚴 浩,王玉棟,鐘 武,莊 洋,楊 宏,
(1.華中農業(yè)大學食品科學技術學院,湖北 武漢 430070;2.武漢輕工大學食品科學與工程學院,湖北 武漢 430023)
白鰱具有較高的營養(yǎng)價值,且其價格低廉易養(yǎng)殖,常被用來制作魚糜,但由于脂肪氧化、酶促反應的影響,會產生難聞的腥味,已有多項研究證明己醛、壬醛和1-辛烯-3-醇是鰱魚腥味的主要來源[1-3]。目前已有許多方法用于水產品腥味的去除,如活性炭吸附等物理方法[4],雙氧水漂洗、酸堿漂洗等化學方法[5-6],以及生物發(fā)酵去腥[7],但前者更適用于液體以及氣體,化學方法去腥則可能導致魚糜中化學成分發(fā)生改變,生物發(fā)酵去腥則會使蛋白變性使水產品的理化性質發(fā)生改變[2]。
大豆分離蛋白(soy protein isolate,SPI)、蛋清蛋白(egg white protein,EWP)、乳清分離蛋白(whey protein isolate,WPI),由于其多種功能特性(如起泡性、凝膠性、黏著性等),被廣泛的應用于魚糜凝膠中。研究表明,一定pH值下,WPI含量的增加能增強對己醛、1-辛烯-3-醇的結合[8];汪娟[9]研究發(fā)現(xiàn),SPI對己醛、壬醛具有較好的結合能力,但會增強1-辛烯-3-醇的釋放;而有關EWP對揮發(fā)性風味物質結合能力的研究較少。揮發(fā)物質與蛋白質的結合主要通過可逆的疏水相互作用,其他的結合方式包括氫鍵、范德華力、離子鍵以及不可逆的化學共價交聯(lián),如醛酮類物質主要與蛋白質的疏水區(qū)域通過疏水相互作用結合,而醇類物質則可通過氫鍵與蛋白質的羥基發(fā)生可逆結合[10]。另外不同種類蛋白質對風味物質的結合能力也存在差異,如小麥蛋白對醛酮類物質的結合能力遠高于油菜蛋白以及豌豆蛋白[11]。
目前已有關于肌原纖維蛋白(myofibrillar protein,MP)結合己醛、壬醛、1-辛烯-3-醇的研究,MP濃度[12]、pH值[13-14]、鹽離子強度及種類[15]、蛋白氧化[16]、外源添加物[2]等因素均可對其結合能力產生影響,如在Xue Chao[17]和Zhang Huimin[2]等的研究中發(fā)現(xiàn),酵母β-葡聚糖可通過提升白鰱MP結合己醛、壬醛、1-辛烯-3-醇的能力抑制白鰱的腥味。而有關于外源蛋白對MP的研究,多是集中于凝膠性能的研究,有關外源蛋白對MP結合腥味物質能力的研究鮮有報道。本研究通過頂空固相微萃取-氣相色譜-質譜研究SPI、EWP、WPI添加量對白鰱魚糜MP結合己醛、壬醛、1-辛烯-3-醇能力的影響,并探究不同外源蛋白添加量下MP結構變化與其結合能力的關系,可為調控白鰱魚糜的腥味提供一定的理論依據(jù)。
1 材料與方法
1.1 材料與試劑
冷凍白鰱魚糜(AA級) 洪湖市井力水產食品股份有限公司;SPI 河南萬邦實業(yè)有限公司;EWP安徽省亳州市眾意蛋業(yè)有限責任公司;WPI 美國希爾瑪奶酪公司;己醛、壬醛、1-辛烯-3-醇(均為色譜級)上海源葉生物科技有限公司;甲醇(色譜級) 德國CNW科技有限公司。
1.2 儀器與設備
XHF-DY高速分散器 寧波新芝生物科技股份有限公司;X-30RC高速離心機 美國Beckman Coulter公司;UV-1700紫外-可見分光光度計 日本島津公司;F-4600熒光光譜儀 日本日立公司;ZS90納米粒度電位分析儀 英國Malvern公司;7000D氣相色譜-質譜聯(lián)用儀、HP-5色譜柱(30 m×0.25 mm,0.25 μm)美國Agilent公司;50/30 μm DVB/CAR/PDMS纖維萃取頭美國Supeleo公司。
1.3 方法
1.3.1 樣品制備
1.3.1.1 MP提取
參考Fan Mingcong等[18]的方法略作修改。稱取2.5 g魚糜,加入4 倍體積低鹽緩沖液(0.05 mol/L NaCl、3.38 mmol/L NaH2PO4、15.5 mmol/L Na2HPO4,pH 7.5),9000 r/min均質1 min,4 ℃靜置15 min,4 ℃、10000 r/min離心10 min,重復提取3 次,取沉淀。將沉淀溶于4 倍體積的高鹽緩沖液(0.45 mol/L NaCl、3.38 mmol/L NaH2PO4、15.5 mmol/L Na2HPO4,pH 7.5),9000 r/min均質1 min,4 ℃放置22 h后12000 r/min離心10 min(4 ℃),取上清液用10 倍體積的冷凝水沉淀30 min,10000 r/min離心10 min(4 ℃),取沉淀用15 mL溶解液溶解(0.6 mol/L NaCl、20 mmol/L Tris-HCl、pH 7.5),即得MP溶液。
1.3.1.2 樣品溶液制備
參考Xue Chao[17]和夏培浩[19]等的方法略作修改。將MP稀釋至4 mg/mL,向溶液中添加溶解好的SPI、EWP、WPI 4 ℃條件下用溶解液溶解12 h后,離心取上清液,使其添加量為MP的2%、4%、6%。
1.3.1.3 特征腥味物質溶液制備
將己醛、壬醛和1-辛烯-3-醇標準品用少量色譜級甲醇溶解,混勻后用超純水稀釋,使三者的質量濃度分別為0.5、0.1、0.5 g/100 mL,用棕色小瓶保存待用。
1.3.2 分析檢測
1.3.2.1 表面疏水性
參考Jia Na等[20]的方法略作修改。取1 mL 4 mg/mL的MP懸浮液添加200 μL 1 mg/mL溴酚藍(bromophenol blue,BPB),混合均勻后室溫下反應2 h,6000 r/min離心15 min(4 ℃)。將上清液用溶解液稀釋10 倍,在波長595 nm處測定吸光度,每個樣品測定3 次平行。BPB結合量按式(1)計算:
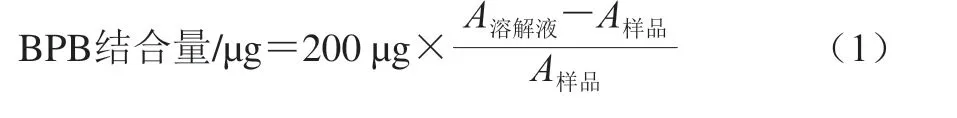
式中:A溶解液為溶解液的吸光度;A樣品為樣品的吸光度。
1.3.2.2 濁度
將MP質量濃度調節(jié)至1 mg/mL,采用紫外分光光度計在波長350 nm處測量透過率(T),每個樣品測定3 次平行,按式(2)計算濁度[21]:

1.3.2.3 粒徑和Zeta電位
參考Zheng Jiabao等[21]的方法略作修改。將MP稀釋至0.1 mg/mL和0.01 mg/mL,納米粒徑電位分析儀分別測定樣品的粒徑以及電位。樣品粒徑在25 ℃通過配備4 mW氦/氖激光器的動態(tài)光散射測量,波長輸出為633 nm,并在173°的檢測角下進行反向散射校準。Zeta電位在25 ℃下使用電泳遷移率池(DTS1070)測定。每個樣品測定3 次平行。
1.3.2.4 內源熒光光譜
參考Liu Qian等[22]的方法略作修改。將MP稀釋至0.1 mg/mL,轉移至光程為1 cm的石英比色皿,使用熒光光譜儀進行測定。樣品在波長280 nm處被激發(fā),發(fā)射光譜在300~400 nm范圍內記錄,激發(fā)和發(fā)射狹縫的寬度均為5 nm的固定值,掃描速率為60 nm/min,電壓為400 V。每個樣品測定3 次平行。
1.3.2.5 紫外全掃描
參考Wang Yu等[23]的方法略作修改。將MP稀釋至0.3 mg/mL,轉移到光程為1 cm的石英比色皿,采用紫外分光光度計在波長230~400 nm內進行測定。每個樣品測定3 次平行。
1.3.2.6 頂空固相微萃取-氣相色譜-質譜
參考An Yueqi等[1]的方法略作修改。取5 mL樣品溶液于15 mL頂空瓶中,并添加5 μL配制好的特征腥味物質溶液,4 ℃放置12 h后,采用氣相色譜-質譜法進行分析。40 ℃平衡10 min后采用50/30 μm DVB/CAR/PDMS萃取頭頂空吸附30 min,將萃取頭插入氣相色譜進樣口,250 ℃解吸5 min。
氣相色譜條件:H P-5 毛細管色譜柱(30 m×0.25 mm,0.25 μm);升溫程序最初為40 ℃,保持4 min,之后以4 ℃/min的恒定速率升溫至250 ℃,保持2 min。進樣口溫度為250 ℃,載氣為氦氣,流量為恒定速率1.0 mL/min,采用不分流模式進樣。
質譜條件:電子電離源;電子能量70 eV;離子源溫度230 ℃;四極桿溫度150 ℃;檢測器溫度250 ℃;氣質接口溫度280 ℃;檢測器電壓1.2 kV;掃描范圍40~350 u,掃描速率2.0 scans/s。
MP對腥味物質的結合能力用游離揮發(fā)性化合物的百分比表示,每個樣品測定3 次平行,按式(3)計算:
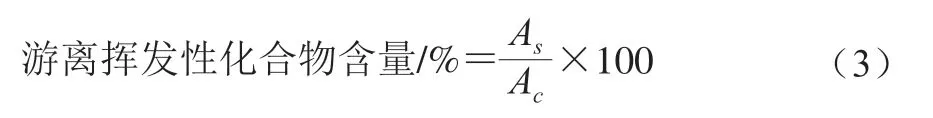
式中:Ac為MP揮發(fā)性化合物的峰面積;As為添加不同質量濃度外源蛋白后揮發(fā)性化合物的峰面積。
1.4 數(shù)據(jù)處理
采用Microsoft Excel 2018整理數(shù)據(jù),IBM SPSS Statistics 26進行顯著性分析,Origin 2017進行繪圖。
2 結果與分析
2.1 外源蛋白對肌原纖維蛋白表面疏水性的影響
Bertsch等[24]的研究中證明BPB分子可以與蛋白表面的疏水位點結合,因此可通過BPB結合量表征白鰱魚糜MP表面疏水性的變化。如圖1所示,外源蛋白添加量增加,MP的BPB結合量先增大后減小,添加4% SPI、2% EWP和4% WPI時MP的BPB結合量顯著高于組內其余樣品(P<0.05),表明此添加量下樣品具有最大的表面疏水性,MP解折疊程度最大。表面疏水性的增強可歸結于外源蛋白與MP產生的相互作用,Herrero等[25]的研究中SPI可以減少MP中α-螺旋的含量,促使MP展開,暴露出更多的疏水基團,同樣一定量的EWP也能夠促進MP的展開[26]。表面疏水性的下降可能是由于當?shù)鞍诐舛瘸^一定臨界限時,不同大分子蛋白由于其大分子質量以及熱力學不相容性,容易發(fā)生相分離形成單獨的相,從而使蛋白的疏水位點被包埋[27]。另外,相較于其他2 組樣品,添加EWP的樣品BPB結合量更低,這是因為蛋清蛋白中主要的蛋白質卵白蛋白的疏水性氨基酸殘基均位于蛋白的內部[28]。
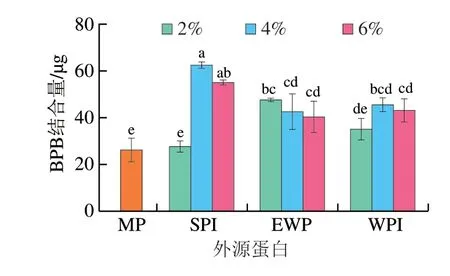
圖1 外源蛋白對MP BPB結合量的影響Fig.1 Effects of external proteins on the BPB binding ability of MP
2.2 外源蛋白對肌原纖維蛋白濁度的影響
如圖2所示,在添加SPI、EWP、WPI后,樣品的濁度皆大于對照組,這與蛋白質聚集體的存在有關,表明可能形成了不溶性聚集體,降低了溶解度,這是由于蛋白內部疏水性氨基酸殘基的暴露,蛋白之間的疏水相互作用增強,從而導致MP的聚集程度加深[13]。研究表明非共價相互作用力是蛋白質聚集的直接驅動力,疏水基團的暴露有助于蛋白質的聚集[22],在Shen Hui等[13]的報道中,在pH 5~7的范圍內,pH值可增強MP表面疏水性,MP溶液的濁度隨之上升。可以看到添加SPI、WPI的樣品濁度變化規(guī)律與圖1表面疏水性的結果一致,而對于添加EWP的樣品,隨著蛋白添加量的增加,樣品的濁度變化較小,這可能是由于蛋白的進一步展開導致α-螺旋減少,蛋白內部的氫鍵遭到破壞,暴露出蛋白表面的氫鍵結合位點,水分子羥基通過氫鍵增強與蛋白質之間的相互作用,兩者的親和力增強,形成的聚集體更容易溶解在溶液中[29-30]。
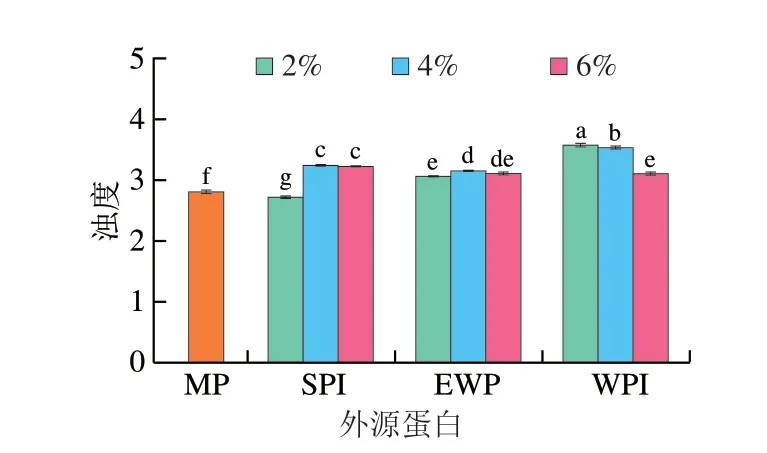
圖2 外源蛋白對MP濁度的影響Fig.2 Effects of external proteins on the turbidity of MP
2.3 外源蛋白對肌原纖維蛋白平均粒徑的影響
粒徑的大小與蛋白分子內或分子間的交聯(lián)相關,而疏水相互作用增強有助于蛋白分子的交聯(lián)以及聚集體的形成,另外蛋白質分子間的靜電相互作用也與蛋白質聚集體的形成有關[13]。如圖3所示,隨著外源蛋白添加量的增加,MP的平均粒徑呈現(xiàn)先上升后下降的趨勢,其中添加4% SPI、2% EWP、2% WPI的樣品平均粒徑顯著高于組內其余樣品(P<0.05),可歸結于顯著增加的表面疏水性引起了蛋白之間的強相互作用使蛋白質聚集程度增加,而粒徑的減小則是由于蛋白分子之間的靜電引力不足,使蛋白分子的聚集程度降低[13]。另外,當外源蛋白添加過多時,不同大分子蛋白由于其大分子質量以及熱力學不相容性,會使不同的蛋白質自聚集形成單獨的相,此時蛋白質的粒徑也會有所降低[31]。
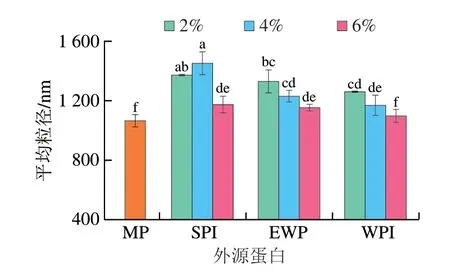
圖3 外源蛋白對MP平均粒徑的影響Fig.3 Effects of external proteins on the average particle size of MP
2.4 外源蛋白對肌原纖維蛋白Zeta電位的影響
蛋白質的分散、聚集均會影響其表面電荷的變化[13]。如圖4所示,所有樣品的Zeta電位值均為負值,表明蛋白表面均帶負電荷。3 種混合溶液的Zeta電位隨著外源蛋白添加量的增加先增大后減小,在SPI、EWP、WPI添加量分別為4%、2%、4%時,樣品的Zeta電位顯著高于組內其余樣品(P<0.05)。Zeta電位增加,表明蛋白分子間的靜電引力大于靜電斥力,此時的靜電相互作用能夠促使蛋白質分子發(fā)生聚集;而隨外源蛋白添加量進一步增加,MP的Zeta電位顯著降低(P<0.05),此時蛋白分子間靜電斥力更大,分子間靜電斥力會降低蛋白質間的聚集度[21],進一步解釋了圖3中外源蛋白添加過量后蛋白分子平均粒徑有所下降的現(xiàn)象。

圖4 外源蛋白對MP Zeta電位的影響Fig.4 Effects of external proteins on the zeta potential of MP
2.5 外源蛋白對肌原纖維蛋白內源熒光強度的影響
內源熒光光譜對色氨酸殘基所處微環(huán)境的極性變化極其敏感,是評價蛋白分子三級結構變化的重要方法,通常蛋白在折疊狀態(tài)下,色氨酸殘基處于蛋白質內部的疏水環(huán)境中,蛋白溶液具有較高的熒光強度,此時,蛋白質表面具有較多的親水基團,表面疏水性較低[22,32]。如圖5所示,添加4% SPI的樣品熒光強度明顯低于組內其余樣品,最大吸收峰略微紅移,這表明SPI添加量為4%時能夠促進MP展開,色氨酸殘基暴露到更加親水的環(huán)境中[22],這與圖1表面疏水性的結果一致。而添加EWP后,MP的熒光強度明顯降低,但隨著添加量的增加MP熒光強度的變化并不明顯,表明EWP能夠促使MP展開,但其含量的增加對MP三級結構的影響不大。而對于添加WPI的樣品,隨著WPI添加量的增加,蛋白溶液的熒光強度呈現(xiàn)先下降后上升的趨勢,WPI添加量為4%時具有最低的熒光強度,此時由于蛋白展開,暴露出的色氨酸基團引起了熒光猝滅現(xiàn)象;添加量繼續(xù)增大,MP的熒光強度明顯下降,其最大吸收峰略微藍移,表明蛋白質發(fā)生聚集,色氨酸殘基被重新包埋進蛋白內。
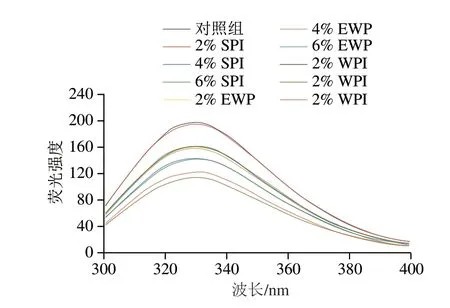
圖5 外源蛋白對MP內源熒光強度的影響Fig.5 Effects of external proteins on the intrinsic fluorescence intensity of MP
2.6 外源蛋白對肌原纖維蛋白紫外吸收光譜的影響
紫外吸收光譜能夠識別3 種芳香族氨基酸殘基(苯丙氨酸、色氨酸、酪氨酸),尤其是酪氨酸殘基所處微環(huán)境的變化,可用來辨別蛋白質的構象變化[23]。由圖6可知,所有樣品均在波長275 nm左右觀察到吸收峰,表明酪氨酸的存在[33]。而在添加SPI、EWP以及WPI后,樣品溶液的吸光度均高于對照組,表明外源蛋白能促進MP展開,暴露出更多酪氨酸殘基。此外,隨著SPI添加量的增加,MP最大吸收峰略微藍移,表明SPI與MP之間產生相互作用促使酪氨酸殘基所處環(huán)境的極性增加。MP的內源熒光光譜以及紫外吸收光譜的結果表明,外源蛋白的添加能使色氨酸、酪氨酸殘基所處環(huán)境的極性增強,表明外源蛋白能夠促使MP展開。
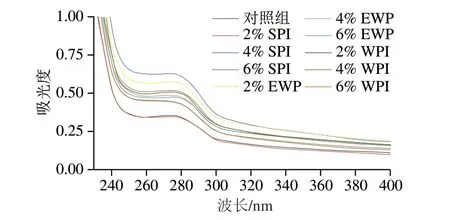
圖6 外源蛋白對MP紫外吸收光譜的影響Fig.6 Effects of external proteins on the UV absorption spectrum of MP
2.7 外源蛋白對肌原纖維蛋白結合特征腥味物質能力的影響
如圖7A、B所示,MP溶液中游離己醛、壬醛含量變化基本一致,隨著外源蛋白添加量的增大,MP溶液中己醛、壬醛的含量均呈現(xiàn)先減小后增大的趨勢,添加量為4%時,溶液中游離的己醛、壬醛含量顯著低于組內其余樣品(P<0.05),僅添加6% EWP的樣品在組內具有最大的壬醛結合能力,表明3 種外源蛋白均能增強MP對己醛、壬醛的結合能力。通常,蛋白對醛類物質的結合能力與其表面疏水性呈正相關,其結合能力的增強可歸結于蛋白展開暴露出更多的疏水結合位點[10]。而圖1和圖5顯示,隨著外源蛋白添加量的增加,MP展開,蛋白的表面疏水性增強,醛類物質與暴露出來的疏水位點以及巰基相結合,此時釋放出的己醛、壬醛的含量顯著降低。而隨著添加量的進一步增大,MP對己醛、壬醛的結合能力下降,這可歸結于蛋白分子由于相分離而發(fā)生自聚集,疏水基團重新嵌入蛋白中,從而導致MP表面疏水性下降所致。圖3、5顯示:外源蛋白添加量過高時,蛋白質的聚集程度增大,但粒徑反而減小,在Sow等[31]的研究中,這是由于相分離導致的自聚集造成的,此時疏水基團被重新包埋,不利于MP與風味物質的結合。此外,由于相分離的發(fā)生,外源蛋白會作為惰性填料填充在MP蛋白之間,這可能會阻礙蛋白質間的靜電相互作用,從而減小揮發(fā)性物質與蛋白質之間的離子相互作用,使通過靜電相互作用結合的揮發(fā)性物質重新釋放出來[27,34],而圖4中Zeta電位的下降也證實了這一結論。
另外,在同樣的處理條件下,MP對壬醛的吸收效果明顯高于己醛,這與Xue Chao等[17]的研究一致。研究表明,較大風味分子的結構所產生的構象阻礙效應,可以阻止庚醛和辛醛靠近蛋白的疏水結合位點,降低蛋白與兩者的親和力[35]。與此類似,MP對己醛的結合量較之壬醛更低,可能歸因于壬醛化學結構所產生的構象阻礙效應。另外,有研究表明MP對碳鏈更長的醛類有更好的結合效果,其結合能力的增強是由于長鏈醛類與蛋白質產生的疏水相互作用更強[14]。
如圖7C所示,MP對醇類物質的結合能力通常與氫鍵以及弱疏水相互作用相關,EWP、WPI添加量增加,MP溶液中游離1-辛烯-3-醇的含量隨之降低,表明MP結合1-辛烯-3-醇的能力增強,而這與圖1中MP表面疏水性的變化并不一致,表明疏水相互作用并不是促使EWP、WPI改變MP結合1-辛烯-3-醇的能力的原因。圖5、6結果表明,添加2% EWP和4% WPI時,MP的展開程度最大,有研究表明蛋白展開可導致蛋白內部的氫鍵遭到破壞,增加了氫鍵結合位點,從而使醇類物質的羥基通過氫鍵與MP結合,增強了兩者之間的親和力[30];而當EWP、WPI的添加量繼續(xù)增加,游離1-辛烯-3-醇含量進一步降低,表明MP結合1-辛烯-3-醇的能力進一步增強,這可能是由于蛋白自聚集,增加了表面的親水基團,通過氫鍵與1-辛烯-3-醇相結合。而添加6% SPI后,游離的1-辛烯-3-醇含量反而增加,這可能是由于SPI中本身具有一定量的1-辛烯-3-醇所致[9]。
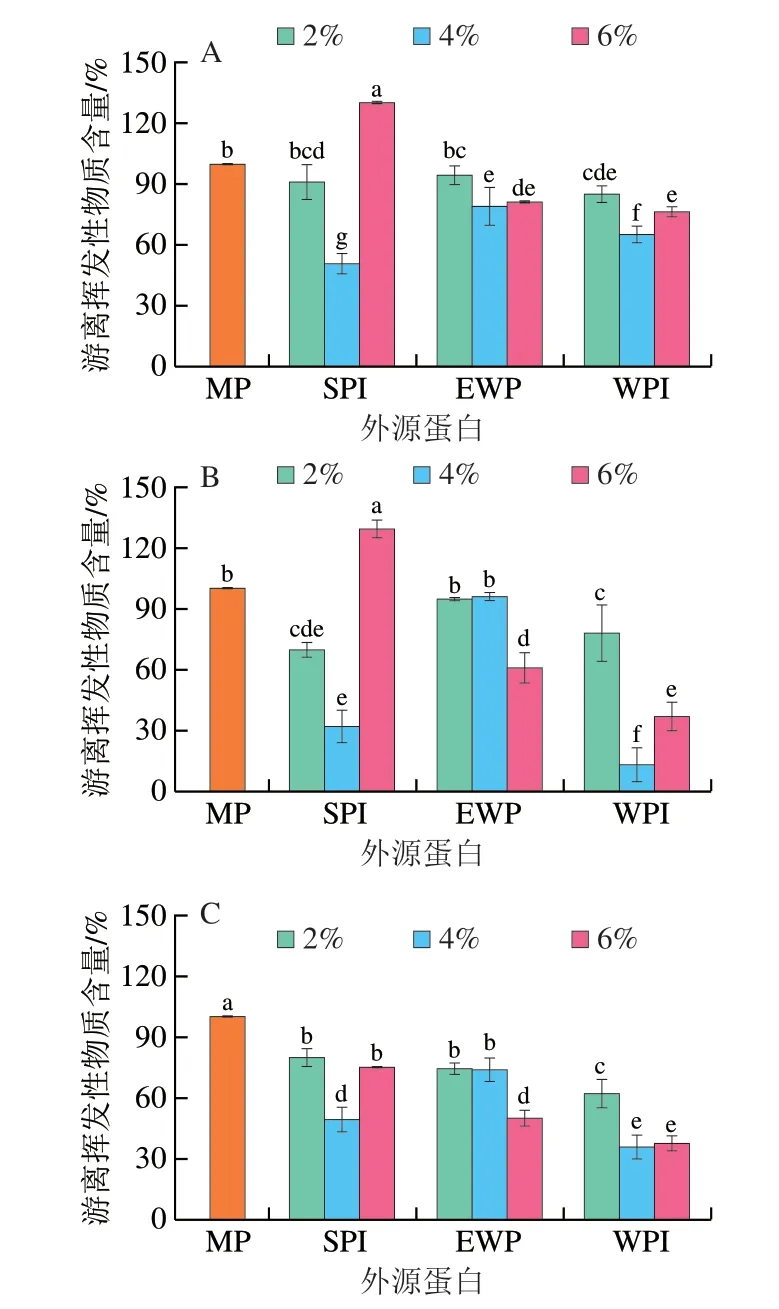
圖7 外源蛋白對MP結合特征腥味物質能力的影響Fig.7 Effects of external proteins on the binding capacity of MP to fishy-odor compounds
此外,添加不同外源蛋白的MP溶液結合能力也存在差異,添加WPI的樣品中游離的己醛、壬醛和1-辛烯-3-醇3 種腥味物質含量顯著低于SPI組以及EWP組,表明添加WPI的MP溶液對3 種腥味物質均具有最強的結合能力。這可能是由于3 種外源蛋白不同的空間排列結構所造成的[11]。SPI主要由7S(β-伴大豆球蛋白)和11S(大豆球蛋白)構成,其中11S是由6 個亞基通過6 個二硫鍵以及少量的非共價相互作用構成[36]。而WPI中主要的蛋白為β-乳球蛋白,其桶狀結構由2 個二硫鍵連接而成,并含有一個游離巰基[37]。相較于WPI,SPI含有更多的二硫鍵,蛋白亞基之間的聯(lián)系更加緊密,產生的空間位阻會減少風味物質進入疏水核心的可能性,而WPI二硫鍵較少可減少風味物質進入蛋白疏水區(qū)域的阻礙,同時WPI中含有的游離巰基,也能夠增強其對醛酮類物質的吸收[11]。而蛋清蛋白中卵白蛋白占其含量的一半以上,含有386 個氨基酸殘基,并且多為疏水性氨基酸,但這些氨基酸均分布于卵白蛋白內部,其疏水區(qū)域并不能與風味物質結合[11,28]。
3 結論
外源蛋白可通過改變MP三級結構影響MP的結合能力。添加適量外源蛋白能促進蛋白展開,增強MP表面疏水性,形成更大的聚集體,溶液濁度也隨之增加,此時MP具有較強的己醛、壬醛結合能力;添加量過高,MP疏水基團被重新包埋,結合己醛、壬醛的能力隨之下降。同時,EWP、WPI添加量的增大可增強MP結合1-辛烯-3-醇的能力,這可歸結于蛋白氫鍵結合位點的增加;而隨SPI添加量的增加,MP對1-辛烯-3-醇的結合能力先上升后下降。此外,添加WPI的樣品對3 種腥味物質的結合能力強于添加SPI、EWP的樣品。但對于這3 種外源蛋白在魚糜制品中是否能起到同樣的作用,仍需進一步研究。

