胞內細菌如何劫持你的細胞
編譯 無機客

作為一名細胞生物學專業的研究生,沙莉?穆克吉(Shaeri Mukherjee)總是在尋找改動細胞內部結構的新方法。那時是21世紀初,穆克吉在阿爾伯特?愛因斯坦醫學院的丹尼斯?希爾茲實驗室研究細胞如何組織蛋白質和其他“貨物”的內部運輸。她對于高爾基體格外感興趣,花費許多時間操縱這種胞器的活動,試圖更好地弄懂它的運作方式。高爾基體是一群幫助協調運輸的膜結合細胞區室。遺傳學方法能在數日內減緩或改變胞器的結構;某些藥物因子讓胞器在不到半小時內分解。但在2008年,穆克吉偶然地發現一種快捷得多的、引起細胞內混亂的新方法。
這項技術來自耶魯大學醫學院的克雷格?羅伊(Craig Roy)的一篇論文。羅伊的團隊發現,“這種叫作AnkX的蛋白質在顯微注射進細胞中(甚至是在皮摩爾水平上)后,能引起整個高爾基體在大約五分鐘內變成碎片。”穆克吉說。惹人注目的是,AnkX并不是哪位細胞生物學家或哪家制藥公司的手筆。它其實是由一種極小的、被稱為嗜肺軍團菌的胞內細菌制造出來的,嗜肺軍團菌這種病原體是一種叫作“軍團病”的嚴重肺部感染的幕后元兇。對于穆克吉來說,這篇論文是個啟示:它不僅確定迄今為止瞄準高爾基體機理的最快方法,還提出科學家可以利用胞內細菌“作為鏡頭,弄懂細胞內的基本進程”。
穆克吉被這個強大的小小微生物激起興趣,應征羅伊實驗室的一個博士后崗位,在那兒詳細研究軍團菌如何從內部攻擊人類細胞。她獲知,研究者已經識別出超過300種軍團菌肽,那些肽模仿宿主蛋白質,或者劫持既有的細胞通路,讓軍團菌有機可乘。她還新識別出其他許多類胞內細菌。這個多種多樣的群體中包括在醫學上重要的病原體,譬如沙門氏菌、李斯特菌和衣原體,以及結核病和麻風病的致病物。
這些微生物都至少享受了一部分生命時光,抵擋住白細胞、抗體和其他免疫防御(以上是身體對付那些活在宿主細胞之外的病原體的手段)的猛攻。作為交換,這些微生物得要想出一些法子來繞過細胞的內部免疫系統,在錯綜復雜、熙熙攘攘的細胞質環境中游弋,最終逃離那個環境,再感染其他細胞,并在過程中變成微小的操縱大師。
如今在加州大學舊金山分校領導著一家實驗室的穆克吉說,關于胞內細菌如何控制宿主的研究不僅告訴科學家這些微生物是如何引起疾病的,也揭示哺乳動物生物學的秘密。她說,這些細菌具有定位細胞關鍵功能的竅門,還滿懷憐愛地補充,軍團菌在繼續幫助她探究真核細胞的運作方式:“它是一名出色的細胞生物學家。”
細菌劫持肌動蛋白細胞骨架,造出尾巴,繼續搭車
20世紀80年代后期,細菌學家丹尼爾?波特努瓦(Daniel Portnoy)拜訪賓夕法尼亞大學的肌動蛋白專家劉易斯?蒂爾尼(Lewis Tilney),討論一個新的研究構思。蒂爾尼后來向《細胞生物學雜志》轉述這段經歷時說:“波特努瓦闖進一場系里的野餐會,堅持讓我看一下他的李斯特菌。”
胞內細菌對宿主的依賴程度差別不小。所謂的兼性胞內細菌(譬如單核細胞增生性李斯特菌和嗜肺軍團菌)不需要在宿主細胞內部就能繁殖。相比之下,專性胞內細菌,譬如沙眼衣原體和麻風桿菌需要在宿主細胞內部才能繁殖,這個特征使得在實驗室里培養和研究這些細菌成為不小的挑戰。專性胞內病原體比起兼性胞內病原體常常會有著縮減的基因組,這個遺傳趨勢反映出它們更受限的生活形態
那時候,研究人員知道李斯特菌感染巨噬細胞之類細胞的方式是讓自己先被攝取進吞噬泡,再從吞噬泡中突圍,進入細胞質。(巨噬細胞是一種能動的人類免疫細胞,會吞噬病原體和細胞殘片。)研究人員也已經描述過李斯特菌迅速擴散到毗鄰細胞。但是,1988年加入賓夕法尼亞大學醫學院的波特努瓦發現,他能夠以化學方式抑制肌動蛋白的聚合,借此阻斷這種細胞之間的擴散。肌動蛋白是一種細胞用來建造胞內骨架,幫助細胞運動、分裂和其他重要進程的蛋白質。蒂爾尼對此深深入迷,接下這個課題,兩人的研究顯示出,李斯特菌從吞噬泡中突圍后,以某種方式設法用肌動蛋白微絲,建構出自身的尾狀結構。
結果產生的李斯特菌“彗星”——這是這對研究搭檔對它的叫法——利用新獲得的肌動蛋白能動性,颼颼地繞過細胞質,最終讓自己撲向細胞膜,產生一個延伸進入毗鄰巨噬細胞內的突出。這個突出被接收方細胞吞沒,形成一個吞噬泡,李斯特菌接下來只需強行逃出新的區室來完成傳染。波特努瓦和蒂爾尼在1989年的一篇論文中形容了整個過程,評論說他們的發現“應該對于那些關注寄生物造成感染的細胞機理各階段的人士很重要……對于想要知道細胞內的肌動蛋白微絲如何變得井然有序的細胞生物學家來說,很激動人心”。
從那時開始,許多其他科學家加入了李斯特菌肌動蛋白征用的研究。20世紀90年代時,微生物學家帕斯卡萊 ?科薩爾(Pascale Cossart)在巴斯德研究院研究李斯特菌的毒性,很快就識別出一種叫ActA的細菌蛋白質,李斯特菌需要有這種蛋白質才能造出尾巴。接下來,當時在加州大學舊金山分校工作的細胞生物學家馬修?韋爾奇(Matthew Welch)與同事們分離出一種宿主細胞蛋白質復合體Arp2/3,李斯特菌要變得能動,Arp2/3也是必不可少的。團隊發現,李斯特菌的ActA招募Arp2/3復合體到細菌細胞表面,以此啟動肌動蛋白的聚合——證實了李斯特菌征用細胞自身裝置和原材料用于自身。這個研究工作暗示,真核生物可能擁有自身的Arp2/3激活蛋白質,而且果不其然,研究者從那時起描述了一整個家族的宿主肌動蛋白成核促進因子,李斯特菌的ActA正是成功地模仿這些因子。
不少其他胞內細菌類群——包括志賀氏菌屬、立克次體屬、分枝桿菌屬、伯克氏菌屬——都已經被觀察到構造自身的肌動蛋白“尾巴”,常常是通過劫持Arp2/3的方式。許多細菌采取類似李斯特菌的方法來感染新宿主(擠入毗鄰細胞中,被攝取進吞噬泡),但那并非唯一的方法。如今在加州大學伯克利分校任教的韋爾奇與研究生諾拉?科斯托(Nora Kostow)最近利用活細胞影像和其他技術研究了泰國伯克氏菌,這種細菌通過引起毗鄰細胞的融合而擴散。
韋爾奇說,“這種細菌本質上是擴大能讓它們成長的可獲取的環境,它們能不斷重復融合步驟,所以你在某些案例中能遇到數百個細胞融合在一起。”他和科斯托指出,由肌動蛋白賦能的泰國伯克氏菌實現這樣的擴散,靠的是推動細胞膜來生成突出——而不是在毗鄰細胞中生成吞噬泡——使得兩個細胞變成一個細胞。這個合并過程似乎依賴于細菌在形成突出時分泌的特定蛋白質。作者們在論文中寫道,這點洞察能幫助細胞生物學家理解更廣泛意義上的細胞融合。
對于這些細菌與肌動蛋白的交互作用差別的研究依然產生新的未解之謎。韋爾奇和博士后諾伯特?希爾(Norbert Hill)在研究海洋分枝桿菌(結核分枝桿菌的一個近親)時,于最近發現,微生物的蛋白質不僅能賦予肌動蛋白在細菌上的能動性,還有在另一類胞內目標脂滴上的能動性。目前還不清楚,這種脂滴的運動與分枝桿菌的存在如何發生關聯,但一種誘人的推測是,這種情況可能發生在感染時,要么是有利于細菌,要么是細胞對于感染的某種反應,韋爾奇說。好幾個方向的研究提出,分枝桿菌可能利用脂滴作為一種化學能量來源和其他作用,所以讓那些脂滴颼颼地運動,或許符合細菌的利益。
微生物為各種目的控制胞內膜
細胞質并非誰都能自由來去的。盡管李斯特菌之類的細菌能獲取肌動蛋白之類的“建筑材料”,它們也得要躲避細胞的免疫防御,從一個它們幾乎沒有控制權的化學環境中挺過來。有些細菌為了避開這些不便,轉而占據胞器之類的區室,將它們與細胞其余部分隔離。這些微生物能夠并且仍然與肌動蛋白互動——譬如,某些微生物分泌出蛋白質,引起細胞骨架的重排,幫助從外部占據細菌,或者形成類似公路的突出,伸進其他細胞。但是,許多微生物征服一類全然不同的目標,使得它們不用冒險進入細胞質,就能控制細胞其余部分——這里指的目標就是脂質膜。
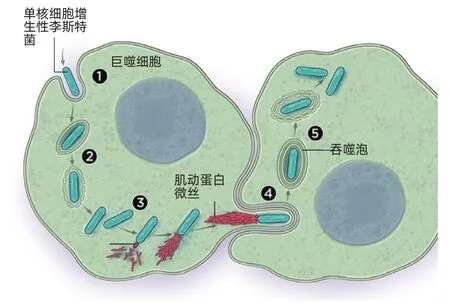
李斯特菌利用宿主來造出自己的肌動蛋白“尾巴”
一些胞內細菌利用宿主細胞的肌動蛋白供給來建造自身的運動系統。食源性致病菌單核細胞增生性李斯特菌感染被稱為巨噬細胞的免疫細胞,方式是先被攝取進一個吞噬泡①。然后進入細胞質,在那兒生存和復制②。它在細胞質中使用一種ActA蛋白質招募宿主細胞的肌動蛋白聚合裝置來在它身后造出一條肌動蛋白微絲尾巴③。這一步給予細菌一種推進自身運動的方式,讓它能推動宿主細胞膜,形成伸進毗鄰細胞的突出④。那些毗鄰細胞把這些突出當作吞噬泡攝取,李斯特菌從吞噬泡中逃脫,進入細胞質,重新開始這個周期⑤
穆克吉在耶魯大學做博士后時,讓她全神貫注的就是軍團菌占據、甚至模擬胞內膜的能力。事實證明,引起高爾基體分解的微生物蛋白質AnkX是一個更大的陰謀的一部分,該陰謀是強迫宿主準備一個對細菌友好的區室。軍團菌使用包括AnkX在內的肽,瞄準被稱為Rab GTPase的宿主酶。Rab GTPase位于內質網和高爾基體之類胞器的表面,調節蛋白質貨物在細胞內的運輸。
穆克吉和羅伊等人具體地表明,通過對細胞的一個Rab蛋白質進行一種不常見的“磷酸膽堿化”修飾,軍團菌能夠引起宿主運輸通道的大規模迅速坍塌。此外,軍團菌通過另一個機制,招募同一種Rab蛋白質到它所在胞內區室的表面,將它的藏匿之所改裝為酷似內質網的東西。包括羅伊的實驗室在內的多家實驗室已經展現了這套膜轉化如何成為相關生化進程的一部分。在其他微生物中,也已經描述過類似的膜復制或膜劫持進程。比如,性傳播的病原體沙眼衣原體就密謀改組它所在胞內區室周圍的高爾基體膜,同時變更胞器泡的路線,讓它們奔向自己,以此作為脂質來源。
其他胞內細菌已經找到不同辦法來干預細胞膜。單細胞寄生物弓形蟲——美國疾病控制與預防中心估計,目前單單在美國就有超過4 000萬人感染了弓形蟲——幸存在一個胞內泡中,再從那兒部署蛋白質,破壞宿主細胞的功能。“研究人員在數十年前觀察到,弓形蟲所在的泡,像多種細菌區室一樣,常常變得被線粒體包圍——這個現象現在被認為與細胞抗病原體反應有關。”由寄生物學家轉行為細胞生物學家的萊娜?佩爾納斯(Lena Pernas)說道,她工作于德國科隆的馬克斯?普朗克衰老生物學研究所。
佩爾納斯的團隊最近發現,弓形蟲能夠通過釋放一種蛋白質,使得線粒體蛻下它們兩層膜中的外層膜,破壞和利用這種線粒體圍攻。“我們不確定那具體是怎么發生的……這是實驗室進行中的研究主題。”佩爾納斯說。但她的團隊的實驗確實暗示了,蛻膜行為是線粒體對于外層膜壓力的自然反應,甚至可能在未被感染的細胞中發生,而弓形蟲劫持了這個進程——或許是通過模擬一個通常會觸發反應的宿主蛋白質。其他病原體有沒有利用這條路徑或相關路徑?這依然有待研究,然而一些研究人員已經注意到,至少有一個佩爾納斯的研究中提到的線粒體蛋白質似乎也是嚴重急性呼吸系統綜合征冠狀病毒2型(SARS-CoV-2)之類病毒瞄準的目標。
穆克吉說,發現新類型的膜操縱方法不會讓人驚訝,這個行為提供一種多用途的方法,能對從細胞分裂到胞器的胞內位置的一切、甚至是病原體本身施加影響力。“那就是為何許多細菌瞄準細胞內的各種膜的原因。”
細菌重編程宿主細胞,讓它們聽命行事
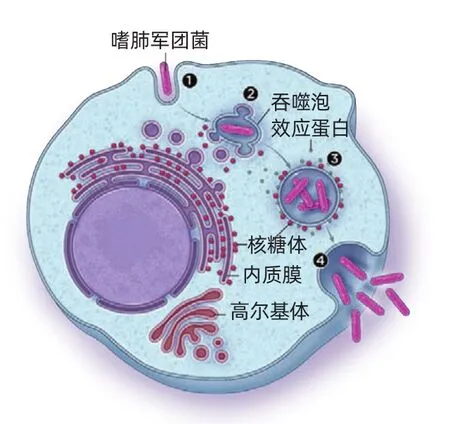
軍團菌控制宿主的膜
一些胞內細菌(譬如嗜肺軍團菌)棲息在宿主細胞內的膜結合區室內①。一旦進入區室,微生物通常會與宿主膜互動,分泌出所謂的效應蛋白,效應蛋白幫助微生物控制宿主膜②。軍團菌特別地與高爾基體和內質膜互動,盜取一些胞器的蛋白質,變更胞器泡的運輸路線。之后,新形成的膜變得散布核糖體③。核糖體也許有助于細菌制造某些宿主蛋白質——或者可能僅僅是膜的類似內質膜身份的副產物。軍團菌先在這個區室內復制,然后突圍離開細胞④
胞內細菌和其他寄生物攜帶自身的制造蛋白質裝置,所以在某些時候,它們關閉或暫停宿主的大部分蛋白質制造活動,也許是合乎情理的。“宿主極可能會制造出對細菌有害的蛋白質。”穆克吉解釋說,她最近的實驗顯示,軍團菌通過瞄準宿主的一個參與蛋白質折疊的肽,能夠阻止蛋白質合成。另一方面,胞內細菌不想在它準備繼續前進之前消滅宿主,也不想錯失一個讓宿主執行那些對細菌有利的高耗能任務的機會。
面對這些權衡時,一些細菌開始一番精心設計安排的努力,在感染的不同時刻操縱細胞能做什么,不能做什么。譬如說,穆克吉和同事最近識別出一種軍團菌分泌的模擬轉運核糖核酸(tRNA)的毒素,能拖延宿主核糖體沿著核糖核酸(RNA)的移動,進而引起碰撞。“假如你拖慢領頭的核糖體,它后面的核糖體繼續前進,撞到它……就像高速公路上的連環車禍。”研究人員發現,這引起細胞內的一連串事件,包括基因表達的大規模變更,允許僅僅少量關鍵轉錄本繞過交通堵塞,被翻譯為蛋白質。這個反應導致被控制的細胞死亡,而這對于軍團菌而言是好消息:宿主門戶大開,釋放出細菌,細菌能繼續去感染其他細胞。穆克吉說,這又是一個微生物教授生物學家細胞運作方式的案例,她在bioRxiv上發表的預印本文章中描述了這一研究,多虧了軍團菌瞄準那條路徑的能力,她的團隊才能發現對于核糖體碰撞的遺傳反應。
一些胞內細菌似乎采取了一種不同的方法:它們沒有慫恿細胞自我毀滅,而是引起宿主細胞類型的改變。愛丁堡大學的阿努拉?蘭布卡納(Anura Rambukkana)通過麻風桿菌研究了重編程。麻風桿菌感染施萬細胞——一種包圍神經元的神經膠質細胞,幫助生長和修復周圍神經。感染通常引發廣泛的神經損傷,并最終導致遭受感染的肢體感受不到疼痛或觸摸。但在2013年,蘭布卡納與同事報告了一系列體外實驗和小鼠實驗的結果,提出麻風桿菌首先劫持宿主的基因表達,似乎是對施萬細胞進行了重編程,讓它回到類似干細胞的狀態。

麻風桿菌使它的宿主還原到類似干細胞的狀態
麻風桿菌將細胞重編程發揮到極致,讓作為宿主的施萬細胞還原到類似干細胞的狀態①。這些細胞隨后能重新分化為肌肉細胞,可能將麻風桿菌擴散到其他組織②。重編程后的細胞也可以將感染傳給巨噬細胞,巨噬細胞然后形成被稱為肉芽腫的結構,再繼續親自傳播感染③
這種在基因表達上所做的手腳似乎在至少兩方面幫助了麻風桿菌的擴散。首先,被變更的細胞能繼續分化為其他細胞類型,其中包括肌肉細胞,于是就有可能將麻風桿菌播種到其他組織中。其次,重編程之后的細胞引來巨噬細胞,巨噬細胞能攝取感染,將它散播到其他組織。蘭布卡納的團隊目前在努力進一步弄懂這種細胞重建(rewiring)的底層機制,探索這個現象的潛在治療應用。譬如說,研究細菌用來重編程細胞狀態的因子可能為再生醫學提供新技術。團隊目前在九帶犰狳上檢驗一些原理,九帶犰狳對于人類生物學而言不是理想模型,但它是除了人類以外,麻風桿菌的幾個天然宿主之一。
科薩爾眼下是歐洲分子生物學實驗室位于德國海德堡的總部的一名訪問科學家,她稱施萬細胞重編程上的研究工作是個“非常有趣”的研究方向,指出這幾種發現凸顯出胞內病原體在企圖破壞細胞方面是如何各顯神通的。她指出:“不同類型的病原體有不同類型的結果,除了研究物種差別,研究者如果想要弄清感染的生物學后果,應該鉆研細菌的不同品系之間在不同條件下的差異。”譬如說,直到相對近期,科學家才開始考慮胞內細菌與它們感染的有機體的微生物體之間直接或間接的相互作用,科薩爾說這個研究領域值得獲取更多關注。
然而,在許多情況下,使用胞內細菌做研究的更廣泛影響也許很難預先估測,穆克吉說。她注意到CRISPR之類的工具產生自基礎研究,是基于一個細菌用來保衛自身免受病毒感染的系統。她說:“我們是基礎科學家,我們想要研究基本的進程。這項工作能在未來產生影響。”
資料來源 The Scientist

