淺析《中國藥典》(2020版)中阿奇霉素顆粒標準的變化
崔玉玲,張紅梅
濟南市食品藥品檢驗檢測中心, 濟南 250014
阿奇霉素是大環內酯類抗菌藥物,可通過抑制細菌的蛋白質合成而達到抗菌作用,其抗菌譜較廣,對革蘭陽性菌、革蘭陰性菌、支原體等都有抗菌活性,適用于敏感菌引起的急性支氣管炎、急性細菌性肺炎、支原體肺炎、急性扁桃體炎等[1-2]。阿奇霉素的顆粒制劑因便于分劑量、易服用的優點而廣泛用于兒童。《中國藥典》(2005版)開始收錄阿奇霉素顆粒,經過15年的發展,到《中國藥典》(2020版),阿奇霉素顆粒的標準制定得更加規范合理,更加科學嚴謹,充分保證了其臨床使用的安全性和有效性。
本文以實驗為基礎,結合《中國藥典》(2020版)與《中國藥典》(2015版)中有關物質項因標準不同出現的結果判定變化,并對新增項目溶出度進行測定,比較不同版本《中國藥典》中阿奇霉素顆粒的標準變化。
1 阿奇霉素顆粒標準在歷版《中國藥典》中的演變[3 -6 ]
阿奇霉素顆粒標準檢驗項目主要有性狀、鑒別、檢查及含量測定。其中,反映藥品安全性的檢查項目包括堿度、水分及顆粒劑項下的粒度、裝量差異等,具體變化見表1。

表1 阿奇霉素顆粒在不同版本《中國藥典》中的方法和判定標準比較a
2 阿奇霉素顆粒有關物質在不同標準下的結果判定差異[5 -6 ]
2.1 儀器與試劑
LC-20A高效液相色譜儀(日本島津公司);MS105DU型電子天平(瑞士Mettler Toledo公司);PB-10酸度計(德國賽多利斯公司)。
阿奇霉素對照品(批號:130593-202004,純度94.3%)、阿奇霉素系統適用性對照品(批號:130609-202008,系統適用性試驗用)、阿奇霉素雜質A(批號:130651-202003,鑒別/檢查用)、阿奇霉素雜質S(批號:130655-202004,鑒別/檢查用)均購自中國食品藥品檢定研究院;乙腈(色譜純)、甲醇(色譜純)、磷酸氫二鉀(分析純)、磷酸二氫銨(分析純)、磷酸(分析純)等均購自國藥集團化學試劑有限公司;純化水(山東普利思飲用水股份有限公司)。
5批阿奇霉素顆粒樣品分別來自A、B、C、D、E共5家生產企業,批號分別為8D0251F04、1912022、19061301、190604、200102,依次編號為 S1、S2、S3、S4、S5。
2.2 實驗方法
2.2.1 色譜條件
按照《中國藥典》(2015版、2020版)有關物質測定方法,采用CAPCELL PAK C18MGⅡ色譜柱(4.6mm×250mm,5μm);以磷酸鹽緩沖液(取0.05mol/L磷酸氫二鉀溶液,用20%磷酸溶液調節pH至8.2)-乙腈(45∶55)為流動相A,以甲醇為流動相B;線性梯度洗脫(0~35min,75%→95%A;35~64min,95%→95%A;64~65min,95%→75%A;65~71min,75%→75%A);柱溫為30℃;流速為1.0ml/min,檢測波長為210nm;進樣體積為50 μ l。
2.2.2 溶液的制備
稀釋液:稱取磷酸二氫銨1.73g,加水溶解并稀釋至1000ml,用氨試液調節pH至(10.0±0.05),得到磷酸二氫銨溶液。按磷酸二氫銨溶液-甲醇-乙腈(7∶7∶6)為比例配制稀釋液。
供試品溶液:取阿奇霉素顆粒適量,加稀釋液溶解并定量稀釋制成每1ml中約含阿奇霉素10mg的溶液,用0.45μm的微孔濾膜濾過,取續濾液。
對照溶液:精密量取供試品溶液1ml,置200ml量瓶中,用稀釋液稀釋至刻度,搖勻。
雜質S對照品與雜質A對照品溶液:取雜質S對照品與雜質A對照品各適量,加稀釋液溶解并稀釋制成每1ml中各約含0.05mg的溶液。
系統適用性溶液:取阿奇霉素系統適用性對照品適量,加雜質S對照品與雜質A對照品溶液溶解并稀釋制成每1ml中約含10mg的溶液。
靈敏度溶液:精密量取對照溶液10ml,置50ml量瓶中,用稀釋液稀釋至刻度,搖勻。
2.2.3 限度規定
《中國藥典》(2015版)規定限度為:雜質B峰面積不得大于對照溶液主峰面積的4倍(2.0%);雜質H與雜質Q按校正后的峰面積計算(分別乘以校正因子0.1、0.4)不得大于對照溶液主峰面積的2倍(1.0%);其他單個雜質峰面積不得大于對照溶液主峰面積的2倍(1.0%);各雜質峰面積之和按校正后的峰面積計算不得大于對照溶液主峰面積的8倍(4.0%)。
《中國藥典》(2020版)規定限度為:雜質B峰面積不得大于對照溶液主峰面積的4倍(2.0%);雜質R、雜質Q、雜質J、雜質I、雜質S、雜質A和雜質H按校正后的峰面積計算(分別乘以校正因子0.5、0.4、0.7、1.6、0.4、1.4、0.1)均不得大于對照溶液主峰面積的2倍(1.0%);其他單個雜質峰面積不得大于對照溶液主峰面積的2倍(1.0%);各雜質峰面積的和按校正后的峰面積計算不得大于對照溶液主峰面積的8倍(4.0%);小于靈敏度溶液主峰面積的峰忽略不計。
2.3 結果
對5批樣品同時進行有關物質項檢查,通過《中國藥典》(2015版、2020版)不同的判定標準,結果變化見表2。

表2 應用不同版本《中國藥典》標準比較5批阿奇霉素顆粒有關物質的結果 %
3 溶出度測定[6]
3.1 儀器與試劑
UDT-812溶出度試驗儀(美國LOGAN公司);ZKT-18F真空脫氣儀(天大天發科技有限公司);高效液相色譜儀、酸度計、電子天平同“2.1”項下。
磷酸氫二鈉(分析純)、鹽酸(分析純)均購自國藥集團化學試劑有限公司;其他同“2.1”項下。
樣品同“2.1”項下。
3.2 實驗方法
按照《中國藥典》(2020版)溶出度與釋放度測定法(通則0931 第二法)測定5批阿奇霉素顆粒的溶出度。以磷酸鹽緩沖液(pH6.0)500ml為溶出介質,轉速為50r/min,分別于15、30、45、60min取樣進行測定,其中30min時取樣用以計算溶出度。每批樣品取6袋進行測定。測定方法除進樣體積為100μl外,其余條件同“2.2.1”項下。
3.3 結果
3.3.1 溶出度
5批阿奇霉素顆粒的溶出度結果見表3。
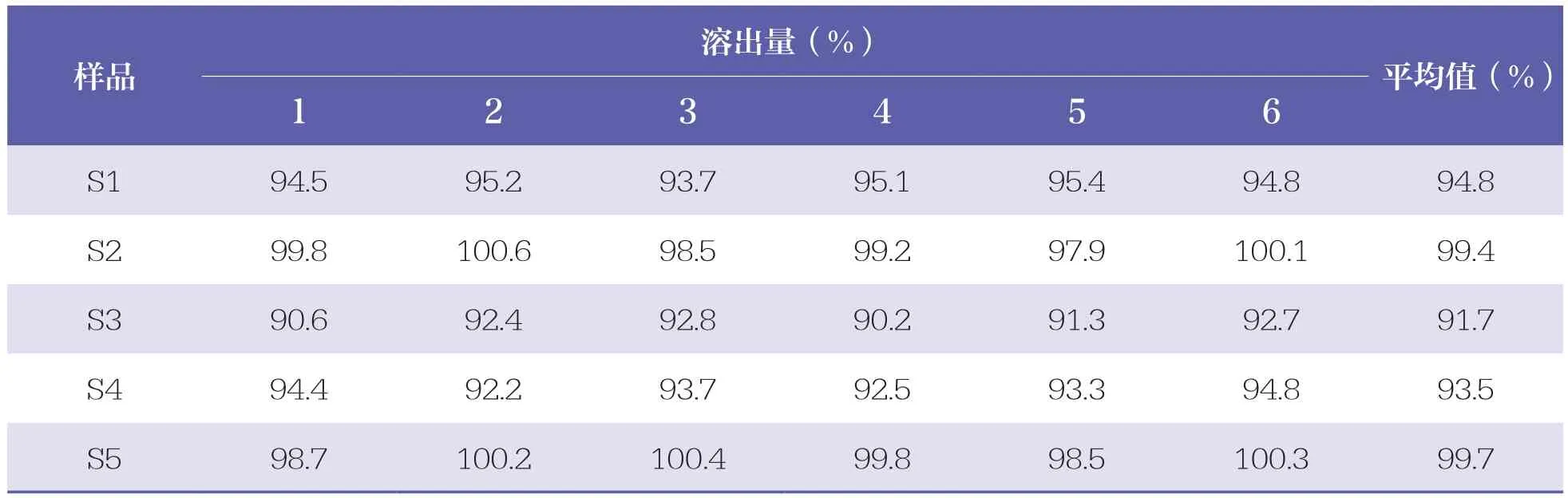
表3 5批阿奇霉素顆粒的溶出度結果
3.3.2 溶出曲線
5批阿奇霉素顆粒的溶出曲線見圖1。
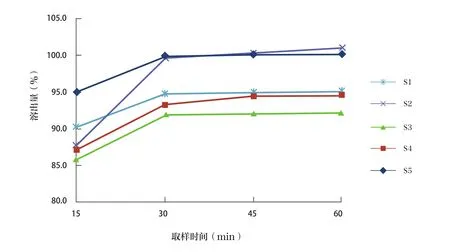
圖1 5批阿奇霉素顆粒的溶出曲線
4 討論
經過多年的發展、改進和提升,《中國藥典》中阿奇霉素顆粒的鑒別項在單一的薄層色譜法基礎上增加了HPLC,且薄層色譜法的點樣濃度由30mg/ml降至5mg/ml、點樣量由10μl降至2μl,提示方法靈敏度有了較大幅度的提升;有關物質項由薄層色譜法改為HPLC,色譜條件由等度洗脫改為梯度洗脫,系統適用性增加分離度、信噪比的要求以及判定標準中增加各雜質限量要求,不僅提高了方法靈敏度、系統適用性要求,還更加嚴格控制了各雜質的限量,進一步保證了藥品的安全性;溶出度是控制藥品質量、評價藥物生物利用度和療效的重要指標,阿奇霉素為水難溶性藥物,口服吸收性較差,生物利用度不高,而溶出是限速步驟,應對溶出度進行考察[7-11],《中國藥典》(2020 版)增加了溶出度測定項,進一步合理完善了阿奇霉素顆粒的標準;含量測定方法由抗生素微生物檢定法改為HPLC,提高了方法的靈敏度和準確度,減少人為操作影響,提高檢驗效率和結果的可靠性,進一步保證了藥品的有效性。
本研究中,因為標準的不同,同一批樣品測得的數據結果判定會有差異,但由于雜質的量都很小,影響不是很明顯。按《中國藥典》(2015版)中阿奇霉素顆粒標準判定,對于雜質R、雜質J和雜質S只能按其他雜質(限度1.0%)計算。如果雜質含量處于限度邊緣,樣品結果判定可能為不合格;但當按《中國藥典》(2020版)中阿奇霉素顆粒標準判定,分別乘以相應的校正因子,雜質含量可能低于相應限度,這樣計算出來的雜質含量更準確,樣品結果判定更為合理。因為阿奇霉素顆粒有關物質測定采用的是主成份自身對照法,各雜質與主成份(阿奇霉素)在HPLC上的響應因子不同,所以各雜質以相應的校正因子進行計算更為合適。《中國藥典》(2020版)對阿奇霉素顆粒有關物質項的判定更加細化、更加嚴格,也同阿奇霉素原料標準保持一致,而《中國藥典》(2015版)中阿奇霉素顆粒有關物質項的判定與阿奇霉素原料藥標準判定要求不一致,表現為比阿奇霉素原料藥要求更寬松。
阿奇霉素在水中幾乎不溶,作為口服藥物應該測定其溶出度。本研究中,不同廠家的樣品溶出度結果雖然不同,但都達到了標準中的限度要求,即標示量的75%,表明樣品均符合規定;各樣品溶出量基本在30min左右達到峰值,表明《中國藥典》(2020版)標準設置的取樣時間合理。
綜上所述,歷版《中國藥典》對于阿奇霉素顆粒的標準在不斷修訂和完善,且《中國藥典》(2020版)的檢驗項目設置更合理,判定標準更加嚴謹,整體標準日趨完善,進一步確保了藥品的安全性和有效性。

