實時熒光RNA恒溫檢測在氣管支氣管結核療效監測中的應用價值
徐銀娟 趙國連 崔曉利 黨麗云 康磊 周永
近年來,隨著內鏡技術的日益進步與不斷推廣,氣管支氣管結核有增多趨勢,并與10%~40%的活動性肺結核患者有合并感染[1]。但由于氣管支氣管結核抗結核治療時間長、藥物不良反應重[2]、缺乏靈敏且有效的療效監測方法,難以實時掌握結核病患者病情和療效變化,不利于及時調整治療方案和降低傳播風險,使得相當一部分患者的服藥依從性較差,導致治療失敗或產生耐藥。
隨著支氣管內鏡治療被廣泛應用于氣管支氣管結核,支氣管肺泡灌洗液標本的結核分枝桿菌檢測也得以被廣泛使用。這其中有多種分子診斷方法被用于結核分枝桿菌的直接檢測,為結核病的診斷,特別是菌陰肺結核,提供了極大幫助。比如實時熒光聚合酶鏈反應(qRT-PCR)、實時熒光RNA恒溫檢測技術(SAT-TB),以及GeneXpert MTB/RIF,但這些方法在療效監測方面的作用還有待探索。臨床中,結核分枝桿菌DNA檢測(如qRT-PCR)不能區分死菌和活菌,而結核分枝桿菌RNA檢測(如SAT-TB)則可有效區分[3],表現出較高的診斷價值[4-5],但對兩種方法應用于支氣管肺泡灌洗液標本檢測的對比研究并不多,故筆者通過分析SAT-TB和qRT-PCR對氣管支氣管結核支氣管肺泡灌洗液標本中結核分枝桿菌的檢出能力,為SAT-TB用于監測抗結核藥物治療氣管支氣管結核效果提供依據。
資料和方法
一、研究對象
采用回顧性研究方法,選取西安市胸科醫院2021年1—12月確診[2]且符合入組標準的168例初治氣管支氣管結核患者。所有患者均為病原學檢測陽性,完成治療,且有MGIT 960培養、SAT-TB和qRT-PCR檢查結果;均為排除合并糖尿病、腫瘤、其他免疫系統疾病者及相關檢查不全者。168例患者中,男性66例(39.29%),女性102例(60.71%);年齡中位數(四分位數)為32.5(26.2,53.8)歲。
二、 研究方法
所有患者均于入院1周內及開始抗結核藥物治療前(基線期)進行首次支氣管鏡檢查并送檢MGIT 960培養、SAT-TB和qRT-PCR檢查,此后至少每4周進行1次支氣管鏡檢查及送檢以上3種方法檢測。
1.標本收集及前處理:所有患者均經纖維支氣管鏡檢查收集支氣管肺泡灌洗液10~15 ml,再將標本混勻后分為3份,分別送檢MGIT 960培養、SAT-TB和qRT-PCR檢查。所有操作均按照《結核病實驗室檢驗規程》[6]進行。因本研究有94例患者每2周做1次支氣管鏡,74例患者每4周做1次支氣管鏡,故本研究選擇每2周做1次支氣管鏡的94例患者進行3種檢測方法陽性率和檢測效能評價的分析,選擇全部患者進行陰轉時間評價的分析。
2.MGIT 960培養及菌種鑒定:取2 ml混勻的支氣管肺泡灌洗液標本按照1∶1體積加入4%NaOH溶液中處理15 min,3000×g離心20 min,棄上清后經0.1 mol/L磷酸鹽緩沖液洗滌后取0.5 ml上清至配置好的MGIT培養管中,置于BACTEC MGIT 960培養儀中,由儀器自動監測并報告結果(儀器培養時間最長為42 d報告結果)。若BACTEC MGIT 960系統報告陽性,則取出培養管進行涂片抗酸染色以確認是否為抗酸桿菌,若抗酸桿菌陽性則進行MPB64蛋白免疫膠體金法(杭州創新生物檢控技術有限公司)檢測以進一步鑒定菌種,MPB64蛋白陽性為結核分枝桿菌,陰性則為非結核分枝桿菌。若 BACTEC MGIT 960系統報告陰性,則視為分枝桿菌培養陰性。
3.SAT-TB:取1 ml支氣管肺泡灌洗液標本液化離心洗滌后,加50 μl RNA裂解緩沖液,超聲15 min(功率300 W),15 000×g離心5 min,上清即為擴增模板。采用結核分枝桿菌核酸檢測試劑盒(RNA 恒溫擴增;購自上海仁度生物科技股份公司),按照試劑盒說明書進行操作。擴增儀器為ABI 7500熒光定量PCR儀(美國應用生物系統公司)。儀器每分鐘捕獲1次熒光,實驗結果根據實時熒光信號的出現時間和強度判斷。儀器捕獲熒光產生的樣本曲線與閾值線(閾值線設置為超過正常陰性對照擴增曲線的最高點)交點橫坐標讀數即為dt值(探測時間,detection time,1dt=1 min)。dt值<40為陽性,dt值≥40為陰性。
4.qRT-PCR:取1 ml支氣管肺泡灌洗液標本液化離心洗滌后,向沉淀中加入50 μl核酸提取液并轉入帶磁珠的核酸提取管中,提取儀快速振蕩10 min,然后95 ℃水浴5 min,取2 μl提取好的核酸溶液加入18 μl PCR擴增試劑中進行擴增。擴增試劑為分枝桿菌核酸檢測試劑盒(PCR-熒光探針法;北京博奧晶典生物科技有限公司),擴增儀器為ABI 7500熒光定量PCR儀(美國應用生物系統公司)。按照說明書操作。
三、統計學處理
使用SPSS 18.0軟件進行數據的統計分析。計量資料以“中位數(四分位數)[M(Q1,Q3)]”描述,兩組間差異的比較采用Mann-WhitneyU檢驗;計數資料以“百分率(%)”描述,兩組間差異的比較采用χ2檢驗,以P<0.05為差異有統計學意義。一致性檢驗Kappa值介于0.00~0.20為極低一致性,0.21~0.40為一般一致性,0.41~0.60為中等一致性,0.61~0.80為高度一致性,0.81~1.00為幾乎完全一致。當一致性檢驗受結果分布影響較大時,采用符合率和受試者工作特征(ROC)曲線分析,計算曲線下面積(AUC),AUC越接近于1,說明診斷效果越好;AUC介于0.7~0.9表明診斷具有一定準確性,介于0.5~0.7為準確性較低,<0.5為無診斷價值。
結 果
一、三種方法在氣管支氣管結核患者治療期間檢測陽性率下降情況
對每2周做1次支氣管灌洗的94例患者標本進行MGIT 960培養、qRT-PCR和SAT-TB檢測結果的分析,發現三者從基線至治療12周的陽性率均呈下降趨勢,其中,qRT-PCR和SAT-TB從基線至12周陽性例數下降幅度分別為67.81%(59/87)和82.95%(73/88),均低于MGIT 960培養的98.78%(81/82),差異均有統計學意義(χ2值分別為28.472和12.469,P值均<0.001),即qRT-PCR和SAT-TB陽性率下降慢于MGIT 960培養法。另外,qRT-PCR和SAT-TB在基線期與MGIT 960培養陽性率的差異均無統計學意義(P值均>0.05),但治療2、4、6、8、10及12周時的陽性率均明顯高于MGIT 960培養,差異均有統計學意義(P值均<0.05)。具體見表1和圖1。

表1 以MGIT 960培養為參照標準qRT-PCR和SAT-TB檢測94例氣管支氣管結核患者標本的陽性情況
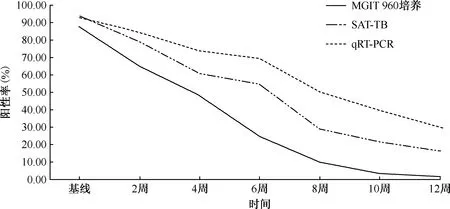
圖1 治療期間三種方法檢測陽性率下降情況
二、qRT-PCR和SAT-TB以MGIT 960培養結果為參照標準的檢測效能
以MGIT 960培養結果為參照標準,qRT-PCR對上述94例患者在不同檢測點(基線,治療2、4、6、8、10及12周)檢測的敏感度、特異度、陽性預測值、陰性預測值、Kappa值、符合率和ROC曲線下面積(AUC)均明顯低于SAT-TB,具體見表2。
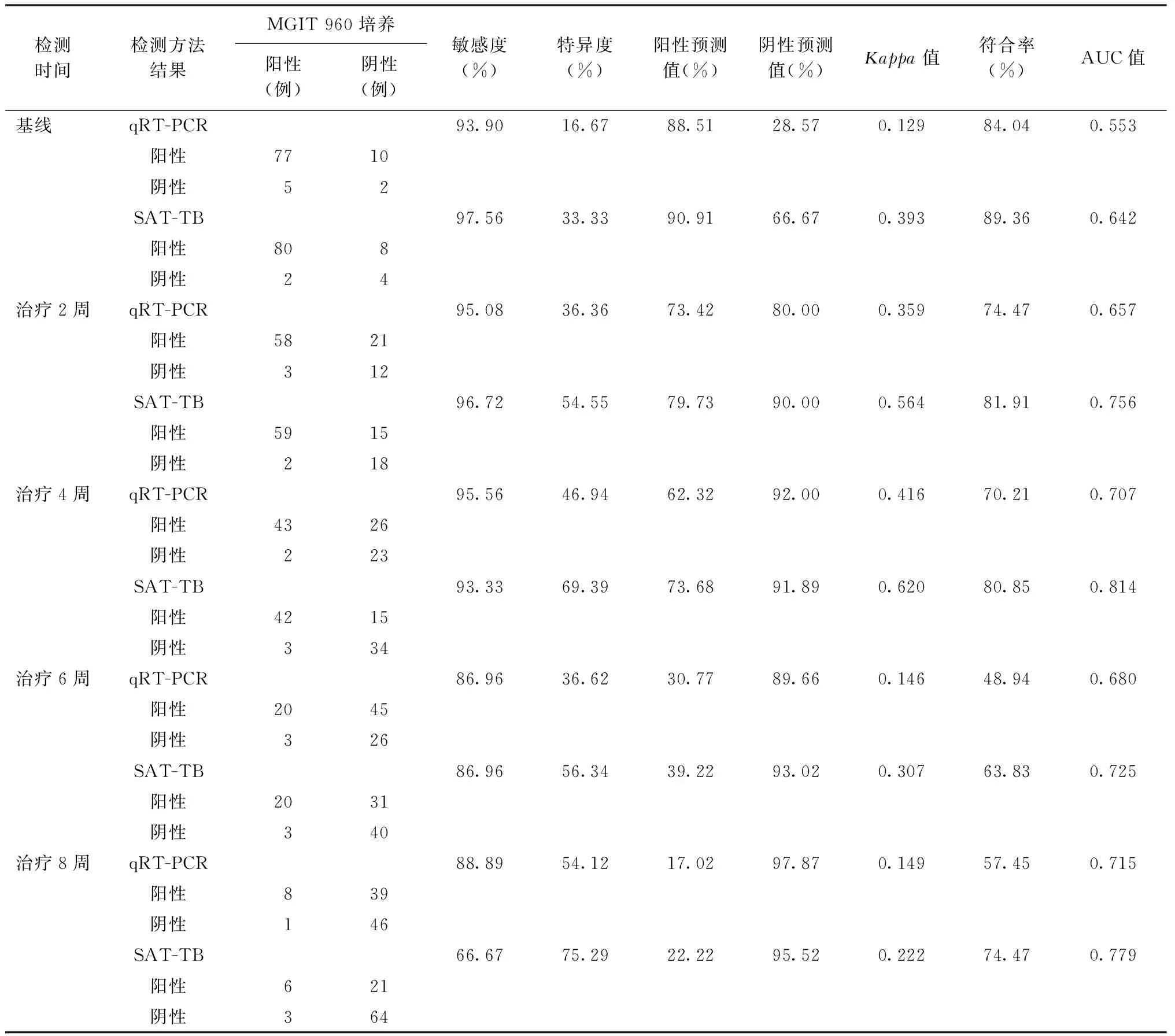
表2 qRT-PCR和SAT-TB以MGIT 960培養結果為參照標準對94例氣管支氣管結核患者的檢測效能
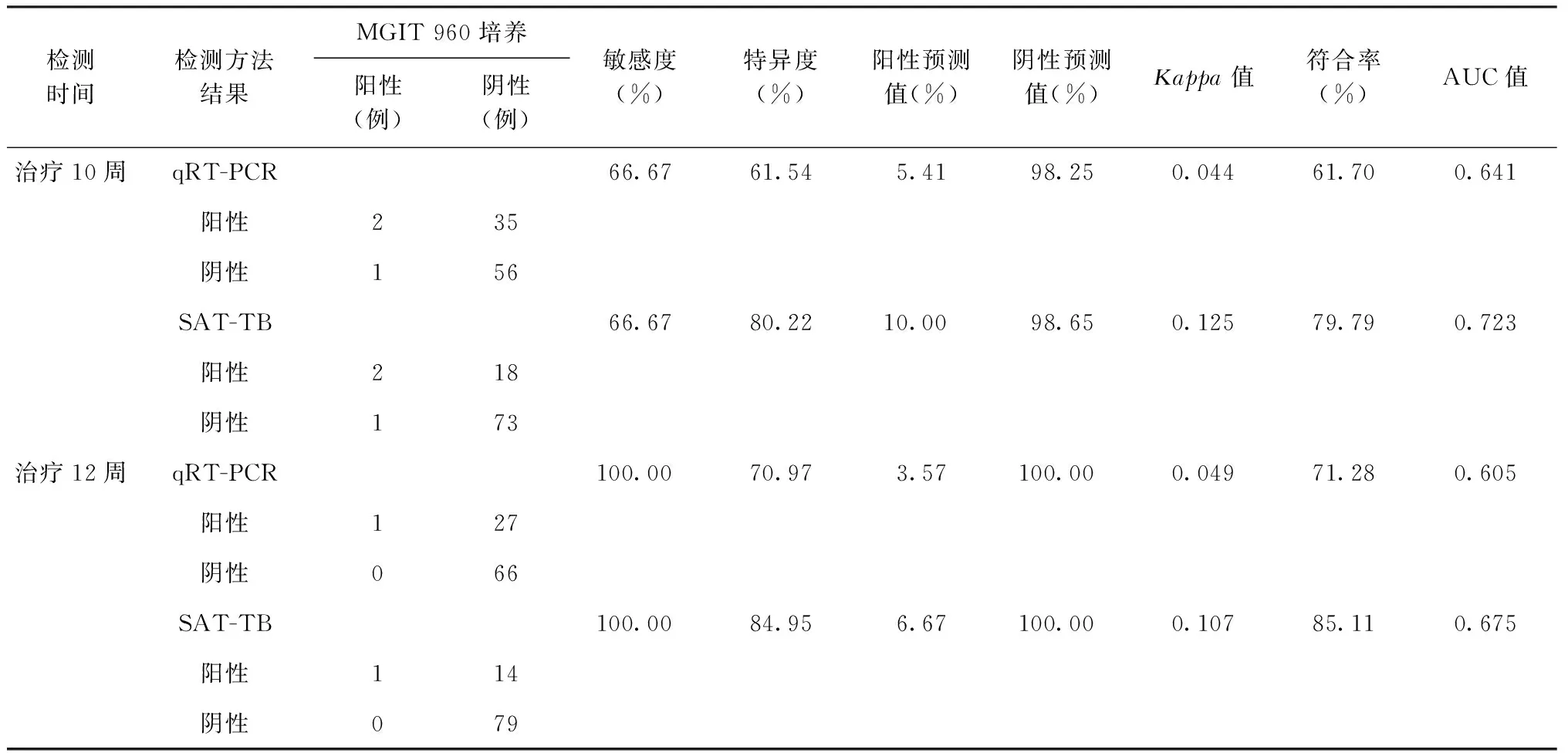
續表2
三、MGIT 960培養不同陰轉時間與SAT-TB檢測肺泡灌洗液標本dt值的關系
根據MGIT 960培養陰轉時間將168例氣管支氣管結核患者分為3組,即1~4周組(74例)、5~8周組(68例)和9周及以上組(26例)。分析不同MGIT 960陰轉時間組首次肺泡灌洗液標本SAT-TB檢測dt值的差異。結果顯示,1~4周組的dt值[7.264(4.891,10.990)]與5~8周組[5.113(3.520,6.390)]和9周及以上組[5.222(4.068,6.886)]的差異均有統計學意義(Z=-4.318,P<0.001;Z=-2.017,P=0.044),但5~8周組與9周及以上組的dt值差異無統計學意義(Z=-1.219,P=0.223)。
討 論
SAT-TB是建立在實時熒光檢測技術和RNA恒溫技術基礎上的新一代核酸檢測技術,其原理是以結核分枝桿菌特異的16S rRNA為檢測靶標,在M-MLV反轉錄酶和T7RNA多聚酶的共同作用下實現核酸恒溫擴增RNA,熒光標記的探針與靶標片段的擴增產物雜交后釋放出熒光信號,并用儀器進行實時熒光檢測,從而判斷樣本中是否存在結核分枝桿菌。SAT-TB技術30 min左右可將模板擴增109倍[7],大大減少了檢測時間,具有反應速度快和擴增效率高的特點。又因RNA在結核分枝桿菌死亡后會很快降解,故其僅存在于活菌中,因此,以RNA作為檢測靶標不僅可以區分結核分枝桿菌與非結核分枝桿菌,還可以監測抗結核治療效果[8]。
有研究發現,女性是肺結核患者合并支氣管結核的危險因素[9]。本組氣管支氣管結核患者多為中青年,且女性多于男性,約為2∶1,與以往報道基本接近[10-11],進一步提示應關注女性肺結核患者合并支氣管結核狀況。對94例2周進行1次支氣管鏡灌洗檢查的患者治療期間的MGIT 960培養、qRT-PCR 和SAT-TB檢測結果進行分析,發現qRT-PCR和SAT-TB在基線期的檢測陽性率(92.55%和93.62%)與MGIT 960培養(87.23%)的差異均無統計學意義,說明3種方法對于患者初診時的檢測能力相近。但3種方法在治療監測期間,從治療第2周至第12周的陽性檢出率均呈下降趨勢,且qRT-PCR和SAT-TB的下降幅度均明顯低于MGIT 960培養,即MGIT 960培養的陽性率下降最快,qRT-PCR下降最慢。筆者分析原因可能為:首先,MGIT 960培養檢測的敏感度通常低于分子生物學方法[12],且隨著治療過程中排菌量的減少及細菌活性降低,部分患者會出現培養陰性早于分子生物學檢測的情況,這可能是在治療過程中有很多患者已沒有活菌排出,但其排出的死菌或者殘留的結核分枝桿菌DNA片段卻可以造成qRT-PCR檢測“陽性”。其次,SAT-TB是以RNA作為檢測的靶標,假陽性的檢測概率較低,較qRT-PCR能更迅速地反映當前治療效果,可作為療效監測的重要檢測方法。但本研究顯示SAT-TB檢測陽性率較MGIT 960培養仍有一定滯后性,這一結果與胡永領等[13]研究結果有所差異,該研究在長達6個月的動態觀察中發現SAT-TB與MGIT 960培養陽性率始終不相上下,這可能是由于試劑、實驗室操作及研究人群差異導致。
以MGIT 960培養結果為參照標準對qRT-PCR與SAT-TB進行檢測效能分析,發現在治療開始至12周各檢測點SAT-TB的檢測效能指標均高于qRT-PCR,與MGIT 960培養的一致性均高于qRT-PCR,但在不同檢測點的檢測一致性程度差異較大,Kappa值介于0.107~0.620之間,考慮到一致性檢驗受結果分布影響較大,故筆者又采用符合率和ROC曲線分析qRT-PCR和SAT-TB與MGIT 960培養的一致性程度。結果發現,從基線至治療第12周檢測,SAT-TB與MGIT 960培養的符合率(63.83%~89.36%)和AUC(0.642~0.814)也均明顯高于qRT-PCR(48.94%~84.04%;0.553~0.715),這與吳聯朋[14]的研究結果基本一致。說明SAT-TB與MGIT 960培養的一致程度更高,總體檢測效能更好,同時也意味著療效監測效果更好。
SAT-TB檢測產生的實時放大信號dt值可用于結核分枝桿菌的相對定量,有助于結核病治療的臨床管理。筆者探討了在不同MGIT 960培養陰轉時間首次SAT-TB檢測dt值的差異,結果顯示,1~4周內陰轉患者的dt值明顯高于4周以上陰轉患者的dt值,差異有統計學意義;而5~8周陰轉患者的dt值與9周及以上陰轉患者的dt值差異無統計學意義,這可能是抗結核治療后第1個月的菌載量下降得最快,而1個月后的下降趨于緩慢,且下降幅度基本平穩的原因。這一結果也被胡永領等[13]研究所證實,提示如果抗結核治療4周內細菌載量下降明顯,則可預示患者陰轉時間快,治療效果良好。
綜上所述,SAT-TB用于病原學陽性氣管支氣管結核患者的療效監測時,監測效果與MGIT 960培養的一致性高。但是相對于MGIT 960培養周期長的嚴重不足,SAT-TB更能滿足臨床快速診斷的要求。
利益沖突所有作者均聲明不存在利益沖突
作者貢獻徐銀娟和趙國連:設計實驗、實施具體研究、收集分析數據、撰寫文章及審閱修改;崔曉利和黨麗云:參與設計、完善實驗步驟、幫助實施研究、分析解釋部分數據;康磊和周永:指導部分研究、幫助采集分析數據

