血清miR-30a、miR-155水平與急性心肌梗死患者并發急性心力衰竭的相關性
蘇寧,劉海闊
(漯河醫學高等專科學校第二附屬醫院 急診科,河南 漯河 462000)
急性心力衰竭為急性心肌梗死(acute myocardial infarction,AMI)患者常見院內并發癥,可加重患者心臟負荷,嚴重可致患者心臟驟停,危及生命[1]。由于AMI早期并發急性心力衰竭無特異性臨床表現,臨床治療以開通梗死病灶為目標,易忽略對心力衰竭的救治,常導致患者預后不佳。早期探尋AMI患者并發急性心力衰竭的相關指標逐漸成為臨床關注的焦點。近年來,多項研究證據表明微小核糖核酸(microRNA,miRNA)可能參與了心力衰竭、冠心病等心臟疾病的發生、發展過程。作為miRNA家族成員之一,微小核糖核酸-30a(microRNA-30a,miR-30a)在炎癥反應和內皮細胞凋亡中發揮重要作用[2]。相關研究發現,miR-30a在心力衰竭患者血清中呈高表達[3]。微小RNA-155(microRNA-155,miR-155)為典型的多功能基因,在調節免疫、炎癥、心血管疾病的發生發展中發揮重要作用[4]。目前國內外關于血清miR-30a、miR-155水平與AMI患者并發急性心力衰竭的關系臨床研究較少,需做進一步探究。因此,本文通過對AMI患者并發急性心力衰竭的血清miR-30a、miR-155水平進行觀察,旨在分析二者與AMI患者并發急性心力衰竭的關系。
1 資料與方法
1.1 研究對象選取2019年8月至2021年7月漯河醫學高等專科學校第二附屬醫院收治的170例AMI患者作為本次研究對象,患者已簽署知情同意書。病例納入標準:(1)符合《內科學》(第9版)[5]中AMI診斷標準,并經冠狀動脈造影檢查明確診斷;(2)首次AMI發病,且AMI患者發病至入院時間不超過12 h;(3)認知功能正常,可配合完成研究。排除標準:(1)合并胃癌、肺癌等惡性腫瘤疾病;(2)伴有自身免疫性疾病;(3)伴有先天性心臟病;(4)既往有冠狀動脈手術史。170例AMI患者中男103例,女67例;年齡45~74(61.43±3.68)歲;體質量指數17.84~26.14(22.27±1.26)kg·m-2;AMI發病至入院時間0.5~6(3.82±0.64)h。
1.2 研究方法
1.2.1急性心力衰竭判定及分組方法 于AMI患者入院48 h內完善相關檢查,參照相關標準[6]進行判定。(1)臨床表現:突發嚴重呼吸困難,呼吸頻率常達30~50次·min-1,強迫坐位,持續性低血壓;(2)影像學檢查:胸部X線片顯示存在肺水腫、肺淤血;(3)生物學標志物檢測:50歲以下患者血漿N-末端腦鈉肽前體(N-terminal pro-brain natriuretic peptide,NT-proBNP)水平超過450 ng·L-1,50~75歲患者血漿NT-proBNP水平超過900 ng·L-1。滿足上述條件即可判定AMI患者并發急性心力衰竭,納入心衰組;其他患者即未并發急性心力衰竭,納入非心衰組。
1.2.2臨床資料收集 通過醫院的病歷資料系統將患者年齡、性別、體質量指數、AMI發病至入院時間、梗死區域、梗死面積、糖尿病合并情況、高血壓合并情況、肌酸激酶同工酶(creatine kinase isoenzymes-MB,CK-MB)水平、NT-proBNP水平、左室射血分數等數據錄入。
1.2.3血清miR-30a、miR-155檢測方法 采集所有入選病例入院當日5 mL空腹外周靜脈血,在室溫下靜置30 min,以4 500 r·min-1離心8 min,取上清液,置入環氧樹脂管。利用 EastepTM總RNA提取試劑盒[普洛麥格(北京)生物技術有限公司]提取血清總RNA,并嚴格參照逆轉錄試劑盒(美國Fermentas公司)說明書進行逆轉錄,合成cDNA。利用AGS9600型實時熒光定量PCR儀(杭州安杰思生物科技有限公司)進行檢測,反應條件設置為:95 ℃預變性5 s,60 ℃變性20 s,62 ℃退火1 s,40個循環,重復進行3次實驗。將U6作為內參基因,應用2-△△Ct法計算血清miR-30a、miR-155相對表達水平。
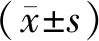
2 結果
2.1 AMI患者并發急性心力衰竭情況170例AMI患者中,發生急性心力衰竭42例,占比為24.71%,未發生急性心力衰竭128例,占比為75.29%。
2.2 心衰組與非心衰組臨床資料心衰組血清miR-30a、miR-155水平、梗死面積、CK-MB、NT-proBNP水平高于非心衰組,左室射血分數低于非心衰組,差異有統計學意義(P<0.05);組間年齡、性別、體質量指數、AMI發病至入院時間、梗死區域、合并糖尿病、合并高血壓比較,差異無統計學意義(P>0.05)。見表1。

表1 心衰組與非心衰組臨床資料比較
2.3 血清miR-30a、miR-155水平與AMI患者并發急性心力衰竭的關系將上述比較差異有統計學意義的指標作為自變量并賦值,以AMI患者并發急性心力衰竭情況作為因變量(心衰=1,非心衰=0)。logistic回歸分析結果顯示,血清miR-30a、miR-155、CK-MB以及NT-proBNP高表達、梗死面積大是AMI患者并發急性心力衰竭的危險因素(OR>1,P<0.05)。見表2。

表2 血清miR-30a、miR-155水平與AMI患者并發急性心力衰竭的關系
3 討論
急性心力衰竭的發生與AMI患者梗死范圍、梗死時間有關,是AMI患者預后不良的危險因素[7]。相關研究報道,AMI后并發急性心力衰竭的概率可達30%[8]。本研究170例AMI患者中,發生急性心力衰竭42例,占24.71%,與上述研究相近。可見,AMI后并發急性心力衰竭風險較高,因此需尋求AMI患者并發急性心力衰竭的預測指標,以指導臨床治療方案的調整,減少急性心力衰竭的發生,改善患者預后。
miRNA是長約22個核苷酸的內源非編碼RNA,廣泛存在于生物體中,可通過參與調節其下游基因翻譯過程而發揮其生物學功能,其水平的變化可介導心血管疾病、腫瘤等多種疾病的發生[9]。作為miRNA家族成員,miR-30a在心肌細胞中廣泛表達,能夠調控心肌細胞自噬,在心肌細胞氧化應激反應中發揮重要的促進作用[10]。研究指出,miR-30a可通過影響機體氧化應激、信號傳導過程,促進慢性心力衰竭的發生、發展[11]。miR-155可由活化的免疫、炎癥相關細胞產生,在免疫系統及免疫、炎癥性疾病中發揮重要調節作用,與心血管疾病的發生發展密切相關[12]。研究指出,miR-155可通過參與天然免疫應答反應和獲得性免疫應答反應,引起機體強烈的炎癥反應,增加炎癥因子的分泌,促進冠心病的發生與發展[13]。基于血清miR-30a、miR-155的作用機制,推測二者與AMI患者并發急性心力衰竭存在一定關聯。本研究結果顯示,心衰組血清miR-30a、miR-155水平高于非心衰組,說明血清miR-30a、miR-155水平與AMI患者并發急性心力衰竭有關。原因可能為:miR-30a在正常情況下,可對機體組織、細胞產生保護作用,而AMI發生后,心肌細胞缺血、缺氧,可引起miR-30a水平升高,不僅會加重心肌受損程度,還可與自噬相關基因結合,導致大量的血管緊張素Ⅱ分泌、釋放,引發心肌肥厚,促進急性心力衰竭的發生[14-15]。同時,miR-30a可通過激活信號轉導和轉錄激活因子3信號通路,促進缺氧誘導的心肌細胞凋亡,導致心肌細胞進行性喪失,增加急性心力衰竭的發生風險[16]。miR-155可通過募集巨噬細胞、淋巴細胞等炎癥細胞促進機體炎癥反應,加重AMI患者心肌缺血再灌注損傷,促進患者心肌細胞凋亡,增加急性心力衰竭的發生[17]。由此可見,血清miR-30a、miR-155高表達的AMI患者,極易并發急性心力衰竭,增加患者預后不良風險。
為進一步證明血清miR-30a、miR-155水平與AMI患者并發急性心力衰竭的關系,本研究經logistic回歸分析檢驗,結果顯示,血清miR-30a、miR-155高表達是AMI患者并發急性心力衰竭的危險因素。由此可證明,血清miR-30a、miR-155相對表達水平與AMI患者并發急性心力衰竭有關。因此,臨床醫護人員可考慮早期監測AMI患者血清miR-30a、miR-155相對表達水平,若患者入院時血清miR-30a、miR-155水平較高,可及時采取干預方案調控血清miR-30a、miR-155表達,以預防急性心力衰竭的發生。此外,本研究經logistic回歸分析還發現,CK-MB、NT-proBNP水平以及梗死面積與AMI患者并發急性心力衰竭有關。分析原因為:作為心肌損傷的標志物,CK-MB主要存在于心肌組織中,CK-MB升高提示患者存在心肌損害,造成心肌結構及功能變化,進而增加急性心力衰竭發生風險[18]。NT-proBNP為心臟功能指標,其水平升高提示患者心室容量、壓力負荷增加,是目前最有價值的心力衰竭診斷生物標志物。AMI患者心肌梗死面積大,提示心肌壞死的面積大,患者心臟功能受損較為嚴重,會增加急性心力衰竭的發生。
綜上所述,血清miR-30a、miR-155水平與AMI患者并發急性心力衰竭有關,因此對于血清miR-30a、miR-155水平高的AMI患者,臨床可盡早采取干預方案調控患者血清miR-30a、miR-155表達,以降低急性心力衰竭發生風險。本研究為單中心研究,未結合其他醫院AMI患者并發急性心力衰竭進行分析,研究結果可能存在一定的偏倚,后續仍需要多中心研究加以證實血清miR-30a、miR-155水平與AMI患者并發急性心力衰竭的關系,為臨床的防治工作提供參考依據。

