烏頭湯治療類風濕關節炎的研究進展*
巴鑫,陳哲,涂勝豪
(華中科技大學同濟醫學院附屬同濟醫院中西醫結合科,武漢 430030)
類風濕關節炎(rheumatoid arthritis,RA)是一種全身性慢性自身免疫性疾病,影響全球0.5%~1.0%的人口。RA主要表現為關節對稱性、持續性炎癥損害,若不及時治療會導致患者關節變形,關節活動度降低,軀體功能下降,甚至最終生活不能自理。目前,改善病情抗風濕藥物(disease modifying antirheumatic drugs,DMARDs)是RA的主要治療藥物。根據作用機制的不同,DMARDs可以分為三類:傳統合成DMARDs(如甲氨蝶呤、來氟米特)、生物DMARDs[如腫瘤壞死因子α(TNF-α)拮抗劑]和靶向DMARDs(如Janus激酶的抑制劑)。其中合成DMARDs不良反應較大,副作用較多,患者耐受性差;生物DMARDs雖不良反應少,但仍有三分之一治療效果不理想[1],且價格昂貴,患者難以負擔;此外,靶向DMARDs藥物非選擇性的JAK抑制劑(Xeljanz)Ⅳ期臨床研究失敗,未達到心血管事件、惡性腫瘤發生率非劣效終點,因而被美國食品藥品管理局(FDA)給予黑框警告[1]。總之,目前針對 RA的治療,存在部分患者效果不佳、或無法阻止疾病進展等情況。因此,尋找治療RA安全有效的中醫藥顯得十分有意義。
烏頭湯源自《金匱要略》“病歷節不可屈伸,疼痛,烏頭湯主之”,其主要組成為:麻黃、芍藥、黃芪三兩,炙甘草,川烏五枚(葉父咀,以蜜二升,煎取一升,即出烏頭)。烏頭湯為溫經散寒、除濕止痛之良劑,主治寒濕歷節之證,凡寒濕凝滯、經脈閉阻之痹證、諸痛、腳氣等病,皆可運用。現今烏頭湯主要用于治療風濕性疾病、坐骨神經痛、膝骨關節炎等疾病,特別是在治療RA上,開展一系列臨床研究和實驗研究,并取得一些進展。
1 烏頭湯治療RA的臨床研究
烏頭湯作為治療痹癥的經方,在臨床上被廣泛應于治療RA。一系列臨床試驗證明烏頭湯可以明顯改善病情,聯合西藥使用時可以減少西藥用量,從而減少副作用的發生。
臨床研究證實,單用烏頭湯治療RA 8周后,患者臨床癥狀得到明顯改善,尤其是緩解疼痛、腫脹等效果顯著;病情活動度也得到明顯改善,C-反應蛋白(CRP)水平、紅細胞沉降率(ESR)和DAS28評分都明顯降低;血清中炎癥因子,如白細胞介素(IL)-6、TNF-α的水平也明顯降低[3-4]。此外,在降低抗環瓜氨酸肽抗體(cycliccitrullinated peptide,CCP)、類風濕因子(RF)上,與對照組甲氨蝶呤比較烏頭湯組有一定優勢[3];在降低CRP水平上,比雷公藤效果更明顯[5]。更多的研究是將烏頭湯加味和DMARDs(如甲氨蝶呤、來氟米特、艾拉莫德)、非甾體抗炎藥(NSAIDs)等西藥聯合應用[6-9]。研究發現,烏頭湯聯合西藥治療寒濕痹阻型RA,在怕冷關節數、關節腫脹數、關節壓痛數、視覺模擬評分、晨僵等指標方面改善作用均優于單用常規西藥,并且在降低血沉、CRP、RF、IL-1β和 TNF-α等炎癥相關指標水平方面也均優于對照組。此外,烏頭湯配合西藥能顯著降低西藥的不良反應,特別是消化道反應[10-13]。總之,不論單用烏頭湯治療還是中西醫結合治療,烏頭湯都可以明顯改善RA患者臨床癥狀,控制病情活動,提高關節活動能力,降低致殘率,提高藥物使用安全性,使患者獲益。
2 烏頭湯治療RA的實驗研究
烏頭湯治療RA不僅在臨床研究方面被證實確有療效,在實驗機制研究方面也取得一些進展。目前,關于烏頭湯治療RA的機制研究主要集中在抗炎、鎮痛、免疫調節以及抑制血管生成等方面。
2.1烏頭湯的抗炎作用 烏頭湯抗炎作用主要體現在它能抑制炎癥細胞因子的產生,并且作用強度與其劑量、配伍和配比密切相關。研究發現烏頭湯能夠有效降低膠原誘導關節炎(collagen induced arthritis,CIA)大鼠血清中促炎細胞因子,如IL-6、IL-15、干擾素(IFN)和粒細胞-巨噬細胞集落刺激因子(GM-CFS)的含量,且與烏頭湯濃度呈負相關[14]。同樣,對于佐劑性關節炎(adjuvant induced arthritis,AIA)模型大鼠,烏頭湯不同配伍組均能不同程度下調血清中IL-1β、TNF-α水平。在配伍研究方面,全方組與其他各組比較較,差異有統計學意義,在調節IL-18、TNF-α水平上,全方組的效果最好[15]。烏頭湯也可通過影響趨化因子的表達來調節RA的炎癥網絡達到治療效果。MCP-1屬于趨化因子CC亞家族,能趨化單核/巨噬細胞的遷移,參與RA等自身免疫性疾病的發病。MCP-1與其受體CCR2結合后能將ERK1/2磷酸化,進而激活NF-κB轉錄因子,最終調節炎癥細胞因子的生成。研究發現烏頭湯能降低CIA大鼠血清及踝關節局部MCP-1的含量,降低踝關節中CCR2和磷酸化ERK1/2的表達水平,提示烏頭湯通過下調CIA大鼠體內MCP-l/CCR2/ERK1/2信號通路,來調節RA炎癥網絡。此外,烏頭湯對巨噬細胞趨化因子受體5(CCR5)信號通路的調節作用被證實在抑制RA炎癥反應中發揮重要作用。巨噬細胞中CCR5信號通路是與細胞免疫應答和細胞因子信號傳導相關的最重要信號通路,而CCR5敲除能改善AIA大鼠的關節炎癥[16]。該途徑中蛋白激酶C(PKC)和p38被視為RA中烏頭湯的靶蛋白,而PKC、p38可以促進巨噬細胞中的趨化因子[如巨噬細胞炎性蛋白(MIP-1α)、受激活調節正常T細胞表達和分泌因子(RANTES)、單核細胞趨化蛋白1(MCP-1)、干擾素誘導蛋白10(IP-10)]的表達,從而趨化和募集巨噬細胞、中性粒細胞、T細胞等到關節處,加重關節滑膜的炎癥。與CIA模型組大鼠比較,烏頭湯治療組大鼠血清中趨化因子MIP-lα、MIP-2、RANTES、IP-10和MCP-1的蛋白水平及踝關節中趨化因子MIP-lα、RANTES和IP-10的mRNA相對表達水平均明顯降低。此外,烏頭湯還降低來自CIA大鼠踝關節巨噬細胞中CCR5,PKC和p38的磷酸化水平[17]。以上實驗表明烏頭湯可以通過MCP-l/CCR2/ERK1/2信號通路和CCR5信號通路來調節CIA大鼠中的炎癥因子網絡,改善關節滑膜的炎癥,而達到治療RA目的。
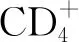
2.3烏頭湯的鎮痛作用 研究觀察烏頭湯對小鼠熱板法和醋酸扭體法兩種疼痛模型的鎮痛作用結果表明,烏頭湯能顯著提高小鼠熱刺激所致疼痛的痛閾值,亦能明顯延長醋酸刺激所致扭體反應的潛伏期,并減少其發生的次數,這些證明烏頭湯有很好的鎮痛作用[20]。與AIA大鼠模型組比較,大、中劑量烏頭湯能降低大鼠關節腫脹度,烏頭湯各劑量能升高冷板痛閾值,大、中劑量能提高機械痛閾值,大劑量對熱輻射痛閾值也有一定的增高作用。同時,烏頭湯能降低血漿前列腺素E(prostaglandin E,PGE)、5-羥色胺(5-hydroxytryptamine,5-HT)和背根神經節瞬時感受器電位香草酸受體1(transient receptor potential vanilloid 1,TRPV1)表達水平,提高瞬時感受器電位M8(transient receptor potential melastatin 8,TRPM8)表達水平。這些提示烏頭湯具有鎮痛作用,其機制可能與降低血漿中PGE和5-HT水平以及調節背根神經節中TRPV1、TRPM8的表達有關[21-22]。另外,通過網絡藥理學方法,根據烏頭湯主要化學成分,找出烏頭湯中化合物可能作用于誘導型一氧化氮合酶(inducible nitric oxide synthase,iNOS)、p38、c-Jun 氨基末端激酶 1、TNF-α、磷酸二酯酶4A(phosphodiesterase 4A,PDE-4A)和 Kappa 阿片受體等靶標,提示其可能調控p38MAPK等信號通路,抑制NO釋放;調控JNK信號通路,減弱機械痛敏;作用于Kappa 阿片受體,最終導致突觸后膜超極化,阻止痛覺沖動的傳導和傳遞等,達到多靶點、多途徑治療疼痛的效果[23]。
2.4烏頭湯的抑制血管生成作用 烏頭湯顯著降低CIA大鼠炎癥關節滑膜組織中的未成熟血管,還抑制雞胚中體內血管生成和體外血管內皮生長因子165(vascular endothelial growth factor165,VEGF165)誘導的微血管芽形成。同時,烏頭湯抑制MH7A誘導的人臍靜脈內皮細胞(human umbilical vein endothelial cells,HUVEC)的遷移、侵襲、粘附和血管形成。此外,烏頭湯顯著降低CIA大鼠滑膜中和HUVEC中促血管生成細胞因子的表達,包括VEGF、血管內皮生長因子受體2(vascular endothelial growth factor receptor 2,VEGFR2)、白細胞介素1β(IL-1β)、IL-17、轉化生長因子β(transforming growth factor β,TGFβ)、血小板衍生生長因子、胎盤生長因子、血管生成素(AngⅠ/Ⅱ)等[24]。進一步研究發現,WTD改善滑膜血管生成的潛在機制可能與PI3K-AKT-mTOR和HIF-1α途徑有關[25]。
2.5其他 此外,烏頭湯在抗氧化、減輕關節損傷,表觀遺傳學及網絡藥理學方面也取得一些研究進展。烏頭湯可以通過升高超氧化物歧化酶(superoxide dismutase,SOD)、谷胱甘肽過氧化物酶(GSH-Px),降低AIA大鼠血清中丙二醛(malondialdehyde,MDA)含量而起到抗氧化作用;抑制基質金屬蛋白酶(消化基質蛋白多糖、糖蛋白的基質酶MMP-3、能特異性降解Ⅰ、Ⅱ、Ⅲ型膠原的膠原酶MMPs-1,13和水解蛋白聚糖的金屬蛋白酶ADAMTs)的產生,減輕CIA大鼠的軟骨損傷[26]。
在表觀遺傳方面,烏頭湯可以通過調節DNA甲基化、組蛋白修飾和miRNA,來改善RA的癥狀。已有研究顯示,與健康者比較,RA患者免疫細胞內甲基化異常及甲基轉移酶表達異常,與細胞遷移、細胞黏附、細胞外基質代謝相關的一些基因DNA甲基化出現紊亂,外周血單個核細胞組蛋白去乙酰化酶(histone decetylases,HDAC)的活性顯著增加[27]。改善組蛋白乙酰化水平,RA癥狀也得到緩解[28]。研究發現,與CIA模型組比較,烏頭湯組DNA甲基轉移酶1(DNMT1)的mRNA表達顯著降低、DNA甲基化水平顯著降低,而PBMC的組蛋白3(H3)乙酰化過表達。這表明烏頭湯可通過DNA甲基化和組蛋白修飾,達到改善RA病情的作用[29]。此外,WTD還可以通過激動芳香烴受體 (AhR),促進長鏈非編碼RNA LOC101928120的轉錄,進而降低SHC1,最終抑制了IL-1β引起的軟骨細胞凋亡和ROS產生[30]。
通過將藥物靶標預測,網絡分析和實驗驗證相結合的方法,分析出烏頭湯可能通過調節產熱PPAR-γ共激活因子發揮緩解寒性RA癥狀的作用。通過實驗驗證與PPAR-γ共激活因子產熱通路相關蛋白,包括PPAR-γ、核受體輔助活化因子1(nuclear receptor coactivator 1,NC0A1)、核受體輔助活化因子2(NC0A2)、轉錄中介體復合物1(mediator comple 1,MED1)、類視黃醇X受體α(retinoid X receptor α,RXR-α)和轉錄因子環磷酸腺苷反應元件結合蛋白(cAMP-response element binding binding protein,CREBBP)等6個分子在大鼠踝關節組織及體外培養的RA-FLS細胞中的蛋白表達水平均顯著降低。烏頭湯治療后,CIA寒證模型組的PPAR-γ,RXR-α,MED1和NC0A2蛋白表達水平呈濃度依賴性增加,且作用效果與CIA寒熱證型相關。烏頭湯在CIA熱證模型組中對六種蛋白的調節作用較對CIA寒性組的作用弱[31-32]。烏頭湯可能是通過調節PTGS2、ESR1、ESR2、NOS2、AR等靶點,調控TNF信號通路、人巨細胞病毒感染、IL-17信號通路、Th17細胞分化、NOD樣受體信號通路、Th1和Th2細胞分化、T細胞受體信號通路、FOXO信號通路、Toll樣受體信號通路等通路,從而抑制炎癥,調節免疫功能達到治療RA的目的[33]。
3 結論
烏頭湯具有抗炎鎮痛、免疫調節、抑制血管生成等作用,可以抑制炎癥細胞因子的產生,調節細胞因子網絡失衡,抑制細胞因子對滑膜和軟骨細胞的刺激作用,阻止滑膜炎癥細胞浸潤,抑制關節炎性遞質和蛋白水解酶的釋放,從而減少關節軟骨、骨質的吸收,阻止骨的破壞,減少血管翳的形成,減輕病情,這可能是烏頭湯治療RA主要機制之一。隨著網絡藥理學和表觀遺傳學的發展,對烏頭湯治療RA臨床研究和實驗研究進一步的深入,有利于探索傳統方劑烏頭湯治療RA多靶點、多途徑的具體機制,為烏頭湯的臨床應用提供科學依據,有利于揭示RA的發病機制,為新藥的開發提供基礎。

