超聲自動功能成像評估2型糖尿病病人心肌早期損害的臨床價值
卿順華,龔元淑,陳玲玲,梁柏松,張平洋
隨著我國人民生活水平的改善,糖尿病(diabetes mellitus,DM)的發病率呈直線上升趨勢,且糖尿病死亡病例中近80%是由于心血管疾病,死亡率是未患糖尿病人群的2倍之多。現已證明2型糖尿病能夠在無明顯冠狀動脈或大血管病變的情況下發生糖尿病性心肌損害,并最終發展為心功能不全甚至心力衰竭[1]。目前臨床上往往關注糖尿病并發冠狀動脈粥樣硬化等引起的繼發性心臟病變,而忽視糖尿病性心肌病(diabetic cardiomyopathy,DCM)本身的損害,盡管糖尿病的治療手段不少,但心血管并發癥的死亡率卻未見明顯下降。因此,準確評價糖尿病性心肌損害尤其是早期實時監測和診斷具有重要意義[2]。目前,臨床對DCM的早期診斷較為困難,心內膜活檢雖然可以判定,但系有創檢查,且費用昂貴,難以推廣應用[3]。超聲自動功能成像(automated function imaging,AFI)技術基于二維斑點追蹤顯像,無角度依賴性,快速簡捷,重復性好,可提供心肌應變牛眼圖,并且可用不同顏色標識左室心肌節段的應變大小,直觀反映左室壁節段的收縮功能變化,對評價室壁運動有明顯優勢,尤其左室壁各節段長軸收縮期峰值應變(LPSS)可發現常規超聲心動圖不能發現的心肌早期損害[4]。本研究基于超聲自動功能成像技術探討輕型2型糖尿病病人左室收縮期心肌力學特征,以期尋求早期準確診斷DCM的新方法。
1 資料與方法
1.1 一般資料 選取2016年1月—2019年12月江蘇省人民醫院浦口分院明確診斷為2型糖尿病的病人42例為病例組,其中,男26例,女16例,年齡39~68(55.66±8.11)歲。入選標準:符合1999年世界衛生組織(WHO)制定的2型糖尿病診斷標準[5],常規超聲心動圖檢查未見明顯心臟大小異常且左室射血分數(LVEF)>55%。另外,隨機選取同期性別、年齡相匹配的32名健康成年人作為對照組,均無心血管病史,而且經過超聲心動圖、心電圖及生化等檢查排除明顯心肺疾患,男18名,女14名,年齡42~62(52.59±7.51)歲。所有受檢者均簽署知情同意書,本研究獲得我院倫理委員會批準后實施。
1.2 設備與方法 采用GE Vivid E95彩色超聲診斷儀,配有M5S探頭(頻率1.0~4.5 MHz)和6S探頭(頻率2.7~8.0 MHz),頻幀70~80幀/s,超聲儀內置AFI分析軟件。檢查時,囑受檢者左側臥位,連接心電圖,平靜呼吸,首先進行常規超聲檢查,主要采集左室長軸切面M型超聲圖像,檢測左室舒張末期內徑(LVEDD)、左室質量指數(LVMI)、左室短軸縮短率(FS)、LVEF、每搏量(SV),并計算心排血量(CO),記錄二尖瓣口舒張早期峰值血流速度/舒張晚期峰值血流速度(E/A)。在日常超聲心動圖檢查完成后,分別獲取3~5個連續心動周期的左室心尖四腔心、兩腔心、心尖左心室長軸切面的二維灰階動態圖像及左室心尖五腔切面采集的主動脈血流頻譜靜態圖像,存儲圖像,以備下一步進行心肌應變分析[4]。
1.3 圖像分析 首先,根據主動脈頻譜確定主動脈瓣關閉時間點,對左室心尖長軸觀的動態圖像進行分析。在心尖左心室長軸觀動態圖像AFI模式下,按照提示依次選擇二尖瓣兩側瓣環點和心尖點三點心內膜,由此自動程序顯示心內膜輪廓,必要時也可輔以手動微調,使得寬度與心肌厚度基本一致,此后系統自動分析得出追蹤結果,接下來同樣的方法對心尖四腔觀和兩腔觀的動態圖像進行分析,程序自動分析獲得整個左室17個節段LPSS的牛眼圖及應變平均值(見圖1)。

圖1 1例糖尿病病人的AFI結果 [AFI顯示左室心肌整體應變降低,整體長軸收縮峰值應變(GLPS)=-18.2%]
重復性檢驗:隨機選取病例組和對照組各10例,由兩名同年資、有經驗的超聲醫生,在并不知曉受檢者病情和檢查結果的情況下獨立完成。2名檢查者分別對每個受檢者測量2次,然后對同一檢查者的2次檢測結果和不同檢查者的檢測結果進行重復性檢驗。
1.4 血液生化檢測 所有受檢者均于超聲檢測當日清晨留取空腹外周靜脈血樣本,采用Vidas-Blue全自動熒光免疫分析儀及其配套原裝試劑進行血清超敏肌鈣蛋白I(hs-cTnI)及血漿N末端B型鈉尿肽前體(NT-proBNP)水平的檢測;同期采血樣用酶聯免疫吸附試驗(ELISA)法,按照基質金屬蛋白酶-2(MMP-2)試劑盒及基質金屬蛋白酶組織抑制因子(TIMP)試劑盒說明書(武漢博士德公司)操作,用iMARK 680型酶聯儀(Bio-Rad公司)檢測受檢者血清MMP-2及TIMP-1濃度;另外,檢測血液中C反應蛋白(CRP)、肌酸激酶同工酶(CK-MB)水平。

2 結 果
2.1 兩組超聲參數、血液檢測指標比較 病例組與對照組LVEDD、LVMI、LVEF、FS、SV、CO以及CK-MB、CRP、NT-proBNP、MMP-2、TIMP-1比較差異均無統計學意義(P>0.05),而病例組GLPS絕對值、E/A明顯減小,hs-cTnI明顯增高,差異均有統計學意義(P<0.01)。詳見表1。

表1 兩組超聲參數、血液檢測指標比較(±s)
2.2 兩組左室壁各節段心肌長軸應變比較 病例組左室前壁基底段、前間隔基底、后間隔基底、后間隔中段、側壁中間段、前壁心尖段、間隔心尖段、側壁心尖段、心尖部LPSS的絕對值較對照組明顯降低(P<0.01)。病例組正常左室壁心肌應變的超聲表達特征,即由基底段向心尖段逐漸增大的趨勢不復存在,左室心肌GLPS絕對值降低(P<0.01)。詳見表2。

表2 兩組左室壁各節段心肌長軸應變比較(±s) 單位:%
2.3 hs-cTnI≤0.1 ng/mL與>0.1 ng/mL的糖尿病病人超聲參數及血生化指標比較 與hs-cTnI≤0.1 ng/mL的糖尿病病人相比,hs-cTnI>0.1 ng/mL的糖尿病病人GLPS絕對值、E/A明顯性降低(P<0.01),而其他超聲參數、血液檢測指標比較差異均無統計學意義(P>0.05)。詳見表3。

表3 hs-cTnI≤0.1 ng/mL與>0.1 ng/mL的糖尿病病人超聲參數及血生化指標比較(±s)
2.4 GLPS與其他超聲參數及血液檢測指標的相關性及受試者工作特征(ROC)曲線分析 相關性分析顯示,糖尿病病人GLPS與LVEF、FS、E/A均呈正相關(r值分別為0.61,0.45,0.39,P<0.05或P<0.001),與hs-cTnI呈負相關(r=-0.63,P<0.001),而與LVEDD、LVMI、SV、CO、NT-proBNP、CRP、MMP-2、TMP-1無相關性(P>0.05)。ROC曲線分析顯示,GLPS絕對值<18.5%評價心肌損害的敏感度為90.0%,特異性為88.7%,曲線下面積為0.91。詳見圖2。
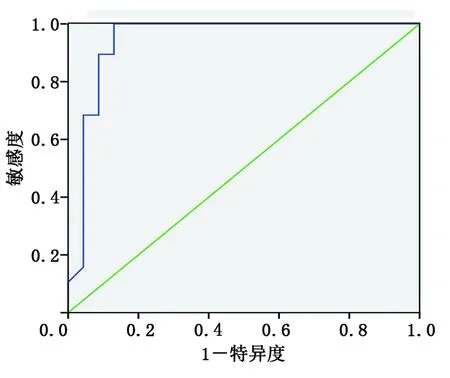
圖2 GLPS預測糖尿病病人心肌損害的ROC曲線
2.5 重復性檢驗 2名同年資、經驗較豐富的超聲醫生,隨機選取10例糖尿病病人和10名正常對照者,所測的LPSS差異無統計學意義(P>0.05),且對同一檢查者兩次檢測的LPSS差異亦無統計學意義(P>0.05)。
3 討 論
DCM是糖尿病在沒有其他危險因素(如冠心病、高血壓或瓣膜病)的情況下存在心臟結構和功能異常,在疾病的早期階段,病人常常并無明顯臨床癥狀,但晚期則會出現心律失常、心力衰竭甚至心源性休克等嚴重并發癥,心臟損害早期多屬可逆性病變,如果早期發現并及時治療,大多數是可以較好地恢復,因此,DCM的早期發現和診斷非常重要[6]。盡管目前判定糖尿病病人心室舒張功能障礙并不具備糖尿病的特異性,但是,臨床上對DCM早期特征的關注主要還是集中在舒張功能障礙,而對收縮功能關注甚少,這很大程度上是因為臨床上發現DCM病人早期LVEF往往保持正常,傳統的LVEF并不能敏感、準確地反映早期左室心肌收縮功能的降低[7],但是又沒有更好方法或者途徑來評判此時心肌收縮能力的改變,那么這些DCM早期的心肌生物力學能力真的并無受損嗎?本研究選擇42例在常規超聲心動圖檢查并未發現心臟結構和LVEF異常的新近確診(病程<1年)糖尿病病人進行觀察,利用AFI評價其左室心肌力學特征,結果發現,與對照組相比,病例組hs-cTnI明顯增高(P<0.05)。這是因為糖尿病病人血糖升高,一方面,因為胰島素缺乏引起心肌細胞內糖、脂肪、蛋白質代謝異常,能量供應障礙;另一方面,可能由于心臟微血管病變導致心肌缺血、代謝和營養發生障礙,受損心肌的肌鈣蛋白釋放進入血液,從而使得病人血清hs-cTnI濃度增高[8]。當然,并非每例糖尿病的hs-cTnI都是異常的,這是因為hs-cTnI、CK-MB作為臨床用來判定心肌損害的生化指標,總是會受到病人病程時間窗、心肌損害程度等的限制,尤其心肌損害程度的敏感度和特異性有時均差強人意[9],因此,本研究利用AFI早期評價糖尿病心肌早期損害。
NT-proBNP 是腦鈉肽在腦鈉肽前體蛋白酶的作用下裂解的產物,TIMP-2是基質金屬蛋白酶調控性因子,能夠通過結合基質金屬蛋白酶-1(MMP-1),進而調控心肌細胞的纖維化,參與DCM的病情進展[10]。許士達等[11]研究顯示,DCM病人血清MMP-1、腦鈉肽、TIMP-2水平較單純2型糖尿病病人升高更加明顯,三者聯合檢測對于早期發現病人心肌損害有一定價值。但本研究結果顯示,病例組與對照組LVMI、NT-proBNP、MMP-2、TIMP1比較差異均無統計學意義,這與許士達等[11]和梅玉紅[12]的研究結果不同,可能是因為本研究的對象是新近確診的糖尿病病人,所以心肌質量增加并不明顯、心肌纖維化的程度也較輕[13]。
心室壁由心內膜、心肌層和心外膜3層構成,心肌層是構成心壁的主體,主要由心肌細胞組成,分為內、中、外3層,走行方向分別為淺層斜行、中層環形、深層縱行,心內膜下的心肌纖維主要為縱向排列,很多病變(如缺血)往往首先累及心內膜下心肌,導致心肌縱向應變的下降[14]。本研究結果顯示,盡管兩組超聲指標LVEF、FS、LVEDD、SV比較差異均無統計學意義,但病例組E/A、部分左心室節段的LPSS以及GLPS的絕對值較正常組明顯減小,糖尿病病人GLPS與LVEF、FS、E/A以及hs-cTnI有相關性,提示糖尿病病人存在舒張功能異常和心肌損害風險,且與左室心肌縱向應變下降密切相關。hs-cTnI升高有助于發現亞臨床的心肌損傷[8,15],本研究中還參照文獻[16]將血清hs-cTnI>0.1 ng/mL的糖尿病病人與hs-cTnI ≤0.1 ng/mL作比較,結果顯示,與hs-cTnI ≤0.1 ng/mL的糖尿病病人比較,血清hs-cTnI>0.1 ng/mL的糖尿病病人GLPS的絕對值、E/A明顯降低,證明糖尿病早期心肌損害加重與其左室心肌收縮期應變下降和舒張功能障礙加重相關,而且ROC曲線分析顯示,GLPS評價心肌損害的敏感度、特異度較高。表明糖尿病早期雖然左室容積、質量及射血分數等并無明顯異常改變,但是病人不僅左室舒張功能發生障礙,而且左室心肌收縮期力學特性也已經出現變化,大部分左室節段的心肌形變能力下降,并導致左室整體應變降低。DCM病人糖代謝功能障礙會引起心肌微血管發生廣泛病變,心肌糖蛋白膠原纖維、三酰甘油及膽固醇的沉積可以引起心肌細胞肥大變性甚至不同程度的壞死纖維化,致使一定程度的心肌松弛性甚至順應性減小,而且收縮能力下降,引起舒張和收縮功能降低[13,17]。可能由于疾病早期這些改變程度相對較輕、范圍偏小等緣故,傳統的超聲心動圖中LVEF、FS尚不能敏感反映出這些變化,但基于AFI的心肌應變特性反映出了糖尿病病人左室心肌收縮期的形變能力下降,而且指標重復性好,所以能夠很好地揭示糖尿病病人左室心肌早期收縮能力的異常,如果與現有的指標聯合應用,應該可以更好地評判糖尿病的左室心肌早期損害。
局限性:基于2D-STI的AFI檢查,不僅對圖像質量要求高,需要能夠清晰辨識心肌尤其是心內膜,而且對圖像采集的幀頻要求也高,一些糖尿病病人常合并肥胖,圖像質量差,尤其是心率加快時圖像采集的準確性會不理想,這使得研究結果在臨床的推廣應用可能會受到一定程度的限制。
綜上所述,糖尿病病人左室心肌生物力學改變有一定的特異性,超聲自動功能成像能較敏感地觀測病人左室心肌基于形變改變的心肌收縮能力變化,從而為臨床DMC的早期診斷提供簡便、可靠的新方法。

