廢鋁蝕刻液中硝酸、磷酸和醋酸濃度的電位滴定法連續測定研究
陳荔英,許椐洋,余豐毅,侯海麗,王志巍,陳嘉賓,黃麗英,曾廣志
(1.福建省固體廢物及化學品環境管理技術中心,福建 福州 350003;2.藍保(廈門)水處理科技有限公司,福建 廈門 361024;3.福建省環境保護設計院有限公司,福建 福州 350011)
硝酸、磷酸和醋酸混酸(鋁蝕刻液)是晶片產業集成電路中鋁模板刻蝕劑,其蝕刻液中混酸的組成大概為磷酸(70%~72%)、硝酸(1.8%~2.0%)、冰醋酸(8.0%~10.0%),為了有效利用這些廢蝕刻液,探索一種快速簡便的單酸含量分析法,對這些廢酸的回收利用有著重要的指導作用和意義。
目前,對于混酸的分析方法主要為傳統的酸堿滴定法[1]、分光光度法[2]和離子色譜法[3]等。其中采用自動電位滴定儀測定混酸含量較為普遍,該方法具有操作簡單、分析準確度高等優點[4、5]。根據酸堿質子理論,一種物質在某種溶液中表現出的酸或堿的強度,不僅與酸堿的本質有關,也與溶劑的性質有關[6]。在水溶液中,各酸組分之間pKa值的差別應達到5 左右時,才能采用滴定法分析其各酸的含量,因此在水溶液中無法區分硝酸(pKa值為-1.32)和磷酸的一級電離(其pKa1值為1.96),也無法區分醋酸(pKa值為4.73)和磷酸的二級電離(其pKa2值為7.12)。由于水溶液中的這種極性效應,通常只能通過多步法或在非水溶劑中才能將混酸中各酸區別開來。陳旗等采用兩步電位滴定分析法測定了混酸(硝酸、磷酸、冰醋酸),第一步是以乙醇為溶劑,用0.01 mol/L 四丁基氫氧化銨標準滴定溶液,測定硝酸濃度,第二步是在氯化鈉飽和溶液中,用0.5 mol/L 氫氧化鈉標準滴定溶液,測定磷酸和醋酸濃度。徐蕊等申請的專利“鋁蝕刻液混酸濃度的電位滴定方法”[5]中,提出了一種一步法連續滴定各單酸含量的方法,但其給出的溶劑配比太寬泛,實際操作性不強。本研究對一元醇和二元醇溶劑的比例進行探索,得到一個可以同時判斷3 個酸的滴定終點的混合溶劑。提高混合酸的測定精確度和效率。
1 實驗部分
1.1 儀器與試劑
實驗儀器:雷磁ZDJ-4B 電位滴定儀、參比電極、玻璃電極、溫度電極、磁力攪拌子。
實驗試劑:鄰苯二甲酸氫鉀基準試劑、氫氧化鈉、無水乙醇、乙二醇、硝酸、磷酸、醋酸均為市售分析純。
1.2 混酸的配制
分別稱取1.219 4 g 硝酸(質量分數30%)、8.166 6 g磷酸(質量分數85%)、1.133 6 g 冰醋酸(質量分數99.1%)和0.736 5 g 去離子水,配成混合溶液。
1.3 標準滴定溶液配制與標定
配制:稱取50 g 氫氧化鈉,溶于1 000 mL 無水乙醇中,搖勻,在聚乙烯容器中密閉放置至溶液清亮。量取50 mL 上層清液,加入400 mL 無水乙醇,搖勻。
標定:將工作基準試劑鄰苯二甲酸氫鉀置于電烘箱中,105~110 ℃干燥至恒重,稱取0.5 g,加入50 mL蒸餾水,溶解。用配制好的氫氧化鈉/乙醇溶液標定其濃度。
氫氧化鈉/乙醇標準滴定溶液的濃度(mol/L),按式(1)計算:

式中:m—鄰苯二甲酸氫鉀的質量,g;
V1—氫氧化鈉/乙醇溶液的體積,mL;
V2—空白試驗氫氧化鈉/乙醇溶液的體積,mL;
M—鄰苯二甲酸氫鉀的摩爾質量,g/mol,[M(KHC8H4O4)=204.22]。
1.4 分析步驟
準確稱取0.3 g 樣品,置于測量杯內,加入100 mL無水乙醇/乙二醇混合溶液(2∶3)。使用231-01pH 玻璃電極、T-818-B-6 溫度電極、232-01 參比電極(填充液為2 mol/L 乙醇氯化鋰溶液),設置終點電位突躍為20 mV/mL,用0.15 mol/L 氫氧化鈉/乙醇溶液進行電位滴定,記錄第一個突躍點的滴定體積V1:
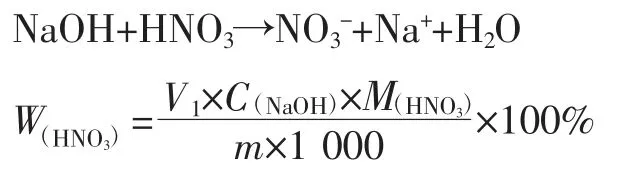
繼續用堿滴定,記錄第二個突躍點的滴定體積V2:
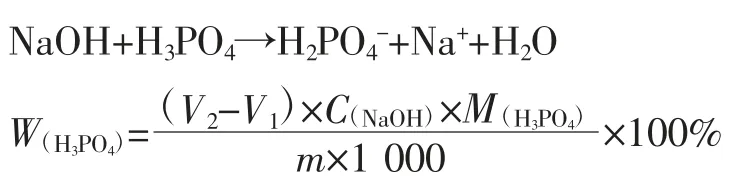
繼續用堿滴定,記錄第三個突躍點的滴定體積V3:
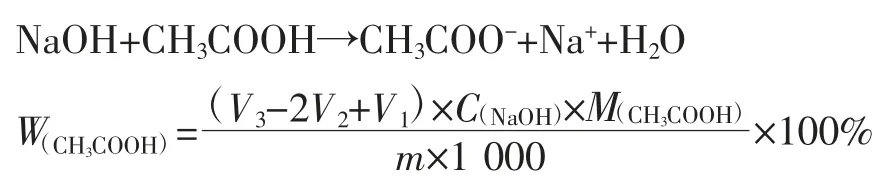
2 結果與討論
2.1 滴定條件的選擇
2.1.1 滴定溶劑比例的選擇
配置硝酸濃度為3.25%、磷酸濃度為61.67%和醋酸濃度為9.98%的混酸,以氫氧化鈉/乙醇為滴定劑,并固定該滴定設備攪拌速度25 r/min,設置電位突變值分別為ΔV1:35、ΔV2:22 和ΔV3:30,采用不同的乙醇與乙二醇配比進行滴定,結果如表1 所示。
從表1 可以看出,乙二醇/乙醇比例不同影響了溶劑的極性,也影響各酸的pKa值的分離,1,2 號(乙二醇∶乙醇分別為2.33∶1 和3.33∶1)實驗中沒有出現醋酸的電位突變點,無法測出各酸的含量。而在3,4 號(乙二醇/乙醇體積比為1.5∶1)中分別出現硝酸、磷酸和醋酸的滴定突變點,可以測出各酸含量。根據這一結果,本研究選擇乙二醇/乙醇體積比為1.5∶1 的混合溶劑進行連續滴定。
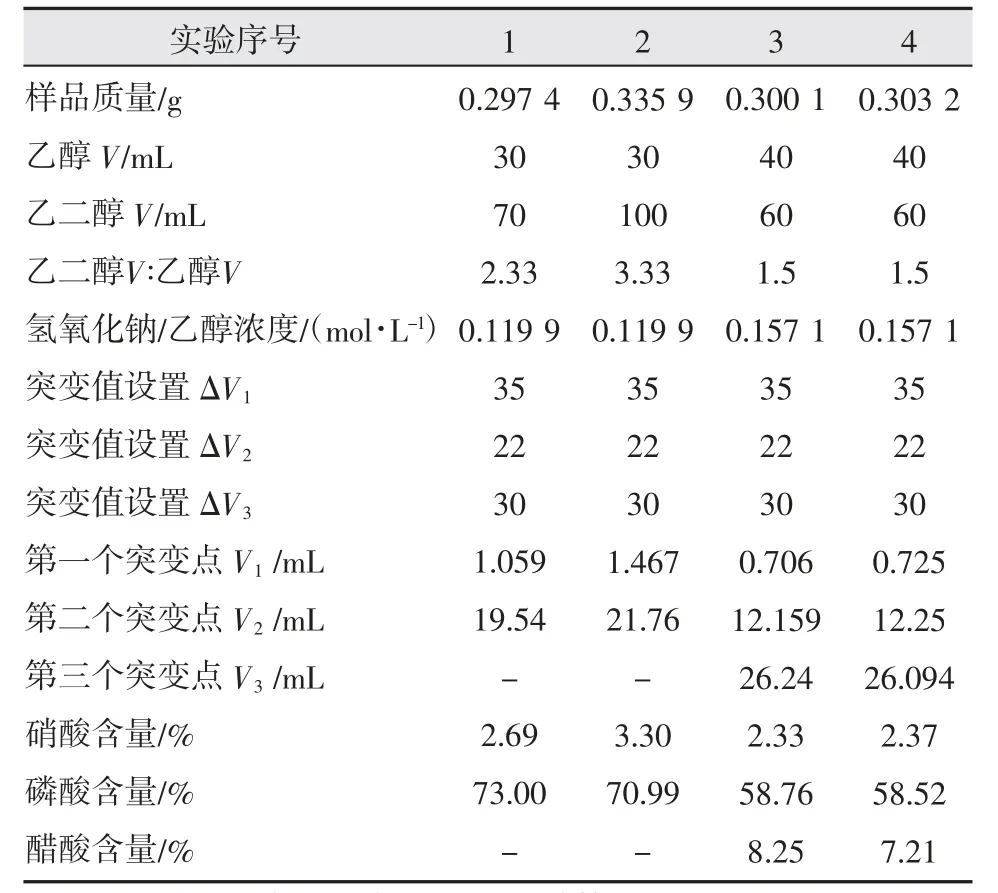
表1 不同溶劑比例對單酸含量電位滴定結果影響
2.1.2 電位突變值設置的選擇
以氫氧化鈉/乙醇作為滴定劑,固定混合溶劑乙醇/乙二醇的體積比為40 mL∶60 mL,采用如上配置的混酸濃度,并固定該滴定設備攪拌速度25 r/min。固定第一階ΔV1為35,設置不同ΔV2和ΔV3值,滴定混酸中的硝酸、冰醋酸和磷酸各酸濃度。分別根據第一個、第二個和第三個滴定終點消耗氫氧化鈉/乙醇的體積,計算各酸的含量,結果列于表2 中。
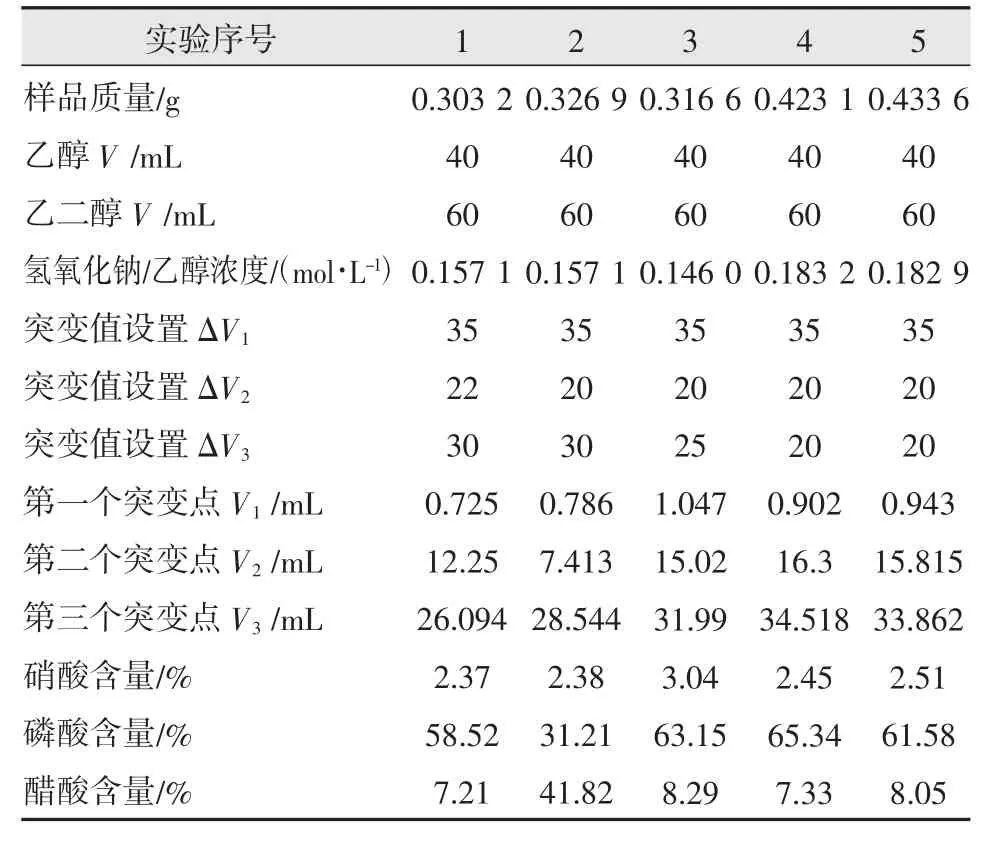
表2 不同電位突變值設置對檢測結果的影響
從表2 可看出,電位突變設置值不同,對滴定結果產生的影響較大。2 號實驗結果中磷酸和醋酸的含量與實際值偏差較大,說明2 號的點位突變值設置不合理。而1、3、4 號實驗結果與實際值偏差較小。可見,將3 個點位突變點分別設置在ΔV1為35,ΔV2為20 和ΔV3為25 較為合理。
綜上實驗結果,得到最佳滴定條件如下:乙二醇/乙醇體積比為1.5∶1,電位突變設置值ΔV1為35,ΔV2為20,ΔV3為25,攪拌速度為25 r/min。
2.2 檢驗測試方法的可靠性驗證
按照2.1.1 中的各單酸濃度配置混酸,以乙二醇/乙醇混合比例(1.5∶1)為滴定溶劑,以氫氧化鈉/乙醇為滴定劑,在上述的最佳滴定條件下對混合酸進行連續滴定。混酸的用量為0.380 7 g,氫氧化鈉/乙醇的濃度為0.146 mol/L,分別記錄第一個、第二個和第三個滴定終點出現是所消耗氫氧化鈉/乙醇的體積。各酸的點位滴定曲線如圖1 所示,滴定結果列于表3 中。
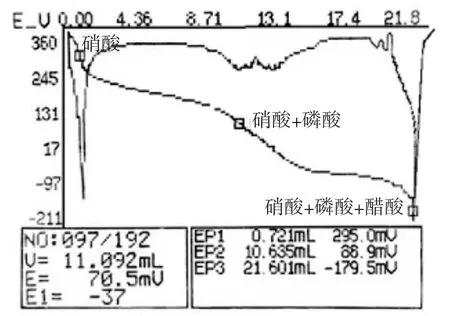
圖1 混合酸中各單酸含量電位滴定圖
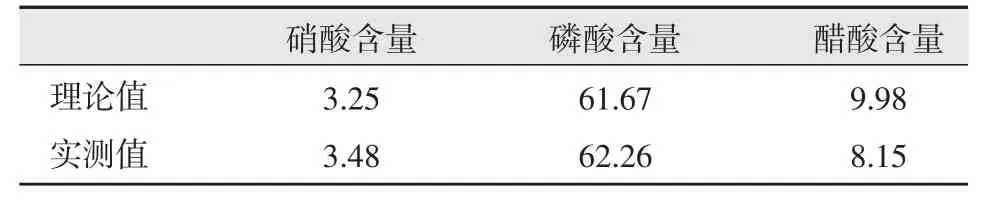
表3 混合酸中各單酸含量電位滴定結果 %
從表3 可以看出,磷酸的測定值與理論值相近。醋酸的實測值與理論值存在誤差的原因可能是由于該酸揮發較大引起的。
2.3 檢驗測試方法的重現性
按照2.2 描述的實驗條件,重復進行三次測定,結果如表4 所示,計算其偏差值列于表5 中。
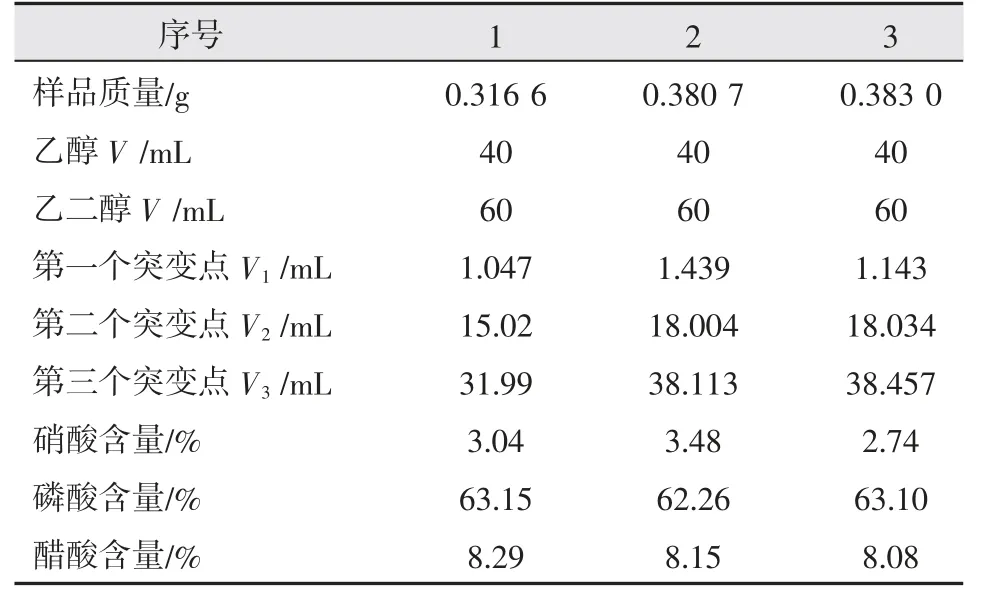
表4 混合酸中各單酸含量電位滴定重現性檢測結果
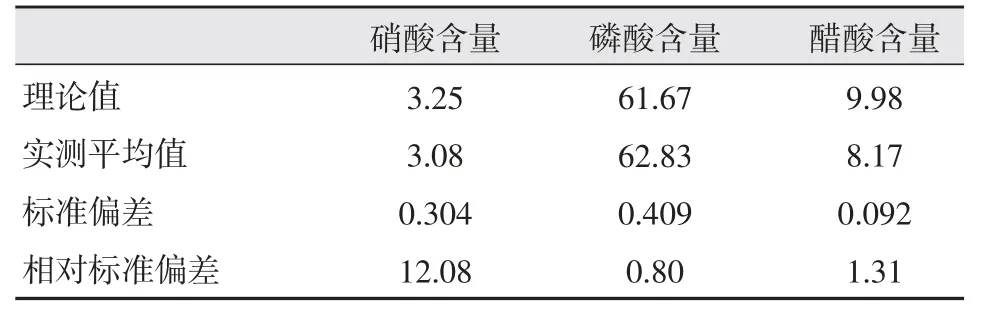
表5 重現性檢測的標準偏差計算 %
從表5 可以看出,與文獻[4]的兩步電位滴定法結果相比,本方法測定的磷酸和醋酸的標準偏差較小,而與文獻[3]采用的離子色譜法測定混合酸中各組分相比,本方法測定的硝酸和磷酸含量的相對標準偏差稍大,但醋酸含量的相對標準偏差則在同一數量級上。可見,本方法具有較好的可靠性。
3 結論
本研究提出了采用非水體系,通過一步連續電位滴定法,快速高效檢測混酸中各酸含量的方法,優化了滴定條件,并進行了可靠性和重現性驗證。結果表明,本實驗的最佳滴定條件為,乙二醇/乙醇體積比為1.5∶1,電位突變設置值:ΔV1為35,ΔV2為20,ΔV3為25,攪拌速度:25 r/min;所測的混酸中硝酸、磷酸和醋酸的含量與實際值的標準偏差均較小。可滿足現實生產中廢混酸回收利用等的分析要求,有望獲得實際應用。

