生物醫用亞穩β鈦合金的研究進展
肖文龍,付 雨,王俊帥,曾 達,梁雄偉,陳 恒,趙新青,馬朝利
(1 北京航空航天大學 材料科學與工程學院,北京 100191;2 大博醫療科技股份有限公司,福建 廈門 361026)
隨著醫療器械行業的快速發展,人們對接骨板、牙種植體和人工關節等硬組織修復替代材料的需求越來越大。相比于不銹鋼和Co-Cr合金,鈦及鈦合金具有高比強度、低彈性模量、優異的耐腐蝕性和生物相容性等優點,在臨床上已經得到了廣泛應用。然而,傳統的生物醫用鈦合金如Ti-6Al-4V和Ti-6Al-7Nb等,由于存在Al,V等對人體有毒元素,并且彈性模量遠高于人體骨骼,在生物相容性和力學相容性方面無法滿足醫用金屬材料的要求。以Ti-Nb基為代表的生物醫用β型鈦合金,具有更優異的生物相容性、更低的彈性模量以及超彈性和形狀記憶等功能特性,已成為新一代醫用金屬材料重點的發展方向。本文將綜述生物醫用鈦合金的發展歷程,重點介紹Ti-Nb基鈦合金的設計與制備方法和發展現狀,并展望醫用鈦合金的發展趨勢。
1 生物醫用鈦合金的基本特征及發展概況
1.1 醫用金屬材料的基本特征
醫用植入金屬材料的安全性對其綜合性能提出了高要求。植入物在使用過程中承受力學/化學環境的交互作用,除了應具備低彈性模量、高強度、耐磨損和優異的疲勞性能等之外,還應具有無毒、不致敏和不致癌等生物相容性。針對不同用途的醫用金屬材料,其性能要求的側重點也不同,例如對于人工關節和接骨板等需要承受較大載荷的外科植入物用金屬材料,除了應滿足良好的生物相容性(biocompatibility)、化學穩定性以及耐腐蝕性外,還對其力學相容性(mechanical compatibility)提出了額外的要求,如高強度、高韌性、低彈性模量、良好的耐磨性和足夠的疲勞壽命等。目前常用的醫用金屬材料主要為316L不銹鋼、Co-Cr合金以及純鈦和鈦合金。表1為常用金屬元素的生物相容性及各項生物性能指標,可以知道Co,Cr和Ni等元素存在生物毒性[1]。并且,醫用不銹鋼(210~250 GPa)和Co-Cr合金(190~210 GPa)的彈性模量遠高于人骨(10~30 GPa)[2],容易引起“應力屏蔽”效應而導致植入物失效,無法滿足長期使用的要求。鈦及鈦合金因具有高比強度、低彈性模量、優異的生物相容性和耐腐蝕性等綜合特性,成為當前生物醫用金屬材料領域的研究熱點和重要候選材料[3]。

表1 鈦合金中常用合金化元素的生物相容性[1]Table 1 Biocompatibility of common alloying elements in Ti alloys[1]
1.2 醫用鈦合金的發展概況
生物醫用鈦合金的發展可以劃分為三代。第一代是純鈦和Ti-6Al-4V(質量分數,下同)。Ti-6Al-4V具有良好的耐蝕性、較低的彈性模量(110~130 GPa)和優良的強塑性匹配,在醫用金屬材料領域獲得了廣泛應用。然而,其彈性模量為人體骨骼的4~20倍,且臨床使用發現Al元素和V元素可能導致阿茲海默癥、神經紊亂和骨軟化等不良反應[4]。隨后,德國和瑞士在20世紀80年代分別用Fe和Nb替代V,開發了以Ti-5Al-2.5Fe和Ti-6Al-7Nb為代表的第二代α+β型醫用鈦合金[5]。Ti-5Al-2.5Fe和Ti-6Al-7Nb具有與Ti-6Al-4V相近的力學性能和更優的生物相容性,但仍含有潛在毒性元素Al,且彈性模量仍遠高于人骨[6]。為了進一步改善醫用鈦合金的生物相容性和力學相容性,自20世紀90年代開始,世界各國相繼開展了不含Al和V等有毒元素且具有更低彈性模量的第三代β型醫用鈦合金的研究,并開發了一系列新型醫用鈦合金,如美國的Ti-13Nb-13Zr, Ti-12Mo-6Zr-2Fe(TMZF)和Ti-35Nb-7Zr-5Ta(T-Osteum),日本的Ti-29Nb-13Ta-4.6Zr(TNTZ)和Ti-23Nb-0.7Ta-2Zr-1.2O(原子分數/%,Gum metal),中國的Ti-24Nb-4Zr-7.9Sn(Ti-2448),TLE(Ti-(3~6)Zr-(2~4)Mo-(24~27)Nb)與TLM(Ti-(1.5~4.5)Zr-(0.5~5.5)Sn-(1.5~4.4)Mo-(23.5~26.5)Nb等。表2給出了目前列入ASTM標準的醫用鈦合金及力學性能。可以看出,新一代醫用鈦合金大多為Ti-Nb體系,并添加了表1[1]列出的Mo,Ta,Zr和Sn等生物友好元素,具有比純鈦和Ti-6Al-4V等醫用鈦合金更低的彈性模量與更優的生物相容性。Ti-Nb基鈦合金通過合金成分設計和微觀組織調控可以獲得優異的生物相容性、低彈性模量、高強度、超彈性和形狀記憶效應等特性[7-8],受到了材料和醫學領域研究人員的廣泛關注。
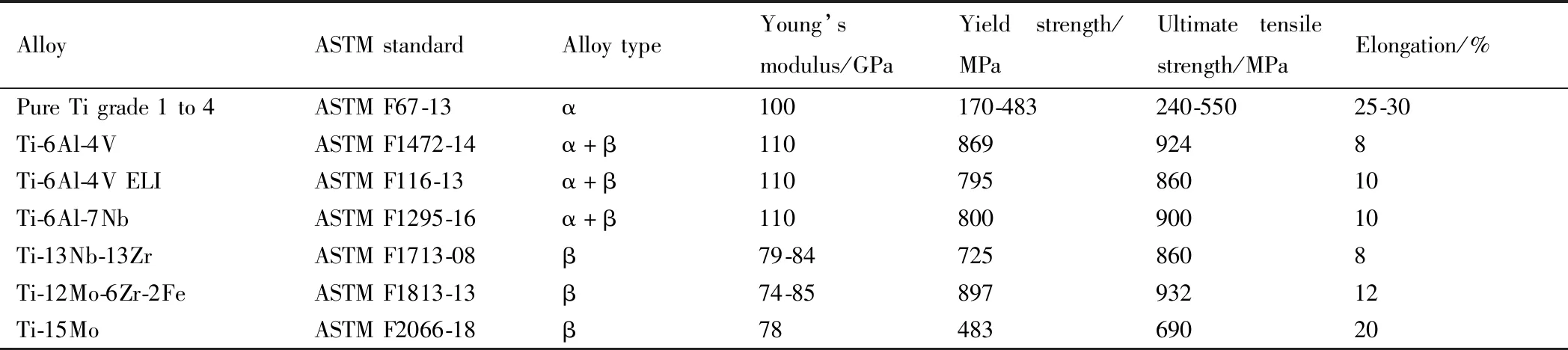
表2 列入ASTM標準的醫用鈦合金Table 2 Titanium alloys for biomedical applications registered in ASTM standard
2 新型生物醫用鈦合金的成分設計方法
新型醫用鈦合金以近/亞穩β鈦合金為主,將降低彈性模量作為發展第三代醫用鈦合金的重要目標之一。鈦合金的彈性模量與相組成以及β相的結構穩定性密切相關,可借助經驗方法和理論計算設計合金成分,獲得低彈性模量。傳統鈦合金的成分設計主要基于鉬當量([Mo]Eq)經驗方法,其計算公式為[9]:[Mo]Eq=1.0Mo+0.67V+0.44W+0.28Nb+0.22Ta+2.9Fe+1.25Cr+1.25Ni+1.7Mn-1.0Al,鉬當量與β相穩定性成正比。新型醫用鈦合金含有較高含量的Nb,Mo,Zr,Sn和Ta等元素,而鉬當量經驗法將Zr和Sn視為中性甚至α穩定元素,未計入計算公式中。但研究發現,當Zr和Sn與Nb和Mo等β穩定元素復合添加時,能有效抑制α″馬氏體和無熱ω相的形成,表現為較強的β穩定元素作用,且其β穩定作用的強弱還與所添加的其他β穩定元素的種類和含量有關[10-11]。近年來,研究學者提出將Zr作為鈦合金中弱β穩定元素,其鉬當量系數為0.34或0.47,而Sn的鉬當量系數為0.38或0.30[12-13]。此外,研究表明間隙元素O和N等α穩定元素也是新型醫用鈦合金的理想合金化元素,溶入β相中的O和N元素實際起著穩定β相的作用[14],但并未計入鉬當量計算或被作為α穩定元素看待。因此,鉬當量只能粗略估算醫用鈦合金的β相穩定性,在進行β型醫用鈦合金的成分設計時,應充分考慮Zr,Sn和O等元素對β相的穩定作用和合金化元素間的交互作用,并結合其他方法進行成分設計。
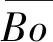
(1)
式中:Xi為元素i的原子分數;(Bo)i和(Md)i分別為元素i的Bo和Md值。
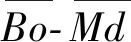
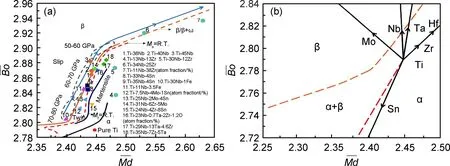
圖圖及常見Ti-Nb基醫用鈦合金在其中的位置(a)[16]以及合金元素Nb,Mo,Ta,Zr,Sn和Hf對和值的影響趨勢(b)[10] map showing the positions of some typical Ti-Nb based biomedical Ti alloys (a)[16] and the effect trend of Nb,Mo,Ta,Zr,Sn and Hf addition on values (b)[10]
You等[18]在d-電子理論的基礎上,考慮鈦與其他合金化元素間的鍵合力(bonding force,BF),進行低彈性模量鈦合金的設計,設計的Ti-11Nb-38Zr(原子分數/%)的彈性模量低至38 GPa。基于庫侖定律,合金元素間的鍵合力計算方式為:
(2)
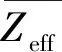
需要特別注意的是,d-電子理論、平均價電子濃度和鉬當量等方法均是建立在Ti-M二元合金(M為合金化元素)的基礎上發展而來的半經驗方法,僅考慮了Ti元素與第二組元元素之間的相互作用。新型醫用鈦合金的多元合金化元素間的交互作用比較復雜,采用d-電子理論、平均價電子濃度法和鉬當量進行合金成分設計會與預期出現偏差。這可能是由于在具有較高Zr,Sn和O含量的鈦合金中,這些合金化元素可被視為點缺陷,抑制了宏觀長程馬氏體轉變和無熱ω相,形成納米疇(nanodomain)即O′相,從而將室溫不穩定的β相穩定至室溫,獲得低彈性模量、超彈性和高強度等多種特性,但并未反映在電子參數和鉬當量計算中。此外,合金化元素之間存在相互作用,而這些平均參量設計法沒有考慮它們之間的相互作用。因此,在進行新型醫用β鈦合金成分設計時,應充分考慮多組元間的交互作用,綜合利用各種手段,如高通量實驗法、第一性原理計算、人工神經網絡和團簇線配比法等。
3 Ti-Nb基醫用鈦合金的研究進展
3.1 合金元素的作用
新型醫用鈦合金設計的基本原則是抑制α′,α″和ω相的形成,獲得低穩定性的近/亞穩β鈦合金。合金化元素的選取考慮生物相容性、β相穩定作用以及固溶強化效果等。從表1[1]可知,可選取的生物相容性元素為Nb,Mo,Ta,Zr,Sn,Hf(注:Mo的生物相容性較低)以及間隙元素O和N。根據鈦合金的物理冶金原理,Nb,Mo,Ta為β穩定元素,Zr,Sn,Hf為中性元素,O和N通常被視為α穩定元素。
圖2[28-32]列出了上述合金化元素對Ti-M二元和Ti-Nb-M三元合金(M為合金化元素)的馬氏體相變開始溫度(Ms)的影響,Mo是最強的β穩定元素,每添加1%(原子分數)Mo,Ms降低88 K,當Mo與Nb復合添加時,Mo的β穩定作用更強,添加1%(原子分數)Mo使Ti-Nb的Ms降低120 K[32]。Nb的β穩定作用次之,每添加1%(原子分數)Nb,Ms可以降低40 K[33],Ta較弱,每添加1%(原子分數)Ta,Ms降低30 K[28]。Nb,Mo,Ta,Zr,Hf在β相中均可無限互溶,產生固溶強化作用。實驗和理論計算均表明,在Nb含量低于26%(原子分數)時,隨著Nb含量增加,Ti-Nb合金應力誘發α″馬氏體相變所需的臨界應力降低[34-35]。Mo的原子半徑和熔點與Nb比較接近,但Ti-Mo合金的超彈性和形狀記憶效應較差[36]。金屬Ta已經在生物醫用材料領域獲得應用,但Ta在鈦合金中的β穩定作用較弱,且密度大、熔點高、成本較高,一般避免添加或少添加。表3對比了一些低彈性模量的Ti-Nb,Ti-Mo和Ti-Ta二元亞穩β鈦合金的力學性能[37-40]。由于Ti-Nb合金彈性模量更低,受到人們的高度關注。
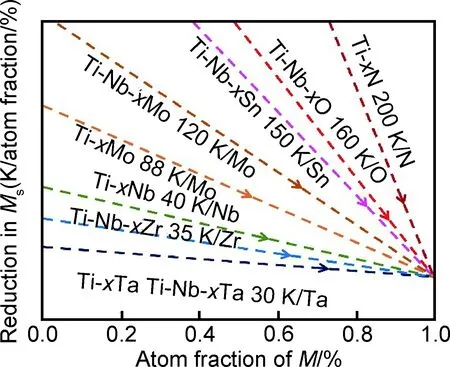
圖2 合金元素M對Ti-M二元合金與Ti-Nb-M三元合金Ms的影響[28-32]Fig.2 Reduction of Ms as a function of alloying element M in Ti-M binary alloys and Ti-Nb-M ternary alloys[28-32]
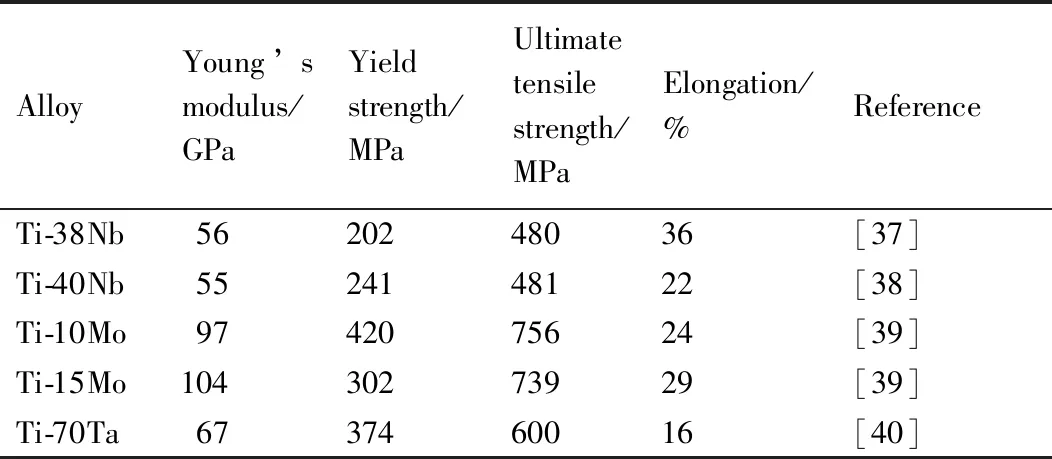
表3 Ti-Nb,Ti-Mo和Ti-Ta二元亞穩β鈦合金的力學性能Table 3 Mechanical properties of metastable Ti-Nb,Ti-Mo and Ti-Ta binary alloys
除了β穩定元素外,新型醫用β鈦合金一般會同時加入中性元素Zr和Sn。Zr和Sn對β轉變溫度影響較小,但在α和β相中均有較大的固溶度,起固溶強化作用。當Zr和Sn與其他β穩定元素復合添加時,能夠降低Ms,有效抑制α″和ω的析出,獲得低彈性模量,如Ti-24Nb-4Zr-8Sn[26]。Miyazaki等[41]指出,在Ti-Nb-Zr中每增加1%(原子分數)Zr,Ms降低35 K;在Ti-Nb-Sn中每增加1%(原子分數)Sn,Ms降低150 K,而在Ti-Nb-Zr-Sn中Ms僅降低80 K[42]。Zr和Sn的β相穩定作用受合金體系的影響,可能與合金化元素之間的交互作用有關,關于Zr和Sn與其他元素復合添加對β相穩定性的影響機理尚不完全清楚。此外,Zr和Sn可以提高β-TiNb合金的應力誘發馬氏體相變和位錯滑移的臨界應力,從而獲得更高的超彈性和形狀記憶效應。

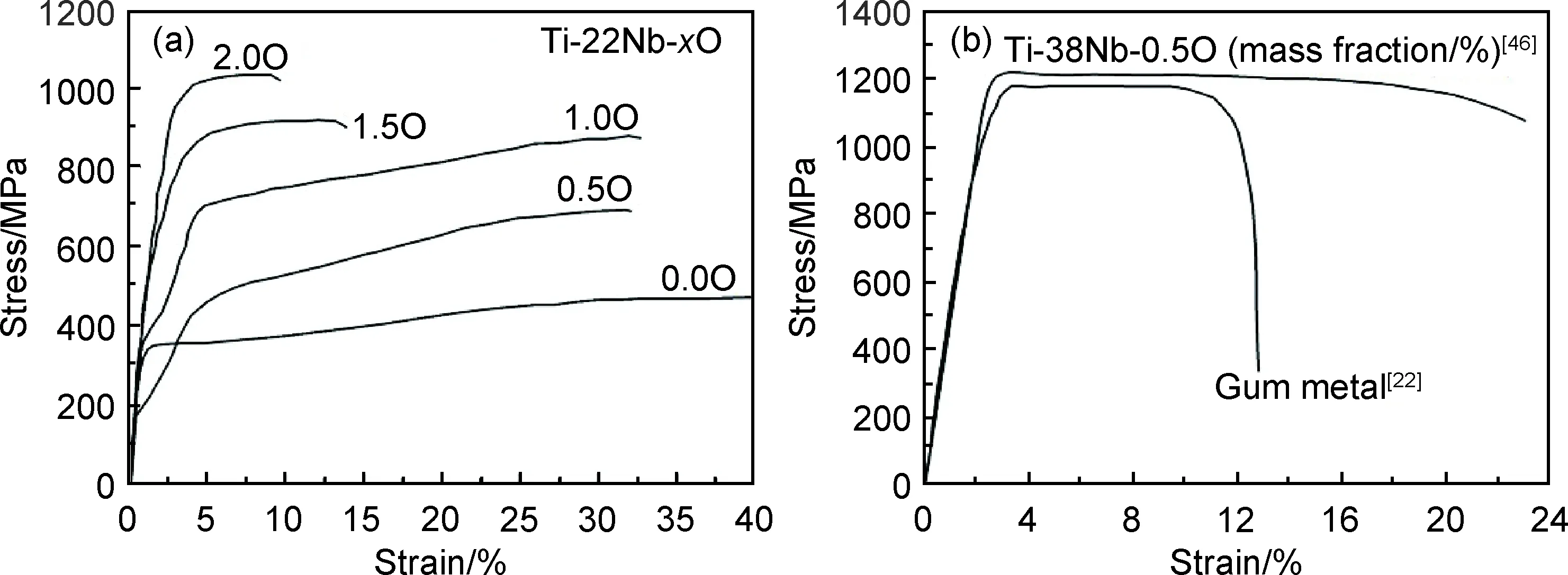
圖3 Ti-22Nb-xO(原子分數/%)的拉伸應力-應變曲線(a)[43]以及Ti-38Nb-0.5O與Gum metal的拉伸性能對比(b)[22,46]Fig.3 Tensile stress-strain curves of Ti-22Nb-xO (atom fraction/%) alloys(a)[43] and comparison of tensile properties between Ti-38Nb-0.5O and Gum metal(b)[22,46]
3.2 Ti-Nb二元合金的組織與性能
Ti-Nb二元合金的彈性模量隨Nb含量的變化趨勢呈“W”形[52],如圖4(a)[52]所示,這與不同Nb含量的合金相組成和β相結構穩定性變化密切相關。當Nb含量分別約為16%和40%時,合金的主要相組成分別為α″馬氏體和亞穩β相,具有最低的彈性模量。當Nb含量低于14%時,為α′相,此時隨Nb含量的降低,彈性模量逐漸升高;當Nb含量高于40%時,彈性模量隨Nb含量的增加而增加;而當Nb含量位于16%~40%之間時,由于存在ω相,彈性模量隨Nb含量的增加先升高后降低,在28%時達到最大。
Kim等[33]研究發現,β-TiNb二元合金具有低彈性模量、超彈性和形狀記憶等特性。Ti-Nb二元合金的力學性能強烈依賴于Nb含量,如圖4(b)所示。低β相結構穩定性容易引起應力誘發β→α″馬氏體相變,出現雙屈服現象,初始屈服強度低至200 MPa以下,控制Nb含量在40%附近時可獲得低彈性模量,且具有一定的超彈性和形狀記憶效應[33,53]。Ti-45Nb合金的應力誘發馬氏體相變被抑制,但Nb的固溶強化作用弱,合金的強度低。添加其他合金元素如Mo,Zr,Sn和O等,可以對相組成、相穩定性和彈性模量進行調控,獲得低彈性模量和高強度,改善超彈性和形狀記憶效應,由此發展出三元和多元Ti-Nb基生物醫用鈦合金。
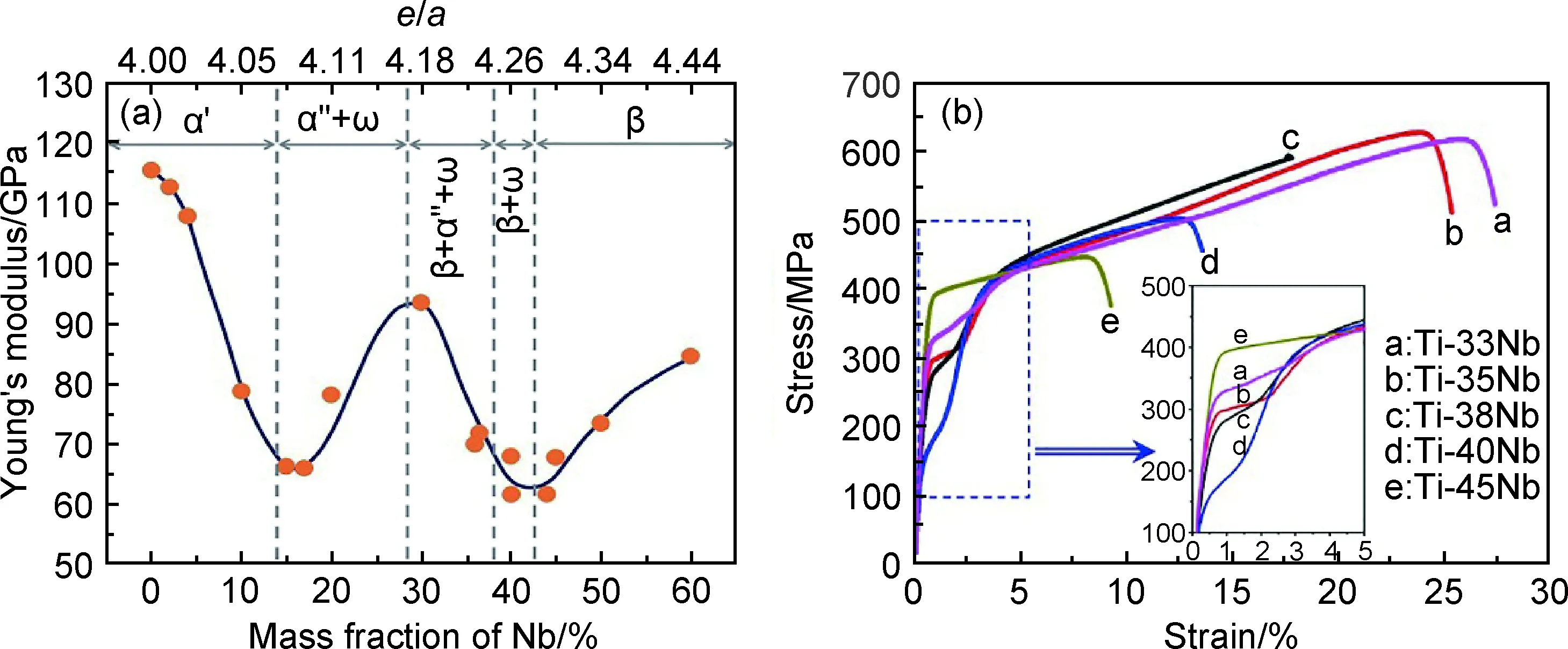
圖4 Ti-Nb二元合金的彈性模量與相組成(a)[52]和拉伸應力-應變曲線(b)隨Nb含量的變化Fig.4 Evolution of Young’s modulus and phase constituents (a)[52] and tensile stress-strain curves (b) of Ti-Nb binary alloys as a function of Nb contents
3.3 Ti-Nb基鈦合金的發展現狀
通過多元合金化進一步降低彈性模量,提高強度,改善超彈性和形狀記憶效應,是拓寬Ti-Nb合金在生物醫學領域應用的關鍵。目前,世界各國通過添加Mo,Zr,Sn,Ta等生物友好元素以及間隙元素O,研發了一系列低彈性模量Ti-Nb基生物醫用鈦合金,部分列于表4[7,25,27,37,46,54-79]。由于Ti-Nb二元合金塑性較好,通過熱機械處理可以大幅度提高強度。例如,Zhao課題組[55]通過冷軋后進行低溫退火,利用細小彌散的α相、高密度位錯和晶界抑制應力誘發α″馬氏體相變,在保持低彈性模量(56 GPa)的情況下,將Ti-38Nb的屈服強度和抗拉強度分別提高至850 MPa和1020 MPa。日本學者Kim等[33]研究了Ti-Nb二元合金的超彈性和形狀記憶效應,Ti-(22~25)Nb(原子分數/%)具有形狀記憶效應,Ti-(25.5~27)Nb(原子分數/%)具有超彈性,由于Ti-Nb二元合金較低的應力誘發α″馬氏體相變臨界應力、位錯滑移臨界應力和馬氏體相變應變(martensitic transformation strain),超彈性最大為3%。
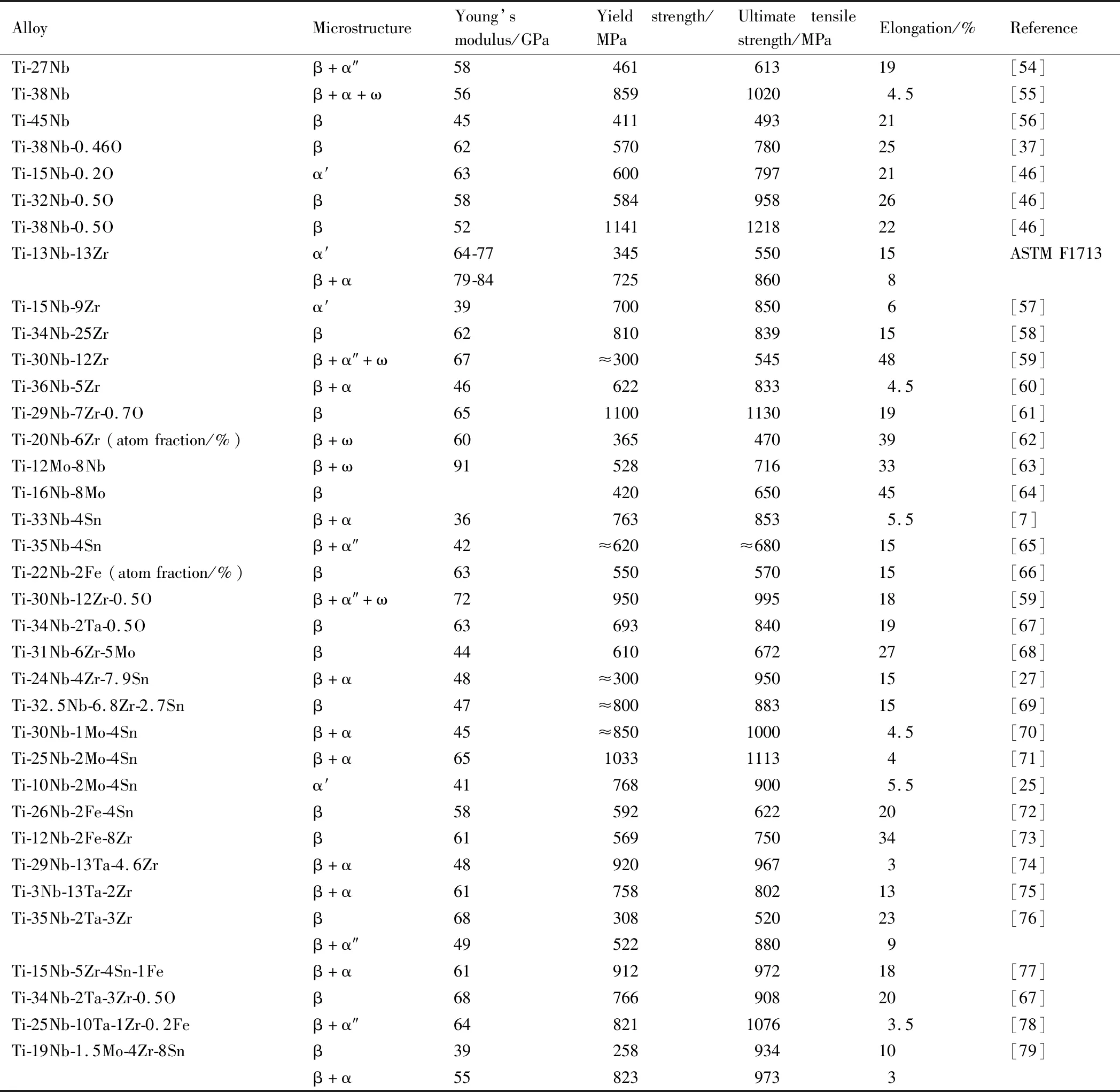
表4 醫用Ti-Nb基合金的組織類型與力學性能Table 4 Phase constitutions and mechanical properties of biomedical Ti-Nb based alloys
4 醫用鈦合金的制備技術
通過各種制備技術對新型醫用鈦合金組織結構進行調控,可以提高其綜合性能,目前研究人員針對醫用鈦合金的形變熱處理、大塑性變形、表面改性、多孔化和增材制造技術等開展了大量的研究。
4.1 形變熱處理技術
通過冷/熱加工與熱處理相結合的形變熱處理方法調控鈦合金的微觀組織,可以改善高強度和低彈性模量匹配,提高超彈性和形狀記憶效應。為了獲得低彈性模量,β型鈦合金一般采用β單相區固溶淬火獲得單一β相,但低的β相結構穩定性容易導致低屈服強度。通過后續時效處理析出α和ω相可以提高強度,但伴隨著彈性模量升高和塑性降低[86]。低彈性模量亞穩β鈦合金的低強度源自其本征低β穩定性,Zhao等[55,71,87]通過冷軋獲得超細晶,并進行后續低溫短時退火處理,引入大量晶界和位錯等抑制應力誘發馬氏體相變,穩定具有本征低彈性模量的亞穩β相,同時獲得了超低彈性模量和高強度。形變熱處理的關鍵在于引入各種強化因素提高強度,抑制宏觀長程馬氏體相變,但應盡量降低β相結構穩定性,以此實現高強度和低彈性模量匹配。在軋制后進行退火處理,調控β晶粒尺寸和α相的析出,或低溫時效析出一定等溫ω相,可提高位錯滑移的臨界應力,改善超彈性和形狀記憶效應[88-89]。此外,形變熱處理還能形成特定織構,對降低彈性模量和改善超彈性和形狀記憶效應有利[53,90]。如前所述,α′和α″馬氏體亦能獲得低彈性模量,但由于應力作用下馬氏體變體的自協作(reorientation)作用,導致α′和α″型鈦合金的屈服強度較低。最近研究發現,利用高壓固溶處理獲得的純α″型Ti-30Zr-5Al-3V的彈性模量低至34 GPa[91]。Hanada等[65]采用冷軋預變形使Ti-35Nb-4Sn誘發大量α″馬氏體,彈性模量降低至42 GPa,同時實現強度提升。經冷軋細化晶粒后,α′型Ti-15Nb-9Zr[57]和Ti-10Nb-2Mo-4Sn[25]彈性模量分別為39 GPa和41 GPa,抗拉強度超過850 MPa。
由于對低彈性模量的要求,醫用鈦合金的形變熱處理一般應盡可能避免析出高彈性模量的α和ω相。然而,通過在兩相區形變熱處理調控等軸α相的大小和數量,亦可使具有低β相結構穩定性的亞穩β型Ti-Nb合金獲得低彈性模量。最近,本課題組提出基于電子理論的合金成分設計和基于β基體穩定性的組織調控方法,通過析出超細等軸α產生的元素再分配調控剩余β基體的結構穩定性至能獲得低彈性模量的范圍,利用低穩定性的β基體提供低彈性模量和超細等軸α相提供強化,獲得了低彈性模量和高強度匹配[47,77,92]。進一步研究形變熱處理調控β穩定性和α的析出、形貌、數量和分布等,是制備低彈性模量、高強度Ti-Nb基醫用鈦合金的研究方向之一。
4.2 大塑性變形方法
與粗晶材料相比,超細晶/納米晶材料可以獲得更高的強度、硬度和疲勞性能。針對醫用鈦合金,研究人員采用等通道轉角擠壓(equal channel angle pressing,ECAP)、累積疊軋(accumulative roll bonding,ARB)、高壓扭轉(high pressure torsion,HPT)和攪拌摩擦加工(friction stir processing,FSP)等大塑性變形晶粒細化方法開展了相關工作。Hohenwarter等[93]通過HPT將Ti-45Nb的晶粒尺寸從15 μm細化至50 nm,強度從450 MPa提升至990 MPa以上。Inoue等[94]利用冷軋大變形將Ti-18Nb-17Zr的晶粒細化為約5 nm,在彈性模量為55 GPa時強度提高至1100 MPa,彈性應變極限約為2%。于振濤等[95]利用改進的ARB法將Ti-25Nb-3Zr-2Sn-3Mo(TLM)合金板材的晶粒細化至80~300 nm,彈性模量為62~70 GPa,抗拉強度達到了995~1050 MPa。Arockiakumar等[96]利用ECAP將Ti-40Nb-0.3O的晶粒尺寸細化至1 μm,并利用隨后的退火處理析出細小α相,降低應力誘發馬氏體相變臨界應力和提高位錯滑移臨界應力,從而改善了合金的超彈性。FSP主要應用于Ti-6Al-4V,進行合金表面超細晶化/納米化[97]。本研究團隊利用傳統軋制退火工藝獲得了等軸超細α+β雙相組織,實現了良好的低彈性模量和高強度匹配[47]。針對新型醫用鈦合金,大塑性變形方法主要應用于改善本征低彈性模量鈦合金的強度,關于大塑性變形表面改性的研究較少。利用表面噴丸、機械碾磨和攪拌摩擦加工等[98]表面納米化技術不僅能提高材料的力學性能,還可使其具備納米生物學的優點,提高鈦合金的表面活性,有利于細胞黏附增殖,提高耐磨性,但目前關于新型醫用鈦合金的研究較少。
4.3 多孔化技術
多孔化方法可以進一步降低彈性模量至與人體骨骼相匹配的水平,且多孔結構及粗糙的表面有利于成骨細胞的黏附、增殖和分化,促進新骨組織的再生與重建,加快愈合過程。此外,多孔鈦合金受到應力作用時,還存在較長的應力平臺區,可以有效地緩沖外來應力,起到減震和抗沖擊效果[99]。目前,醫用多孔鈦合金制備方法主要有液態成孔法、固態成孔法、氣態成孔法和水溶液成孔法,其中以固態成孔法中的粉末冶金法的研究和應用最多。Rao等[100]利用NH4HCO3作為發泡劑,將TiH2與Nb,Zr粉末復合,制備出不同孔隙率(6.06%~62.80%)的多孔Ti-20Nb-15Zr合金,其力學性能與孔隙率及孔洞大小密切相關,彈性模量在1.2~10.8 GPa之間。邵燁[101]利用粉末冶金法制備了多孔Ti-39Nb-6Zr鈦合金,彈性模量低至3.5 GPa左右。研究發現,隨著孔隙率的提高,多孔材料的壓縮強度和彈性模量急劇下降;粉末粒度對多孔材料的屈服強度和彈性模量也有一定的影響,在相同孔隙率下,粉末越細,多孔材料的力學性能越好。王璽涵等[102]在常規粉末冶金法的基礎上對成形方法和燒結工藝進行了優化,制得的多孔Ti-24Nb-4Zr-8Sn合金孔隙率為20%~30%,彈性模量為6~20 GPa,抗壓強度為140~432 MPa,與人體皮質骨相當。Nouri等[103]采用粉末冶金法制備多孔Ti-4Nb-16Sn合金,獲得的彈性模量為0.3~2 GPa,抗壓強度為7~14 MPa,與人體松質骨的力學性能基本接近。粉末冶金法多用于制備形狀簡單的多孔鈦合金,其生產工藝簡單,工藝參數可控性強,制備孔隙率范圍寬,但孔隙結構不易控制,必須對工藝參數進行精確調控,才能獲得優異的綜合性能。此外,還可利用增材制造技術制備復雜形狀的多孔鈦合金,并對孔隙結構進行精細調控,制備的Ti-35Nb-2Ta-3Zr合金兼具低模量(約3.1 GPa)和超彈性[104]。
4.4 表面改性技術
鈦合金是生物惰性材料,植入生物組織后會在表面形成纖維膜,影響與周圍組織間的結合。另外,鈦合金在體內長期服役時,有可能產生有害的金屬顆粒或碎屑,這些微粒容易與體液發生化學反應,導致局部組織磨損,產生炎癥和毒性反應等。因此,對鈦合金植入物進行表面改性,提高鈦合金的生物活性、耐磨性、耐腐蝕性和生物學行為等,研究其與生物組織之間的相互作用和微觀機制,是醫用鈦合金重要的研究方向。用于生物醫用金屬材料的表面改性技術主要有機械法(研磨、拋光和表面噴丸等)、物理法(離子注入、激光表面改性和物理氣相沉積等)、化學法(電化學處理、微弧氧化和化學氣相沉積等)和生物化學法等[98]。目前對鈦合金表面改性主要關注其改性后的生物學性能,主要研究對象為純鈦和Ti-6Al-4V。有學者[105-107]分別將苯乙烯磺酸鈉、甲基硅氧烷、醋酸乙烯酯等引入鈦表面,大幅度提高了涂層的生物活性。Rychly等[108]利用植入材料與細胞之間基體透明質酸帶負電的特性,在鈦合金表面嫁接功能化氨基,引導成骨細胞,進而引導骨形成。而采用細胞學和分子生物學方法將蛋白質、細胞生長因子和酶等固定在支架表面,可有效提高鈦合金植入物的血液相容性,減少并發癥,引導內皮細胞快速準確定向生長,加快植入物內皮化速度。將具有生物活性的分子固定在血管內支架,可以明顯地降低纖維蛋白原的吸附、沉積以及血小板的活化,表現出極好的生物相容性。Huang等[109]通過表面機械處理在TLM鈦合金上形成納米和超細晶粒的β-Ti層,納米晶層的成骨細胞黏附、增殖、成熟和礦化能力顯著增強。在Ti-35Nb-2Ta-3Zr表面通過微弧氧化和攪拌摩擦加工分別形成致密的Nb2O5和TiO2微/納米復合層,極大地改善了其耐腐蝕性,攪拌摩擦加工還細化了表層晶粒,進一步增加了表面氧化層的致密度[110-111]。對Ti-Nb基鈦合金進行表面改性提高其生物學性能,將促進Ti-Nb基鈦合金在生物植入物領域的應用。
4.5 增材制造技術
增材制造技術又稱3D打印技術,可以對植入物進行三維個性化設計,高效率制造復雜結構產品,還可以引入多孔結構,并對孔隙直徑和分布進行針對性設計[112]。增材制造技術已經逐漸成為高端個性化醫療器械設計、制造和醫用的重點發展趨勢[113]。目前主要的增材制造技術有激光選區燒結(selective laser sintering,SLS)、激光近凈成形(laser near net shaping,LENS)、電子束熔化成形(electron beam melting,EBM)和激光選區熔化(selective laser melting,SLM)等。在醫學領域,目前的研究工作主要集中在Ti-6Al-4V這一傳統醫用鈦合金[114],對低彈性模量亞穩β鈦合金的研究報道較少。Fischer等[115]利用SLM技術制備了二元Ti-26Nb(原子分數/%)合金,其力學性能與傳統熔煉制備的Ti-26Nb(原子分數/%)合金相近。Hernandez等[116]采用EBM技術制備了塊體Ti-24Nb-4Zr-8Sn,在β基體中觀察到了厚度為60 nm左右的板條狀α″相,合金的硬度約為2.5 GPa。Yang等[117]采用SLM方法制備了具有雙峰晶粒結構的Ti-24Nb-4Zr-8Sn,表現出比鍛造態合金更高的強度和塑性。Liu等[118]采用SLM和EBM制備了多孔Ti-24Nb-4Zr-8Sn支架,彈性模量僅為0.95 GPa。Hariharan等[119]通過調控增材制造工藝和后續熱處理制度,在Ti-13Nb-13Zr中保持較低彈性模量的同時,實現了良好的強塑性匹配。最近,Kong等[120]對Ti,Nb,Ta和Zr純元素粉末進行混合和SLM打印,制備的合金具有較高的強塑性和生物相容性。由于增材制造特殊的凝固和冷卻過程,增材制造亞穩β鈦合金的組織結構隨著合金成分和工藝參數發生明顯的變化。近期Alabort等[2]提出了基于最優增材制造工藝參數和低彈性模量合金成分要求的醫用β鈦合金設計與制備方法,采用該方法研發的新型β鈦合金具有較大的工藝窗口,獲得了強度、塑性和彈性模量的良好匹配。利用患病部位的CT掃描成像輔助三維建模,增材制造技術可以制造個性化的鈦合金醫療器械[121]。于振濤等[122]利用有限元分析了鈦合金材料、多孔結構對梯度多孔材料力學性能的影響,最后通過激光選區熔化技術制備出類骨小梁組織的多孔TLM鈦合金植入物。
5 結束語
提高生物相容性和力學相容性是發展生物醫用鈦合金的重要目標。以Ti-Nb基為代表的醫用亞穩β鈦合金具有優異的生物相容性、低彈性模量和良好的功能特性等特點,在醫用植入材料領域有著廣闊的應用前景。但采用傳統的合金設計與制備方法往往難以兼具低彈性模量和高強度的匹配。目前進入臨床應用的亞穩β型醫用鈦合金只有少數幾種,進一步降低β鈦合金的彈性模量,提高強度、疲勞性能和功能特性等綜合性能是擴大其應用的關鍵,建議可以從以下方面進行深入研究:(1)深入研究多元合金中元素之間的交互作用機理及其對相結構穩定性、彈性模量和強韌性的影響機制,明確Zr,Sn和O等元素的β穩定作用及其與其他合金元素的交互作用機制;(2)開展兼具高強度和低彈性模量的鈦合金設計與制備技術研究,探索合金的成分設計與組織性能調控方法,研究β單相和α+β雙相鈦合金的微觀組織特征對彈性模量、屈服強度、耐磨性能和疲勞性能等綜合力學性能的影響,揭示不同相含量和相結構穩定性耦合下鈦合金的微觀力學機制;(3)探索基于大塑性變形、增材制造等工藝特點的合金成分設計方法和制備技術,研究不同工藝條件下亞穩β鈦合金的組織演變及其對力學性能和功能特性的影響機制,開發綜合性能優異的醫用亞穩β鈦合金及其醫療器械。

