干擾lncRNA ROR1-AS1通過調節miR-504抑制人肝癌細胞株增殖、遷移和侵襲的研究
烏吉斯古楞,張文華,張彤
肝癌是全球范圍內最常見的致命惡性腫瘤,發病率逐年增加,在發展中國家發病率較高[1-2]。探究肝癌的發病機制,并尋找分子靶向藥物已成為當前的研究熱點。長鏈非編碼RNA(long non-coding RNA,lncRNA)可在肝臟微環境和慢性肝臟疾病的調節中發揮關鍵作用,能夠調節免疫反應、肝臟再生和氧化還原信號,lncRNA失調可導致慢性肝炎、肝臟增生和氧化應激,最終導致肝癌的發生和進展[3]。長鏈非編碼RNA酪氨酸蛋白激酶跨膜受體1反義RNA 1(tyrosine protein kinase transmembrane receptor 1 antisense RNA 1,ROR1-AS1)在肝細胞癌中表達上調,且與患者臨床分期、T分期及N分期有關,ROR1-AS1高表達與不良預后有關[4]。但ROR1-AS1對肝癌細胞增殖、遷移、侵襲的調控機制尚不清晰。微小RNA-504(microRNA-504,miR-504)在肝細胞癌組織和細胞系中下調,miR-504通過介導FZD7/Wnt/β-catenin通路在肝癌中發揮抑癌作用[5]。基于上述研究推測ROR1-AS1可能通過靶向miR-504參與肝癌疾病進展,本研究對此展開探討,報道如下。
1 材料與方法
1.1 材料 (1)組織標本:選取2019年6月—2021年5月于內蒙古醫科大學附屬醫院肝膽外科收治肝癌患者32例,患者均無放、化療史。術中收集患者癌組織及癌旁組織(距手術切緣≥3 cm,病理檢測證實無癌細胞)標本。本項研究符合《世界醫學協會赫爾辛基宣言》,且經醫院倫理委員會審核、批準(20190711),患者及家屬知情同意并簽署知情同意書。(2)細胞系及試劑:人肝細胞癌MHCC97H細胞株(中國科學院上海細胞生物學研究所);si-NC、si-ROR1-AS1、miR-NC、miR-504 mimics、anti-miR-NC及anti-miR-504質粒均由上海吉瑪制藥技術有限公司提供;三磷酸甘油醛脫氫酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)、細胞周期蛋白依賴性激酶抑制劑1A(p21)、基質金屬蛋白酶2(matrix metalloproteinase 2,MMP-2)、MMP-9、上皮型鈣黏附素(E-cadherin)兔單克隆抗體及Luciferase Reporter Assay底物試劑盒均由英國Abcam公司提供;LipofectamineTM2000試劑盒、Trizol試劑(美國Invitrogen公司);逆轉錄試劑盒(日本TaKaRa公司)。(3)儀器設備:顯微鏡(GMM-900,上海光密儀器有限公司);酶標儀(SpectraMax iD5,上海美谷分子儀器有限公司)。
1.2 實驗方法 采用RPMI 1640培養基(含10%胎牛血清),在97%濕度、5%CO2、37℃環境下培養MHCC97H細胞。培養基每2~3 d更換1次,當細胞匯合度至80%~90%時,胰蛋白酶消化后傳代。將對數期MHCC97H細胞接種于6孔板,密度調整至1×105個/孔,細胞匯合度達60%時,分別將si-ROR1-AS1、si-NC、miR-504 mimics、miR-NC、si-ROR1-AS1和anti-miR-504、si-ROR1-AS1和anti-miR-NC轉染至MHCC97H細胞,記為si-ROR1-AS1組、si-NC組、miR-504 mimics組、miR-NC組、si-ROR1-AS1+anti-miR-504組及si-ROR1-AS1+anti-miR-NC組,采用LipofectamineTM2000試劑盒進行轉染。24 h后更換培養基,繼續培養24 h,收集細胞備用。
1.3 觀測指標與方法
1.3.1 qRT-PCR檢測ROR1-AS1、miR-504表達:將患者癌組織、癌旁組織標本移植于液氮預冷的研缽體中,研磨成粉末狀,并收集人肝細胞癌MHCC97H細胞,經PBS清洗后,分別加入TRIzol試劑1 ml,然后上下翻動細胞、組織粉末,以保證混合均勻后,靜置10 min,使核酸蛋白復合物完全分離。分別再加入氯仿、異丙醇,翻動混勻后靜置5 min,離心吸取上清液于EP管中,留取RNA沉淀,最后提取MHCC97H細胞及患者癌組織、癌旁組織樣本中總RNA,并檢測其純度和濃度,然后按逆轉錄試劑盒說明書操作合成cDNA,并采用熒光定量PCR試劑盒和PCR儀進行PCR反應,反應體系:cDNA 1 μl、SYBR Green Mix 10 μl、上下游引物各0.5 μl、ddH2O 8 μl。反應條件:95℃ 10 min、95℃ 15 s、58℃ 30 s、72℃ 30 s,共計30個循環。于熒光定量PCR儀上擴展,2-△△Ct法計算ROR1-AS1、miR-504的相對表達量。引物序列見表1。

表1 ROR1-AS1、miR-504及相應內參GAPDH、U6的引物序列
1.3.2 細胞克隆形成實驗:將轉染相應質粒后的各組MHCC97H細胞接種于6孔板(5 000個/孔),培養基每2 d更換1次。培養14 d后,甲醛固定30 min,結晶紫染色1 h并風干。于顯微鏡下觀察并記錄細胞克隆數。
1.3.3 MTT法檢測細胞增殖:將轉染相應質粒后的各組MHCC97H細胞接種于96孔板(2.5×104個/孔),培養24 h,加入MTT(5 g/L)20 μl,孵育4 h,加入二甲基亞砜150 μl,低速震蕩,于酶標儀490 nm處測定吸光度值(A),計算細胞存活率=A實驗組/A對照組×100%。
1.3.4 Transwell檢測細胞遷移、侵襲:向各組細胞中加入RPMI 1640培養基(不含胎牛血清),并調整細胞濃度為5×104個/ml。遷移實驗:取上述細胞懸液100 μl加入Transwell小室上室中,RPMI 1640培養基(含10%胎牛血清)500 μl加入下室。培養48 h,經多聚甲醛固定、結晶紫染色后,倒置顯微鏡下觀察、計數。侵襲實驗:采用RPMI 1640培養基稀釋預冷的Matrigel基質膠(8∶1),并鋪于Transwell上室,晾干后加入上述細胞懸液100 μl。后續步驟與遷移實驗相同。
1.3.5 Western-blot法檢測MMP-2、MMP-9、p21及E-cadherin蛋白表達:RIPA試劑提取細胞總蛋白,二喹啉甲酸(bicinchoninic acid,BCA)法測定蛋白濃度。將蛋白煮沸使其變性,行聚丙烯酰胺凝膠電泳,各泳道上樣量為30 μg。蛋白分離后,移至聚偏(二)氟乙烯(PVDF)膜,5%脫脂奶粉封閉2 h,洗膜,分別置于MMP-2、MMP-9、p21、E-cadherin抗體孵育液中,4℃過夜。再加入二抗孵育液,37℃孵育2 h。ECL顯影,Quantity One凝膠軟件分析結果。
1.3.6 雙熒光素酶報告實驗驗證ROR1-AS1與miR-504的靶向關系:Starbase數據庫預測ROR1-AS1、miR-504是否存在結合位點。根據ROR1-AS1、miR-504結合區域序列,構建ROR1-AS1野生型(WT)及突變型(MUT)質粒,并分別轉染miR-504 mimics、miR-NC,培養48 h后,檢測熒光素酶活性。
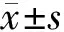
2 結 果
2.1 肝癌組織與癌旁組織ROR1-AS1、miR-504的表達比較 肝癌患者癌組織中ROR1-AS1水平高于癌旁組織(P<0.01),miR-504水平低于癌旁組織(P<0.01),見表2。
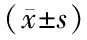
表2 肝癌組織及癌旁組織中ROR1-AS1、miR-504表達比較
2.2 抑制ROR1-AS1對MHCC97H細胞增殖、遷移、侵襲及蛋白的影響 與si-NC組比較,si-ROR1-AS1組ROR1-AS1水平、克隆形成數、細胞存活率、遷移細胞數、侵襲細胞數、MMP-2、MMP-9蛋白水平下降(P<0.01),miR-504、p21蛋白、E-cadherin蛋白水平升高(P<0.01),見圖1、2,表3、4。
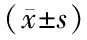
表3 抑制ROR1-AS1對MHCC97H細胞增殖、遷移、侵襲的影響

圖1 各組MHCC97H細胞克隆形成、遷移、侵襲情況比較(結晶紫染色,×200)

注:A.si-NC組;B.si-ROR1-AS1組;C.miR-NC組;D.miR-504 mimics組;E.si-ROR1-AS1+anti-miR-NC組;F.si-ROR1-AS1+anti-miR-504組
2.3 過表達miR-504對MHCC97H細胞增殖、遷移、侵襲的影響 與miR-NC組比較,miR-504 mimics組MHCC97H細胞的克隆形成數、細胞存活率、遷移細胞數、侵襲細胞數、MMP-2、MMP-9蛋白水平降低(P<0.01),miR-504、p21蛋白、E-cadherin蛋白水平增高(P<0.01),見圖1、2,表5。
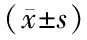
表4 抑制ROR1-AS1對MHCC97H細胞增殖、遷移、侵襲相關蛋白表達的影響
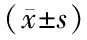
表5 過表達miR-504對MHCC97H細胞增殖、遷移、侵襲及相關蛋白的影響
2.4 ROR1-AS1靶向調控miR-504表達 Starbase數據庫預測,ROR1-AS1與miR-504存在互補序列,見圖3。雙熒光素酶報告結果顯示,與共轉染WT-ROR1-AS1和miR-NC比較,共轉染WT-ROR1-AS1和miR-504 mimics的熒光素酶活性降低(P<0.01),見表6。

圖3 ROR1-AS1與miR-504的靶向序列預測

表6 2組細胞熒光素酶活性比較
2.5 干擾miR-504表達逆轉ROR1-AS1對MHCC97H細胞增殖、遷移、侵襲及相關蛋白表達的作用 與si-ROR1-AS1+anti-miR-NC組比較,si-ROR1-AS1+anti-miR-504組細胞克隆形成數、細胞存活率、遷移細胞數、侵襲細胞數及MMP-2、MMP-9水平升高(P<0.01),miR-504、p21蛋白、E-cadherin蛋白水平下降(P<0.01),見圖1、2,表7。
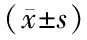
表7 干擾miR-504表達逆轉ROR1-AS1對MHCC97H細胞增殖、遷移、侵襲及相關蛋白表達的影響
3 討 論
肝癌中異常表達的lncRNA對miRNA、mRNA和蛋白質發揮多效作用,通過改變miRNA、mRNA的表達和穩定性,以及影響蛋白質表達、結構、降解或與轉錄調節因子的相互作用來影響多種癌癥表型[6]。因此,探究lncRNA在肝癌中的分子機制,可為肝癌的靶向治療提供新的方向。ROR1-AS1是近年來發現的lncRNA,主要位于細胞核中,可能參與基因轉錄的表觀遺傳調控過程,首次在套細胞淋巴瘤中被發現,可通過與EZH2和SUZ12相互作用發揮致癌作用[7]。Wang等[8]研究發現,ROR1-AS1在結腸癌組織或細胞系中均高表達,具有增強細胞增殖、加速細胞周期、抑制細胞凋亡的作用,可能通過與EZH2結合下調DUSP5影響結腸癌的發生發展。本研究結果顯示,ROR1-AS1在肝癌組織中表達增高,提示ROR1-AS1在肝癌進展中可能起促進作用。此外,干擾ROR1-AS1表達后,MHCC97H細胞的克隆形成數、細胞存活率、遷移及侵襲細胞數降低,提示干擾ROR1-AS1表達可抑制肝癌細胞增殖、遷移和侵襲。MMP-2、MMP-9可參與細胞外基質、基底膜降解過程,對細胞遷移、侵襲具有促進作用[9]。p21能夠參與調控細胞周期,發揮腫瘤抑制作用,其高表達可抑制細胞增殖[10]。E-cadherin表達下降可降低細胞間的黏附作用,從而導致細胞脫落、遷移[11]。本研究結果顯示,與si-NC組比較,si-ROR1-AS1組MMP-2、MMP-9蛋白水平下降,p21、E-cadherin蛋白水平升高,提示干擾ROR1-AS1表達可能通過調控MMP-2、MMP-9、p21、E-cadherin蛋白水平從而抑制肝癌細胞增殖、遷移、侵襲。
lncRNA可充當miRNA“海綿”,抑制miRNA表達,并通過轉錄因子或修飾酶復合物調節基因轉錄[12-15]。通過搜索Starbase數據庫發現,miR-504可能是ROR1-AS1的靶基因。此外,ROR1-AS1過表達可誘導骨肉瘤MG-63細胞遷移,促進N-鈣黏蛋白和波形蛋白的表達,抑制E-鈣黏蛋白的表達。雙熒光素酶測定證明,ROR1-AS1與miR-504存在靶向關系,ROR1-AS1過表達可抑制MG-63細胞中miR-504的表達,miR-504過表達可消除ROR1-AS1對骨肉瘤細胞遷移和增殖的部分影響[16]。本研究亦通過雙熒光素酶實驗驗證,miR-504是ROR1-AS1的靶基因。miR-504在胃癌組織中高表達,可通過靶向RBM4促進胃癌細胞增殖、抑制細胞凋亡[17];miR-504過表達可抑制膠質母細胞瘤細胞的遷移、侵襲、上皮間質轉化等惡性行為,miR-504低表達與患者間充質亞型轉變及較差的生存期有關[18]。以上研究顯示,miR-504可在多種惡性腫瘤中發揮不同作用。本研究結果顯示,肝癌組織中miR-504表達下調,提示miR-504在肝癌中發揮抑癌作用。同時,過表達miR-504可抑制肝癌細胞增殖、遷移、侵襲能力,并下調MMP-2、MMP-9蛋白表達,上調p21、E-cadherin蛋白表達,再次證明miR-504的抗肝癌作用,且這種抗癌作用可能與調控相關蛋白表達有關。此外,沉默ROR1-AS1可導致miR-504表達升高,而抑制miR-504表達可減弱沉默ROR1-AS1對MHCC97H細胞增殖、遷移、侵襲的影響,進一步證實miR-504是ROR1-AS1的靶基因。
綜上所述,ROR1-AS1在肝癌組織中表達上調,抑制ROR1-AS1表達可能通過靶向miR-504抑制肝癌MHCC97H細胞的增殖、遷移及侵襲。
利益沖突:所有作者聲明無利益沖突
作者貢獻聲明
烏吉斯古楞:課題實驗設計,實施研究過程,論文審核;張文華:分析實驗數據,論文撰寫;張彤:論文終審,論文撰寫

