不同形態厭氧氨氧化污泥低溫保存的性能差異研究
彭正華,楊本芹,楊志宏,詹友生,潘學軍
不同形態厭氧氨氧化污泥低溫保存的性能差異研究
彭正華,楊本芹*,楊志宏,詹友生,潘學軍
(昆明理工大學環境科學與工程學院,云南 昆明 650500)
厭氧氨氧化污泥的保存對其后續在反應器的脫氮過程有著重要的影響,因此,本研究針對不同形態的厭氧氨氧化污泥—生物膜和顆粒污泥的低溫保存性能開展研究.結果表明,在64d 4℃的保存后,生物膜和顆粒污泥的厭氧氨氧化比活性分別降至(351.4±14.5),(32.3±2.7)mgN/(gVSS×d),分別為初始活性的62.1%和6.0%.EPS含量分別減少至(18.4±0.3)mg/gVSS和(13.3±1.5)mg/gVSS.生物膜和顆粒污泥中厭氧氨氧化功能菌屬豐度分別減少為6.1%和1.6%,厭氧氨氧化菌16S rRNA豐度分別降低為(1.48±0.29)×108gene copies/gVSS和(5.05±1.53)×107gene copies/gVSS.在后續的活性恢復過程中生物膜相較于顆粒污泥達到NRR為0.54kgN/m3/d花費周期縮短了15d.因此,厭氧氨氧化生物膜是比顆粒污泥更好的保存形態.
厭氧氨氧化;保存;細胞胞外聚合物(EPS);微生物群落結構
厭氧氨氧化脫氮工藝是當下的研究熱點.由于其具有高脫氮率、低污泥產率和不需要額外的碳源和曝氣,厭氧氨氧化成為當前最有應用潛力的生物脫氮工藝[1].然而,厭氧氨氧化過慢的生長過程和對環境的極敏感性導致其啟動周過長,進而影響了其在實際廢水處理中的應用[2].因此,在反應器中直接補充厭氧氨氧化污泥是一種高效的啟動厭氧氨氧化反應器的方式[3].然而,可用來作為接種污泥的全尺寸厭氧氨氧化設備在全球也只有110多個[2].所以這導致厭氧氨氧化污泥不可避免地需要進行運輸.在此過程中如何有效地保存厭氧氨氧化污泥的活性是一個重要的課題.
針對厭氧氨氧化污泥的保存已存在大量研究.厭氧氨氧化污泥的保存溫度是重要的影響因素,不同的保存溫度對厭氧氨氧化污泥產生不同的影響.研究表明高溫會增加細胞凋亡,而過的低溫則可能導致不可逆的細胞損傷,4℃下保存厭氧氨氧化污泥擁有最好的活性且有著最短的活性恢復周期[4-6].由于厭氧氨氧化細菌生長緩慢,因此利用厭氧氨氧化菌易于團聚的特性形成顆粒污泥或在反應器中添加填料形成生物膜[7-8],提升厭氧氨氧化微生物停留時間加速厭氧氨氧化啟動周期.已有大量研究針對厭氧氨氧化顆粒污泥的保存過程的研究,顆粒污泥都可以良好地保存污泥的厭氧氨氧化活性并可以恢復其活性[4-6,9].然而,針對厭氧氨氧化生物膜的保存過程研究較少.Kaewyai等[10]將厭氧氨氧化生物膜在4℃下保存了164d之后進行活性恢復,在經過44d的恢復后厭氧氨氧化生物膜的NRR之恢復到保存前的26%.而在其他的兩項研究中只進行K1填料和生物轉盤厭氧氨氧化生物膜的保存實驗,結果表明分別在30d和100d的保存后其比厭氧氨氧化活性(SAA)分別為保存前的92%和31%[11-12].然而這些研究都只針對某一種形態的厭氧氨氧化污泥的保存及恢復過程進行研究,對于保存形態之間的差異缺乏研究.
因此,本文對厭氧氨氧化生物膜和厭氧氨氧化顆粒污泥的保存過程開展研究,考察保存過中厭氧氨氧化活性、細胞外多聚物、微生物群落結構及其酶活性變化,并對進行活性恢復過程的研究,以找到厭氧氨氧化污泥更好的保存形態,為之后的應用過程提供理論基礎.
1 材料與方法
1.1 原始厭氧氨氧化顆粒污泥及填料
厭氧氨氧化顆粒污泥及厭氧氨氧化生物膜來自于實驗室所培養的10L UASB反應器,反應器在(35±1)℃下運行1年多,氮負荷率(NLR)為0.6kg·N/ (m3·d),氮去除率(NRR)為(0.52±0.2)kg·N/(m3·d).其中,厭氧氨氧化生物膜填料為聚氨酯海綿,尺寸為1×1×1cm,孔徑在0.6~1.5mm,孔隙率為96%~99%,比表面積為105m2/m3.
1.2 污泥存儲及恢復實驗
將顆粒污泥及生物膜填料從反應器中取出后,用0.1M的磷酸鹽緩沖液(PBS)沖洗3次,以去除基質及其他物質的干擾.之后將600mL的厭氧氨氧化污泥和600個生物膜填料分別平均分為4份裝入試劑瓶在4℃下保存.前三份污泥和生物膜填料分別于保存的14d、32d和64d取出測定其相關性質,第四份用于64d保存后的活性恢復實驗.
活性恢復時,將污泥及生物膜填料從瓶中取出,分別放入兩個UASB反應器中,其中加入生物膜和顆粒污泥的反應器分別標記為R1和R2.這兩個反應器容積均為200mL,通過水套保持溫度在(35±1)℃,水利停留時間(HRT)為24h.運行過程中應用模擬廢水,模擬廢水配方如文獻所示[3].其中NH+ 4-N和NO- 2-N初始濃度分別為25mg/L,等反應器可穩定去除后逐步提升至150mg/L.
1.3 測試方法
樣品中的NH+ 4-N、NO- 2-N、NO- 3-N、TN、SS和VSS的測定方法根據國家標準法測定[13].SAA利用文獻所報道的方法[14].細胞外多聚物(EPS)的提取利用樹脂法提取,采用蒽酮比色法測定多糖含量,用BCA法測定蛋白質(碧云天BCA 濃度測定試劑盒)[15].利用熒光光譜儀(F-7000,Hatchi 公司)測定提取的EPS樣品進行三維熒光(3D-EEM)測定分析,參數與文獻一致[16].之后利用平行因子(PARAFAC)法對對EPS的熒光光譜進行分析[17].
1.4 微生物群落結構分析
分別在0d、14d、32d和64d取污泥及生物膜上的污泥樣品進行微生物群落測定.采用Illumina Misep測序平臺對樣品中的微生物進行測序分析,包括DNA提取、PCR擴增、Miseq文庫構建和Miseq測序,其中使用338F(5′-ACTCCTACGGGAGG- CAGCAG-3′)和806R(5′-GGACTACHVGGGTW- TCTAAT-3′)對16S rRNA基因V3~V4可變區進行PCR擴微,生物測序過程委托上海美吉生物醫藥科技有限公司完成.測序結果已上傳至NCBI數據庫,編號為PRJNA858682.
對這些樣品中的全菌、厭氧氨氧化16S rRNA、、進行定量分析,采用ABI Step One擴增儀(Thermo Fisher,美國)進行qPCR擴增及檢測,表1列出了用于擴增擴增基因的引物及相關信息.反應體系為25μL,其中包括:12.5μL SYBR qPCR Mix (High ROX) (艾德萊,北京,中國),1μL DNA樣品,0.5μL正反引物,10.5μL ddH2O.
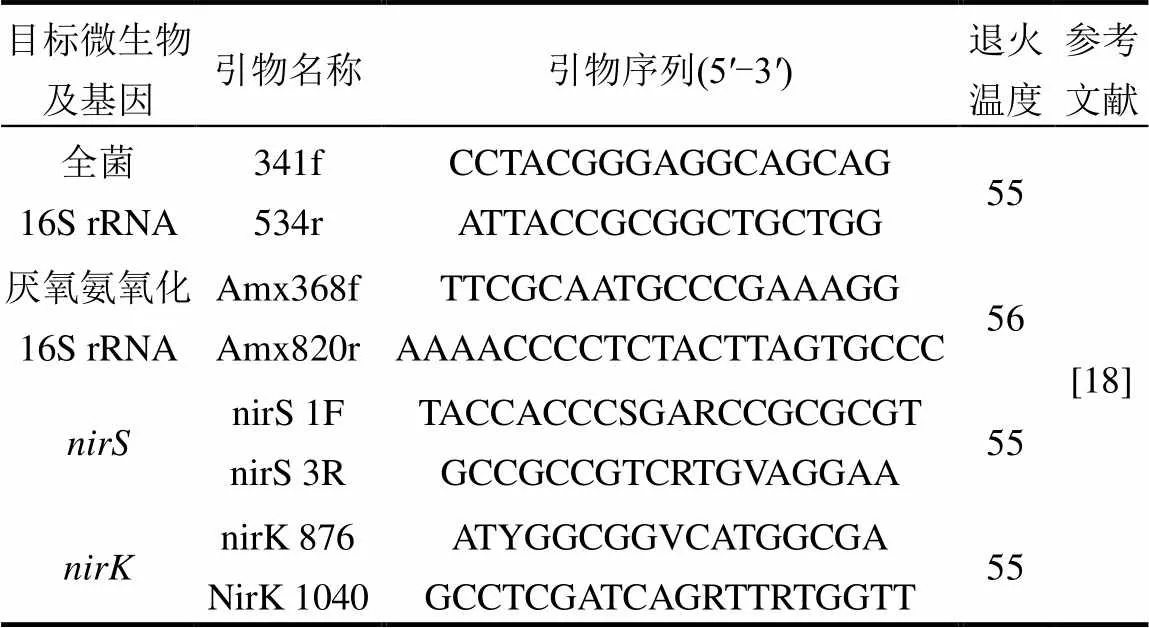
表1 qPCR目標基因引物序列及退火溫度
1.5 酶活測試方法
對初始樣品及保存過程14,32,64d的樣品進行肼脫氫酶(HDH)、亞硝酸鹽還原酶(NIR)及亞鐵血紅素 c(Heme c)的測定.酶液的提取及測定方法根據Yin等[19]的研究.
1.6 數據分析方法
所有數據利用IBM SPSS 20進行差異性及相關性分析.
2 結果與討論
2.1 污泥活性變化
SAA作為生物活性指標,代表了厭氧氨氧化細菌的代謝活性.如圖1所示,厭氧顆粒污泥及生物膜填料保存前的活性分別為(536.1±22.0)mg·N/ (gVSS·d)和(565.7±24.9)mg·N/(gVSS·d),兩者之間不存在顯著差異(<0.05,ANOVA).隨著保存過程逐步進行,顆粒污泥及生物膜填料的SAA都逐步下降,生物膜填料的SAA剩余率在14、32和64d分別為81.1%、68.8%和62.1%,而顆粒污泥的SAA剩余率則分別為51.1%、30.3%和6.0%.在儲存過程中生物膜填料的SAA減小量明顯小于顆粒污泥的減小量.這說明生物膜填填料在4℃的保存過程中更容易保留厭氧氨氧化的活性.
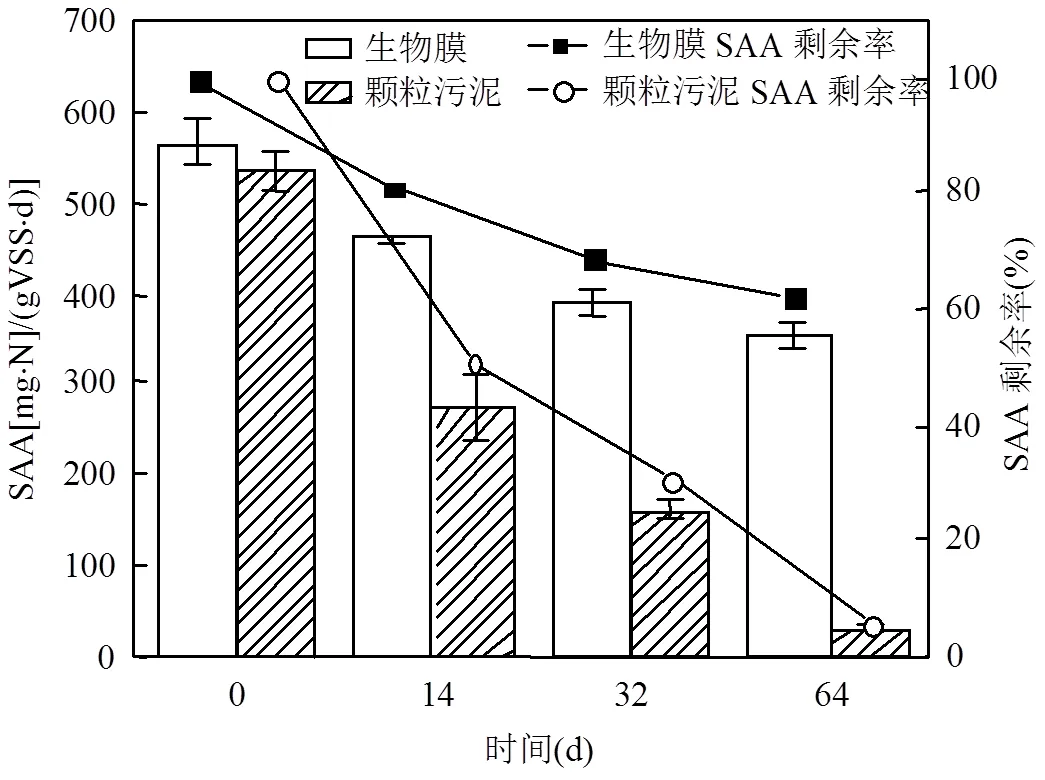
圖1 保存過程中SAA的變化
2.2 污泥中EPS及其熒光特性變化
2.2.1 污泥中EPS含量變化 EPS是一種由微生物細胞自身所分泌的生物聚合物,主要有蛋白質(PN)和多糖(PS)組成,其對顆粒污泥和生物膜的形成過程及保持其結構穩定性有著重要的影響作用.因此,本研究對保存過程中顆粒污泥及生物膜中的EPS含量進行了測定,結果如圖2所示.保存前的生物膜和顆粒污泥的EPS含量分別為(35.8±0.2)mg/gVSS和(43.4±0.3)mg/gVSS,顆粒污泥的EPS含量更多.在4℃ 64d的保存后,厭氧氨氧化顆粒污泥和生物膜中的EPS含量都明顯呈下降趨勢,分別減少至(13.3± 1.5)mg/gVSS和(18.4±0.3)mg/gVSS.這是由于在儲存過程中微生物所產生的EPS被用于內源代謝進以維持微生物的穩定進而分解減少[14].
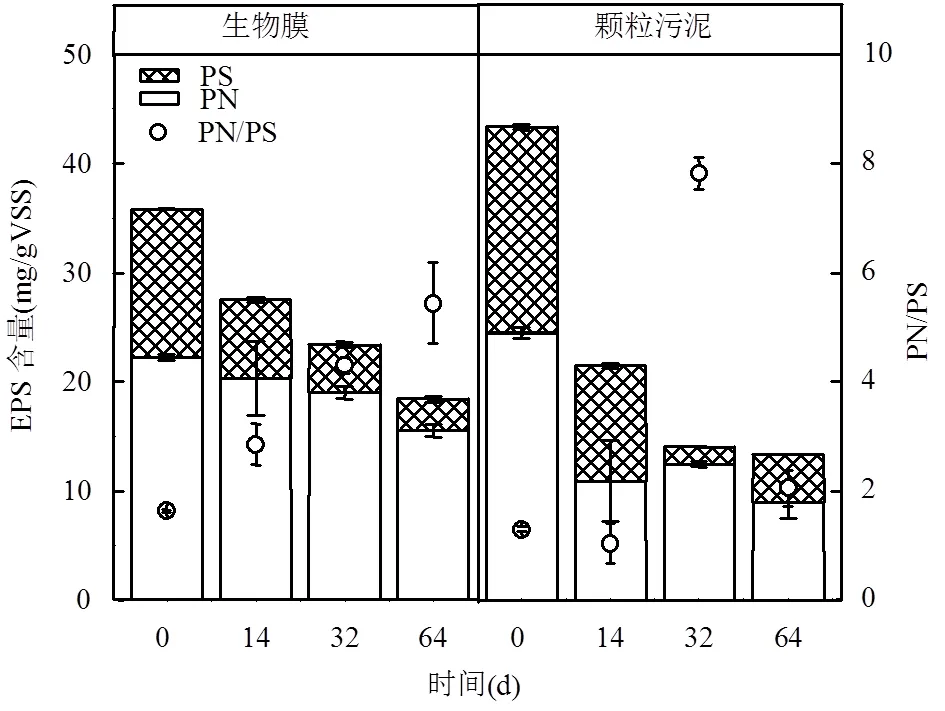
圖2 儲存過程中EPS變化
在生物膜中PN的含量從初始的(22.2±0.2)mg/ gVSS逐步的下降為14d的(20.4±3.4)mg/gVSS、32d的(19.0±0.6)mg/gVSS和64d的(15.5±0.6)mg/gVSS.而PS的含量則從初始的(13.62±0.04)mg/gVSS至14,32,64d分別減少為(7.1±0.2)mg/gVSS、(4.4± 0.3)mg/gVSS和(2.9±0.3)mg/gVSS.其中,PS的減少比例明顯高于PN,表示生物膜中的微生物在內源代謝過程中更容易利用PS.之前的研究表明在饑餓條件下生物膜EPS中的PS相較于PN更容易被利用[20].同時,由于PS的含量減少的更多,PN的含量變化不大.因此,生物膜中的PN/PS逐步增加,從保存前的1.6分別增加到(2.9±0.4)(14d)、4.3(32d)和5.4 (64d).
與生物膜中EPS的減少過程不同,顆粒污泥中EPS的減少量沒有明顯的規律.在保存14d后,PN和PS的分別從(24.5±0.5)mg/gVSS和(18.9±0.3)mg/ gVSS減少為(10.9±3.7)mg/gVSS和(10.5±0.2)mg/ gVSS.在此過程中PN和PS都被用于微生物內源代謝過程.而從14d至32d的保存過程中,PS則出現明顯下降,相較于14d的PS含量減少了84.87%.在32d至64d的保存過程中PS含量增加了172.4%,PN含量則減少了28.1%.相應的PN/PS也從初始的(1.30±0.05)分別變化為(1.04±0.37) (14d)、(7.82±0.29) (32d)和(2.06±0.32) (64d).厭氧氨氧化顆粒污泥的PN/PS對其沉降性能及穩定性都存在著影響.然而厭氧氨氧化顆粒污泥的PN/PS數值變化從小于1至15都有存在[8],且不同的接種污泥及運行條件都會對厭氧氨氧化污泥的PN/PS產生影響[21].Xing等[7]的研究表明在4℃的保存過程中顆粒污泥EPS的PN/PS呈現下降趨勢.而本研究中顆粒污泥EPS的PN/PS最終為增加的過程,這可能與微生物的群落結構及其代謝過程相關,需要進一步的研究.
相較于生物膜在儲存過程中主要消耗PS為主,顆粒污泥的儲存過程中PN和PS都會被消耗.根據研究表明在顆粒污泥中PN主要起將微生物凝聚在一起的作用,PS起穩定顆粒結構的作用,且兩者作用才能使顆粒污泥的結構穩定[15,22].然而,在保存過程中由于顆粒污泥EPS中PN和PS的含量都降低,引起了整個顆粒污泥結構的變化,導致其結構穩定性變差更容易裂解,無法有效保留更多的微生物.相較于顆粒污泥,生物膜形成過程中主要依靠PN對微生物的黏附作用[23].然而生物膜中PN并未大量降解,因此功能微生物更容易被保留下來.
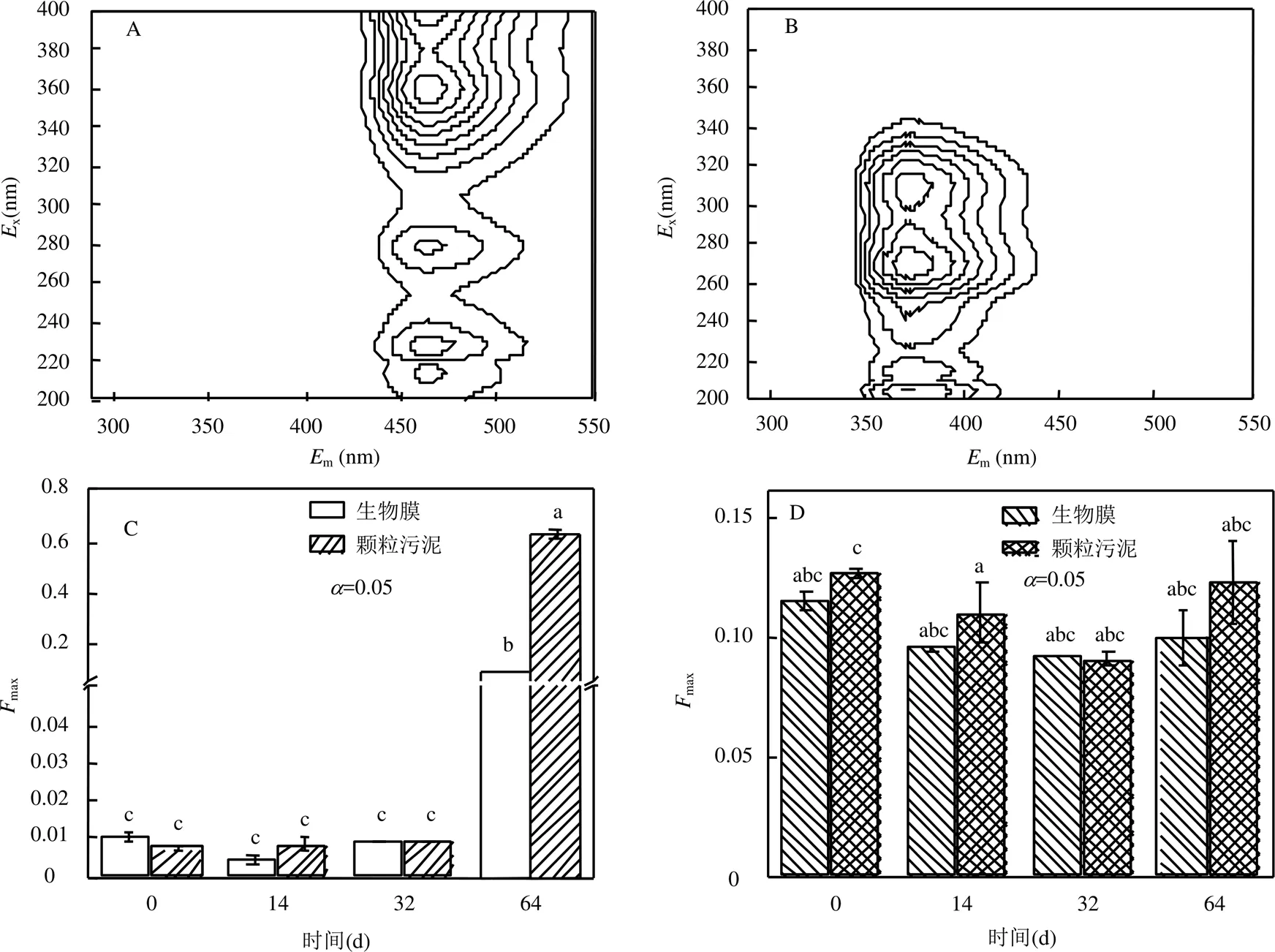
圖3 EPS 3D-EEM-PARAFAC組分及其Fmax變化圖. (A,C)組分1熒光圖及Fmax值變化,(B,D)組分2熒光圖及Fmax值變化
2.2.2 污泥EPS的熒光特性 EPS中所具有的物質通常包含具有熒光性的基團,可以通過這些熒光性的基團分析EPS在反應過程中成分、含量和種類的變化情況,因此對EPS進行3D-EEM分析.應用PARAFAC模型對保存不同階段EPS的3D-EEM進行分析,可以分辨出兩種主要組分(圖3).組分1的所在的激發(x)/發射(m)為(215,230, 280,360)/436,這種物質主要為類腐殖酸和類富里酸類物質,主要是由微生物裂解死亡后所產生[24].同時,應用PARAFAC模型可以得到不同組分的最大熒光鋒強度(max),max值被用于評價不同組分物質的含量.組分2所在位置的x/m則是(205,270,310)/370,此類物質代表的是微生物所產生的蛋白類物質[24].在整個保存過程中,除了顆粒污泥在初始14d的保存過程中組分2的Fmax從0.13減少至(0.11±0.01),有著顯著差異(<0.05, ANOVA).其余各個階段組分2的max值無明顯變化(>0.05,ANOVA).而在保存的32d內,無論是生物膜EPS還是顆粒污泥EPS中的組分1的Fmax值都沒有發生明顯的變化(> 0.05,ANOVA).當保存到第64d時,生物膜和顆粒污泥EPS中組分1的max值分別增加至0.11和(0.62± 0.02).相較于保存過程前32d中組分1的Fmax值有著顯著的提升,且顆粒污泥EPS中組分1的max值更高.這表明在32~64d的保存過中微生物大量死亡產生,且在顆粒污泥中微生物的死亡更多.因此,相較于顆粒污泥,生物膜更有利于保存更多的微生物.
2.3 微生物群落結構變化
2.3.1 微生物群落結構變化 對保存過程中厭氧氨氧化生物膜及顆粒污泥中的微生物進行高通量測序得到其中的微生物群落結構變化.門水平下的微生物群落結構如圖4A所示.無論是厭氧氨氧化生物膜還是顆粒污泥,其中變形菌門(Proteobacteria)、綠灣菌門(Chloroflexi)、浮霉菌門(Planctomycetota)和擬桿菌門(Bacteroidota)都為優勢菌門,且四種菌門總豐度都超過80%.其中Planctomycetota是厭氧氨氧化微生物所屬的門,其豐度在生物膜及顆粒污泥的保存過程中都逐漸在減少.生物膜中的豐度從0d的20.7%分別減少為14d、32d和64d的15.1%、16.6%和11.5%.而在顆粒物中其豐度則是從保存前的20.3%分別減少到7.2%(14d)、7.3%(32d)、6.1%(64d).結果表明生物膜可以更好的保存厭氧氨氧化菌.Proteobacteria、Chloroflexi和Bacteroidota是厭氧氨氧化顆粒污泥、絮體和生物膜中最常出現的微生物菌門[25].Proteobacteria是除0d顆粒污泥外所有樣品中豐度最高的菌門,豐度在40.9%~65.1%變化.大量異養微生物及反硝化菌屬于Proteobacteria,其可以利用NO- 2-N或NO- 3-N進行代謝和增殖活動,并消耗溶解氧和有機物為厭氧氨氧化細菌創造適宜的生存環境[25].Chloroflexi在厭氧氨氧化顆粒污泥形成過程中作為載體讓其他微生物附著生長,為顆粒污泥的結構的穩定起到重要的作用[26].而Bacteroidota在顆粒污泥形成過程中負責構建網狀結構以增強顆粒穩定性[27].Chloroflexi和Bacteroidota在生物膜中從0d的豐度和為22.3%分別下降為14d、32d和64d的20.7%、19.7%和18.2%.保存前的顆粒污泥中Chloroflexi和Bacteroidota是豐度和為42.9%,其后在分別轉變為30.3%(14d)、31.5%(32d)和18.0%(64d).在整個保存過程中各個階段顆粒污泥中除64d外Chloroflexi和Bacteroidota的豐度和都高于生物膜,尤其是未保存前.這是由于顆粒污泥形成過程中需要更多此類功能微生物用于形成網狀結構和作為載體以提升其強度[8],而生物膜的形成主要是通過微生物黏附在載體膜材料上[23].因此,在顆粒污泥中Chloroflexi和Bacteroidota的豐度和更高.同時,隨著保存時間增加,顆粒污泥會出現解體現象,這使得起結構支撐作用的Chloroflexi和Bacteroidota兩者總體豐度減少.
微生物群落分布的屬水平結構分布如圖4B所示,其為屬豐度的對數熱圖.是出現在生物膜及顆粒污泥中唯一的厭氧氨氧化細菌.在保存前生物膜及顆粒污泥中的豐度分別為16.3%和16.8%.隨著保存周期增加,生物膜中的豐度逐漸減少為12.6%(14d)、11.4%(32d)和6.1%(64d),而在顆粒物污泥中其豐度變化為3.8%(14d)、4.0%(32d)和1.6%(64d).在保存過程中,生物膜中的豐度始終高于顆粒污泥.這可能是由于生物膜有著更好的截留特性,可以保留更多的厭氧氨氧化細菌[28].而在顆粒污泥在保存過程中由于EPS的減少及骨架微生物的減少進而導致其顆粒結構被破壞,無法保留厭氧氨氧化細菌.除了厭氧氨氧化細菌外,反硝化細菌也在生物膜及顆粒污泥中大量出現,典型的屬有、、、.在生物膜保存過程中的豐度在12.2%~19.7%變化,而在顆粒污泥中其豐度則在0.5%~1.3%變化.結果表明更容易在生物膜上生長.與相反,在顆粒污泥中的豐度(3.5%~24.8%)比生物膜中更高(0~1.8%).異養微生物在微生物群落中也占有著重要成分,主要包括和13.在生物膜和顆粒污泥的豐度分別在7.1%~12.0%和7.9%~13%.作為異養微生物可以使不受到外部氧氣、有機物等不利因素的影響,同時可以作為污泥絮體的主干[29].13經常出現在厭氧氨氧化污泥中,且其所屬于綠灣菌門,可以以絲狀生物質的形式強化顆粒的結構穩定性[30].
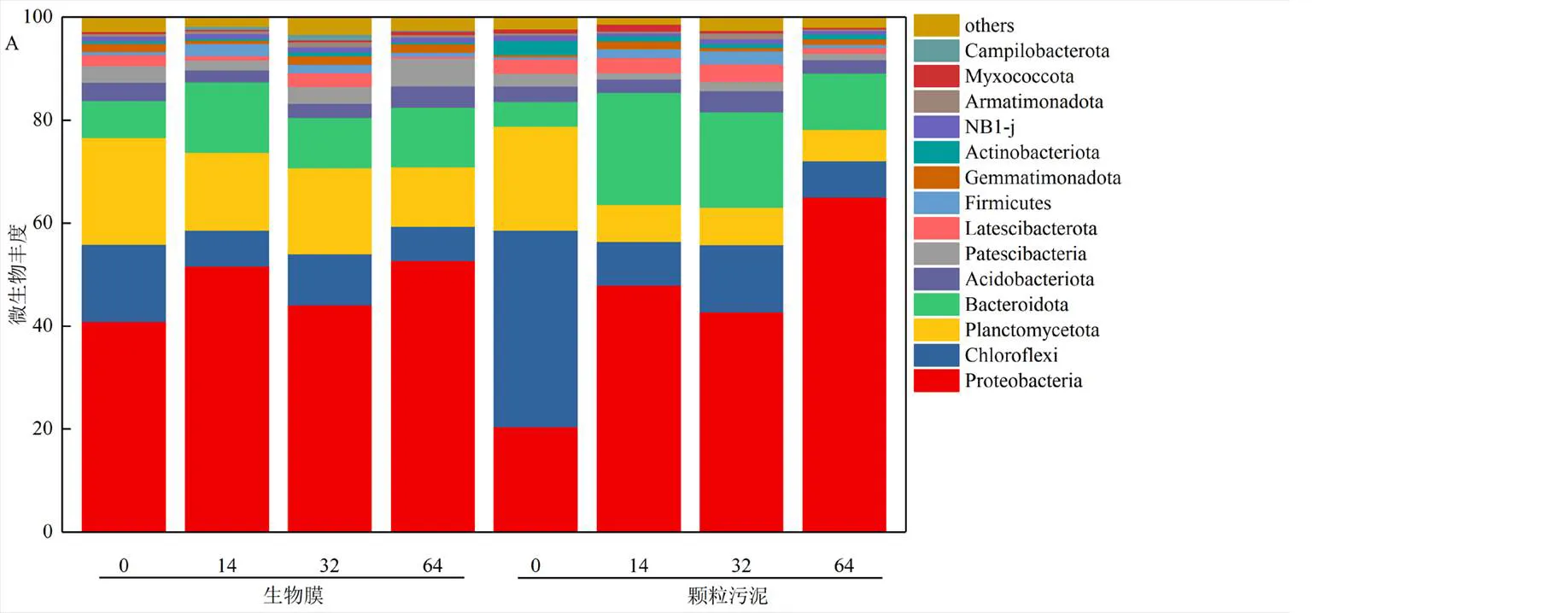
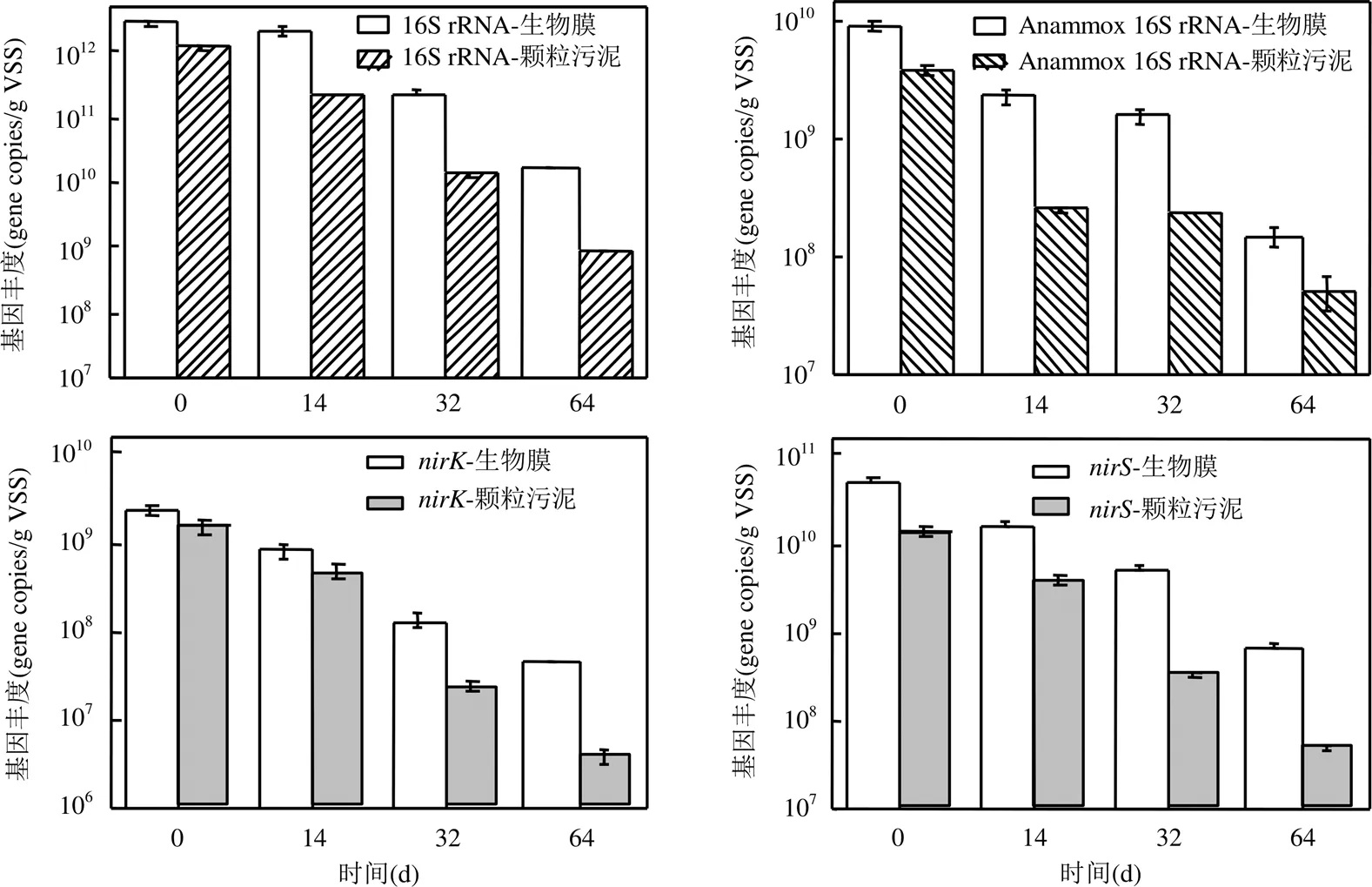
圖5 保存過程功能基因豐度
2.3.2 功能基因變化 利用qPCR來分析保存過程中特定微生物及基因的變化情況,結果如圖 5所示.其中選取16S rRNA來表示樣本中所有細菌的數量,利用Anammox 16S rRNA來表示厭氧氨氧化微生物的數量.和代表著亞硝酸鹽還原酶,這兩種基因既在反硝化細菌中出現也在厭氧氨氧化細菌中出現[19].qPCR結果顯示保存前生物膜和顆粒污泥中全菌豐度為(2.74±0.03)×1012gene copies/gVSS和(1.2±0.09)×1012gene copies/gVSS.在保存過程中全菌的豐度逐漸下降,直至64d分別減少為(1.64± 0.02)×1010gene copies/gVSS和(8.69±0.61)×108gene copies/gVSS.結果表明在此過程中細菌總量大幅度減少,生物膜中的全菌豐度保存過程中始終顯著地高于顆粒污泥中的豐度(<0.01,ANOVA).因此,生物膜在保存過程中可以保留更多的微生物.在保存過程中厭氧氨氧化菌的豐度與全菌豐度變化過程相似,在各個階段在生物膜上的厭氧氨氧化菌的豐度都明顯的高于其在顆粒污泥中的豐度.到64d時生物膜和顆粒污泥中厭氧氨氧化菌豐度分別降低為(1.48±0.29)×108gene copies/gVSS和(5.05±1.53)× 107gene copies/gVSS.厭氧氨氧化菌的qPCR豐度變化與的豐度變化呈正相關(=0.86,<0.01, Spearman),這表明兩者有著良好的一致性.和的豐度也隨著保存過程進行逐漸降低,且降低過程中生物膜中的豐度始終高于顆粒污泥的豐度.總之,在保存過程中生物膜相較于顆粒污泥可以保存更多的功能微生物.
2.4 酶活變化
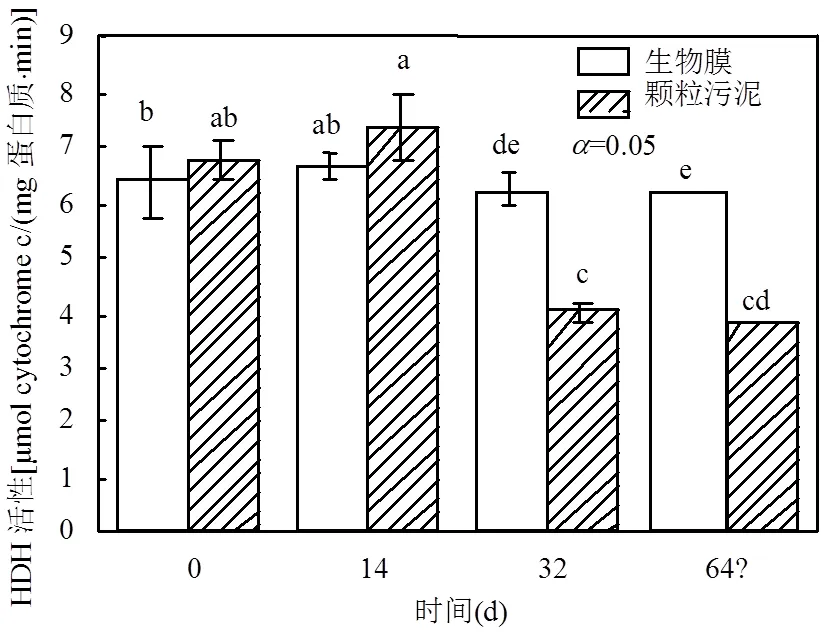
厭氧氨氧化過程中涉及到多種酶參與其中,酶活性的變化對厭氧氨氧化的脫氮效果有著重要的影響.本研究考察了,HDH、Heme c和NIR三種酶活性的變化.其中,HDH是催化肼轉化為氮氣的關鍵步驟,其主要成分為可溶性多種血紅素組成的細胞色素c的復合物[31].而細胞血色素c參與厭氧氨氧化細菌的電子轉移過程,其主要是通過Fe2+還原和Fe3+氧化循環完成電子的轉移[31].如圖6所示,保存前的生物膜及顆粒污泥中HDH活性分別為(6.42± 0.64)μmol cytochrome c/(mg蛋白質×min)和(6.80± 0.39)μmol cytochrome c/(mg蛋白質×min),兩者不存在顯著差異(>0.05,ANOVA).隨著保存周期增長,生物膜和顆粒污泥中的HDH活性分別下降至初始活性的96.95%和45.7%.結果表明生物膜中污泥HDH活性顯著地高于顆粒污泥中的活性.
Heme c是細胞色素c的關鍵輔基之一[31],且HDH種包含192個血紅素(Heme)[32].生物膜和顆粒污泥儲存前Heme c的含量分別為(4.6±0.23)μmol/ gVSS和(5.2±0.38)μmol/gVSS.生物膜在保存之后的14d、32d和64d Heme c的含量分別下降至初始的89.18%、80.92%和75.36%.而顆粒污泥則在保存的14d、32d和64d分別減少為保存前的81.28%、53.39%和19.07%.在保存過程中厭氧氨氧化菌屬的豐度與Heme c的含量存在正相關(=0.74,<0.05,Spearman),且HDH活性和Heme c含量之間也存在正相關(=0.88,<0.01, Spearman).此結果表明生物膜相較于顆粒污泥可以截留保存住更多厭氧氨氧化微生物是Heme c含量更高的原因.同時,Heme c的含量與顆粒污泥的色度存在著正相關[31].因此,在保存過程中顆粒污泥逐漸從紅色轉變為黑色,與Heme c的變化一致.
NIR可將亞硝酸鹽轉化為一氧化氮的酶.在整個儲存過程中微生物填料污泥中NIR活性都顯著地高于顆粒污泥NIR的活性.之前的研究表明厭氧氨氧化生物膜污泥中NIR的活性都高于厭氧氨氧化污泥中的活性,且當溫度下降時厭氧氨氧化生物膜也有著更好的NIR活性.NIR活性與的豐度也存在著正相關(=0.74,<0.05, Spearman).
2.5 污泥活性恢復過程
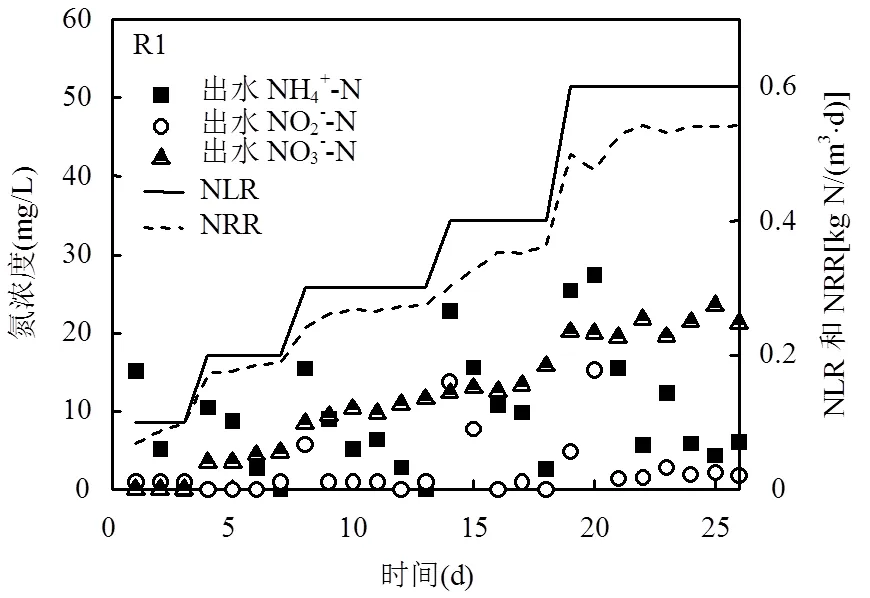
將保存64d后的厭氧氨氧化生物膜和顆粒污泥分別裝入UASB反應器中進行活性恢復實驗.初始進水NH+ 4-N和NO- 2-N的濃度為25mg/L,R1和R2出水中NH+ 4-N濃度分別15.1mg/L和17.6mg/L,都未超過進水中NH+ 4-N濃度.這是由于保存后的生物膜和顆粒污泥都存在厭氧氨氧化活性.隨著恢復過程的繼續,生物膜及顆粒污泥中厭氧氨氧化活性逐漸恢復,出水NH+ 4-N和NO- 2-N濃度逐步下降.當反應器處理效果穩定后通過增加進水NH+ 4-N和NO- 2-N濃度來提升反應器的負荷.提升負荷后,出水NH+ 4-N和NO- 2-N濃度都有所上升,然而在R1和R2中NRR基本都在持續上升.結果表明在活性恢復階段,厭氧氨氧化生物膜及厭氧氨氧化顆粒污泥的活性在持續提升.之后,R1通過25d的恢復可以在NLR為0.6kgN/m3/d時NRR達到0.54kgN/m3/d,去除率達到90%.表明厭氧生物膜已恢復且就有良好的厭氧氨氧化能力.在同樣的25d,R2在NLR為0.40kgN/m3/d, NH+ 4-N和NO- 2-N的出水濃度為36.0mg/L和30.3mg/L,總氮去除率為64.2%.雖然R2也恢復了厭氧氨氧化能力,但是處理能力低于R1.R2在NLR為為0.6kgN/m3/d時,總氮除率達到90%則需要花費40d.因此,在厭氧氨氧化活性恢復過程中,生物膜相較于顆粒污泥有著更高效的恢復過程.
3 結論
3.1 經過64d 4℃的保存后,厭氧氨氧化生物膜和厭氧氨氧化顆粒污泥的SAA分別為(351.4± 14.5)mgN/(gVSS×d)和(32.3±2.7)mgN/(gVSS×d),分別為初始活性的62.1%和6.0%,厭氧氨氧化生物膜能夠更好保存形式.
3.2 保存過程中生物膜利用更多的EPS截留更多的厭氧氨氧化菌,而顆粒污泥由于EPS及造粒微生物(Chloroflexi和Bacteroidota)無法有效的截留厭氧氨氧化菌.
3.3 恢復過程中當NRR達到0.54kgN/(m3×d)生物膜所需周期相較于顆粒污泥所需周期可縮短37.5%.
[1] Li J, Li J, Peng Y, et al. Insight into the impacts of organics on anammox and their potential linking to system performance of sewage partial nitrification-anammox (PN/A): A critical review [J]. Bioresource Technology, 2020,300:122655.
[2] Huang D, Fu J, Li Z, et al. Inhibition of wastewater pollutants on the anammox process: A review [J]. The Science of the Total Environment, 2022,803:150009.
[3] Chen H, Hu H, Chen Q, et al. Successful start-up of the anammox process: Influence of the seeding strategy on performance and granule properties [J]. Bioresource Technology, 2016,211:594-602.
[4] Huang D, Wang Y, Wu Q, et al. Anammox sludge preservation: Preservative agents, temperature and substrate [J]. Journal of Environmental Management, 2022,311:114860.
[5] Ji Y, Jin R. Effect of different preservation conditions on the reactivation performance of anammox sludge [J]. Separation and Purification Technology, 2014,133:32-39.
[6] Xing B, Guo Q, Jiang X, et al. Influence of preservation temperature on the characteristics of anaerobic ammonium oxidation (anammox) granular sludge [J]. Applied Microbiology and Biotechnology, 2016, 100(10):4637-4649.
[7] Adams M, Xie J, Kabore A W J, et al. Research advances in anammox granular sludge: A review [J]. Critical Reviews in Environmental Science and Technology, 2022,52(5):631-674.
[8] Adams M, Xie J, Xie J, et al. The effect of carrier addition on Anammox start-up and microbial community: a review [J]. Reviews in Environmental Science and Bio/Technology, 2020,19(2):355-368.
[9] Chen H, Jin R. Summary of the preservation techniques and the evolution of the anammox bacteria characteristics during preservation [J]. Applied Microbiology and Biotechnology, 2017,101(11):4349- 4362.
[10] Kaewyai J, Noophan P L, Wantawin C, et al. Recovery of enriched anammox biofilm cultures after storage at cold and room temperatures for 164days [J]. International Biodeterioration & Biodegradation, 2019,137:1-7.
[11] Engelbrecht S, Fondengcap M T, Rathsack K, et al. Highly efficient long-term storage of carrier-bound anammox biomass [J]. Water Science & Technology, 2016,74(8):1911-1918.
[12] Vlaeminck S E, Geets J, Vervaeren H, et al. Reactivation of aerobic and anaerobic ammonium oxidizers in OLAND biomass after long- term storage [J]. Applied Microbiology and Biotechnology, 2007, 74(6):1376-1384.
[13] 國家環境保護總局.水和廢水監測分析方法[M]. 4版.北京:中國環境科學出版社, 2002.
The State Environmental Protection Administration. Water and wastewater monitoring and analysis method. Fourth Edition [M]. Beijing: China Environmental Science Press, 2002.
[14] 李鴻江,王 超,徐曉晨,等.AOB與AnAOB在不同生物填料上掛膜效果的研究 [J]. 中國環境科學, 2019,39(10):4141-4149.
Li H J, Wang C, Xu X C, et al. Biofilm formation of ammonia- oxidizing bacteria and anaerobic ammonium-oxidizing bacteria on different biocarriers [J]. China Environmental Science, 2019,39(10): 4141-4149.
[15] Hou X, Liu S, Zhang Z. Role of extracellular polymeric substance in determining the high aggregation ability of anammox sludge [J]. Water Research, 2015,75:51-62.
[16] 王衫允,賈方旭,靳鵬飛,等.高效厭氧氨氧化顆粒污泥脫氮特征及EPS分層特性[J]. 中國給水排水, 2016,32(11):35-39.
Wang S Y, Jia F X, Jin P F, et al. Nitrogen removal performance and EPS characteristics of anammox granular sludge with high activity [J]. China Water & Wastewater, 2016,32(11):35-39.
[17] He W, Hur J. Conservative behavior of fluorescence EEM-PARAFAC components in resin fractionation processes and its applicability for characterizing dissolved organic matter [J]. Water Research, 2015,83: 217-226.
[18] Sy A, Yp A, Sz B, et al. Carrier type induces anammox biofilm structure and the nitrogen removal pathway: Demonstration in a full- scale partial nitritation/anammox process [J]. Bioresource Technology, 2021:125249.
[19] Yin X, Qiao S, Zhou J. Using electric field to enhance the activity of anammox bacteria [J]. Applied Microbiology and Biotechnology, 2015,99(16):6921-6930.
[20] Zhang X, Bishop P L. Biodegradability of biofilm extracellular polymeric substances [J]. Chemosphere, 2003,50(1):63-69.
[21] 陳重軍,曹茜斐,鄒馨怡,等.厭氧氨氧化顆粒污泥EPS的作用,成分及影響因素研究進展[J]. 環境工程學報, 2022,16(2):381-389.
Chen C J, Cao Q F, Zou X Y, et al. Review on function, composition and influencing factors of EPS in anammox granular sludge [J]. Chinese Journal of Environmental Engineering, 2022,16(2):381-389.
[22] Ni S, Sun N, Yang H, et al. Distribution of extracellular polymeric substances in anammox granules and their important roles during anammox granulation [J]. Biochemical Engineering Journal, 2015, 101:126-133.
[23] Chen Z, Meng Y, Sheng B, et al. Linking exoproteome function and structure to anammox biofilm development [J]. Environmental Science & Technology, 2019,53(3):1490-1500.
[24] Jia F, Yang Q, Liu X, et al. Stratification of extracellular polymeric substances (EPS) for aggregated anammox microorganisms [J]. Environmental Science & Technology, 2017,51(6):3260-3268.
[25] Pereira A D, Cabezas A, Etchebehere C, et al. Microbial communities in anammox reactors: A review [J]. Environmental technology reviews, 2017,6(1):74-93.
[26] 宋壯壯,呂 爽,劉 哲,等.厭氧氨氧化耦合反硝化工藝的啟動及微生物群落變化特征[J]. 環境科學, 2019,40(11):5057-5065.
Song Z Z, Lv S, Liu Z, et al. Start-up of simultaneous ANAMMOX and denitrification process and changes in microbial community characteristics [J]. Environmental Science, 2019,40(11):5057-5065.
[27] 馬瑞婕,劉永紅,梁繼東,等.基于顆粒污泥的短程反硝化USB反應器啟動和運行研究 [J]. 中國環境科學, 2022,42(5):2129-2135.
Ma R J, Liu Y H, Liang J D, et al. Study on start-up and operation of USB reactor for partial denitrification based on granular sludge [J]. China Environmental Science, 2022,42(5):2129-2135.
[28] Peng Z, Lei Y, Liu Y, et al. Fast start-up and reactivation of anammox process using polyurethane sponge [J]. Biochemical Engineering Journal, 2022,177:108249.
[29] Wang C, Liu S, Xu X, et al. Achieving mainstream nitrogen removal through simultaneous partial nitrification, anammox and denitrification process in an integrated fixed film activated sludge reactor [J]. Chemosphere, 2018,203:457-466.
[30] Xu L, Zhang Q, Fu J, et al. Deciphering the microbial community and functional genes response of anammox sludge to sulfide stress [J]. Bioresource Technology, 2020,302:122885.
[31] Kang D, Li Y, Xu D, et al. Deciphering correlation between chromaticity and activity of anammox sludge [J]. Water Research, 2020,185:116184.
[32] Akram M, Dietl A, Mersdorf U, et al. A 192-heme electron transfer network in the hydrazine dehydrogenase complex [J]. Science Advances, 2019,5(4):v4310.
Characterization of anammox biofilm and anammox granular sludge at low temperature preservation.
PENG Zheng-hua, YANG Ben-qin*, YANG Zhi-hong, ZHAN You-sheng, PAN Xue-jun
(Faculty of Environmental Science and Engineering, Kunming University of Science and Technology, Kunming 650500, China)., 2023,43(2):658~666
The preservation of anammox microorganisms is essential since it affects the subsequent reactor performance in nitrogen removal. The characters of anammox biofilm and anammox granular sludge at low temperature preservation were examined in this study. Results showed that after 64days preservation at 4°C, the specific anammox activities were found to be (351.4±14.5) mgN/(gVSS×d) for anammox biofilm and (32.3±2.7) mgN/(gVSS×d) for anammox granular sludge, which were 62.1% and 6.0% of those before preservation. Their EPS content decreased to (18.4±0.3) and (13.3±1.5) mg/gVSS, respectively. Moreover, the abundance of functional anammox genus, Candidatus Kuenenia, decreased from 16.3% to 6.1% in anammox biofilm and decreased from 16.8% to 1.6% in anammox granular sludge. Their anammox gene abundance also decreased to (1.48±0.29)×108and (5.05±1.53)×107gene copies/gVSS, respectively. During the reactivation of anammox process by using those two preserved anammox microorganisms, the time used to reach the NRR of 0.54kgN/m3was lowered by 15days for anammox biofilm compared to that of anammox granular sludge showing the anammox biofilm was a better preservation form for anammox microorganisms than anammox granular sludge.
anammox;preservation;extracellular polymeric substances (EPS);microbial community
X703.5
A
1000-6923(2023)02-0658-09
彭正華(1994-),男,甘肅白銀人,昆明理工大學博士研究生,研究方向為污水處理技術.發表文章1篇.
2022-07-15
昆明理工大學高層次人才引進經費項目(10978191)
* 責任作者, 副教授, ynybq87@kust.edu.cn

