腹膜透析患者骨代謝與骨質疏松、腹主動脈鈣化的相關性
湯靜 陳蘊 王冬雪 陳安珉 黃建槐 夏文亞 馮錦紅
徐州醫科大學附屬醫院,江蘇 徐州 221006
慢性腎臟病-礦物質骨代謝異常(chronic kidney disease-mineral and bone disorder,CKD-MBD)是一種全身性綜合征,臨床表現主要是鈣、磷、甲狀旁腺激素(parathyroid hormone,PTH)和成纖維細胞生長因子(FGF-23)代謝紊亂,如不及時診治,將會導致骨代謝異常、血管鈣化(vascular calcification,VC)或其他軟組織鈣化的發生[1],更有甚者可能會增加患者的心血管事件和死亡率。近年來,“骨-血管軸”理論的提出表明VC與異常的骨轉換有關,其共同的病理生理機制驅動骨丟失、血管鈣化的發生[2]。臨床中腎性骨病特指CKD-MBD中的骨異常,其診斷的金標準是骨活檢,但因其是有創性檢查,不適用于日常臨床診療,使得檢測骨代謝標志物(bone turnover biomarkers,BTMs)成為臨床診斷腎性骨病的重要方法[3]。本研究旨在探討腹膜透析患者的血清BTMs水平與骨質疏松(osteoporosis,OP)、腹主動脈鈣化(abdominal aortic calcification,AAC)之間的關系,這可為臨床防治腹膜透析患者合并骨質疏松和監測VC嚴重程度提供更多理論依據。
1 資料與方法
1.1 研究對象
選取自2021年6月至2022年4月在我院進行規律腹膜透析治療≥3個月的患者80例。男45例,女35例,年齡19~78歲,記錄所有患者的臨床資料。排除以下患者:①既往行甲狀旁腺切除手術或有甲狀旁腺瘤患者;②近半年有服用類固醇糖皮質激素藥物的患者;③有骨腫瘤和(或)惡性腫瘤骨轉移病史者;④近12個月有骨折病史者;⑤合并有嚴重感染或心肺疾病者。患者對本研究均知情并簽署知情同意書。
1.2 方法
1.2.1血標本收集:清晨空腹、PD治療前留取血標本,檢測各項血生化指標:C反應蛋白(CRP)、白蛋白(ALB)、血清肌酐(Scr)、尿素氮(BUN)、腦鈉肽(BNP)、血磷 (P)、血鈣(Ca)、低密度脂蛋白(LDL)、高密度脂蛋白(HDL)等,計算鈣磷乘積(CPP)。
1.2.2骨代謝指標:Ⅰ型膠原氨基酸延長肽(TPINP)、骨堿性磷酸酶(BALP)、骨鈣素(OC)、β-膠原特殊序列(β-CTX)、甲狀旁腺激素(PTH)、25(OH)D。檢測方法:TPINP、β-CTX、OC、25(OH)D的測定采用電化學發光(ECL)(儀器為:羅氏Cobas e602)檢測。BALP、PTH的測定采用化學發光免疫測定(CLIA)(儀器為:貝克曼DXI 800)檢測。
1.2.3AAC評分測定:采用腰椎側位X線片評估患者的AAC。AACS是由兩位放射科醫生使用Kauppila等[4]鈣化積分法計算,取其平均值。根據AACS結果將患者分為3組:無鈣化組(AACS=0)、輕度鈣化組(AACS=1~4)和中重度鈣化組(AACS≥5)。
1.2.4骨質疏松診斷:使用GE雙能X線骨度儀(型號:DPX BRAVO)測定腰椎(L1-L4)、髖關節骨密度值(g/cm2)。采用WHO推薦的骨質疏松診斷標準[5]:①絕經女性和年齡50歲以上的男性根據T值診斷:若T值≤-2.5,則為骨質疏松;②絕經前女性和年齡50歲以下的男性根據Z值診斷:若Z值≤-2,則為低于預期年齡范圍,BMD低于預期年齡范圍的患者納入骨質疏松組[6]。
1.3 統計學處理
2 結果
80例腹膜透析患者年齡為50(36.25~59)歲;透析齡為25(12.75~41.75)個月。OP組腰椎骨密度、全髖骨密度明顯低于非OP組(P<0.01);OP組血清AACS、血P、CRP、β-CTX較非OP組明顯升高(P<0.05)。見表1。

表1 腹膜透析患者骨質疏松與非骨質疏松組比較Table 1 Comparison between osteoporosis and non-osteoporosis groups in peritoneal dialysis patients
按AACS分組,無鈣化組30例、輕度鈣化組29例、中重度鈣化組21例,三組患者的年齡、CRP、BNP、血P、CPP、β-CTX、PTH、腰椎骨密度比較,差異具有統計學意義(P<0.05)。其余生化指標比較差異均無統計學意義(P>0.05)。見表2。
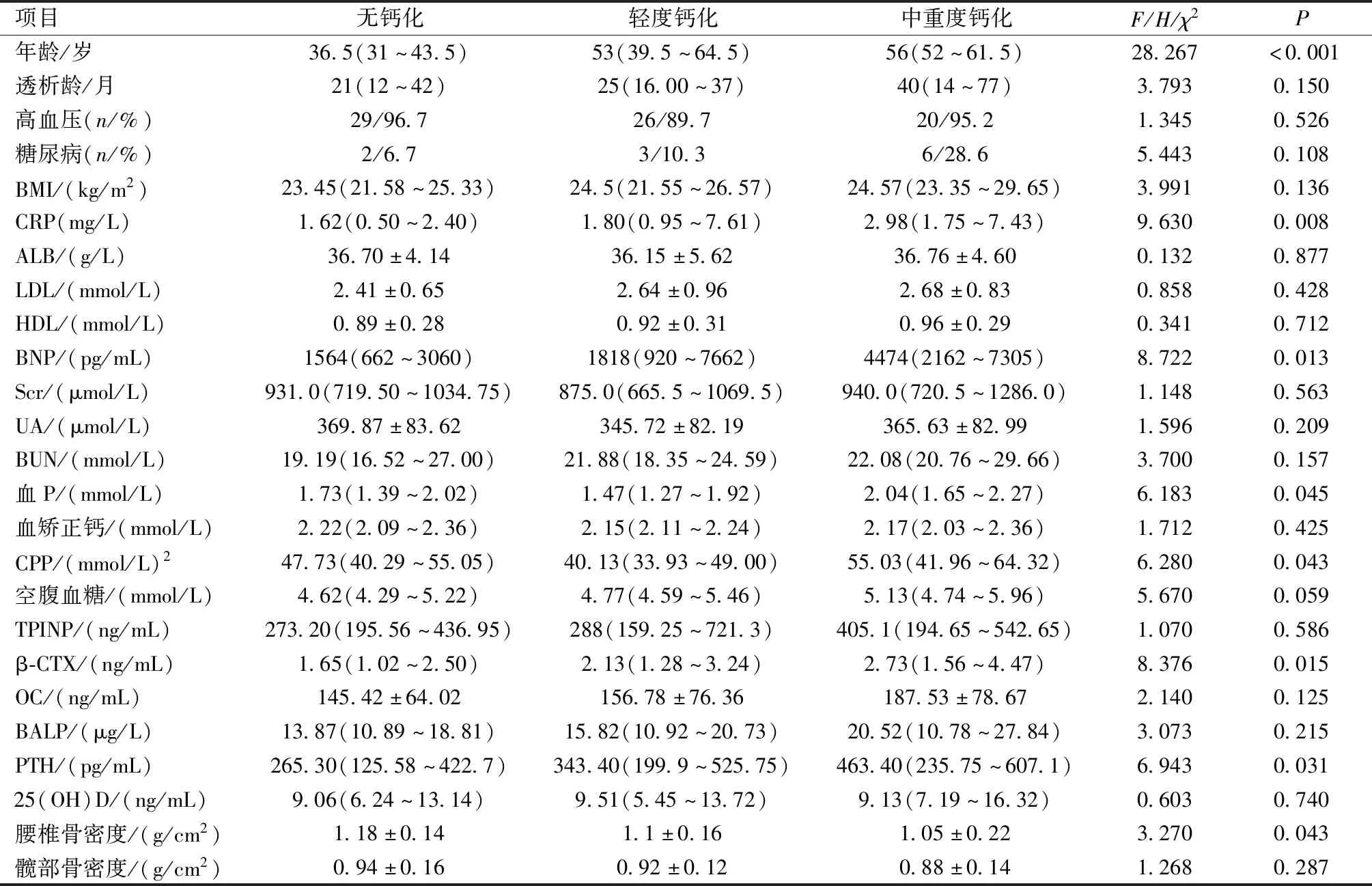
表2 AACS不同程度組臨床及實驗室數據比較Table 2 Comparison of clinical and laboratory data among different groups with AACS
在Spearman相關性分析中,PD患者AACS與腰椎骨密度呈負相關(r=-0.294,P=0.008),AACS與全髖骨密度無相關性。AAC與年齡、透析齡、BMI、CRP、BNP、空腹血糖、β-CTX、PTH呈正相關(P<0.05)。見表3。

表3 腹膜透析患者AACS與各參數間的相關性Table 3 Correlation between AACS and various parameters in peritoneal dialysis patients
以PD患者是否AACS≥5為因變量,調整透析齡、PTH后,二元Logistic回歸分析顯示年齡、CPP、β-CTX為AACS≥5分的獨立危險因素。見表4。
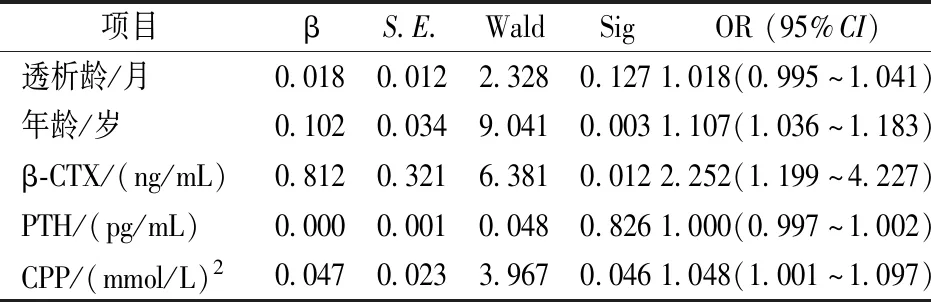
表4 腹膜透析患者AACS≥5 的多因素 Logistic 回歸分析Table 4 Multi-factor logistic regression analysis of AACS≥5 in peritoneal dialysis patients
以PD患者是否發生骨質疏松為因變量,二元Logistic多因素回歸分析發現β-CTX是其獨立危險因素(P=0.046,OR=1.689,95%CI:1.009~2.825),BALP差異無統計學意義(P>0.05)。見表5。

表5 腹膜透析患者并發骨質疏松的Logistic 回歸分析Table 5 Logistic regression analysis of peritoneal dialysis patients complicating osteoporosis
3 討論
血管鈣化和骨質疏松在ESRD患者中很常見,與普通人群相比,ESRD患者的骨骼代謝狀態、血管鈣化程度和早發的心血管事件有著更為緊密的聯系[7]。本研究發現骨代謝標志物β-CTX與AAC和OP有相關性。近年來大量研究表明VC是一種類似于骨重建的復雜生物學過程,其中血管平滑肌細胞(vascular smooth muscle cell,VSMC)向成骨樣細胞的轉分化被認為是最重要的病理生理因素[8]。而且血管鈣化和成骨過程有許多相似之處,骨骼通過旁分泌和內分泌因子與血管系統相互作用,途徑包括Wnt信號、骨保護素(OPG)/核因子JB受體激活劑(RANK)/RANK配體系統和Galectin-3/晚期糖基化終產物受體軸。由此可以看出VC不是被動礦化過程,而是細胞介導的主動礦化過程[7]。鈣化的血管釋放影響骨代謝的循環因子,骨代謝因子紊亂進而導致骨質疏松[9]。本研究還發現CRP與AAC呈正相關,與骨密度呈負相關。有研究表明VC和OP的共同發病機制是炎癥因子[2]。炎性因子可以通過激活Msx2-Wnt/β-catenin信號促進VSMC的鈣化,也可促進內皮細胞向間充質細胞轉變,此外炎癥也可能會抑制重要的鈣化抑制物胎球蛋白A。而且血管鈣化還會增加全身炎癥負擔,促進RANKL、M-CSF和單核細胞趨化蛋白-1的增加,并下調OPG的表達,導致骨吸收增加,骨重建障礙。進而觸發一種惡性循環,加速血管鈣化和骨質疏松進程[9-10]。
骨質疏松癥是一種以骨量和骨質量受損為特征的肌肉骨骼疾病,易增加骨折的風險。正在進行透析的患者骨折發生的風險是無慢性腎臟病患者的4倍以上[11]。骨質疏松的診斷以 BMD為基礎,但BMD無法反映患者短期內骨代謝情況,完全依賴BMD預測骨折可能會有滯后的風險,BTMs可反映短期內患者骨代謝狀況,有助于指導臨床治療[12]。BTMs包括骨吸收指標(β-CTX、TRACP-5b等)和骨形成指標(TPINP、BALP、OC等)[13-14]。本研究在Logistic多因素回歸分析時發現β-CTX是骨質疏松的獨立危險因素。這一結論可為腹膜透析患者提供除影像學以外的血清學指標來判斷骨損傷的程度。β-CTX是破骨細胞通過分泌蛋白酶降解I型膠原蛋白,釋放出N端和C端片段(分別為NTX和CTX)。CTX又分為α-CTX和β-CTX。其中β-CTX是骨吸收的重要血清學指標[15]。TPINP 是從Ⅰ型前膠原中去除產生Ⅰ型膠原的前肽之一,標志著形成新的骨基質[16]。骨堿性磷酸酶(BALP)是一種錨定在成骨細胞和基質小泡膜上的同源二聚體,由肝臟降解,其水平不受腎功能的影響。它參與了羥基焦磷酸鹽礦化為羥基磷灰石,繼而羥基磷灰石沉積在新形成的骨膠原纖維之間,它可促進體內血管鈣化的發生,是骨形成的敏感和特異性指標[17-18]。本研究同時發現β-CTX、BALP是腹膜透析患者發生OP的危險因素,提示腹膜透析合并OP患者體內破骨細胞活性較強,骨吸收亢進,這可能是因為腹膜透析患者長期處于微炎癥狀態和鈣磷代謝紊亂中所致。國外Nguyen等[19]報道骨質疏松患者的 PINP、β-CTX 水平升高,在多元線性回歸分析中調整性別、年齡和體重后,β-CTX與股骨頸和腰椎骨密度有相關性。Yan等[20]在一項對絕經女性的前瞻性隊列研究顯示PINP和β-CTX的升高可增加髖部骨折風險。結合本研究的結果,早期監測β-CTX對預測骨折具有重要價值[21]。
本研究發現β-CTX、年齡、CPP是AACS≥5分的獨立危險因素。當AACS>5.5分時,終末期腎臟病患者新發冠狀動脈疾病的幾率將大大增加[22]。Liu等[23]對中國1 023例老年患者研究發現骨密度、護骨素、骨鈣素和I型膠原的C端交聯末端肽(CTX)與VC進展有關。熊琳等[24]在慢性腎臟病大鼠身上研究發現血P、CPP升高和骨轉換異常會促進VC的發生和進展。高P會上調成骨細胞轉錄因子Osterix和Runx2,進而刺激VSMC向成骨細胞轉分化,推動VC的進程[25]。本研究顯示隨著β-CTX、CPP水平的增加,VC的程度會增加。這是因為骨代謝加快將會導致骨質釋放更多的鈣和磷,而且骨骼礦物受阻也會引起血中鈣磷增加。本研究同時發現在腹膜透析患者中腰椎骨密度與AAC呈負相關,與髖部骨密度無相關性。目前AAC與不同部位骨密度的關聯強度仍存在爭議,尚需進一步的研究[7]。
綜上所述,腹膜透析患者的β-CTX水平與AAC、骨密度密切相關,因此監測β-CTX有助于判斷腹膜透析患者心血管疾病、骨質疏松發生的風險。此外,本研究的樣本量有限,且屬于橫斷面研究,無法確定腹膜透析患者BTMs與OP、VC之間的因果關系,具有一定的局限性,易受其他混雜因素的影響,仍需大樣本的前瞻性研究來進一步證實。

