三種人工肝模式治療慢加急性肝衰竭晚期患者療效對比分析
呂云云
(內蒙古自治區人民醫院重癥醫學科,內蒙古 呼和浩特,010017)
肝衰竭是臨床常見危重癥,為多因素造成的肝功能受損,肝臟合成、排泄、生物轉換等功能出現嚴重障礙,發生以凝血障礙、肝性腦病、黃疸等為主要臨床癥狀的一種病癥。據調查,肝衰竭病死率高達73.5%[1]。目前,針對慢加急性肝衰竭患者,多以人工肝治療為主,主要是通過代替肝臟部分功能,進而為肝功能恢復提供基礎[2]。人工肝治療有多種治療模式,以血漿置換(PE)、分子吸附再循環(MARS)、雙重血漿分子吸附系統(DPMAS)最為常見,上述三種治療模式具有不同的臨床效果,本研究選取內蒙古自治區人民醫院收治的90 例慢加急性肝衰竭患者進行分析,研究PE、MARS、DPMAS 治療的臨床效果,闡述如下。
1 資料與方法
1.1 一般資料
選取2019 年1 月—2021 年1 月內蒙古自治區人民醫院收治的的90 例慢加急性肝衰竭患者作為研究對象,按照隨機數表法將患者分為PE 組、MARS 組和DPMAS 組,每組30例。其中PE 組男18 例,女12 例;年齡31~54 歲,平均年齡(42.51±5.63)歲;病程1~6 年,平均病程(3.62±0.27)年。MARS 組男19 例,女11 例;年齡31~55 歲,平均年齡(42.18±5.37)歲;病程1~6 年,平均病程(3.67±0.25)年。DPMAS 組男16 例,女14 例;年齡32~54 歲,平均年齡(42.39±5.47)歲;病程1~6 年,平均病程(3.54±0.23)年。三組一般資料比較,差異無統計學意義(P>0.05),有可比性。本研究經內蒙古自治區人民醫院醫學倫理委員會審核批準。患者對研究知情同意,自愿簽署知情同意書。
1.2 納入與排除標準
納入標準:①符合《肝衰竭診治指南(2018 年版)》[3]中相關疾病診斷標準者;②采取人工肝治療者;③年齡>18 歲;④首次發病者。
排除標準:①既往存在精神病史者;②患有腎、心等其他器官功能衰竭者;③伴血液系統疾病、自身免疫疾病、雙重感染等。
1.3 方法
1.3.1 設備與材料
①設備:選擇血液透析器210(生產企業:百特醫療用品公司);血液透析機(生產企業:德國費森尤斯公司,規格:4008S)。②材料:MARSFlux 主透析器與diaFlux 副透析器、IE250 陰離子樹脂吸附器、AE250 活性炭吸附器、BS330 膽紅素吸附柱與HA330-Ⅱ灌流器(生產企業:珠海健帆生物科技股份有限公司)、血漿分離器(生產企業:旭化成可樂麗醫療株式會社)。
1.3.2 治療方法
所有患者均接受人工肝治療。①PE 組患者采用 PE 治療。開始前,應建立循環通路,使用體外肝素化方式抗凝,給予患者2 000 mL/次血漿,速度:100~120 mL/min,分漿率:28%~30%,共治療39 次,平均1.30 次/例。②MARS 組患者采用MARS 治療。實施股靜脈插管,結束后留置單針雙腔導管,并給予低分子肝素鈣注射液(生產企業:Glaxo Wellcome Production,國藥準字H20181135,規格:0.3 mL∶3 075AXaIU)進行抗凝處理。利用血液凈化-人工肝支持系統,設置血漿置換量:1 500~2 500 mL/次,血流速度:120~150 mL/min,流量:100~120 mL/min,治療8 h/次,共39 次,平均1.30 次/例。③DPMAS 組采用DPMAS 治療。建立體外循環通路,疏通進行抗凝治療,血漿灌流量6 000 mL/次,時間3 h/次,灌注速度:100~120 mL/min,共治療39 次,平均1.30 次/例。三組患者均持續治療至出院。
1.4 觀察指標
①比較三組療效。療效評價標準,有效:治療后臨床癥狀明顯改善,腹水、肝腎綜合征等得到較好控制,血清總膽紅素降低≥40%;無效:治療后,臨床或生化指標未達到上述情況,或病情加重,發生并發癥,甚至死亡[4]。有效率=有效例數/總例數×100%。
②比較三組ALT、AST、PTA 指標。待患者空腹抽取10 mL靜脈血,選擇AU2700 型全自動生化分析儀檢測三組丙氨酸轉氨酶(ALT)、天冬氨酸轉氨酶(AST)指標變化情況,同時使用ACL7000 型血凝儀及配套試劑檢測凝血酶原活動度(PTA)。
③比較三組血細胞與電解質指標。以CoulterJT-IR 型全自動血細胞分析儀及配套試劑,測定血小板計數、血紅蛋白,并檢測兩組血鉀、血鈉、pH 變化情況。
1.5 統計學分析
2 結果
2.1 三組療效比較
MARS 組有效率顯著高于PE 組和DPMAS 組,差異有統計學意義(P<0.05),PE 組、DPMAS 組總有效率比較,差異無統計學意義(P>0.05)。見表1。
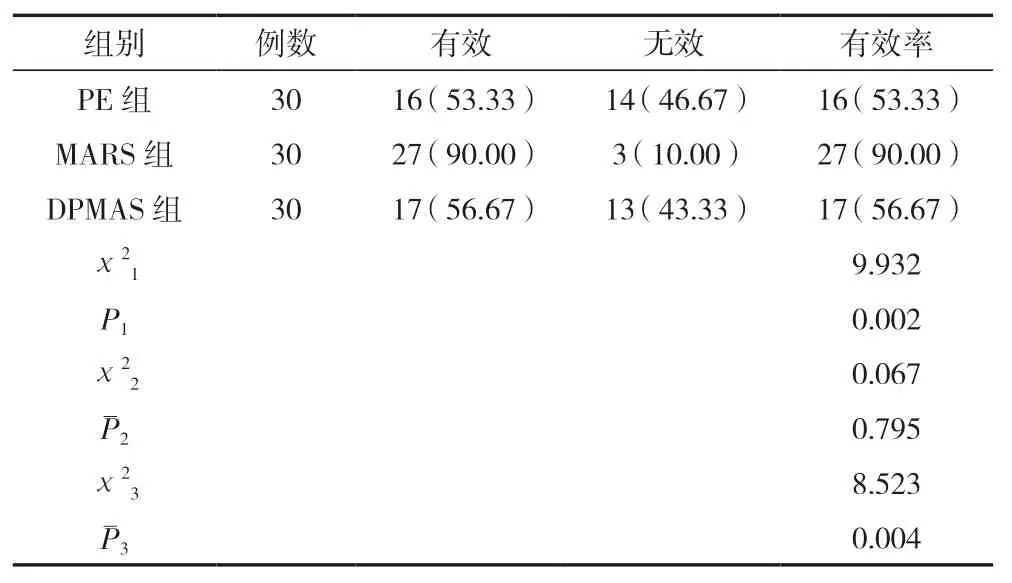
表1 三組療效比較 [n(%)]
2.2 三組ALT、AST、PTA 指標比較
治療前,三組ALT、AST、PTA 指標比較,差異無統計學意義(P>0.05)。治療后,MARS 組和DPMAS 組ALT、AST指標均高于PE 組,PTA 指標低于PE 組,差異有統計學意義(P<0.05),MARS 組和DPMAS 組ALT、AST、PTA 指標比較,差異無統計學意義(P>0.05)。見表2。
表2 3 組ALT、AST、PTA 指標比較 ()
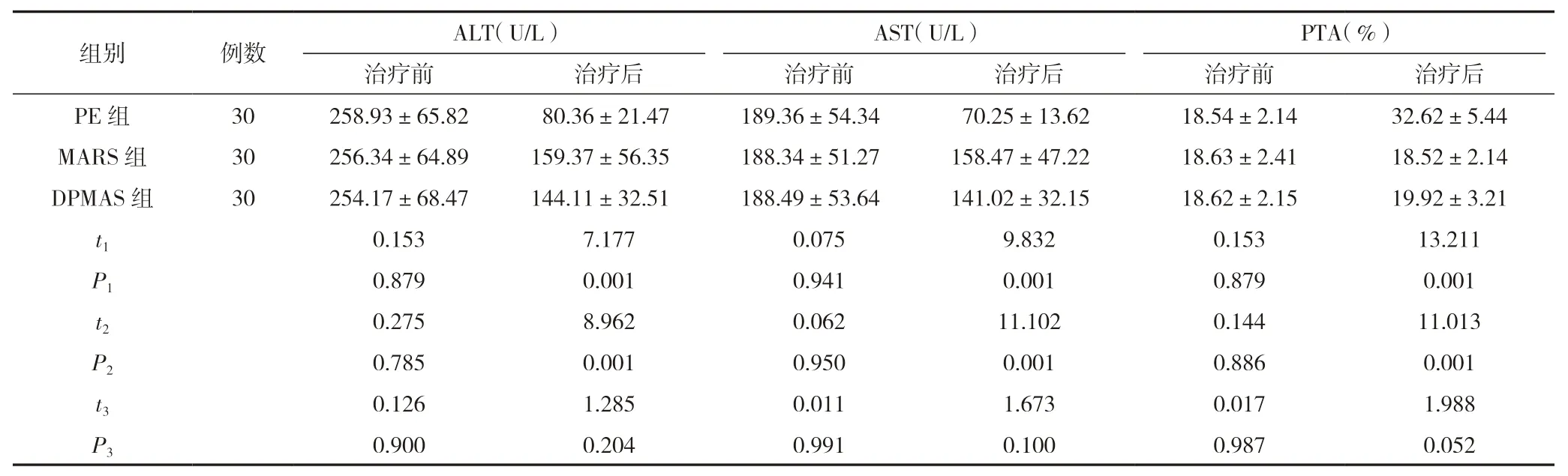
表2 3 組ALT、AST、PTA 指標比較 ()
注:t1、P1 表示PE 組與MARS 組比較;t2、P2 表示PE 組與DPMAS 組比較;t2、P3 表示MARS 組與DPMAS 組比較。
2.3 三組血細胞與電解質指標比較
治療前,三組血小板計數、血紅蛋白、白細胞計數、血鉀、血鈉、pH 指標比較,差異無統計學意義(P>0.05);治療后,MARS 組、DPMAS 組血小板計數、血紅蛋白低于PE 組,白細胞計數高于PE 組,差異有統計學意義(P<0.05),三組血鉀、血鈉、pH 指標比較,差異無統計學意義(P>0.05)。見表3。
表3 三組血細胞與電解質指標比較 ()
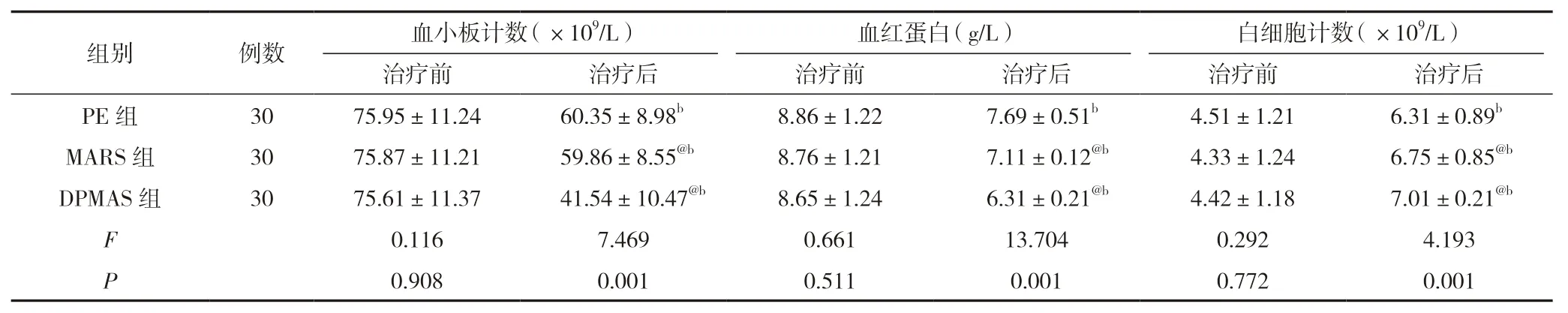
表3 三組血細胞與電解質指標比較 ()
續表3 三組血細胞與電解質指標比較 ()
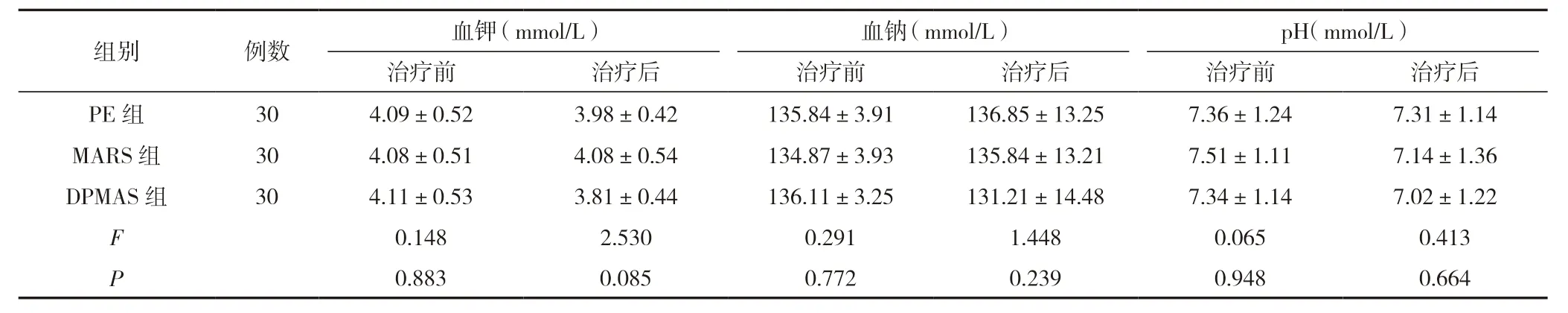
續表3 三組血細胞與電解質指標比較 ()
注:與PE 組比較,@P<0.05;與同組治療前比較,bP<0.05。
3 討論
肝衰竭是臨床常見危重癥,該病為多因素造成的肝功能受損。肝炎病毒是引起肝衰竭的主要病因,而慢加急性肝衰竭是最為常見的一種,常伴有肝外器官損傷[5]。目前,針對慢加急性肝衰竭,臨床多以肝移植治療為主,但因肝源短缺、費用高昂等,多數患者無法接受肝移植技術治療,常在等待肝源期間死亡,進而喪失肝移植機會[6]。
隨著人工肝技術逐漸發展,人工肝支持系統在肝衰竭中應用越來越廣泛,并取得了較好的臨床效果,其主要是通過替代部分肝功能,以此促使肝臟負擔減輕,為改善患者肝功能奠定良好基礎,為部分患者康復帶來希望[7]。人工肝伴多種模式,不同治療模式具有不同的優缺點[8]。本研究比較PE、MARS、DPMAS 三種不同治療模式療效,結果得出,MARS 組治療有效率高于PE、DPMAS 組,差異有統計學意義(P<0.05),表明使用MARS 治療效果更佳。分析原因在于,MARS 可模擬肝細胞解毒過程,一旦血流經過MARS 膜時,在MARS 膜作用下,中、小分子有毒物質能夠侵入膜外側白蛋白中,與毒素結合后,通過MARS 可逐漸打開相應結合點,并在MARS 膜一側吸附,以此結合膜外側高濃度白蛋白,進而迅速清除機體中多種代謝物質[9-10]。ALT 主要存在于各種細胞中,特別是以肝細胞為最,整個肝臟中其含量約為血液中含量的100 倍,若組織發生病變,該酶活力增加,促使其大量釋放到血中;AST 主要位于心肌,其次為肝臟、骨骼肌與腎臟等組織中,在正常血清中AST 含量較低,若破壞相應細胞,胞漿中AST 可逐漸釋放至血中,其血清濃度可顯著上升[11-13];PTA 是反映肝臟凝血功能的重要指標,也是反映肝臟儲備功能程度的重要指標,其與肝病病情程度密切相關。本研究顯示,MARS 組ALT、AST 改善情況優于PE 組、DPMAS 組,但其PTA 改善情況不如PE 組,差異有統計學意義(P<0.05),考慮原因為PE、MARS 治療均可穩定患者血流狀態,改善患者的血生化指標與肝功能,但PE 不僅能夠清除毒素,也可補充相應的凝血因子[14-15]。在血液細胞中,血小板為最小細胞,能夠保證毛細血管完整性;血紅蛋白是紅細胞的主要成分,是紅細胞內運輸氧氣的特殊蛋白質;白細胞是機體中較為重要的一種細胞,在機體中發揮著重要作用[16-17]。血鉀、血鈉均為機體重要的電解質,上述指標在細胞內與細胞外濃度具有一定差異[18-20]。本研究顯示,治療后,MARS 組、DPMAS 組血小板計數、血紅蛋白低于PE 組,白細胞計數高于PE 組差異有統計學意義(P<0.05),但血鉀、血鈉、pH 指標比較,差異無統計學意義(P>0.05),表明PE、MARS、DPMAS 三種治療方式均可刺激白細胞上升,降低血紅蛋白與血小板。
綜上所述,PE、MARS、DPMAS 三種治療方式具有不同優缺點,臨床需依據患者具體情況采取個體化治療方案。其中PE 是肝衰竭患者很好的選擇,若患者凝血酶原活動度正常或下降不明顯,應選擇白蛋白溶液,若患者凝血酶原活動度下降明顯,應以血漿代用品,再用新鮮冰凍血漿進行PE;而針對肝性腦病患者,不建議實施PE。MARS 適用于肝衰竭及合并肝性腦病、多器官衰竭等并發癥患者,針對凝血酶原活動度較低患者的患者,可與含有血漿的人工肝治療模式如PE、血漿透析濾過組合使用。DPMAS 適用于各種原因造成的肝衰竭、肝衰竭前期、高膽紅素血癥患者,特別適合伴有肝性腦病者、伴黃疸的膿毒癥等患者。

