雙酚類化合物對人胚腎細胞HEK293的毒性和氧化應激的研究
李專, 陳力可, 汪雪格, 李廣柱, 邊德軍*
(1.長春工程學院水利與環境工程學院, 長春 130012; 2.吉林省城市污水處理重點實驗室, 長春 130012; 3.海南省環境科學研究院, 海口 571126)
雙酚類化合物(bisphenols, BPs)是一類對環境和健康具有潛在風險的新型持久性有機污染物。主要應用于合成高分子聚合材料,如聚碳酸酯、環氧樹脂等,以及其他工業產品和日常生活消費品[1]。BPs 經排放進入水體、沉積物、空氣、土壤等環境介質中,通過各種途徑進入生物體并在體內蓄積[2-6]。其中,雙酚A(bisphenol A, BPA)是最典型且產量最高的BPs,大量研究表明BPA對生殖和發育、神經和心血管、肝腎代謝等方面會產生負面影響[7-9]。因此,加拿大、美國、歐洲和中國先后出臺相關法律政策,禁止和限制含BPA制品的生產和使用[10],這一舉措刺激了BPA替代品的生產和使用。其中,雙酚S(bisphenol S, BPS)、雙酚F(bisphenol F, BPF)和雙酚AF(bisphenol AF, BPAF)是最常見的BPA替代品。BPS 主要用于個人護理品、環氧樹脂膠水、食品罐頭包裝及熱敏紙、染料的改良劑和穩定劑。BPF常用于清漆、襯墊、塑料粘合劑、牙科密封劑及食品包裝中。BPAF 可作為交聯劑,應用于氟橡膠、電子和光纖等聚合物的生產中[11-12]。雙酚類化合物的產量及應用在全球范圍內的迅速增長,其安全性也受到越來越多的關注。多項研究顯示,雙酚類化合物經過度排放進入環境介質中,并通過食物鏈的放大作用在生物體內累積,在水體、沉積物、顆粒物、動植物及人體血液、尿液甚至母乳等樣本中均發現了雙酚類化合物的存在,其中BPA、BPS、BPF和BPAF是最主要的貢獻單體[13-16]。
迄今為止,已有大量關于BPA對生物機體的毒性效應的研究,主要集中在生殖發育、心血管和腎臟病理學等方面。研究證明BPA可以誘導不同的細胞產生氧化應激,并導致細胞凋亡。美國環境保護署(U.S. Environmental Protection Agency,EPA)根據系列動物的劑量暴露實驗所產生的毒性效應將BPA的安全濃度設置為50 μg/(kg·d),同時有研究表明50 mg/kg的 BPA 就能對大鼠腎臟功能產生中度損傷[17]。腎是人體重要的代謝器官,夠維持體內電解質的穩定和酸堿平衡,排泄有毒物質,對于機體內部的穩定和正常的新陳代謝起到至關重要的作用。Yuan等[18]的研究結果表明,氧化應激、細胞凋亡和 DNA 損傷在BPA(1、10、100和1 000 μmol/L)誘導恒河猴胚胎腎細胞Marc-145的毒性機制中起了關鍵作用。近年來由于BPA替代品的使用量劇增,BPA替代品已逐漸成為威脅環境和健康的重要風險因子。然而,BPA替代品對腎臟系統的毒性效應的研究尚未被廣泛探索,缺乏足夠的毒理學數據來支持健康風險評估。
為了比較4種常見的雙酚類化合物BPA、BPS、BPF和BPAF對具有代謝功能的人胚腎細胞HEK293的毒性影響,現通過測定細胞活力,胞內活性氧簇(ROS)的水平,超氧化物歧化酶(superoxide dismutase,SOD)、谷胱甘肽(glutathione,GSH)和丙二醛(malondialdehyde,MDA)等氧化應激指標的水平及細胞內Ca2+的含量,探討BPs對HEK293細胞氧化損傷作用,從氧化應激的角度分析BPs 對生物體的損傷作用,為深化了解雙酚類化合物的毒理學系統研究和風險評估提供實驗數據和理論基礎。
1 材料與方法
1.1 實驗材料
雙酚A[99%, 2,2-雙(4-羥基苯基)丙烷,BPA]、雙酚F[99%,雙(4-羥苯基)甲烷,BPF]、雙酚S[99%,4,4′-磺酰基二苯酚,BPS]、雙酚AF[99%,2,2-雙(4-羥基苯基)六氟丙烷,BPAF]、二甲基亞砜(dimethyl sulfoxide,DMSO)購自美國Sigma-Aldrich公司;人胚胎腎細胞系HEK293購自中國科學研究所上海細胞生物資源中心,DMEM培養基、胰蛋白酶、磷酸緩沖鹽溶液(phosphate buffered saline, PBS)購自康寧公司(Manassas,VA,USA),胎牛血清(fetal bovine serum, FBS)購自GIBCO公司(Grand Island,NY,USA)。其他試劑均為分析純,購自北京化工制藥廠。
1.2 實驗設計
選取人胚胎腎細胞HEK293作為實驗模型,該細胞為貼壁細胞,培養在含有10% FBS、100 U/mL青霉素100 U/mL鏈霉素改良的DMEM培養基中,在37℃,5% CO2的細胞培養箱中培養。取對數生長期的HEK293細胞,用胰蛋白酶消化細胞,調整細胞密度至2×105個/mL,接種于6孔培養板,在CO2培養箱中(37℃、5% CO2)培養12 h后棄培養基,PBS緩沖液洗兩遍,分別加入含有不同濃度(0、1、5、10、50和100 μmol/L)的BPA、BPS、BPF和BPAF培養基(含0.08%的DMSO)繼續培養。對照組為含有0.08% DMSO的完全培養基。
1.3 細胞活力的測定
細胞暴露于不同濃度組BPA、BPS、BPF和BPAF 24 h和48 h后,利用倒置光學顯微鏡(Leica, DMI 3000B,Germany)觀察細胞的形態,利用MTT細胞活性檢測試劑盒(碧云天,中國)測定細胞活力,調整細胞密度至5×104個/mL,每孔100 μL接種于96孔板中,每孔加入10 μL(MTT)溶液,在37 ℃下孵育4 h,吸出上清液,每孔加入100 μL Formazan溶解液,酶標儀(Epoch,Biotek,美國)在570 nm波長處檢測每孔的光密度。
1.4 活性氧含量(ROS)的測定
活性氧檢測試劑盒是一種通過測量熒光探針DCFH-DA水平,測定細胞內ROS含量試劑盒。將細胞分別暴露于不同濃度BPA、BPS、BPF和BPAF 24 h和48 h后,去除細胞培養基,稀釋細胞懸液至105個/mL,每孔加入1 mL稀釋好的DCFH-DA溶液(終濃度10 μmol/L),避光37 ℃孵育30 min,中間每隔10 min輕搖1次,PBS緩沖液洗滌2~3次,使用酶標儀在 525 nm 波長處測量吸光度。
1.5 超氧化物歧化酶(SOD)的測定
將暴露于不同濃度組BPA、BPS、BPF和BPAF后的細胞用預冷的PBS緩沖液洗滌2遍,按照每106個細胞加入100 μL的比例加入試劑盒提供的SOD樣品制備液,吹打以充分裂解細胞,離心(4 ℃,10 000 g)3 min,取上清作為待測樣品,將樣品、工作液依次加入96孔板中,37 ℃ 孵育30 min,使用酶標儀在450 nm 處測量吸光度。
1.6 總谷胱甘肽(GSH)的測定
收集暴露于不同濃度組BPA、BPS、BPF和BPAF后的細胞,離心,棄上清液,用PBS緩沖液重懸細胞兩次,加入細胞沉淀體積3倍量的蛋白去除試劑M溶液,用液氮和37 ℃水浴將細胞快速凍融兩次,然后冰浴 5 min再離心(4 ℃,10 000 g)10 min,取上清液,依次加入工作液至 96 孔板,使用酶標儀在412 nm波長處測量吸光度。
1.7 丙二醛(MDA)的測定
將暴露于各組BPA、BPS、BPF和BPAF后的細胞,用細胞裂解液處理后,離心(10 000 g)10 min,后取上清,依次加入MDA工作液,沸水水浴15 min,冷卻至室溫離心10 min(1 000 g)后取上清200 μL轉移至96孔板,利用酶標儀再532 nm波長處測量吸光度。
1.8 Ca2+水平的測定
利用 Ca2+熒光探針 Fluo-4 AM 檢測細胞內 Ca2+水平。Fluo-4 AM 是一種可以穿透細胞膜的熒光染料,本身熒光非常弱,進入細胞后可以被細胞內的酯酶剪切形成Fluo-4滯留在細胞內,Fluo-4結合Ca2+后能可以產生較強的熒光。將暴露于BPA、BPS、BPF和BPAF后的細胞用PBS 洗滌細胞 3 次,每孔中加入工作濃度為 4 μmol/L的熒光探針 Fluo-4 AM 和0.1% Pluronic F-127,于37 ℃孵育 30 min。PBS緩沖液洗滌細胞3次,之后消化收集細胞,離心棄上清,PBS緩沖液重懸細胞,利用酶標儀在488 nm波長下測量吸光度。
1.9 統計學分析
所有實驗每組做3個平行。實驗數據用平均值(mean)±標準偏差(SD)表示,利用SPSS 22.0軟件進行統計學分析,并進行單因素方差分析(ANOVA)。以P<0.05為差異顯著具有統計學意義。
2 結果與分析
2.1 細胞活力
為了驗證雙酚類化合物(BPs)在體外對人胚腎細胞HEK293的活力影響,將HEK293細胞分別暴露于不同濃度的BPA、BPS、BPF和BPAF 24 h及48 h后,用MTT法測定細胞活力,實驗結果(圖1)顯示,隨著BPs濃度和暴露時間的增長,HEK293細胞活力均受到不同程度的抑制作用,且細胞活力呈濃度和時間(24 h和48 h)依賴性下降。
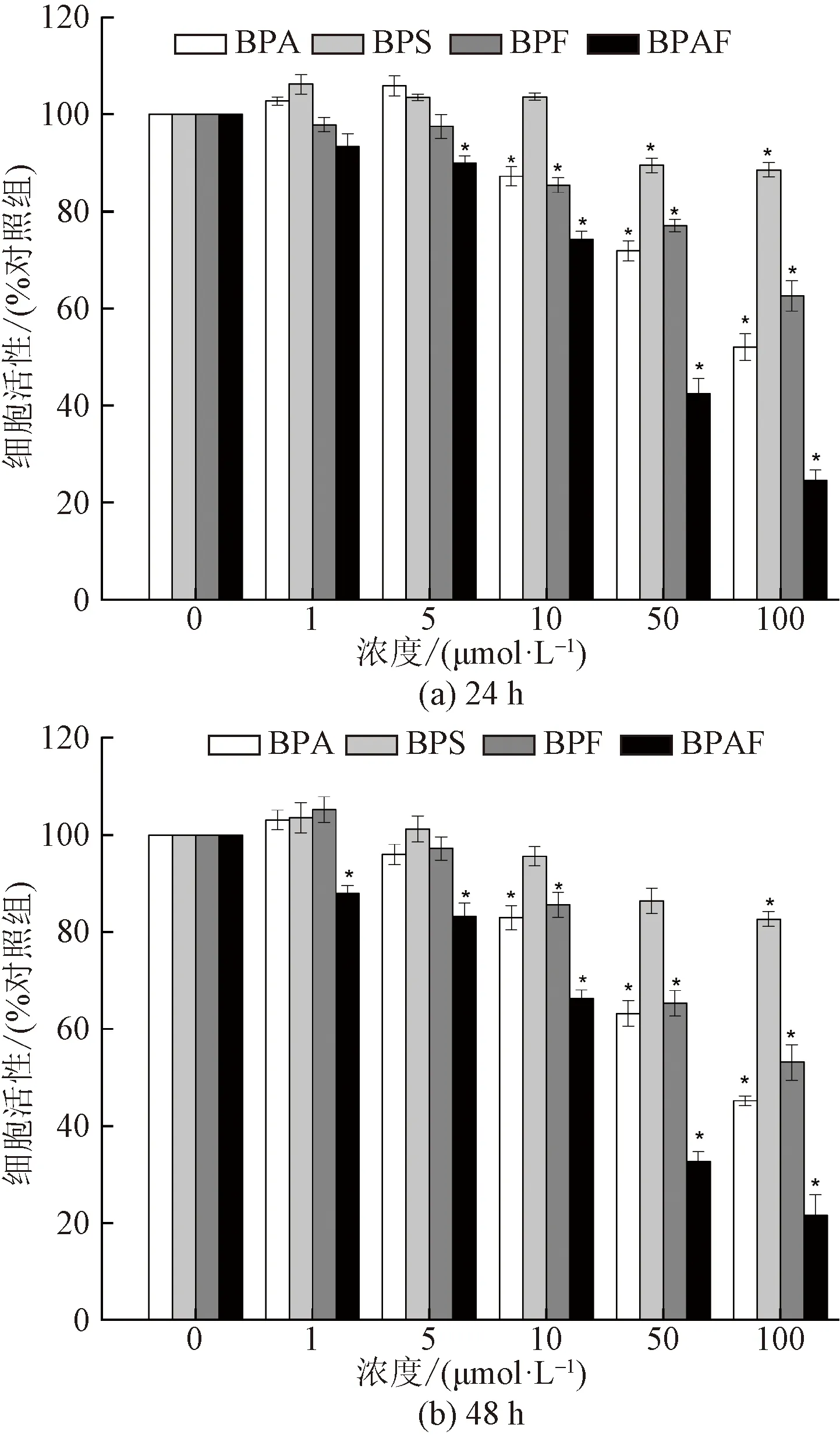
圖1 BPA、BPS、BPF和BPAF暴露24 h及 48 h后對細胞活力的影響Fig.1 Effects of BPA、 BPS、BPF and BPAF on the cell viability of HEK293 after 24 h and 48 h exposure
當細胞分別暴露于100 μmol/L的BPA、BPS、BPF和BPAF 24 h后,細胞活力分別降至對照組的 52.1%、88.6%、62.5%、24.6%;當細胞分別暴露于100 μmol/L的BPA、BPS、BPF和BPAF 48 h后,細胞活力分別降至對照組的 45.2%、82.6%、53.1%、21.5%。可見,BPAF對人胚腎細胞HEK293的活力抑制作用最強,BPA和BPF對HEK293的細胞活力抑制作用次之,BPS在暴露劑量范圍內對HEK293的活力抑制作用最小。當BPAF濃度僅10 μmol/L作用24 h和48 h后,細胞活力分別降至對照組的74.3%和66.3%。這可能時由于BPAF具有較強的親脂性,更容易穿透細胞膜。此外,和BPA比較,BPAF的對位上的CF3基團為強吸電子基團,和細胞能產生更強的反應性,導致BPAF更容易進入細胞導致細胞損傷[19]。Russo等[20]研究了7種雙酚類化合物對3T3-L1、MCF-7、C6和HeLa 4種細胞的毒性效應,研究結果顯示,相比其他幾種BPs,BPAF對這4種細胞均能產生強烈的急性毒性,其中對3T3-L1成纖維細胞的毒性效應最強,IC50可達11 μmol/L左右。與BPA相比,BPF和BPS表現出較小的細胞毒性效應,針對不同細胞毒性略有差異,該研究結果與本項研究結果比較一致。
2.2 活性氧(ROS)
細胞在受到外源刺激時,會導致細胞內 ROS 水平大幅上升,出現氧化應激,誘導蛋白質、脂質和 DNA 的氧化損傷。氧化應激是BPA誘導細胞損傷的主要機制之一,本研究利用 DCFH-DA 探針檢測在不同濃度的雙酚類化合物(BPA、BPS、BPF、BPAF)暴露下的HEK293細胞內 ROS 水平的變化。實驗結果顯示(圖2),在本實驗所選的劑量范圍內,HEK293細胞暴露于不同濃度組BPA、BPS、BPF和BPAF 24 h和48 h后,細胞內ROS水平隨BPs的濃度增加而上升,與對照組相比,當細胞暴露于BPA(10~100 μmol/L)、BPS(100 μmol/L)、BPF(10~100 μmol/L)、BPAF(1~100 μmol/L)后,細胞內ROS水平顯著上升。說明BPs能夠以劑量依賴性的方式誘導 HEK293 細胞內產生ROS,導致細胞內產生氧化應激。當細胞暴露于BPS(1、5、10、50 μmol/L)及低濃度BPA(1、5 μmol/L)、BPF(5 μmol/L)24 h后,與對照組相比,細胞內ROS 水平略有上升,繼續暴露48 h后ROS 水平較24 h時有所下降。這說明細胞能自發的調節 ROS 水平,細胞在24 h 內誘導產生活性氧自由基分子,而隨著暴露時間的延長,抗氧化酶發揮作用,消除了細胞內產生的 ROS,當繼續暴露到48 h 時,ROS水平又逐漸回落,維持了細胞內氧化系統和抗氧化系統的動態平衡。
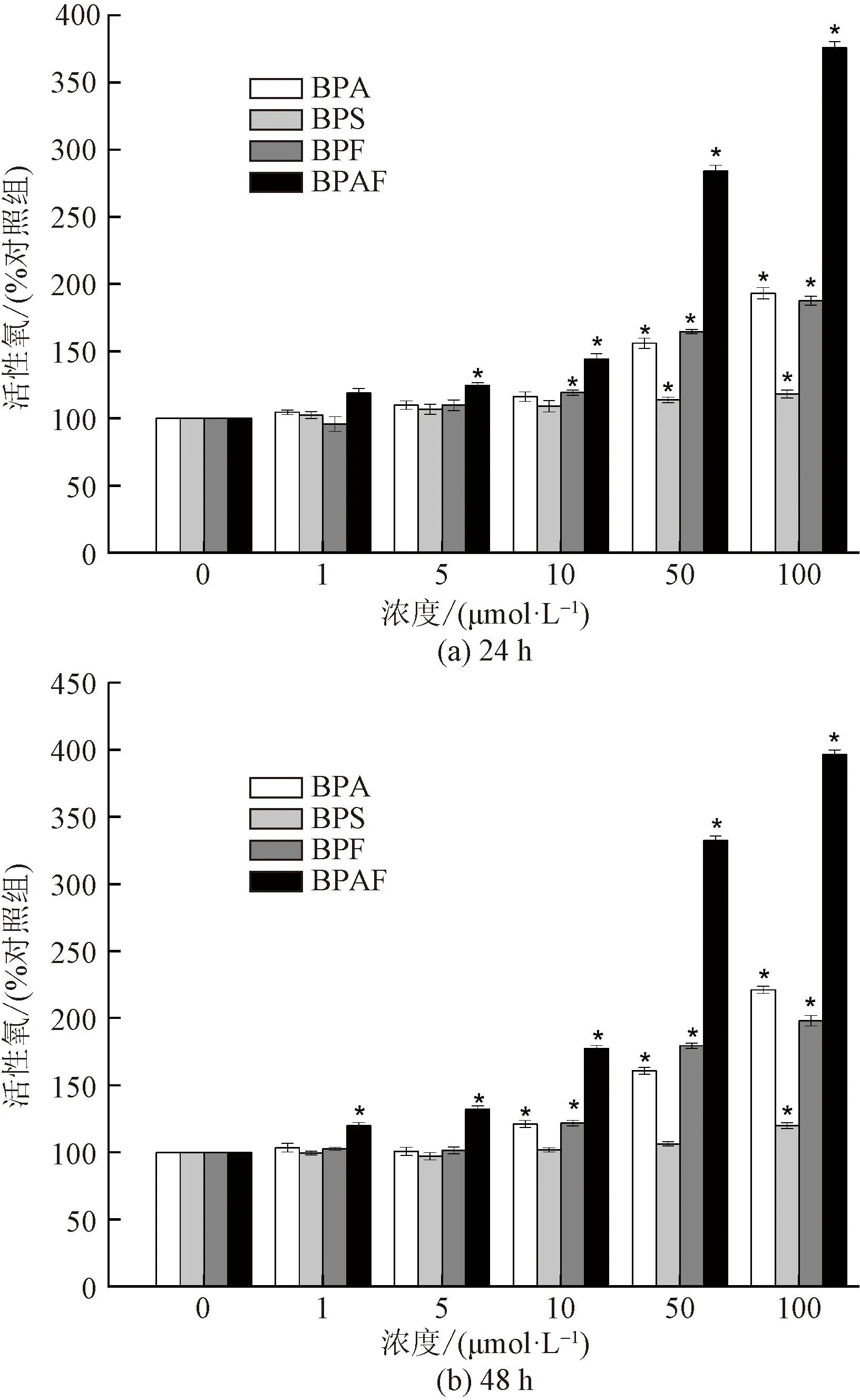
圖2 BPA、BPS、BPF和 BPAF暴露24 h及 48 h后對細胞活性氧水平的影響Fig.2 Effects of BPA、BPS、BPF and BPAF on the intracellular ROS level in HEK293 after 24 h and 48 h exposure
2.3 氧化應激參數
為了進一步研究雙酚類化合物對HEK293細胞的氧化應激作用[21-23],本研究檢測了暴露于不同濃度BPA、BPS、BPF和 BPAF后HEK293細胞氧化應激生化指標的水平。超氧化物歧化酶(SOD)作為生物抗氧化系統的第一道防線,能夠協助清除自由基,降低細胞的氧化損傷[19]。GSH是細胞內重要的非酶抗氧化劑,能夠清除細胞內過量的ROS,穩定細胞內氧化還原狀態的平衡,在一定程度上能反映機體抗氧化的能力。MDA是細胞內自由基作用于脂質過氧化反應的產物,MDA的含量能夠反映出細胞氧化損傷的程度。
由圖3~圖5可知,在所選劑量范圍和時間內,與對照組相比,隨BPs濃度增加,細胞內SOD和GSH的水平呈濃度依賴性降低。暴露于100 μmol/L BPA、BPS、BPF和 BPAF下24 h后細胞內SOD含量分別降至對照組的78.2%、91.9%、72.6%和51.9%。GSH含量分別降至對照組的54.8%、85.5%、62.3%和33.1%。說明BPs能導致細胞內抗氧化能力的下降。當細胞暴露于低濃度BPA、BPS和BPF處理組,SOD的活性與對照組相比呈現先升后降的趨勢。說明在低濃度BPs的作用下,細胞中的抗氧化酶被激活,因此SOD活性略有上升,來分解氧化應激產物,以減少氧化應激對細胞的氧化損傷。當BPs濃度繼續增大,HEK293細胞中SOD活性受到了抑制,細胞中的抗氧化系統不足以應對高濃度的BPs引起的氧化應激,過量的ROS誘發了細胞的氧化損傷。在HEK293細胞中MDA的水平隨BPs的濃度增加而上升。暴露于100 μmol/L BPA、BPS、BPF和 BPAF下24 h后細胞內MDA含量分別約為對照組的1.60倍,1.18倍,1.57倍和3.04倍。這說明ROS 在細胞中過量累積誘發了氧化應激效應,細胞的抗氧化能力減弱,導致細胞脂質過氧化損傷。在正常生理條件下,ROS 在低濃度下以受控方式產生,并作為細胞生長的信號分子發揮作用[24-26]。ROS 的產生受到內源性細胞抗氧化劑的嚴格調節,包括 SOD、GSH以及其他抗氧化劑。ROS 的產生速率與消除速率相平衡。在外源的刺激作用下,細胞產生的 ROS 濃度無法通過正常的保護性抗氧化機制控制,從而導致脂質過氧化的氧化應激狀態,增加了脂質過氧化產物丙二醛(MDA)的濃度。Meng等[27]研究了BPA、BPF和BPAF對雄性小鼠肝功能的影響,研究結果顯示,BPA、BPF和BPAF的暴露會損害小鼠肝臟的抗氧化防御系統,增加脂質過氧化,并導致肝臟氧化損傷。
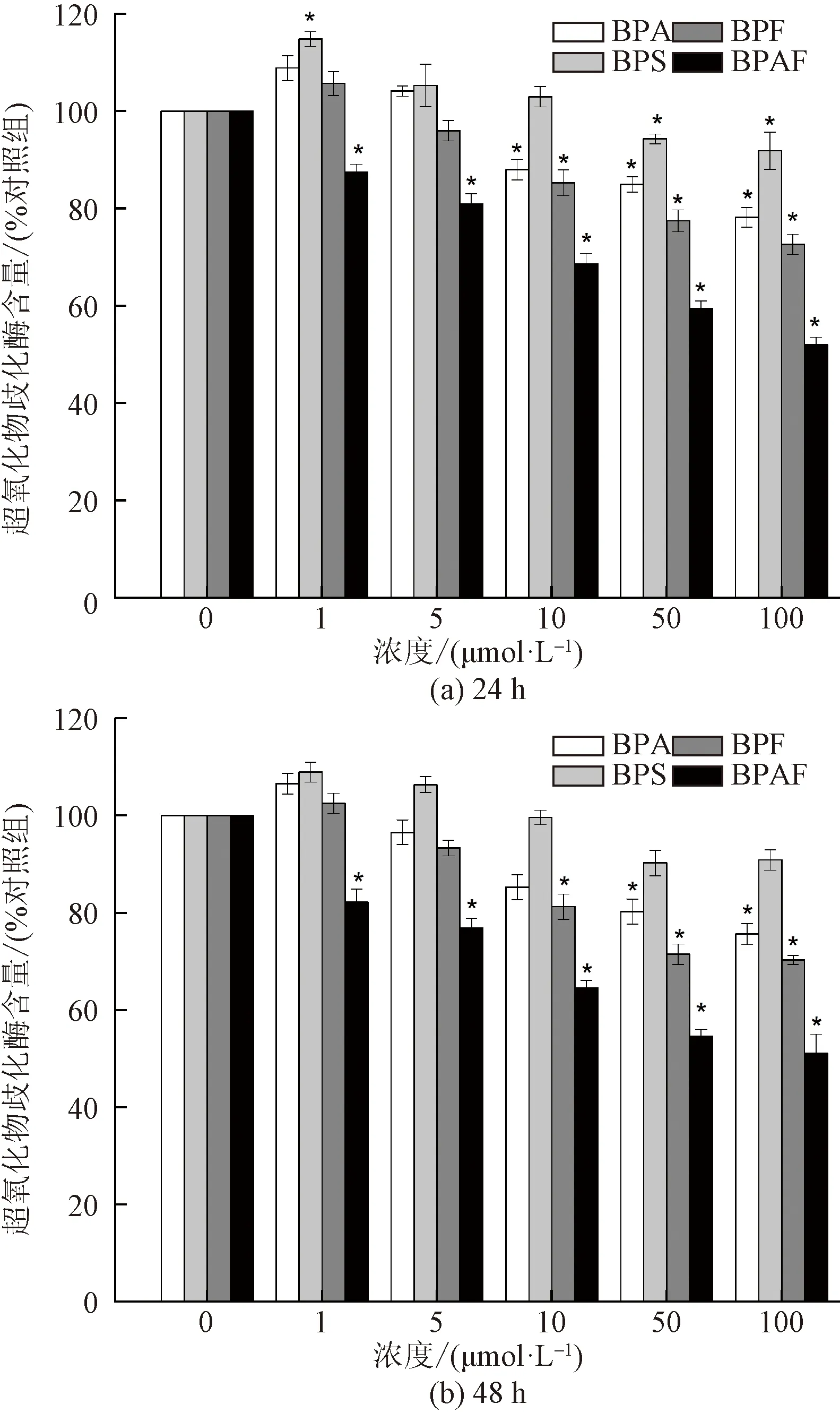
圖3 BPA、BPS、BPF和 BPAF暴露24 h 及48 h 后 對細胞SOD水平的影響Fig.3 Effects of BPA、BPS、BPF and BPAF on the intracellular SOD level in HEK293 after 24 h and 48 h exposure

圖4 BPA、BPS、BPF和 BPAF暴露24 h 及 48 h 后對細胞GSH水平的影響Fig.4 Effects of BPA、BPS、BPF and BPAF on the intracellular GSH level in HEK293 after 24 h and 48 h exposure

圖5 BPA、BPS、BPF和 BPAF暴露24 h 及48 h 后 對細胞內MDA水平的影響Fig.5 Effects of BPA、BPS、BPF and BPAF on the intracellular MDA level in HEK293 after 24 h and 48 h exposure
2.4 Ca2+水平
Ca2+作為細胞內重要的信號分子,當細胞受到外源刺激時,會導致細胞內Ca2+代謝失衡,鈣信號功能紊亂,導致細胞凋亡[28-29]。本文研究評估了暴露于不同濃度BPA、BPS、BPF和BPAF下細胞內Ca2+的水平。結果(圖6)顯示,在所選濃度范圍內,細胞內Ca2+水平隨著BPs濃度的增加而上升。高濃度的BPs,特別是BPAF,能引起細胞內 Ca2+水平的顯著上升,細胞中Ca2+的積累會誘導線粒體功能異常,促進 ROS水平上升,是雙酚類化合物作用于細胞后的常見反應。Wang等[29]研究發現,BPA能破壞大鼠神經元中的鈣穩態,導致Ca2+水平升高,并通過調節蛋白激酶 A(PKA)和蛋白激酶 C(PKC)活性來抑制Ca2+電壓門控通道。Lee等[30]的研究表明,BPAF 能誘導HT-22細胞中Ca2+水平上升,促使細胞內活性氧含量升高,并導致細胞凋亡。
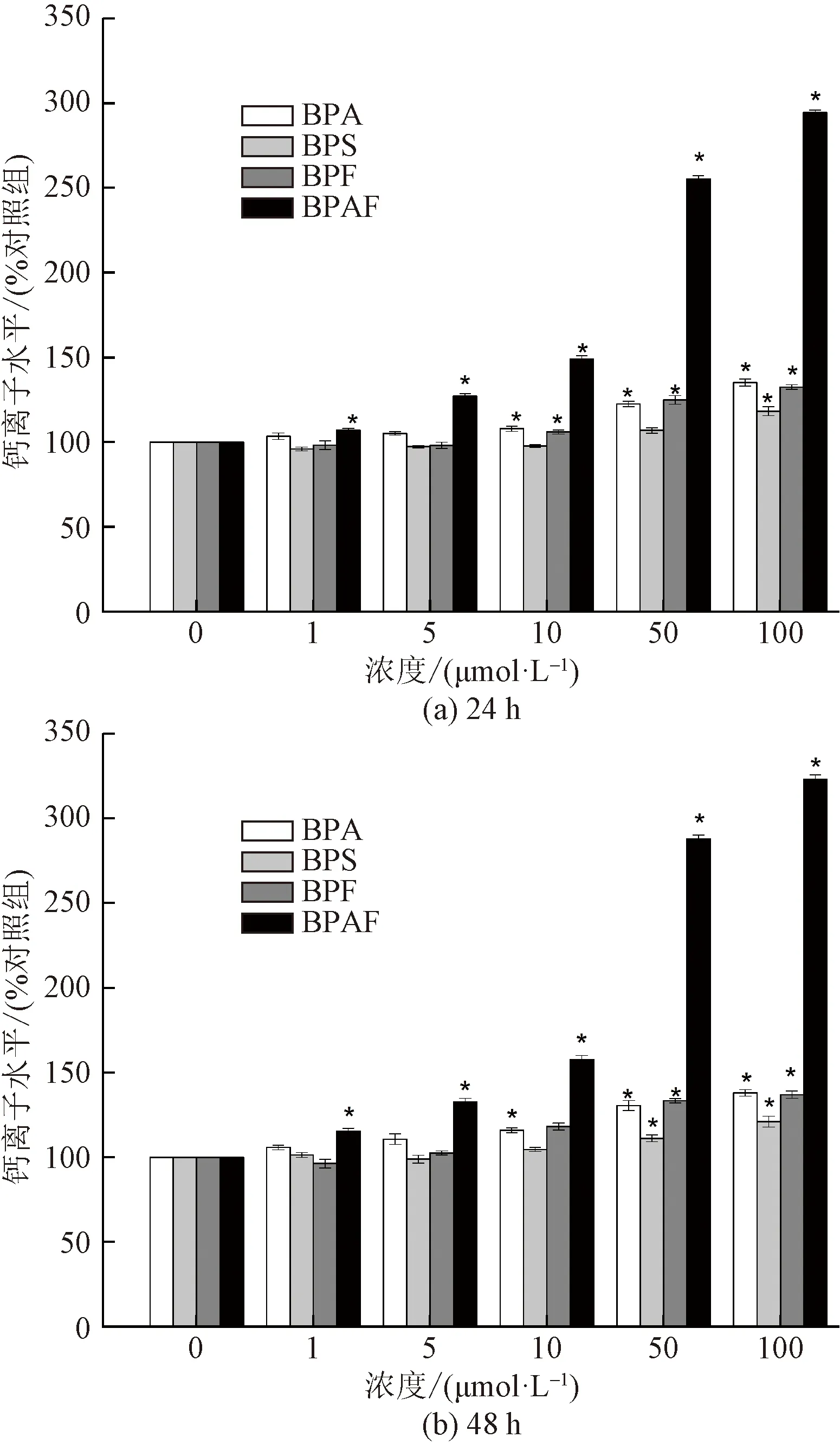
圖6 BPA、BPS、BPF和 BPAF暴露24 h 及48 h 后 對胞內Ca2+水平的影響Fig.6 Effects of BPA、BPS、BPF and BPAF on intracellular calcium(Ca2+) level in HEK293 after 24 h and 48 h exposure
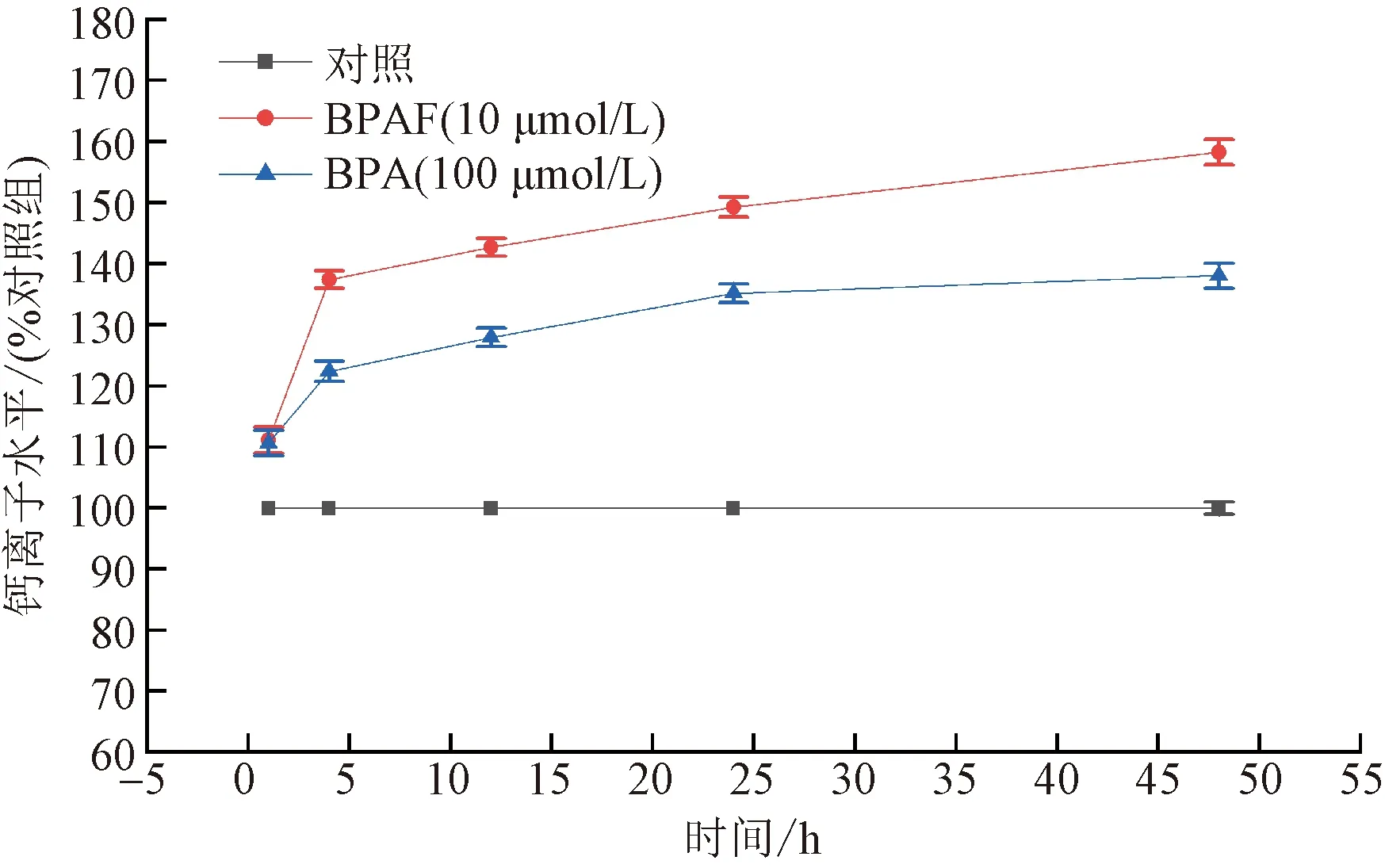
圖7 不同處理時間對胞內Ca2+水平的影響Fig.7 Effects on intracellular Ca2+ level in HEK293 after exposure for the indicated period of time
為了探尋短時間內BPs對HEK293細胞內Ca2+水平的影響,對暴露不同時長后細胞內Ca2+水平進行檢測,實驗結果(圖7)顯示,細胞暴露于 10 μmol/L BPAF溶液1、4、12、24、48 h后,與對照組相比Ca2+水平分別上升了11.1%、37.4%、42.7%、49.2%和58.3%。細胞暴露于 100 μmol/L BPA溶液1、4、12、24、48 h后,與對照組相比Ca2+水平分別上升了10.6%、22.4%、27.9%、35.1%和38.0%。說明BPs在短時間內能促使細胞內Ca2+水平顯著提升。
3 結論
在本文研究選定的劑量范圍和時間內,BPA、BPS、BPF 和BPAF均能抑制HEK293細胞的活力。其中,BPAF對人胚腎細胞HEK293的活力抑制作用最強,BPA和BPF次之,BPS對HEK293的細胞活力抑制作用相對較小。細胞內活性氧的水平隨著BPA、BPS、BPF 和BPAF濃度的增大而上升,特別是BPAF及高濃度的BPA和BPF能顯著提高細胞內活性氧的水平,隨著BPs濃度的增加,SOD和GSH水平顯著下降,MDA水平顯著增加,并且細胞內Ca2+水平在短時間內顯著上升。這表明BPs 能夠誘導HEK293 細胞產生ROS并發生氧化應激,通過抑制細胞內抗氧化酶的產生,破壞細胞內氧化和抗氧化之間的平衡機制,誘導氧化損傷。
綜上所述,本研究所選的4種常見的雙酚類化合物BPA、BPF、BPS 和BPAF能夠抑制HEK293細胞活力,通過促進氧化應激產生 ROS,降低抗氧化能力,增加細胞內 Ca2+水平,誘導HEK293細胞損傷。在本研究所選的濃度范圍內,BPAF對HEK293細胞的毒性最大,作為BPA的替代品的安全性需引起更多的注意;BPF和BPA對HEK293細胞的毒性比較接近,BPS作為聚合物合成和熱敏紙生產中BPA的主要替代品,對HEK293細胞毒性遠低于BPA。研究結果將為評估雙酚類化合物的毒性效應和風險評估提供科學依據。

