缺糖缺氧/再灌注對星形膠質細胞外泌體miRNAs表達的影響*
韓韋華,黃庭睿,文田甜,沈 耀
溫州醫科大學檢驗醫學院(生命科學學院)/檢驗醫學教育部重點實驗室,浙江溫州 325035
星形膠質細胞是腦組織內數量最多的一類細胞,其通過大量突起或遞質的分泌與腦內其他細胞建立密切的信息聯系,在正常生理及病理過程中扮演著重要角色[1]。外泌體是一種直徑為40~100 nm的囊性小泡,是已發現的眾多細胞外微粒體的一種,可由機體多種細胞分泌[2]。外泌體中具有相當數量的微小RNA(miRNAs)、信使RNA(mRNA)、蛋白質,甚至還包括線粒體DNA,并通過依賴于膜表面信號分子,膜融合后的內容物釋放,以及信號分子的胞外釋放等途徑在細胞間信息的傳遞中發揮重要作用[3]。外泌體在多種疾病中發揮著重要調節作用,如間充質基質細胞(MSCs)可通過分泌外泌體在心腦血管等疾病的治療中發揮作用[4-5],而這種作用又受外泌體的來源細胞和靶細胞所處的環境和狀態影響[6-7]。腦組織內的星形膠質細胞也可分泌外泌體,而且對星形膠質細胞做不同的處理就會刺激其釋放出具有不同生物學作用的外泌體[8-9]。細胞分泌的miRNAs通過外泌體的運輸可傳送到另一個細胞,而miRNA通過靶向降解mRNA或抑制mRNA的翻譯參與個體的發育、細胞分化、增殖、凋亡等生理調控過程[10-11]。目前,外泌體miRNAs調控作用成為細胞與細胞之間信息傳遞研究的熱點。然而,星形膠質細胞源性外泌體miRNAs分泌水平在腦缺血過程中的變化及其在缺血損傷及修復中所發揮的作用尚不清楚。因此,本研究利用新一代高通量Illumina MiSeq測序技術對星形膠質細胞源性外泌體miRNAs進行生物信息學分析,探討缺糖缺氧(OGD)和缺糖缺氧/再灌注(OGD/R)對星形膠質細胞外泌體miRNAs表達譜的影響。
1 材料與方法
1.1材料 新生24 h內SPF級的Sprague-Dawley(SD)大鼠由溫州醫科大學動物實驗中心提供。胰酶細胞消化液、多聚-D-賴氨酸溶液、BCA蛋白濃度檢測試劑盒和青霉素-鏈霉素溶液購自碧云天生物技術有限公司。高糖DMEM、無糖DMEM培養液及去外泌體血清購自Gibco公司。胎牛血清為Natocor公司產品。全反式維甲酸誘導(ATRA)購自生工生物工程(上海)股份有限公司。抗-Actin兔單克隆抗體、辣根過氧化物酶標記山羊抗兔IgG(1∶1 000稀釋使用)購自杭州戴格生物技術有限公司。抗-p-細胞外信號調節激酶(Erk)1、抗-p-Erk2和抗-Erk1、抗-Erk2兔單克隆抗體(1∶5 000稀釋使用)購自Abcam公司。RNAiso Plus試劑盒購自寶生物工程(大連)有限公司。實時熒光定量聚合酶鏈反應(qPCR)檢測試劑:HiScript ⅡQ RT SuperMix、ChamQ Universal SYBR qPCR Master Mix均購自諾唯贊生物科技有限公司。
1.2方法
1.2.1細胞培養 參考文獻[12]的方法進行細胞培養。采用24 h內新生SD大鼠的大腦皮層,用手術刀片切碎,再用0.25%胰酶消化20 min。而后用玻璃滴管吹打細胞團塊直到未見明顯絮狀組織后停止吹打而獲得細胞懸液。將細胞種植于預先用多聚-D-賴氨酸溶液包被的密閉細胞培養瓶中。培養10 d左右,細胞長滿整個瓶底,將其固定在37 ℃恒溫搖床中,以250 r/min速率振蕩搖晃16 h左右,以去除小膠質等雜細胞而使星形膠質細胞純化。SH-SY5Y細胞(源于人神經母細胞瘤細胞)培養于DMEM培養液,待生長到60%~70%時去掉舊的培養基,用PBS洗滌細胞3次,而后培養于含1%胎牛血清(FBS)的DMEM培養基。在避光條件下,加入ATRA溶液,使其終濃度為15 μmol/L,處理4 d。
1.2.2細胞OGD/R模型的構建 待星形膠質細胞長滿后,用PBS洗滌3次,加入無糖DMEM溶液,再將細胞置于缺氧罐內(95% N2、5%CO2,37 ℃)處理2/4 h(作為OGD 2/4 h組)。待OGD 2/4 h處理結束后去除無糖DMEM并換成正常含糖DMEM培養基,并置于37 ℃恒溫CO2培養箱內培養,作為OGD 2 h/R 24 h或OGD 4 h/R 24 h組。
1.2.3星形膠質細胞外泌體提取 用去外泌體血清培養星形膠質細胞24 h后收集培養基上清液,然后用超速離心法收集外泌體。分別收集星形膠質細胞在不同條件下處理后的培養上清液。以400×g離心5 min后提高轉速到3 000×g離心15 min。去除沉淀收集上清液,以10 000× g離心30 min后用0.22 μm注射濾器過濾,以120 000×g離心90 min。收集的沉淀用PBS重懸,繼續以120 000×g離心90 min,棄凈上層PBS重懸液后加入100 μL PBS后吹打沉淀,收集到預冷過的EP管內,-80 ℃保存。
1.2.4透射電鏡法鑒定外泌體 樣品固定在2.5%的戊二醛溶液內,置于4 ℃過夜;倒掉固定液后用0.1 mol/L,pH值為7.0的磷酸鹽緩沖液漂洗樣品3次,每次15 min。再用1%的鋨酸溶液固定樣品1~2 h,后用磷酸鹽緩沖液漂洗。設置乙醇溶液濃度梯度(包括30%、50%、70%、80%、90%和95%這6種濃度)對樣品進行脫水處理,每種濃度處理15 min,再用100%的乙醇處理20 min;最后過度到純丙酮中處理20 min。用Spurr包埋劑與丙酮的混合液(體積比為1∶1)處理樣品1 h;用Spurr包埋劑與丙酮的混合液(體積比為3∶1)處理樣品3 h;純包埋劑處理樣品過夜;將樣品經過滲透處理后包埋置于70 ℃加熱過夜,即得到包埋好的樣品。利用萊卡EM UC7型超薄切片機將包埋樣品切成70~90 nm的切片,檸檬酸鉛溶液和醋酸雙氧鈾50%乙醇飽和溶液對切片各染色5~10 min,即可在日立H-7650型透射電鏡中觀察。
1.2.5外泌體流式細胞儀表面標記物檢測 使用流式細胞術進行外泌體表面標記物CD81和CD63的檢測。經超速離心法收集分離得到的星形膠質細胞源性外泌體沉淀,用100 μL已經過濾的PBS復勻外泌體。用不染色的外泌體作為陰性對照;將收集到的外泌體分別進行CD63和CD81兩組抗體染色,標記為CD63和CD81。按照儀器操作規程上機檢測(由廣州市銳博生物科技有限公司完成)。
1.2.6外泌體miRNA高通量測序 標本提取總RNA后,首先使用T4 RNA連接酶2將一個腺苷化單鏈DNA 3′接頭和5′接頭相繼連接到small RNA上,其中3′端接頭的5端為rAPP,3端有氨基保護,所以能夠減少miRNA的自連。5′端接頭被設計成可以捕獲帶有5′磷酸基團的small RNA。帶有5′與3′鏈接接頭的small RNA序列,通過與3端互補的反轉錄引物進行反轉錄反應,最后對反轉錄產生的cDNA序列進行PCR擴增。最后,對140~160 bp長度范圍的PCR產物進行聚丙烯酰胺凝膠電泳后進行膠回收,從而完成整個文庫的制備工作,對構建好的文庫使用Illumina Hiseq2500進行測序,測序讀長為單端1×50 bp(由杭州聯川生物技術股份有限公司完成)。
1.2.7qPCR驗證 檢測細胞內及外泌體內let-7家族3種miRNAs。使用RNAiso Plus試劑提取細胞內及外泌體內總RNA。使用miRNA 1st Strand cDNA Synthesis試劑盒(莖-環法)從1 μg總RNA合成cDNA,然后采用miRNA Universal SYBR qPCR Master Mix進行qPCR,以U6作內參對照。相對miRNA表達水平采用2-ΔΔCt方法進行計算。引物序列如下,let-7 miRNAs反轉錄引物:GTCGTATCCAGTGCAGGGTCCGAGGTATTCGCACTGGAT ACGACAACTAT;let-7f-5p引物,正向:5′-CGCGCGTGAGGTAGTAGATTGT-3′;let-7e-5p引物,正向:5′-CGCGTGAGGTAGGAGGTTGT-3′;let-7a-5p引物,正向:5′-GCGCGTGAGGTAGT AGGTTGT-3′;let-7 miRNA引物,反向:5′-AGTGCAGGGTCCGAGGTATT-3′;U6引物,正向:5′-CTCGCTTCGGCAGCACA-3′,反向:5′-AACGCTTCACGAATTTGCGT-3′。
1.2.8Western blot(WB)檢測Erk磷酸化水平 SH-SY5Y細胞經OGD/R及外泌體處理后收集細胞并提取蛋白質,參考文獻[12],采用WB測定Erk總蛋白表達水平及磷酸化水平,以β-Actin作為內參。
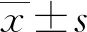
2 結 果
2.1星形膠質細胞外泌體的鑒定 利用透射電鏡觀察外泌體的立體結構,顯示30~100 nm的雙膜結合小泡。使用流式細胞術檢測外泌體表面標記物CD81和CD63的表達,均呈陽性,分別為82.2%和67.6%。
2.2原始數據的篩選分析 在本研究缺糖缺氧再灌注組(OGD/R)與正常對照組的總共3組標本中,經過高通量Illumina MiSeq測序,共獲得了原始數據(Raw reads)2.37×107(對照組),2.66×107(OGD 4 h組),2.54×107(OGD 4 h/R 24 h)。經過數據篩選后,所獲取的有效數據量在各組相應的數據總量中占比分別達到了37.41%(對照組),35.66%(OGD 4 h組),39.77%(OGD 4 h/R 24 h組)。數據的質與量滿足進一步的深度生物信息學分析質控要求。
2.3OGD及OGD/R對星形膠質細胞外泌體miRNAs表達譜的影響 OGD 4 h處理,使外泌體中miR-384-5p、miR-421-3p_R+3、miR-361-5p、miR-16-5p、miR-24-3p、miR-25-3p、miR-92b_R+1、miR-128-3p、miR-151-3p表達顯著下調(P<0.05),而let-7家族成員,如let-7f-5p、let-7e-5p、let-7a-5p、let-7d-5p和miR-98-5p_R-1,以及miR-23b_R+1和miR-30c-5p_R-1表達顯著上調(P<0.05,差異倍數≥2,mapped reads≥1 000)。再灌注24 h處理后,let-7家族成員表達開始下調,恢復至與對照組比較差異無統計學意義的水平(P>0.05),OGD 4 h處理導致的表達下調的miRNAs也恢復至和對照組比較差異無統計學意義的水平(P>0.05)。OGD 4 h/R 24 h組與對照組比較,在同時滿足P<0.05,差異倍數≥2,mapped reads≥1 000的條件下,只有miR-122-5p_R-1的表達差異有統計學意義(P<0.05)。見表1、2。

表1 OGD 4 h組和對照組的比較

續表1 OGD 4 h組和對照組的比較

表2 OGD 4 h/R 24 h和OGD 4 h組的比較
2.4qPCR驗證 為了進一步驗證miRNAs表達水平的變化。本研究從2.3中差異有統計學意義的miRNAs中選擇了let-7家族成員let-7a-5p、let-7e-5p、let-7f-5p進行qPCR驗證。結果發現,這3種miRNAs在外泌體中的分布水平遠高于細胞(P<0.05),即let-7a-5p、let-7e-5p和let-7f-5p主要富集在外泌體中,而這種富集作用不受OGD刺激的影響。此外,OGD 4 h組外泌體中let-7a-5p表達水平高于對照組外泌體中的表達水平(P<0.05),而let-7e-5p和let-7f-5p的表達水平與對照組比較,差異無統計學意義(P>0.05)。見圖1。

注:與對照組比較,**P<0.01;Con exo表示對照組外泌體;Con exo表示OGD 4 h組外泌體。
2.5KEGG富集分析 從對照組、OGD 4 h組和OGD 4 h/R 24 h組中分別挑選出高表達的miRNAs(高于平均值),用metascape和miRWalk預測靶基因,挑選出共同的靶基因在Webgestalt中進行KEGG富集分析。3組中,外泌體高表達miRNAs的靶基因所涉及的信號通路主要為代謝相關通路,如PI3K-AKT、MAPK和mTOR信號通路。3組中外泌體miRNAs富集的信號通路基本相同,3組中富集分析排列在第1位到第9位的信號通路全部相同;而在富集到的前20條信號通路中只有兩條信號通路有所差別;3組間存在少許差異,如OGD 4 h組中沒有富集到Wnt信號通路,OGD 4 h/R 24 h組中沒有富集到AMPK信號通路。
2.6星形膠質細胞外泌體和OGD處理對SH-SY5Y細胞Erk信號通路的影響 為了進一步驗證外泌體和OGD處理對2.5中分析得到的信號通路的影響,選擇了MAPK/Erk信號通路實驗驗證。分別提取了星形膠質細胞對照組、OGD 2 h組、OGD 4 h組、OGD 2 h/R 24 h組、OGD 4 h/R 24 h組分泌的外泌體,分別作用于相同處理的SH-SY5Y細胞,然后提取細胞總蛋白,對p-Erk1、p-Erk2蛋白和Erk1、Erk2蛋白表達進行測定。OGD 2 h和OGD 4 h處理使SH-SY5Y細胞p-Erk水平下調(P<0.05),而給予OGD 2 h和4 h的星形膠質細胞外泌體則能逆轉OGD 2 h和4 h誘導的SH-SY5Y細胞p-Erk水平的下調(P<0.05)。OGD 2 h/R 24 h和OGD 4 h/R 24 h處理促使SH-SY5Y細胞p-Erk水平下調(P<0.05),而給予OGD 2 h/R 24 h和OGD 4 h/R 24h處理的星形膠質細胞外泌體則能逆轉OGD 2 h/R 24 h和OGD 4 h/R 24 h誘導的SH-SY5Y細胞p-Erk水平的下調(P<0.05)。此外,給予正常狀態星形膠質細胞分泌的外泌體進行處理也能顯著上調正常條件下培養的SH-SY5Y細胞的p-Erk1、p-Erk2水平(P<0.05)。見圖2。

注:Con表示對照;exo表示外泌體;與對照比較,*P<0.05,**P<0.01;與OGD或CGD/R處理組比較,#P<0.05,##P<0.01;A、B分別表示對細胞進行OGD 2、4 h處理;C、D分別表示對細胞進行OGD 2 h/R 24 h、OGD 4 h/R 24 h處理。
3 討 論
星形膠質細胞在缺血性腦卒中的發生、發展及后期的恢復過程中均發揮重要的調節作用。腦缺血后,在受影響腦區的星形膠質細胞是最早對缺血作出反應的細胞,形成反應性星形膠質細胞,通過大量突起、分泌膠質細胞來源遞質及外泌體等與腦內其他細胞建立密切的信息聯系[13-15]。有文獻報道,對星形膠質細胞做不同的處理會刺激細胞釋放出具有不同生物學作用的外泌體。如使用β-淀粉樣蛋白作用于小鼠大腦皮層星形膠質細胞,會引起星形膠質細胞分泌富含神經酰胺和前列腺凋亡反應蛋白4的外泌體,這些外泌體可作用于星形膠質細胞自身及其周圍神經元,促進星形膠質細胞和神經元的凋亡[16]。而熱應激則引起星形膠質細胞釋放含有大量Hsp/c70的外泌體,該外泌體可能對星形膠質細胞周圍神經元的存活起關鍵作用[17]。
不同程度的OGD處理會造成不同程度的星形膠質細胞損傷,也可能導致星形膠質細胞增殖[18-19]。OGD處理不同時間導致的星形膠質細胞狀態改變也對神經元產生保護或損傷的不同作用。這可能與不同時間OGD處理會促使星形膠質細胞遞質、外泌體等釋放的改變有關。在研究采用OGD 4 h處理星形膠質細胞后,其外泌體miRNAs表達譜發生了明顯改變。其中miRNAs let-7家族成員,包括let-7f-5p、let-7e-5p、let-7a-5p、let-7d-5p,以及miR-98-5p表達水平在OGD處理后上調。選取let-7a-5p、let-7e-5p和let-7f-5p進行qPCR驗證,結果顯示OGD處理上調了外泌體中let-7a-5p的表達水平。miRNAs let-7家族是最早被研究的miRNAs之一,參與多種疾病的發生、發展,如癌癥、炎癥、免疫性疾病等[20]。最近,有研究發現let-7家族成員也參與了腦卒中的發生、發展,如JIANG等[21]發現miRNA let-7參與調節酸敏感離子通道1α的表達,繼而可能影響腦卒中等疾病后腦神經功能的損傷和修復。有學者在SD大鼠短暫性大腦中動脈阻塞模型(tMCAO)和tMCAO加短暫性股動脈閉塞處理模型中發現tMCAO可誘導let-7a等11個miRNAs的上調;短暫性股動脈閉塞可能通過抑制let-7a等miRNAs的上調,發揮對tMCAO后腦組織的保護作用;而側腦室注射let-7a模擬物可逆轉短暫性股動脈閉塞對tMCAO后腦組織的保護作用[22]。此外,有研究在72例急性期缺血性卒中患者中發現血清和腦脊液中let-7e表達水平顯著升高,且具有高度一致性;血清let-7e作為缺血性腦卒中急性期生物標志物的特異度高達73.4%,靈敏度為82.8%[23]。結合本研究的結果,筆者認為缺血可促進星形膠質細胞等神經細胞釋放外泌體,而外泌體內含有的大量miRNAs,包括let-7家族成員等釋放進入循環系統。這也符合本研究的另一個發現,miRNAs在星形膠質細胞內主要分布于外泌體中,而缺血后外泌體的釋放會顯著影響血清或腦脊液內miRNAs的水平。
處理結果中所列出的表達受影響的miRNAs外,絕大部分miRNAs表達水平均沒有受OGD處理的影響。本研究將3組中高表達的miRNAs進行靶基因預測再進行KEGG富集分析,結果提示OGD 4 h處理對大部分星形膠質細胞外泌體miRNAs靶基因信號通路的影響不大,3組間僅存在少許差異,如OGD 4 h組中沒有富集到Wnt信號通路,OGD 4 h/R 24 h組中沒有富集到AMPK信號通路。選取MAPK/Erk信號通路做進一步的實驗驗證,發現來自對照組星形膠質細胞的外泌體處理對照組SH-SY5Y細胞,或者來自OGD處理組和OGD/R處理組星形膠質細胞的外泌體均可以使對應處理的SH-SY5Y細胞的p-Erk1、p-Erk2水平上調,提示星形膠質細胞外泌體對Erk信號通路的調節可能是通過其miRNAs發揮作用的。此外,有文獻報道Erk信號通路在突觸形成和神經元可塑性中起重要作用[24]。因此,筆者猜測,星形膠質細胞外泌體可能通過miRNAs介導的Erk信號通路調節神經元的可塑性。
綜上所述,OGD處理顯著影響星形膠質細胞外泌體miRNAs的表達。正常對照組、OGD和OGD/R處理組外泌體中高濃度分布的miRNAs均靶向作用于代謝相關通路,如PI3K-AKT、MAPK和mTOR等信號通路。

