D-二聚體、纖維蛋白原水平與尋常型銀屑病患者疾病活動性及銀屑病關節炎的相關性研究
陳詩潔,李 杰,張 娟
重慶市中醫院川渝共建感染性疾病中西醫結合診治重慶市重點實驗室/檢驗科,重慶 400021
尋常型銀屑病(PsV)是一種常見的、異質的、慢性炎癥性皮膚病,以增厚的紅色、鱗狀斑塊和全身炎癥反應為特征,PsV相關全身炎癥反應可導致關節破壞,比如銀屑病關節炎(PsA)[1],PsA是與銀屑病相關的慢性炎癥性肌肉骨骼疾病,可累及外周關節、脊柱、趾和附著點等,PsA還可導致疲勞、身體機能受限、睡眠障礙以及工作能力和社會參與度下降[2]。既往研究顯示銀屑病患者體脂蛋白代謝紊亂,多并發高脂血癥和動脈粥樣硬化[3],而血脂水平升高可激活血小板,銀屑病患者血小板處于高度活化狀態,發生血栓性疾病的風險高[4]。D-二聚體是一種可溶性纖維蛋白降解產物,由纖維蛋白溶解系統有序分解血栓產生,D-二聚體濃度增加提示血液處于高凝狀態,血栓形成風險增加[5]。纖維蛋白原(Fib)通過結合外部位點Ⅱ調節凝血酶,增加凝血酶活性,促使纖維蛋白凝塊形成,Fib水平升高與動靜脈血栓形成有關[6]。D-二聚體、Fib是否與PsV有關尚不清楚,目前缺乏相關報道,鑒于此,本研究擬探討D-二聚體、Fib與PsV疾病活動性以及合并PsA的關系,旨在為臨床診治,病情評估和分析提供參考。
1 資料與方法
1.1一般資料 選取2020年8月至2022年1月本院皮膚科收治的197例PsV患者(PsV組),男137例、女60例,年齡38~55歲、平均(45.20±7.63)歲;體質量指數(BMI)23~28 kg/m2,平均(25.52±2.41)kg/m2;PsV分型:點滴狀8例,斑塊狀189例;共病:2型糖尿病35例,高血壓49例、高脂血癥21例、脂肪肝26例、心血管疾病32例。納入標準:(1)符合《中國銀屑病診療指南(2018完整版)》中PsV診斷標準[7],(2)年齡18周歲以上。排除標準:(1)合并其他自身免疫疾病、急慢性感染、惡性腫瘤,(2)其他類型銀屑病,(3)妊娠或哺乳期女性患者,(4)近期服用免疫抑制劑或糖皮質激素者。根據是否發生PsA分為PsA組(30例)和非PsA組(167例),PsA診斷參考《中國銀屑病診療指南(2018完整版)》中標準[7]。根據銀屑病皮損面積和嚴重程度評分(PASI)[8]分為輕中度組(PASI≤10分,100例)和重度組(PASI>10分,97例)。另選擇同期于門診體檢的70例健康志愿者為對照組,男39例,女31例,年齡35~60歲,平均(46.01±7.29)歲;體質量指數(BMI)22~25 kg/m2,平均(24.02±1.39)kg/m2。PsV組和對照組性別、年齡、BMI比較差異無統計學意義(P>0.05),本研究已經獲得本院倫理委員會批準。納入研究者知情同意并簽署同意書。
1.2方法
1.2.1實驗室檢測 所有患者入組后均采集靜脈血7 mL,其中2 mL注入枸櫞酸鈉抗凝試管混勻離心(相對離心力2 192×g,5 min)取血漿,CP3000全自動凝血分析儀(日本積水)應用膠乳免疫比濁法檢測D-二聚體水平,CLAUSS法檢測Fib水平,Fib試劑盒購自上海太陽生物技術有限公司。3 mL注入干燥試管,離心處理后(相對離心力2 192×g,5 min)分離血清,采用雅培C16000全自動生化分析儀檢測甘油三酯(TG)、總膽固醇(TC)和空腹血糖(FPG)水平。余2 mL注入EDTA-K2抗凝管,深圳亞輝龍VISION-B紅細胞沉降率(ESR)檢測儀檢測ESR水平。
1.2.2臨床資料收集 收集年齡、性別、體質量指數(BMI)、PsV分型、共病、銀屑病家族病史、PASI評分等相關臨床資料。
1.3統計學處理 SPSS 25.00進行數據分析,符合正態分布計量資料(Kolmogorov-Smirnov法)以 表示,組間比較采用獨立樣本t檢驗。偏態計量資料以M(P25,P75)表示,組間比較采用Wilcoxon秩和檢驗。計數資料以例數或百分比表示,組間比較采用χ2檢驗。多因素Logistic回歸分析PsV合并PsA的相關因素。受試者工作特征曲線(ROC)分析D-二聚體、Fib診斷PsV合并PsA的價值。檢驗水準α=0.05。
2 結 果
2.1PsV組和對照組D-二聚體、Fib比較 PsV組血漿D-二聚體、Fib水平高于對照組(P<0.05),見表1。
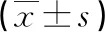
表1 PsV組和對照組D-二聚體、Fib差異
2.2不同疾病活動度PsV患者D-二聚體、Fib比較 重度組血漿D-二聚體、Fib水平高于輕中度組(P<0.05),見表2。
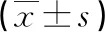
表2 不同疾病活動度PsV患者D-二聚體、Fib差異
2.3PsV合并PsA的單因素分析 PsA組PASI評分、ESR、血漿D-二聚體、Fib水平高于非PsA組(P<0.05),見表3。以PsV是否合并PsA為因變量(賦值:0=否,1=是),PASI評分、ESR、D-二聚體、Fib為自變量,逐步法排除無關變量(P>0.05),最終PASI評分、D-二聚體、Fib是PsV合并PsA的危險因素(P<0.05),見表4。
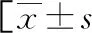
表3 PsV合并PsA的單因素分析結果或n(%)或M(P25,P75)]
2.4D-二聚體、Fib診斷PsV合并PsA的價值分析 建立回歸預測模型,Log(P/1-P)=8.597+0.635×D-二聚體+0.491×Fib,經ROC分析聯合D-二聚體、Fib診斷PsV合并PsA的曲線下面積大于D-二聚體、Fib單項檢測(Z=4.755、5.302,P<0.05),見表5和圖1。

表4 Logistic回歸分析PsV合并PsA的危險因素

圖1 D-二聚體、Fib診斷PsV合并PsA的ROC圖

表5 D-二聚體、Fib診斷PsV合并PsA的效能
3 討 論
銀屑病是一種復雜的慢性復發性炎癥性皮膚病,全球患病率約為2%,PsV是銀屑病最常見的類型,占所有銀屑病病例的90%,PsV病理特征為表皮棘層肥厚、過度角化和角化不全,其發病機制尚不清楚,目前公認由感染、抓撓、文身、β受體阻滯劑、鋰和抗瘧藥等非特異性誘因或某些特異性自身抗原誘發[9-10]。現有研究發現銀屑病患者多合并肥胖和代謝疾病,其頸總動脈和股動脈內膜中層厚度明顯增加,是早期動脈粥樣硬化的獨立危險因素[11]。已知凝血系統激活,纖維蛋白形成和血小板活化參與動脈粥樣硬化過程[12],因此推測凝血/纖溶系統異常可能與PsV有關。
D-二聚體是一種可溶性纖維蛋白降解產物,由纖維蛋白溶解系統降解血栓而產生,是凝血和纖維蛋白溶解激活的標志物,與血栓性疾病密切相關[13]。臨床研究顯示血漿D-二聚體水平過高與缺血性腦卒中、冠狀動脈粥樣硬化性心臟病的患病風險增加有關[14]。本研究發現PsV組血漿D-二聚體水平高于對照組,且D-二聚體水平隨著PsV疾病活動度增加而增高,表明D-二聚體與PsV發生和進展有關。分析原因為PsV全身炎癥反應刺激下,導致血管內皮結構破壞,血管內皮損傷后,血管性血友病因子與暴露內皮下基質結合而激活、黏附和聚集血小板,導致凝血酶的產生和纖維蛋白的形成,從而導致纖維蛋白降解產物的產生增加,即D-二聚體水平增高[15]。本研究進一步分析D-二聚體水平升高與PsV合并PsA有關,表明D-二聚體升高與PsV進展為PsA有著密切的關系。D-二聚體作為血栓炎癥因子,其水平升高不僅反映血液高凝狀態,也反映炎癥反應狀態[15],D-二聚體已被報道在類風濕關節炎患者中顯著升高,且與疾病活動度呈正相關[16]。分析原因為凝血系統與免疫炎癥系統存在相互作用機制,促炎細胞因子可激活凝血因子,并下調抗凝因子,導致血小板增多和高反應性,同時凝血因子還可激活蛋白酶激活受體介導促炎因子產生[16],進而增強PsV疾病活動性,促使疾病進展為PsA,因此D-二聚體作為反映凝血系統激活最常用的指標,其水平增高與PsV進展為PsA可能有關。
Fib是參與血液凝固級聯過程的關鍵因素,主要在白細胞介素-6 誘導下在肝臟中合成并釋放于外周血漿中,Fib水平在炎癥期間顯著增加,通過與纖溶酶原、F、玻連蛋白和纖連蛋白相互作用參與凝血過程的最后階段并轉化為纖維蛋白,形成血凝塊。血漿Fib濃度增加可加速動脈粥樣硬化的進展,增加心血管疾病的風險[17]。本研究發現Fib同樣在PsV患者中增高,且與PsV疾病活動度以及進展為PsA有關。ALPSOY等[18]報道指出銀屑病患者血清Fib水平升高,Fib水平升高與主動脈張力和主動脈順應性降低,β-僵硬指數增加有關。銀屑病作為炎癥性疾病,其發病與白細胞介素-6炎癥信號通路激活有關,銀屑病患者血清IL-6水平明顯增高[19],白細胞介素-6通過 Janus酪氨酸激酶/信號轉導和轉錄活化因子途徑誘導Fib合成和釋放,引起外周血漿中Fib水平增高[20]。同時Fib在激活和介導炎癥過程中也起著關鍵作用,Fib可激活免疫細胞,促進單核細胞中白細胞介素6和腫瘤壞死因子-α等促炎細胞因子合成[21],導致和加劇關節炎的發生。因此Fib水平可反映PsV疾病活動度和病情進展。
ROC分析D-二聚體聯合Fib診斷PsV合并PsA具有較高的效能,高于單獨D-二聚體和Fib,表明D-二聚體、Fib可作為PsV合并PsA的生物學指標,這為臨床PsV發生PsA的風險評估提供了一定參考。
綜上所述,PsV患者外周血D-二聚體、Fib水平均增高,高D-二聚體、Fib與PsV疾病活動度以及PsA的發生有關,D-二聚體、Fib可作為PsV的潛在生物學標志物。通過降低D-二聚體、Fib水平可能有助于抑制PsV病情進展。本研究創新之處在于首次闡述了D-二聚體、Fib與PsV以及發生PsA的關系,為臨床病情分析和治療提供了新的思路和參考,局限之處在于尚未分析D-二聚體、Fib與PsV治療反應的關系,望在以后研究中繼續開展對D-二聚體、Fib的動態監測,以發現和探索新的研究成果。

