活膝湯對膝骨關節炎模型大鼠軟骨細胞焦亡的作用機制
謝 芳,劉永利,李樹冬,戴斌玉,劉 濤,陳紹軍*,邵先舫*
1.湖南省中醫藥研究院附屬醫院,湖南 長沙 410006;2.海口市中醫醫院,海南 海口 570216;3.湖南中醫藥大學附屬常德醫院,湖南 常德 415000
膝骨關節炎(knee osteoarthritis, KOA),是以關節軟骨退變、滑膜炎性增生、軟骨下骨質硬化以及關節周圍骨贅形成為主要病理表現的臨床常見退變性疾病[1]。 在KOA 的進展過程中,無菌性炎癥既能導致關節的疼痛、腫脹,也是KOA 持續進展的內在因素。機體無菌性炎癥反應過程中由趨化因子配體2(CC chemokine ligand 2, CCL2)及其受體(CC chemokine receptor 2, CCR2)介導的免疫應答以及核因子-κB(nuclear factor-kappa B, NF-κB)信號通路介導的促炎信號反應發揮了重要作用,而且CCL2/CCR2 信號軸及NF-κB 信號通路也是目前研究KOA 發病機制的重要切入點[2-3]。
細胞焦亡是由半胱氨酸天冬氨酸蛋白酶(Caspase)介導的與炎癥反應高度相關的細胞程序性死亡方式。 軟骨細胞焦亡是關節軟骨退變的重要方式之一,抑制軟骨細胞焦亡是保護軟骨細胞,防治KOA疾病進展的關鍵所在[4]。 活膝湯是湖南省名中醫邵先舫教授根據獨活寄生湯加減而來,在臨床應用中療效顯著[5],但活膝湯干預KOA 的分子機制尚未明確。本研究結合目前研究熱點及前沿,以軟骨細胞焦亡、CCL2/CCR2、NF-κB 信號通路為立足點探討活膝湯干預KOA 的分子機制。
1 材料與方法
1.1 實驗材料
1.1.1 實驗動物 選取8 周齡SPF 級雄性Sprague-Dawley 大鼠(體質量200~220 g)32 只。 所有大鼠均購自湖南斯萊克景達實驗動物有限公司,合格證號:SCXK(湘)2019-0004。 本實驗大鼠在湖南中醫藥大學SPF 級實驗動物中心飼養,室溫20~25 ℃,相對濕度55%±5%,空氣流通,普通飼料飼養,自由飲食,燈光明暗循環各12 h。 實驗過程中遵循湖南中醫藥大學第一附屬醫院動物倫理委員會標準,實驗已由湖南中醫藥大學第一附屬醫院動物倫理委員會批準,批準號:ZYFY20210115。
1.1.2 實驗藥物 活膝湯組方(獨活15 g,桑寄生15 g,續斷 15 g,杜仲15 g,骨碎補 15 g,川牛膝15 g,秦艽10 g,茯苓10 g,細辛6 g,甘草6 g),以上藥物均由湖南中醫藥大學附屬常德醫院藥劑科提供。煎藥流程:每劑中藥在煎煮前先予以冷水浸泡30 min,除去藥材中的雜質,然后取出放入陶罐中,加入蒸餾水直至水面超過藥物4 cm 左右,首先武火煮至沸騰后改用文火繼續慢煎約30 min,濾出藥汁;再次加入蒸餾水直至超過藥渣約2 cm,同法煎制,將兩次的藥汁混合后,放入燒杯中加熱濃縮至122 mL(即每1 mL 藥液含1 g 原生藥材),靜置過濾取出藥汁,高壓滅菌,置4 ℃冰箱保存。 塞來昔布膠囊(200 mg/粒, 美國輝瑞制藥有限公司, 批號:s92534)。
1.1.3 實驗試劑 還原型SDS 上樣緩沖液(5)、10%APS、10% SDS、TEMED、PBST 緩沖液、30% Acr/Bic、電泳液緩沖液、轉膜緩沖液、麗春紅染液(10)、RIPA裂解液、蛋白磷酸酶抑制劑、Super ECL Plus超敏發光液(長沙艾碧維生物科技有限公司,批號分別為:AWB0055、AWB0093、AWT0047、AWB0068、AWI0130、AWB0020、AWB0083、AWC0114、AWB0225、AWB0136、AWH0650、AWB0005);蛋白酶抑制劑(北京金泰宏達生物科技有限公司,批號:583794);顯影液、定影液(上海佳信科技有限公司,批號分別為:BW-61、BW-62);瓊脂糖(西班牙BIOWEST 公司,批號:111860);上樣緩沖液(6)、mRNA 逆轉錄試劑盒(北京康為世紀生物有限公司,批號分別為:CW0610、CW2569);EDTA(大連美倫生物技術有限公司,批號:MB2514);Tris(美國Sigma 公司,批號:V900483);核酸染料(北京普利萊基因技術有限公司,批號:PB11141);CCL-2 抗體、Caspase-1 抗體(美國Thermo公司,批號分別為:PA5-34505、PA5-87536);CCR2抗體、β-actin 抗體、HRP 山羊抗鼠IgG、HRP 山羊抗兔IgG(美國Proteintech 公司,批號分別為:16153-1-AP、66009-1-Ig、SA00001-1、SA00001-2);p-p65抗體(英國Abcam 公司,批號:ab76302)。
1.1.4 實驗儀器 H1650R 型臺式冷凍離心機 (湖南湘儀有限公司);DYY-6C 型電泳儀、DYCZ-24DN型電泳槽、DYCZ-40D 型轉膜儀(北京六一生物科技有限公司);GL-88B 型旋渦混合器(江蘇其林貝爾儀器制造有限公司);JB-13 型磁力攪拌器(上海儀電科學儀器股份有限公司);BioPrep-24 型生物樣品均質儀(杭州奧盛儀器有限公司);ChemiScope 6100型化學發光成像系統(上海勤翔科學儀器有限公司);PIKOREAL96 型熒光定量RCP 儀、SPL0960 型熒光PCR 板(美國Thermo 公司);YD-315 型切片機(金華市益迪醫療設備有限公司);BMJ-A 型包埋機(常州市中威電子儀器有限公司);BA210T 型普通顯微鏡、BA410T 型熒光顯微鏡(中國麥克奧迪科技有限公司)。
1.2 實驗方法
1.2.1 動物分組 32 只健康SD 大鼠,適應性飼養1 周。 先按照隨機數字表法隨機選取9 只大鼠作為正常組,不做任何干預措施;其余的23 只大鼠為造模組,行手術造模。造模后隨機從正常組和造模組分別取2 只大鼠留取膝關節標本對比驗證造模效果。造模成功后再按隨機數字表法將剩余的21 只大鼠隨機分成3 組:模型組、活膝湯組、陽性藥物組,每組7 只。
1.2.2 動物造模 采用改良Hulth 造模法[6]制備大鼠KOA 模型。 造模組大鼠予以水合氯醛行靜脈麻醉,麻醉后,固定大鼠。取右后膝關節,上端接近髖關節,下端接近踝關節,局部脫毛、備皮、消毒、鋪無菌巾。以大鼠膝關節內側入路顯露摘除內側半月板,剪斷前交叉韌帶,行前抽屜試驗,陽性則表示已剪斷前交叉韌帶。生理鹽水沖洗關節腔后逐層縫合,無菌敷料包扎傷口,不予固定。 術中注意勿損傷關節軟骨面,徹底止血,嚴格無菌操作。 手術后所有大鼠肌內注射青霉素80 000 U/只,連續3 d。 術后每日驅趕大鼠(包括正常組大鼠)進行負重活動,每次20 min,每日2 次,連續4 周。造模后分別從正常組和造模組各取2 只大鼠,麻醉處死后留取膝關節標本,觀察大鼠膝關節造模效果。大鼠膝關節軟骨表面形態改變,軟骨面粗糙,軟骨破壞,關節周圍可見骨贅形成表明造模成功[7]。
1.2.3 給藥方法 大鼠造模成功后,每日灌胃1次,灌胃劑量根據“人與動物體表面積折算的等效劑量比率表”換算。 正常組與模型組予以12.81 mL·kg-1·d-1蒸餾水,活膝湯組予以12.81 mL·kg-1·d-1活膝湯,陽性藥物組予以20 mg·kg-1·d-1塞來昔布(灌胃時溶解于12.81 mL·kg-1·d-1的蒸餾水中)。分別于給藥后第4周,留取大鼠膝關節軟骨組織標本,檢測相關指標。
1.2.4 大鼠膝關節軟骨組織病理形態學觀察 切開大鼠右后肢膝關節,肉眼觀察比較各組大鼠膝關節軟骨退變及滑膜增生情況。取部分軟骨組織,將組織浸泡在4%多聚甲醛溶液中,固定72 h;烤片、脫水后予以HE 染色,樹膠封片后顯微鏡觀察。取部分軟骨組織,烤片、脫水后予以番紅O-固綠染色,樹膠封片,顯微鏡觀察。
1.2.5 RT-PCR 檢測CCL2、CCR2、Caspase-1 mRNA 表達 應用Trizol 試劑提取組織總RNA,紫外分光光度計測定RNA 濃度。按照試劑操作盒說明書進行逆轉錄反應;以Actin 為內參進行,反應條件為95 ℃預變性10 min,95 ℃變性15 s,60 ℃退火60 s,重復40 個循環。 各基因表達水平用2-ΔΔCt方法進行統計。 所有引物序列運用Primer 5 軟件設計,由上海生工合成引物,RNA 引物序列見表1。

表1 RNA 引物序列
1.2.6 Western blot 檢 測CCL2、CCR2、Caspase-1、p-p65 蛋白表達 剪取約0.025 g 組織樣本,加入300 μL的RIPA 裂解液,裂解后提取蛋白;取120 μL 蛋白上清,加入30 μL×5 loading buffer 混勻,沸水煮5 min,放入冰盒中速冷備用。 電泳(75 V,130 min)、轉膜、封閉后用1×PBST 將一抗按照一定比例稀釋,將膜與一抗一起孵育,室溫放置90 min;用1PBST 稀釋HRP 標記的二抗,將稀釋后的二抗與膜共同室溫孵育90 min;使用ECL 化學發光液與膜孵育1 min,用濾紙吸盡液體,用塑封膜包裹雜交膜,在暗盒內與X 膠片曝光后顯影沖洗。
1.2.7 TUNEL-IF 雙染檢測軟骨細胞焦亡情況 60 ℃烤片12 h,切片脫蠟后蒸餾水浸洗,尿素胰酶抗原修復后切片依次置于硼氫化鈉溶液、75%乙醇溶液、蘇丹黑染液中漂洗,封閉后予以1×Equilibration Buffer 覆蓋待檢樣本區域,室溫孵育;加入50 μL TdT孵育緩沖液,37 ℃孵育60 min,PBS 沖洗,滴加適當稀釋的一抗(Caspase-1),4 ℃過夜;滴加50~100 μL抗-兔-IgG 標記熒光抗體,37 ℃孵育90 min;DAPI工作液37 ℃染核10 min,甘油封片后熒光顯微鏡下觀察。
2 結果
2.1 動物造模效果驗證
造模后分別從正常組和造模組各取2 只大鼠,麻醉處死后留取膝關節標本,肉眼直視可見正常組大鼠膝關節軟骨組織完整,表面光滑,未見明顯軟骨水腫或剝脫;造模組大鼠膝關節軟骨面粗糙,軟骨破壞,軟骨下骨暴露,關節周圍骨贅形成,證明造模成功。 詳見圖1。
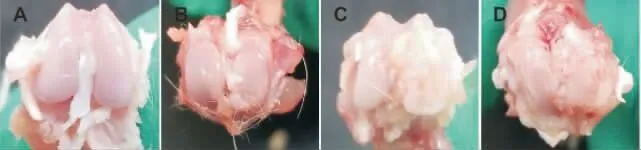
圖1 大鼠KOA 模型驗證
2.2 活膝湯對KOA 大鼠膝關節組織病理學的影響
肉眼直視下可見正常組大鼠膝關節軟骨組織完整,軟骨面光滑;模型組可見明顯的軟骨剝脫及軟骨下骨硬化;活膝湯組及陽性藥物組可見軟骨面的退變但無明顯軟骨剝脫,周圍無明顯骨贅形成。詳見圖2。
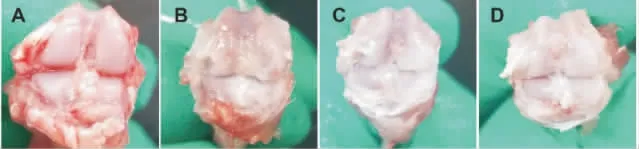
圖2 各組大鼠膝關節大體形態改變
軟骨組織HE 染色顯示,正常組大鼠軟骨細胞排列整齊,胞外膠原纖維染色情況下呈淺粉色未見明顯老化變性;模型組大鼠可見大量軟骨細胞壞死,細胞核皺縮消失,炎性細胞浸潤明顯,胞外膠原纖維染色明顯變深,膠原纖維透明變性;活膝湯組及陽性藥物組大鼠軟骨細胞存在一定程度的細胞壞死情況及炎性細胞浸潤,但較模型組明顯好轉。 詳見圖3。
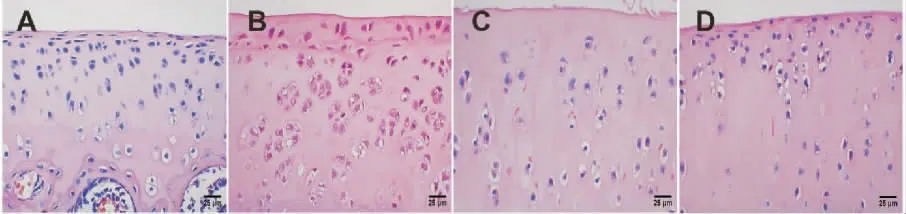
圖3 各組大鼠軟骨組織HE 染色(×400)
軟骨組織番紅O-固綠染色顯示,正常組軟骨細胞排列整齊,軟骨與軟骨下骨分界清楚。 模型組軟骨壞死剝脫嚴重,軟骨下骨增生硬化。 活膝湯組及陽性藥物組均存在軟骨細胞壞死,但未見明顯軟骨組織剝脫,軟骨細胞壞死情況較模型組明顯好轉。與陽性藥物組對比,活膝湯組軟骨細胞存活數量明顯增加,軟骨下骨硬化也有所緩解。 詳見圖4。
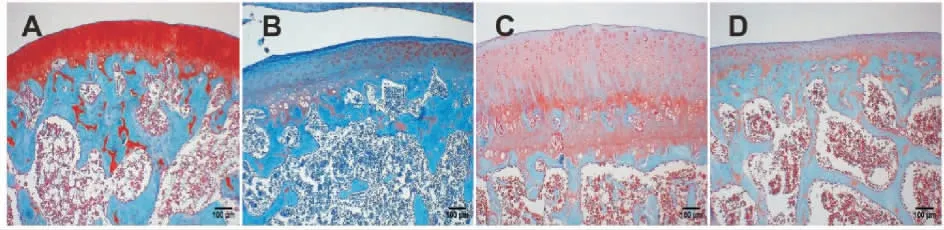
圖4 各組大鼠軟骨組織番紅O-固綠染色(×100)
2.3 活 膝 湯 對KOA 大 鼠 軟 骨CCL2、CCR2、Caspase-1 mRNA 表達的影響
與正常組比較,模型組大鼠關節軟骨中CCL2、CCR2、Caspase-1 mRNA 表達水平均明顯增高(P<0.01)。 與模型組比較,活膝湯組及陽性藥物組CCL2、CCR2、Caspase-1 mRNA 表達水平明顯降低(P<0.01)。與活膝湯組比較,陽性藥物組CCL2 mRNA 表達水平降低(P<0.05),CCR2、Caspase-1 mRNA 表達水平增高(P<0.05)。 詳見表2。
表2 活膝湯對KOA 大鼠軟骨CCL2、CCR2、Caspase-1 mRNA 表達的影響(±s,n=7)
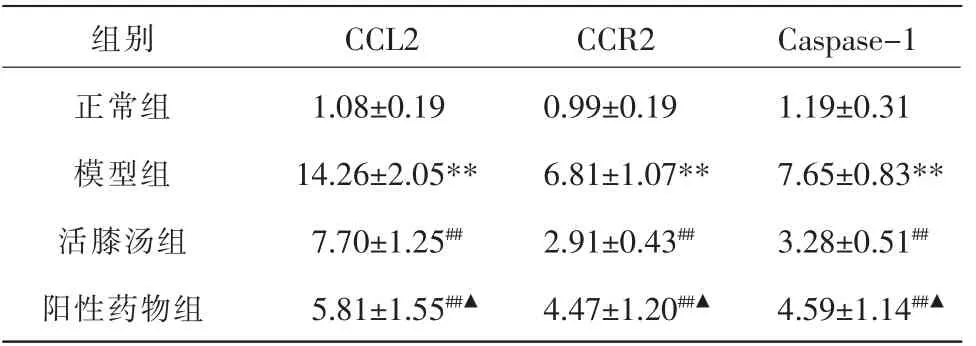
表2 活膝湯對KOA 大鼠軟骨CCL2、CCR2、Caspase-1 mRNA 表達的影響(±s,n=7)
注:與正常組比較,**P<0.01;與模型組比較,##P<0.01;與活膝湯組比較,▲P<0.05。
組別正常組模型組活膝湯組陽性藥物組CCL2 1.08±0.19 14.26±2.05**7.70±1.25##5.81±1.55##▲CCR2 0.99±0.19 6.81±1.07**2.91±0.43##4.47±1.20##▲Caspase-1 1.19±0.31 7.65±0.83**3.28±0.51##4.59±1.14##▲
2.4 活膝湯對KOA 大鼠軟骨CCL2、CCR2、Caspase-1、p-p65 蛋白表達的影響
與正常組比較,模型組大鼠關節軟骨中CCL2、CCR2、Caspase-1、p-p65 蛋白表達水平均明顯增高(P<0.01);與模型組比較,活膝湯組及陽性藥物組大鼠關節軟骨中CCL2、CCR2、Caspase-1、p-p65 蛋白表達水平明顯降低(P<0.01,P<0.05)。 與活膝湯組比較,陽性藥物組CCL2 蛋白表達水平降低,但差異無統計學意義(P>0.05);CCR2、Caspase-1、p-p65 表達水平增高(P<0.05,P<0.01)。 詳見圖5、表3。
表3 活膝湯對KOA 大鼠軟骨CCL2、CCR2、Caspase-1、p-p65 蛋白表達的影響(±s,n=3)

表3 活膝湯對KOA 大鼠軟骨CCL2、CCR2、Caspase-1、p-p65 蛋白表達的影響(±s,n=3)
注:與正常組比較,**P<0.01;與模型組比較,#P<0.05,##P<0.01;與活膝湯組比較,▲P<0.05,▲▲P<0.01。
組別正常組模型組活膝湯組陽性藥物組CCL2/β-actin 0.08±0.02 0.36±0.10**0.24±0.04#0.14±0.05##CCR2/β-actin 0.08±0.03 0.54±0.05**0.24±0.05##0.39±0.07##▲▲p-p65/β-actin 0.08±0.02 0.48±0.02**0.30±0.02##0.35±0.02##▲Caspase-1/β-actin 0.13±0.04 0.81±0.12**0.38±0.12##0.64±0.02#▲▲
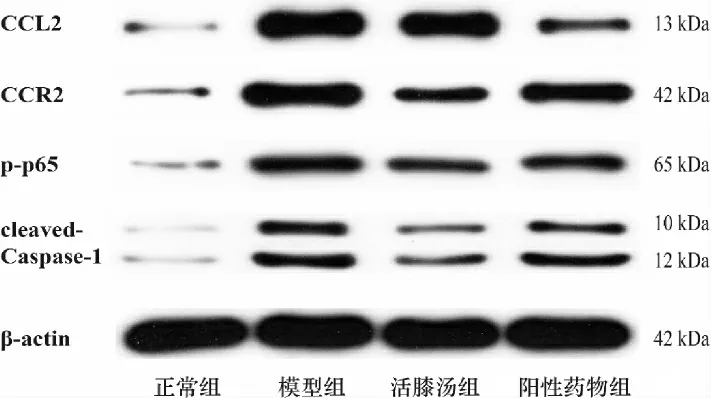
圖5 各組CCL2、CCR2、Caspase-1、p-p65 蛋白表達電泳
2.5 活膝湯對KOA 大鼠軟骨細胞焦亡的影響
與正常組對比,模型組大鼠Caspase-1 及Tunel熒光明顯增多,Caspase-1 介導的軟骨細胞焦亡水平增高。 與模型組對比,活膝湯組及陽性藥物組大鼠Caspase-1 及Tunel 熒光明顯減少,Caspase-1 介導的軟骨細胞焦亡水平降低。 詳見圖6。
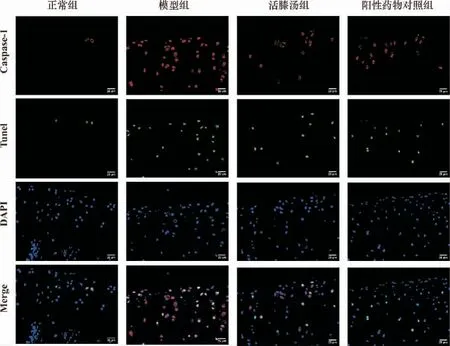
圖6 活膝湯對KOA 大鼠軟骨細胞焦亡的影響(×400)
3 討論
細胞焦亡是一種由炎性小體介導的炎性程序性細胞死亡方式,可破壞細胞的完整性并導致細胞內容物的釋放[8]。 目前研究最為深入的是由Caspase-1介導的經典細胞焦亡途徑,當細胞接受外界刺激信號后Caspase-1 前體與相關蛋白組裝成炎性小體,Caspase-1 前體在炎性小體的作用下裂解為Caspase-1,Caspase-1 激活后啟動下游的一系列機制,最終誘導細胞焦亡[9]。 據報道,在關節炎患者的滑膜積液中發現的炎性小體的表達水平是正常人的5 倍[10]。此外,GEN 等[11]在脂多糖誘導的KOA 模型大鼠中發現由Caspase-1 介導的軟骨細胞焦亡被激活,證明軟骨細胞焦亡是KOA 進展的重要因素。 本研究結果表明,與正常組對比,模型組大鼠膝關節直觀可見軟骨層明顯變薄,軟骨剝脫嚴重;軟骨組織病理染色可見模型組細胞壞死,軟骨下骨硬化。 RT-PCR 及Western blot 結果顯示,模型組軟骨組織中Caspase-1 表達顯著增多;組織熒光雙染結果也證明模型組軟骨組織中Caspase-1 表達及軟骨細胞壞死明顯增加, 這證明Caspase-1 介導的細胞焦亡途徑參與了軟骨退變的過程。
CCL2 是CCR2 的關鍵配體,宿主炎癥部位釋放CCL2 進入循環系統,CCL2 與白細胞表面的CCR2受體結合,通過CCL2 在循環系統中的濃度梯度的變化將免疫細胞遷徙至炎癥部分,完成其免疫細胞遷徙及免疫反應應答的作用[12]。 CCL2/CCR2 信號軸主要通過兩個途徑參與關節軟骨的退變過程。 一方面,退變關節的慢性炎癥釋放CCL2,CCL2 通過與CCR2 結合募集大量免疫細胞吸附于關節軟骨上,加重退變部位的炎癥反應加速軟骨退變[13]。 另一方面,退變部分的炎性滑膜及壞死的軟骨細胞釋放的CCL2 與軟骨細胞表面的CCR2 受體結合,啟動下游應答機制促進軟骨的降解[14]。 NF-κB 信號通路是研究KOA 病理機制的重要靶點,磷酸化p65(phosphorylated p65,p-p65)蛋白是NF-κB 信號通路激活的標志[15]。 NF-κB 信號通路通過上調膠原蛋白降解酶的表達以及促進軟骨細胞肥大等作用機制參與KOA 的病理過程[16]。 研究表明,NF-κB 信號通路激活后能上調炎性小體相關蛋白以及細胞焦亡效應底物的表達,從而促進Caspase-1 介導的經典細胞焦亡途徑[17-18]。 在本研究中與正常組對比,模型組大鼠軟骨組織中CCL2、CCR2、p-p65、Caspse-1 蛋白表達水平顯著增高,提示CCL2/CCR2 及NF-κB 信號通路可能通過上調Caspase-1 的表達促進軟骨細胞焦亡,證明了CCL2/CCR2 信號軸及NF-κB 信號通路對大鼠KOA 疾病進展的促進作用。
中晚期KOA 患者由于病邪入侵經脈,病程遷延反復,疾病由實證轉為虛證或虛實夾雜[19]。活膝湯由獨活、桑寄生等九味藥組方而成,方中:桑寄生、續斷、杜仲、骨碎補均入肝腎經,取其補益肝腎、強筋壯骨之功效,治病之根本,為君藥;獨活、茯苓祛濕消腫為臣藥;秦艽、細辛散寒止痛為佐藥;川牛膝活血通絡,引藥下行,甘草調和諸藥為使藥。 諸藥配伍,標本兼治,共奏補益肝腎、除濕散寒、活血通絡之功。現代藥理學研究顯示,活膝湯組方中的獨活[20]、桑寄生[21]、秦艽[22]、細辛[23]、茯苓[24]均具有抗炎的效果,其中桑寄生、細辛、秦艽的化學成分鎮痛效果優異。 本研究結果顯示,應用活膝湯干預后大鼠軟骨退變情況明顯改善,CCL2、CCR2、Caspase-1、p-p65 的表達水平顯著下降,提示活膝湯通過抑制CCL2/CCR2 信號軸以及NF-κB 信號通路的激活,調控Caspase-1介導的軟骨細胞焦亡,延緩大鼠膝關節軟骨的退變。 除此之外,與陽性藥物對照組比較,活膝湯組Caspase-1及p-p65 的表達水平更低,證明活膝湯對Caspase-1介導的軟骨細胞焦亡及NF-κB 信號通路的抑制作用要強于陽性對照藥物。在研究結果中,雖然CCL2、CCR2、p-p65 的表達變化趨勢同步變化,但CCL2/CCR2信號軸與NF-κB 信號通路在軟骨細胞焦亡途經中的相互調控作用仍需進一步的實驗證明。
綜上所述,活膝湯通過抑制Caspase-1 介導的軟骨細胞焦亡延緩大鼠膝關節軟骨的退變,其作用機制可能與活膝湯對CCL2/CCR2 以及NF-κB 信號通路的調控作用有關。本研究結果初步證實了活膝湯對軟骨細胞焦亡的抑制作用,為進一步研究活膝湯干預KOA 的具體分子機制提供了實驗依據。

