血清骨橋蛋白、膠質纖維酸性蛋白在腦膠質瘤診斷中的應用
張 娜, 尚金星, 龍 平, 王立平
(1. 河北省滄州中西醫結合醫院 檢驗科, 河北 滄州, 061000; 2. 河北省滄州市中心醫院 神經外科, 河北 滄州, 061000)
膠質瘤屬顱內常見的原發性腫瘤,起自神經膠質細胞,惡性程度較高[1]。腦膠質瘤通常預后較差,中位生存時間甚至不超過1年,且復發率高[2]。近年來,人們對于血液生物標志物的應用價值越來越關注,腫瘤患者的診斷、預后評估、治療指導等都是血液生物標志物使用時的重要考慮因素。骨橋蛋白(OPN) 屬于分泌性鈣結合糖磷酸化蛋白,可結合受體整合素及CD44, 對細胞產生趨化、黏附、遷移、增殖等促進作用,與惡性腫瘤侵襲關系密切[3]。膠質纖維酸性蛋白(GFAP)對神經元具有支撐與營養作用,參與星形膠質細胞的細胞增殖、分裂以及血腦屏障生理功能維護、自噬、神經遞質平衡維持等生物功能[4]。本研究分析腦膠質瘤患者血清OPN、GFAP水平變化,現報告如下。
1 資料與方法
1.1 一般資料
選取2019年3月—2021年5月83例腦膠質瘤患者為研究對象(腦膠質瘤組),其中男44例,女39例; 年齡37~75歲,平均(56.66±7.19)歲; 腫瘤部位為額葉46例,顳葉22例,頂葉8例,其他7例; 腫瘤≤3 cm者12例,>3~5 cm者39例,>5 cm者32例; 病理分級為Ⅰ級20例,Ⅱ級21例,Ⅲ級23例,Ⅳ級19例。納入標準: ① 經手術及組織病理學檢查證實為腦膠質瘤者; ② 預計生存期3個月以上者。排除標準: ① 合并腦外傷或有腦手術病史者; ②合并血管畸形、顱內占位者; ③ 合并嚴重顱內壓增高或腦疝者; ④ 合并免疫或血液系統疾病者; ⑤ 入組前接受化療、免疫治療者。將2019年3月—2021年5月顱內良性腫瘤住院患者20例納入顱內良性腫瘤組,男11例,女9例; 年齡36~76歲,平均(55.91±7.03)歲; 疾病種類為垂體瘤6例,腦膜瘤7例,神經鞘瘤5例,中樞神經細胞瘤1例,海綿狀血管瘤1例。另外選擇進行體檢的健康人群20例為對照組,其中男11例,女性9例; 年齡37~74歲,平均(57.03±7.40)歲; 腦膠質瘤組、顱內良性腫瘤組、對照組性別及年齡資料比較,差異無統計學意義(P>0.05)。
1.2 方法
腦膠質瘤組患者均行顯微鏡下腦膠質瘤全切或次全切除術,近距離充分暴露瘤體,顯微鏡下切除非功能區瘤體,術后Ⅰ~Ⅱ級患者次全切除者術后給予放射治療; Ⅲ~Ⅳ級者聯合放化療。術后2周行放射治療,靶區行60Co射線照射, 1.5~2.0 Gy/次, 5次/周,放射治療5周,靶區總劑量50 Gy。同時行化學治療,替莫唑胺(Merck Sharp & Dohme Ltd, 批準文號H20120420)口服劑量為150 mg/m2, 第1周1次/d, 第2周開始根據患者不良反應程度逐步遞增至200 mg/m2, 28 d為1個周期,共治療6個周期。
所有研究對象均于疾病診斷后以及術后第14天、放射和化學治療完成后晨起空腹取肘靜脈血5 mL, 以3 000轉/min離心15 min后取上清液, -80 ℃保存。血清OPN、GFAP的檢測采用雙抗體夾心酶標免疫分析法。每個酶標板孔加入稀釋液100 μL, 空白孔加樣品稀釋液50 μL, 標準孔、待測樣品孔分別加標準品、待測樣品50 μL, 混勻,室溫孵育2 h。吸除液體,甩干,緩沖液洗滌(4次),每孔分別加OPN、GFAP結合物2 000 μL, 酶標板貼覆膜,室溫下孵育2 h, 吸除液體,甩干,緩沖液洗滌(4次)。依序每孔加底物2 000 μL, 室溫下孵育30 min, 酶標板孔中溶液呈藍色,注意避光。以底物液相同順序加入終止溶液50 μL, 終止反應,酶標板孔中顏色由藍變黃。采用酶聯儀測量各孔光密度(OD)值。計算標準曲線直線回歸方程式,橫坐標為標準物水平,縱坐標為OD值,實際水平=OD值×稀釋倍數。試劑盒購自美國R&D公司。
1.3 統計學方法
采用SPSS 20.0對數據進行分析,組間不同時間點計量資料比較采用重復測量方差分析,多組間同一時點比較采用F檢驗,組間兩兩比較采用獨立樣本t檢驗,計數資料組間比較采用χ2檢驗或Fisher確切概率分析,通過受試者工作特征(ROC)曲線評估血清OPN、GFAP檢測對疾病的診斷和病理分級評估價值,P<0.05為差異有統計學意義。
2 結 果
2.1 2組血清OPN、GFAP水平比較
腦膠質瘤組血清OPN、GFAP表達水平高于顱內良性腫瘤組和對照組,差異有統計學意義(P<0.05), 見表1。
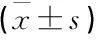
表1 2組血清OPN、GFAP水平比較
2.2 血清OPN、GFAP水平對腦膠質瘤的評估價值分析
血清OPN、GFAP聯合檢測評估發生腦膠質瘤的ROC曲線下面積為0.883, 高于OPN(0.793)、GFAP(0.789)單獨檢測(P<0.05), 見表2、圖1。

表2 血清OPN、GFAP水平對腦膠質瘤的評估價值分析
圖1 血清OPN、GFAP水平診斷腦膠質瘤的ROC曲線
2.3 不同病理特征腦膠質瘤患者血清OPN、GFAP水平比較
不同性別、年齡、腫瘤位置、腫瘤直徑、卡氏評分法(KPS)評分患者血清OPN、GFAP水平比較,差異無統計學意義(P>0.05); 世界衛生組織(WHO)分級為Ⅲ~Ⅳ級、腫瘤抑制基因P53基因型突變型、細胞增殖活性抗原Ki-67高表達腦膠質瘤患者血清OPN高于WHO分級為Ⅰ~Ⅱ級、P53基因型野生型、Ki-67低表達患者, GFAP水平低于WHO分級Ⅰ~Ⅱ級、P53基因型野生型、Ki-67低表達患者,差異有統計學意義(P<0.05), 見表3。
表3 不同病理特征腦膠質瘤患者血清OPN、GFAP水平比較
2.4 血清OPN、GFAP水平對腦膠質瘤WHO分級的評估分析
采用血清OPN、GFAP聯合檢測評估腦膠質瘤WHO分級。聯合檢測診斷Ⅲ~Ⅳ級腦膠質瘤ROC曲線下面積為0.792, 高于OPN(0.690)或GFAP(0.702)單獨檢測(P<0.05), 見圖2、表4。

圖2 血清OPN、GFAP水平對腦膠質瘤WHO分級評估的ROC曲線

表4 血清OPN、GFAP水平對腦膠質瘤WHO分級的評估分析
2.5 不同WHO分級腦膠質瘤患者治療前后血清OPN、GFAP水平比較
WHO分級為Ⅰ~Ⅱ級和Ⅲ~Ⅳ級腦膠質瘤患者術后第14天血清OPN、GFAP水平均較治療前降低,且放化療后患者血清OPN、GFAP水平進一步降低,差異有統計學意義(P<0.05); WHO分級為Ⅲ~Ⅳ級腦膠質瘤患者治療前、術后2周、術后6個月的血清OPN、GFAP水平均高于Ⅰ~Ⅱ級患者,差異有統計學意義(P<0.05), 見表5。
表5 不同WHO分級腦膠質瘤患者治療前后血清OPN、GFAP水平比較
3 討 論
膠質瘤屬于較難治愈的中樞神經系統腫瘤,早期誤診率、漏診率較高,且缺乏特異性診斷方法。膠質瘤侵襲性生長、易復發特征是導致臨床治療效果較差和患者不良預后的主要原因,即使采用手術治療,其5年生存率也極低[5]。腦膠質瘤侵襲受多種基因、蛋白共同調控,這一過程可能涉及腫瘤細胞黏附、增殖、基質降解、遷移等環節[6]。
OPN可促進腫瘤侵襲,是一種新的腫瘤標志物[7]。YU A Z等[8]研究在同一條件下檢測多種腫瘤OPN表達水平,結果顯示食管癌、胃癌、腸癌、肺癌、子宮內膜癌、卵巢癌中均發現OPN 過度表達。本研究也顯示,腦膠質瘤患者血清OPN呈現高表達,血清OPN評估發生腦膠質瘤的ROC曲線下面積為0.793, 可在一定程度上輔助臨床腦膠質瘤的診斷。OPN通過非螯合物前體肽精-甘-天冬氨酸三肽序列(RGD)依賴方式與癌癥干細胞標記物血細胞簇分化抗原44(CD44)結合,激活細胞內特異性信號傳導系統,破壞細胞外基質,誘導新生血管形成,促使腫瘤向周圍趨化、黏附、增殖、遷移,導致腦膠質瘤的發生和發展[9]。本研究顯示, WHO分級Ⅲ~Ⅳ級、P53基因型突變型、Ki-67高表達腦膠質瘤患者血清OPN水平高于Ⅰ~Ⅱ級、P53基因型野生型、Ki-67低表達患者,血清OPN評估腦膠質瘤WHO分級ROC曲線下面積為0.690, 提示OPN高表達有腦膠質瘤不良生物學行為。可能原因為: ① OPN依靠信號異常傳導并刺激正常細胞惡性生物行為轉化; ② 降解細胞外基質,促使腫瘤細胞浸潤遷移,刺激腫瘤生長,促進腦膠質瘤惡性發展[10]。
缺血損傷發生會刺激成熟星形細胞GFAP的合成[11]。PINA-MEDINA A G等[12]研究顯示,膠質瘤患者血清GFAP濃度高于顱內非膠質瘤組織以及正常腦組織機體血清水平,其濃度值在膠質瘤診斷中具有重要價值,尤其是頗內腫瘤來源診斷存在困難時,其陽性表達對于腫瘤組織屬于膠質細胞來源評估具有重要參考價值。本研究也顯示,腦膠質瘤患者血清GFAP呈高表達,且血清OPN評估發生腦膠質瘤的ROC曲線下面積為0.789, GFAP異常不僅可引起細胞骨架結構轉變,易于遷移、游動,還能導致骨架系統結構變化,干擾信號傳導,從而改變腫瘤細胞生物學性狀[13]。進一步分析結果顯示, WHO分級為Ⅲ~Ⅳ級、P53基因型突變型、Ki-67高表達的患者GFAP表達水平相較于Ⅰ~Ⅱ級、P53基因型野生型、Ki-67低表達患者更低,說明腦膠質瘤患者血清GFAP水平隨著腫瘤惡性程度的增高而降低,血清GFAP評估腦膠質瘤WHO分級的ROC曲線下面積為0.702, 提示下調GFAP表達可能導致腫瘤侵襲性增加,進一步增高惡性程度,這可能與GFAP基因表達調控及高甲基化有關,整合素表達隨GFAP表達下調,導致細胞外基質、細胞骨架分離溶解,細胞黏附力下降,腫瘤易擴散。研究[14]顯示,大部分惡性膠質瘤細胞系中, GFAP低表達與該基因呈高甲基化狀態有關,高甲基化狀態可導致GFAP轉錄失活。
本研究結果顯示,惡性程度低的腦膠質瘤患者與惡性程度高的患者放化療后血清OPN、GFAP水平低于治療前,提示治療過程中腫瘤細胞的增殖得到了一定抑制, OPN、GFAP合成及釋放減少。惡性程度低的腦膠質瘤患者治療前血清GFAP水平高于腦膠質瘤惡性程度高患者,但隨著治療時間的延長,患者血清GFAP水平大幅度降低,且術后2周、術后6個月后其水平均低于惡性程度高的患者。本研究不足之處在于未對不同療效患者血清OPN、GFAP變化情況進行探討,未分析其與患者預后的關系,后續研究過程中可進一步對比完全緩解、部分緩解、疾病穩定、疾病進展患者血清OPN、GFAP變化趨勢,并對患者進行隨訪,比較不同血清OPN、GFAP表達水平患者生存時間的差異。
綜上所述,腦膠質瘤患者血清OPN、GFAP呈高表達,其高度惡性患者血清OPN水平高于低度惡性患者, GFAP水平低于低度惡性患者,患者治療后血清OPN、GFAP水平均較治療前降低,兩者在腦膠質瘤的發生和發展中發揮作用。因此,干擾OPN、GFAP表達或可成為腦膠質瘤治療靶點之一。

