完全腹腔鏡下保留十二指腸胰頭全切除術4例臨床分析
阮一,成功,王邏邏,盧葉挺,周新華
胰十二指腸切除術(PD)于1935年由Whipple醫師提出[1],歷經多年發展,目前已成為治療胰頭及其周圍良惡性疾病的標準術式[2]。由于該手術涉及多器官切除及消化道重建,故難度大、并發癥率高、患者術后生活質量差。Beger等[3]于1980年提出了保留十二指腸的胰頭部分切除術,用于慢性胰腺炎的治療。此后該術式緩慢發展,衍生出一些改良術式,如Frey、Hamburg手術,其治療效果也被臨床肯定[4-6],并在近年演變為保留十二指腸的胰頭全切除術(DPPHR)[7]。然而,在腹腔鏡胰十二指腸切除術(LPD)已普及的情況下,仍鮮有醫療中心開展腹腔鏡下保留十二指腸胰頭全切除術(LDPPHR)。本研究回顧性分析寧波市醫療中心李惠利醫院肝膽胰外科4例行LDPPHR患者的臨床資料,探討LDPPHR的可行性及短期效果,現報道如下。
1 資料與方法
1.1 一般資料 收集2020年4月至2022年6月期間4例于寧波市醫療中心李惠利醫院住院行LDPPHR患者的臨床資料。收集其圍手術期資料,包括美國麻醉師分級(ASA)、手術時間、術中出血量、術后住院時間、術后并發癥發生情況及隨訪結果等。本研究通過寧波市醫療中心李惠利醫院倫理委員會審批,所有患者術前均詳細溝通病情并簽署知情同意書。
1.2 方法 患者取仰臥位,主刀醫生站于右側,采用扇形五孔法布局。常規探查腹腔,打開胃結腸韌帶,解離胃結腸融合系膜,廣泛下降橫結腸系膜至完整暴露胰頭十二指腸,找到Henle’s干及腸系膜上靜脈(SMV)。離斷Henle’s干,游離腸系膜上靜脈尾側段后向左側沿胰腺背側下緣游離解剖出脾靜脈,同時拓展胰后隧道。懸吊牽引胃體,在胰腺上緣游離出肝總動脈、肝固有動脈及胃十二指腸動脈(GDA),在肝總動脈后方游離出門靜脈及暴露膽總管左前側壁,貫通胰后隧道,離斷胰腺頸部。懸吊GDA,沿GDA分離出胃網膜右動脈及胰十二指腸上前動脈后結扎離斷,進一步暴露胰頭。以十二指腸水平部與胰腺鉤突之間的融合筋膜為切入點,緊貼胰腺實質游離胰腺鉤突,注意保護十二指腸系膜的完整性,找到胰十二指腸下前弓主干,沿途用超聲刀仔細離斷其供應胰腺的細小分支后循主干找到胰十二指腸下動脈(IPDA)及胰十二指腸下靜脈(IPDV)根部。向左牽引腸系膜上靜脈,在鉤突系膜內向頭側、右側翻書式離斷鉤突,此過程中會離斷數支進入胰腺鉤突的靜脈屬支并顯露胰十二指腸下后弓,注意保護后弓的完整性,在胰后筋膜前方緊貼胰腺往胰頭部游離至十二指腸側緣,全程顯露膽總管至膽胰匯合處,于根部結扎離斷主胰管。繼續在十二指腸膽總管之間游離胰腺,為保護膽總管血運,此處可殘留少許胰腺實質,直至完整切除胰頭,見圖1,標本送快速冰凍病理檢查明確腫塊性質及切緣。胰腸吻合采用胰腺空腸Roux-en-Y雙荷包吻合法[8],沖洗后于胰頭創面及胰腸吻合口附近放置引流管。
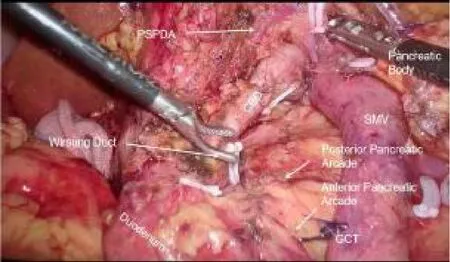
圖1 LDPPHR完成后創面
1.3 圍手術期管理 患者術前均完善相關檢查,排除惡性腫瘤可能及其他手術禁忌證。貫徹快速康復理念(ERAS),術前不常規留置胃管。術后第一天即拔除胃管尿管,予流質飲食,并囑患者下床活動。術后第3、5及7天查引流液淀粉酶,如無明顯胰漏及膽漏則逐步拔除引流管,術后第5~7天常規復查增強CT。
1.4 觀察指標(1)一般情況:年齡、性別、體質量指數(BMI)、ASA分級、術前白蛋白水平、總膽紅素水平及糖抗原-199(CA-199)水平。(2)術中基本情況:手術時間、術中出血量、術中輸血情況、胰管直徑、胰腺質地及最終手術方式。(3)術后恢復情況:術后排氣時間、住院時間及術后并發癥發生情況。(4)術后病理結果。(5)術后隨訪:患者生活質量,有無遠期并發癥,體質量情況等。采用門診復查及電話回訪追蹤患者術后情況,截止2022年7月。術后1年內囑患者每3個月門診復查1次,包括血常規、肝功能,每年復查增強CT或增強MRI。根據復查結果動態決定后續復查治療方案。
2 結果
2.1 一般資料 4例患者中女3例,男1例;中位年齡63(28~73)歲,平均BMI 23.19(20.08~27.85)kg/m2。術前白蛋白、總膽紅素、CA-199均基本正常。其中2例患者因反復右上腹隱痛就診發現胰頭占位,另2例患者為常規體檢發現,平素無腹痛黃疸等不適。4例患者綜合術前實驗室及影像學檢查,均提示良性占位。
2.2 術中情況 4例患者均順利完成手術,均未出現腫瘤破裂。其中1例男性患者因胰尾合并胰腺導管內乳頭狀黏液性腫瘤,加行保留脾臟的胰尾切除術。所有患者術中均未游離Kocher切口,均離斷胰十二指腸上前動脈并完整保留胰十二指腸血管后弓。手術平均時間355(286~420)min,術中平均出血量200(100~400)ml,均未輸血,胰管直徑在2~5 mm,胰腺質地2例軟,2例中等,術中冰凍病理均提示胰頭良性病變及陰性切緣。
2.3 術后并發癥 2例患者術后無出血、膽漏、胰漏、十二指腸穿孔及胃排空障礙等并發癥,1例患者術后僅有胰腺生化漏。1例加行胰尾切除術的患者術后發生胰漏并于術后第7天出現胰腸吻合口出血,表現為嘔血黑便,經再次手術切除殘余胰腺后治愈。
2.4 術后隨訪 4例均獲隨訪,隨訪時間12.75(1~25)個月。除1例胰腸吻合口出血再次手術患者因切除全部胰腺,術后出現糖尿病及消化不良伴體質量減輕,生活質量較差,其余患者均恢復良好,無腹痛腹瀉黃疸等不適主訴,體質量無明顯下降,生活質量幾乎無影響。3例患者術后復查增強CT無腫瘤復發證據,1例患者術后尚未復查增強CT,見表1。
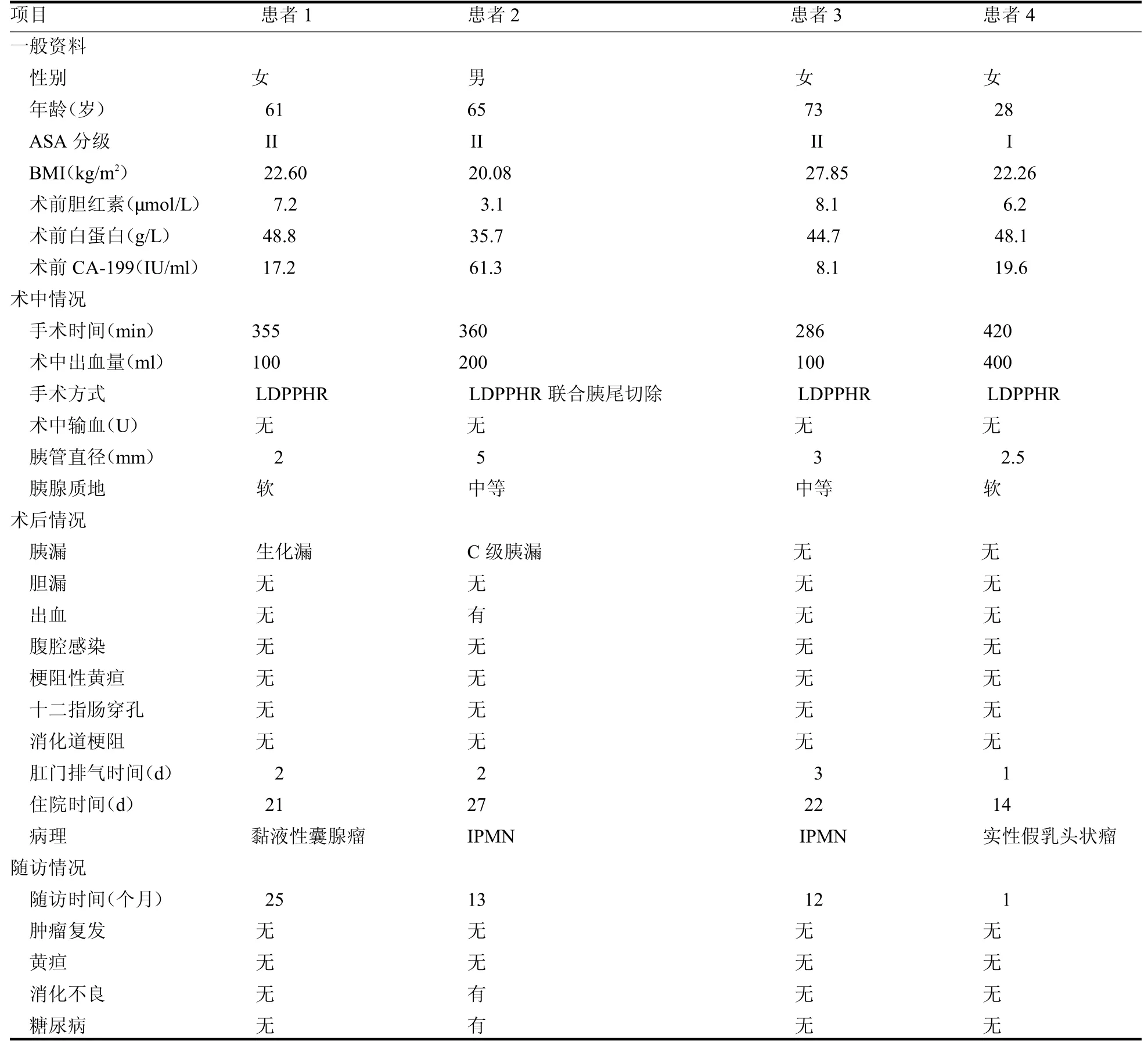
表1 4例患者臨床資料
3 討論
隨著微創理念及技術的發展,胰頭良性疾病的手術治療逐漸摒棄了傳統的胰十二指腸切除術,轉而走向器官功能保留及微創方向,逐步誕生出保留幽門的胰十二指腸切除術、保留十二指腸的胰頭部分切除術(如Beger、Hamburg等術式),直至發展到DPPHR手術。相較于傳統的保留十二指腸的胰頭部分切除術殘留了大量胰腺組織且不能保證膽總管的完整性,DPPHR手術不僅切除了胰頭幾乎所有的胰腺實質組織,還完整保留了十二指腸及膽總管,從而減少了吻合口數量、降低了術后胰漏的風險[9],并在良性和低度惡性腫瘤方面獲得與傳統PD手術相仿的腫瘤學治療效果[10-11]。LDPPHR則將保留功能的胰頭良性疾病微創治療推向頂峰,是胰腺手術的未來發展方向。
LDPPHR相較于常規的LPD手術更為復雜,對于胰頭區解剖的認知與理解是開展此手術的前提條件。胰頭區域誕生于胚胎時期前腸與中腸的交界處,由背胰、腹胰及周圍消化道經過復雜的旋轉融合而形成,由腹腔干分支及腸系膜上動脈分支雙重供血[12]。由于各系膜高度融合,其復雜的膜解剖在LDPPHR手術中并不起到主導地位,而胰頭十二指腸血管弓則是該手術的核心對象,LDPPHR手術也是圍繞著該血管弓來進行的。經典的胰頭十二指腸血管弓由經胃十二指腸動脈(GDA)發出的胰十二指腸上前上后動脈與經腸系膜上動脈(SMA)發出的胰十二指腸下前下后動脈互相吻合而成,其缺乏次級血管弓,邊緣血管直接由主干發出,且前后弓之間存在廣泛的交通支[13]。據文獻報道,胰十二指腸血管弓變異極多,其前弓的不完整性可高達50%,而后弓的不完整性僅為5%~20%[14]。
LDPPHR手術成功的關鍵是保護十二指腸及膽總管的完整性,同時保留足夠的十二指腸、乳頭及膽總管血供,從而保證術后這些器官的功能不受影響,實現真正的器官功能保留。由于十二指腸及膽總管非常容易辨識并保留,故手術的核心其實在于這兩者血供的保護,也就是胰頭十二指腸血管弓的找尋與解剖。因為胰十二指腸血管前弓常不完整也不是膽總管及十二指腸的主要供血來源且常穿行于胰腺實質內,完整游離困難,故可在手術早期離斷胰十二指腸上前動脈,以協助暴露胰頭上部及減少出血。
十二指腸的血供保護較為簡單,僅需保護好前后弓的一部分即可。謝彬等[7]建議在開放DPPHR手術中常規做Kocher切口以協助游離,但筆者認為該步驟不適合在LDPPHR手術中應用,基于以下原因:(1)游離Kocher切口會損傷十二指腸可能存在的后腹膜交通血管[14];(2)開放手術中游離Kocher切口可以更好的掌握并翻轉胰頭,有利于胰十二指腸前后弓的找尋,而腹腔鏡手術視野的獨特性決定了即使做了Kocher切口,也無法像開放手術那樣翻動胰頭,對于手術幾乎無益處。
膽總管胰腺段血供主要由胰十二指腸上后動脈及相關屬支與交通支供應,多位于十二指腸膽總管間溝內,故有學者認為在此處殘余少許胰腺組織有利于保護該段血管。十二指腸乳頭血供多來源于胰十二指腸前后弓交通支,少部分來源于后弓,極少數來源于前弓[15],故保留膽總管及十二指腸乳頭血供的核心就在于保護胰十二指腸血管后弓,這也是LDPPHR手術的最核心點與難點,甚至是關系到手術成功與否的決定性因素。
筆者團隊結合自身手術經驗,認為保護胰十二指腸血管后弓需做到以下幾點:(1)建議選擇胰腺鉤突尾側左側入路,從胰腺鉤突系膜與十二指腸水平部系膜的融合筋膜層面入手,在此層疏松組織內游離胰腺,注意保持十二指腸系膜及Treitz筋膜的完整性,找到胰十二指腸血管弓前后下弓并予以保護;(2)沿腸系膜上動脈離斷胰腺鉤突時,不同于胰十二指腸切除術,僅需沿胰腺表面剝離胰腺實質,盡量不要損傷鉤突系膜,同時需注意保護胰十二指腸下動脈(IPDA)及胰十二指腸下靜脈(IPDV)根部,如不慎離斷,可能造成手術失敗;(3)胰腺實質的游離宜采用尾側向頭側,左側向右側,呈翻書式剝離,但當難度太大時,亦可從右側尋找突破口;(4)游離至膽總管邊緣時,需注意分辨膽胰匯合處,注意保護膽總管末端,結扎離斷主胰管,同時也需要注意有無副胰管存在。因膽總管常部分埋藏于胰腺實質內,故游離膽總管過程中常需切開胰腺實質,造成出血,遮蔽視野,注意此處止血需輕柔,切忌粗暴電凝,可考慮使用細血管縫線縫扎止血,避免對膽總管及后弓血管造成電熱副損傷,引起術后膽漏或遠期狹窄;(5)能量器械的選擇,由于胰十二指腸血管弓纖細脆弱,盲目使用電刀可能造成不可逆損傷,特別是血管弓側的處理應當尤其小心,筆者建議使用超聲刀精準確切地離斷血管弓通往胰腺的分支,如胰腺表面出血可使用雙極電凝止血,效果良好;(6)可運用熒光腹腔鏡等技術示蹤膽總管,進一步減少膽總管損傷的概率[16]。
對于胰頭良性腫瘤的患者,除外導管內乳頭狀黏液性腫瘤可能存在明顯的胰管擴張及胰腺纖維化,其他諸如囊腺瘤、實性假乳頭狀瘤等患者,其胰腺往往質地較軟、胰管不擴張,故胰腸吻合口較惡性腫瘤患者往往更容易產生術后胰漏。筆者建議胰管較粗的患者使用導管對黏膜吻合,胰管直徑較細的患者可考慮使用雙荷包吻合。
綜上所述,LDPPHR相較傳統LPD手術,理論上保留了大量器官功能,患者長期生活質量好。相對于開放的DPPHR手術,術中觀察更仔細、操作更精細,切口小,愈合快。但LDPPHR手術操作難度大,適應證窄,手術量少,大胰腺中心尚未成熟開展,亦未形成流程化及模式化,僅有少量文獻報導[17-18]。筆者團隊在接近200例LPD經驗下手術仍非常困難且耗費時間較長,故建議該手術需要在經驗豐富的胰腺外科醫生帶領下謹慎開展[19]。本研究中有1例患者因同時切除胰頭及胰尾,造成了嚴重的C級胰漏,其余3例患者均恢復良好,手術效果顯著,術后生活質量佳。但由于研究樣本較小,且為回顧性分析,所以LDPPHR治療胰頭良性腫瘤的安全性、遠期療效仍需進一步研究證實。
利益沖突 所有作者聲明無利益沖突
作者貢獻聲明 阮一:實驗操作、論文撰寫;成功、王邏邏:數據整理、統計學分析;盧葉挺、周新華:研究指導、論文修改、經費支持

