難治性膜性腎病患者腎組織IgG亞型以及臨床特點分析
紀春陽,邊學燕
特發性膜性腎病(IMN)是成人腎病綜合征的常見病理類型,近年來發病率逐年升高,且呈年輕化趨勢。2009年發現的M型磷脂酶A2受體(PLA2R)在IMN的研究中具有跨時代的意義[1],PLA2R及其抗體可以作為IMN患者疾病鑒別診斷、病情監控和預測轉歸的新標志物[2-4]。KDIGO指南已明確將PLA2R抗體水平和變化趨勢作為IMN危險分層以及指導免疫治療的重要監測指標。但臨床實踐中發現部分難治性膜性腎病患者的臨床特點不能單用PLA2R抗體滴度水平來預測。本研究分析寧波市第一醫院收治的22例難治性膜性腎病患者的臨床及病理特點,為臨床精準化治療提供依據,報道如下。
1 對象與方法
1.1 研究對象 選取2021年1-12月在本院腎活檢診斷為膜性腎病,并根據治療指南需要免疫抑制劑治療的新發患者40例。納入標準:(1)年齡>18歲;(2)腎活檢前未進行糖皮質激素及其他免疫抑制劑治療;(3)排除系統性紅斑狼瘡、乙肝相關性腎炎及腫瘤相關性腎炎等繼發性膜性腎病;(4)根據指南需要起始免疫抑制劑治療或經過半年保守治療仍未緩解的患者。排除繼發性膜性腎病可能性的IMN患者。本研究獲得寧波市第一醫院醫院醫學倫理委員會審核批準。
1.2 研究方法 所有患者在入院時即行血清PLA2R抗體檢測,根據膜性腎病治療指南選取需要免疫抑制劑治療,同時所有患者均給予能夠耐受ARB類藥物治療。經過半年觀察,所有患者再次行血清PLA2R抗體檢測,并根據治療效果分為緩解組(包括完全緩解及部分緩解)和未緩解組,觀察未緩解患者臨床以及病理特點。
1.3 療效評價(1)完全緩解(CR):尿蛋白尿<0.3 g/d,血漿白蛋白>35 g/L,水腫消失,腎功能穩定。(2)部分緩解(PR):尿蛋白量0.3~3.5 g/d,血漿白蛋白>30 g/d,水腫消失,腎功能穩定。(3)無效(NR):尿蛋白>3.5 g/d,血漿白蛋白<30 g/L,伴水腫或腎功能惡化。
1.4 觀察指標 收集入選患者行腎活檢時的臨床及實驗室資料,包括患者腎穿后使用免疫抑制情況、化驗指標、病理指標及緩解情況等。(1)基本資料:患者性別、腎活檢時年齡、基礎血壓、體質量指數(BMI);(2)腎臟病變評估:血清肌酐(Scr)、血漿白蛋白(Alb)、24 h尿蛋白(24 h UPro)、治療前后血清PLA2R抗體滴度;(3)免疫指標:腎臟組織IgG亞型。腎臟活檢組織部分于10%中性甲醛固定,在穿刺后1周內送廣州金域行HE、PASM、PAS、Masson染色,直接免疫熒光法檢測腎組織各IgG亞型沉積情況以及PLA2R沉積情況,半定量記錄熒光強度,從陰性到最強,記錄為0到4+。熒光強度≥1+定義為陽性,3+、4+定義為強陽性,保存記錄結果。
1.5 統計方法 實驗數據用SPSS 20.0統計軟件進行分析,計量資料以均數±標準差表示,兩組比較用t檢驗;計數資料比較采用2檢驗。P<0.05表示差異有統計學意義。
2 結果
共納入原發性膜性腎病40例,其中男28例,女12例;年齡25~84歲,平均(53.0±10.7)歲。經過半年觀察按照標準符合未緩解(難治性膜性腎病)患者22例,緩解患者18例。在22例未緩解患者中,6例起始治療方案為激素聯合環磷酰胺,16例起始治療為利妥昔單抗治療。緩解患者14例為激素聯合環磷酰胺,4例使用利妥昔單抗。
未緩解組患者男性占比高于緩解組,年齡大于緩解組,BMI>25 kg/m2例數多于緩解組,腎活檢組織IgG3陽性的患者多于緩解組(均P<0.05)。兩組高血壓例數,24hUPro,Alb,Scr,腎小管萎縮程度,PLA2R、IgG1、IgG2、IgG4免疫熒光差異均無統計學意義(均P>0.05),見表1。兩組治療前后PLA2R抗體水平及治療后血清PLA2R轉陰例數差異均無統計學意義(均P>0.05),見表2。
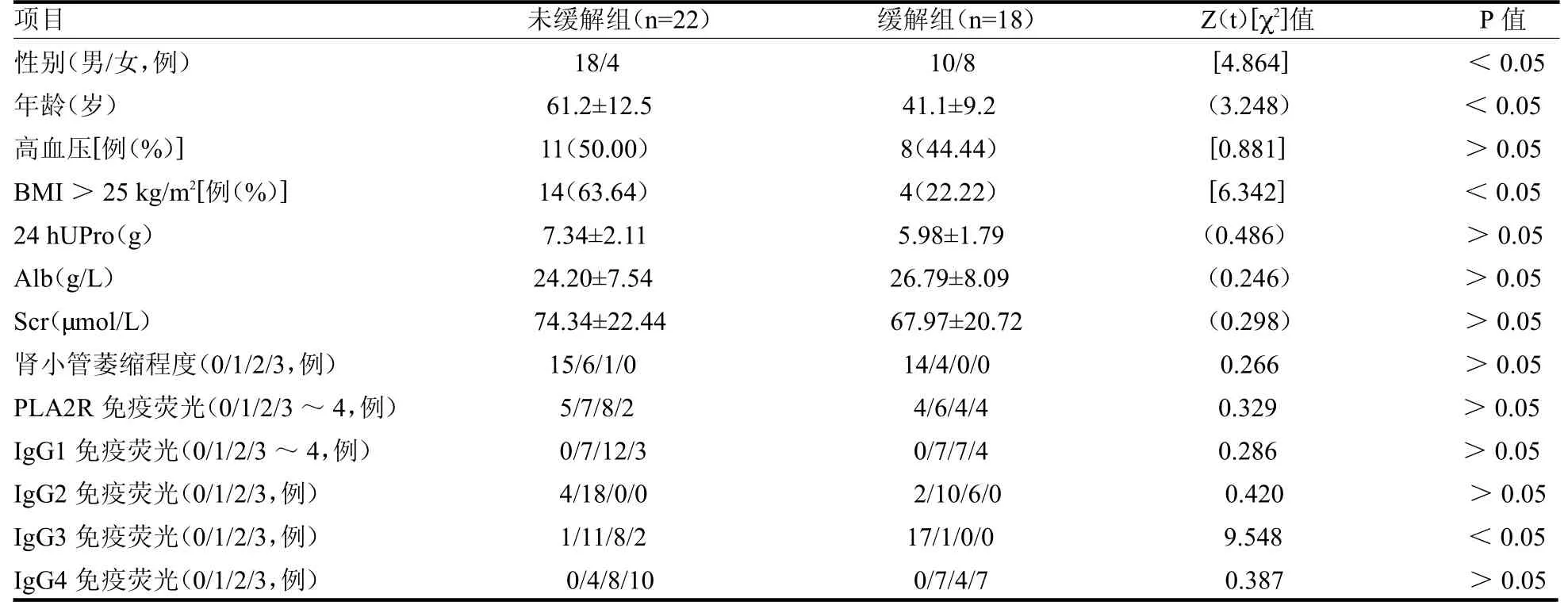
表1 未緩解組與緩解組膜性腎病患者組間臨床與病理指標比較
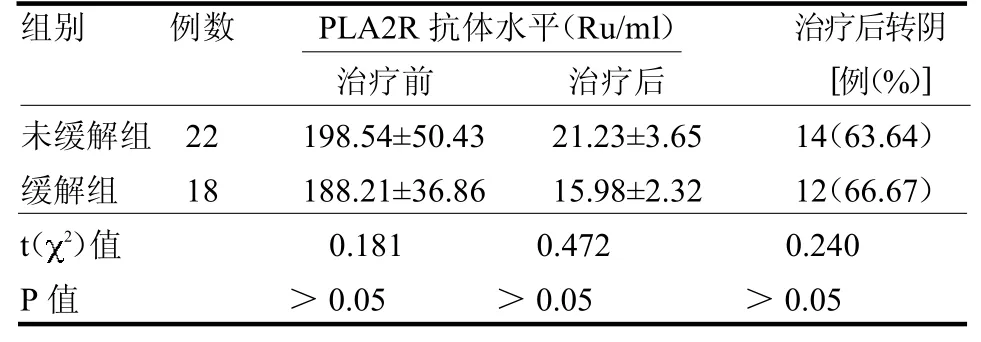
表2 未緩解組與緩解組血清PLA2R抗體水平及轉陰率比較
未緩解組中1例IgG3陰性患者的腎臟病理提示合并中度腎小管-間質損傷。緩解組中1例IgG3陽性患者,肥胖合并高血壓,在給予利妥昔單抗治療的同時,給予4倍劑量的血管緊張素Ⅱ受體拮抗劑(ARB)類藥物,并予減肥,患者體質量下降20 kg左右,半年后蛋白尿降至1.0g/24h,膜性腎病部分緩解。
3 討論
膜性腎病發病表現輕重不一,對治療反應的差別較大,PLA2R抗體可以作為預測IMN進展和預后的指標。但在臨床過程中發現部分膜性腎病患者對免疫抑制劑的敏感程度與PLA2R滴度水平并無關系。本研究發現緩解組與未緩解組治療前PLA2R抗體水平差異均無統計學意義(均P>0.05)。在IMN患者腎活檢標本中,PLA2R抗體以IgG4亞型為主,但有研究觀察發現在疾病早期患者IgG亞型以IgG1沉積為主,伴補體經典途徑起始因子Clq沉積,隨病理分期進展Clq信號逐漸減弱,IgG4信號逐漸增強,這說明在IMN的病程演變過程中可能存在IgG型別的轉換[5]。IgG亞型的沉積特點是否影響腎臟病變程度及預后尚不明確。2019年英國曼徹斯特大學的學者在Kidney Int上重點針對這些尚未解決的問題進行了綜述,他們認為今后仍需通過對遺傳因素以及T細胞和B細胞表位的進一步研究,來找出有疾病進展風險的IMN,從而制定優化的、有針對性的治療策略。該研究同時指出IgG亞型以及PLA2R抗原表位特異性可能是預測難治性膜性腎病更特異性的指標[6]。本研究發現難治膜性腎病患者與免疫抑制劑敏感患者相比,腎組織IgG3亞型分布差異有統計學意義(P<0.05),這提示IgG3可能在膜性腎病的疾病進展中發揮重要作用。
難治膜性腎病患者與免疫抑制劑敏感患者相比,無論從年齡,性別,體質量指數以及IgG3亞型分布差異均有統計學意義(均P<0.05)。這提示新發膜性腎病患者除了根據指南啟動免疫抑制劑治療外,還應注意對于中老年男性及體質量指數偏高患者,尤其是腎活檢免疫熒光IgG3陽性的患者可能免疫抑制劑治療效果欠佳,需要早期足量的免疫抑制劑治療。部分患者可加大ARB/血管緊張素轉化酶抑制劑劑量,爭取部分緩解,肥胖患者需盡量達到標準體質量,或在治療過程中一種免疫抑制劑治療方案效果不佳時,可盡早換用其他免疫抑制劑以爭取達到部分或完全緩解。同時IgG3陽性患者對激素聯合環磷酰胺和利妥昔單抗是否反應不同,兩種免疫抑制劑方案是否對不同臨床以及病理特點患者可以做到個體化治療,仍需進一步研究。對于血清PLA2R抗體轉陰的難治性膜性腎病患者,可能本研究觀察時間不足,需繼續觀察其臨床結局,同時下一步的研究中將進一步研究這部分患者的PLA2R的基因多態性,找出這部分難治性膜性腎病患者的基因型特點。
利益沖突 所有作者聲明無利益沖突

