甘肅隴西黃芩灰霉病病原菌分離鑒定及田間藥劑防治
孫雪艷, 蔣晶晶, 杜 蕙, 陳愛昌, 張敏敏, 漆永紅*
(1.臨洮縣農業技術推廣中心, 甘肅 定西 730500; 2.甘肅省農業科學院植物保護研究所, 甘肅 蘭州 730070; 3.定西市植保植檢站, 甘肅 定西 743000; 4.甘肅省農業科學院生物技術研究所, 甘肅 蘭州 730070)
中圖分類號:S432.45文獻標識碼:A
文章編號:1007-0435(2023)02-0349-09
Identification of Grey Mould Pathogens Isolation fromScutellariabaicalensisand Fungicides Control in Field in Longxi,Gansu
SUN Xue-yan1#, JIANG Jing-jing2#, DU Hui2, CHEN Ai-chang3, ZHANG Min-min4*,QI Yong-hong2*
(1. Lintao Agricultural Extension Center, Dingxi, Gansu Province 730500, China;2. Institute of Plant Protection, Gansu Academy of Agricultural Sciences, Lanzhou, Gansu Province 730070, China;3. Plant Protection Station, Dingxi, Gansu Province 743000, China;4. Institute of Biotechnology, Gansu Academy of Agricultural Sciences, Lanzhou, Gansu Province 730070, China)
Abstract:The aim of this study was to explore pathogens that harmed stem base and root and caused grey mould inScutellariabaicalensis. The typical samples with grey mould were collected in Longxi County,Gansu Province in the spring of 2019 to 2021,and fungi were isolated and cultured. The morphological method and molecular identification based on multiple genes,including internal transcribed spacer (ITS),glyceraldehyde-3-phosphate dehydrogenase (G3PDH),heat shock protein 60 (HSP60) and the second largest subunit of the nuclear RNA polymerase enzyme II (RPB2),were used to determine the pathogens. Meanwhile,toxicity test was determined by hyphal growth inhibition,and fungicides experiments were conducted in the field. The results showed thatBotrytiscinereawas the pathogen responsible for grey mold inS.baicalensis. When the disease occurred in spring,the sprouts did not come out of the soil and the aboveground plant parts died. The root surface near the ground turned dark green and watery,and the xylem of the underground root became soft and brown rot,while the boundary between the rot and healthy root parts was obvious. Toxicity test showed that 97% Fludioxonil had the strongest inhibition forB.cinerea,with EC50of 0.019 2 mg·L-1,followed by 98% Boscalid and 97% Procymidone with EC50of 1.248 0 and 1.758 5 mg·L-1respectively. Field experiments showed that 20% Fludioxonil SC had the best performance and the control efficacy reached 76.07%. The above results provided an important theoretical basis for the disease diagnosis and field control ofS.baicalensisgrey mould.
Keywords:Scutellariabaicalensis;Grey mould;Botrytiscinerea;Toxicity test;Fungicides control
黃芩(ScutellariabaicalensisGeorgi)為唇形科(Labiatae)黃芩屬(Scutellaria)植物,是多年生草本植物。從藥用植物學角度,黃芩分為根、莖葉、種子和種殼四個部位,以根和種子入藥,味苦,性寒,有消炎、健胃等功效[1]。黃芩主產于我國北方的甘肅、陜西、山西等省[2],其中甘肅省定西市作為道地黃芩主產區之一,生產的黃芩具有產量高、品質佳、功效好等優勢。近年來,黃芩種植面積逐步擴大,生產上連年種植,導致黃芩上的病害呈加重趨勢。目前,國內已報道危害黃芩的主要病害和病原菌為:鐮孢屬(Fusariumspp.)引起的根腐病[3]、北方根結線蟲(Meloidogynehapla)引起的根結線蟲病、齊整小核菌(Sclerotiumrolfsii)引起的葉枯病、白粉菌屬(Erysiphespp.)引起的白粉病[4]、立枯絲核菌(Rhizoctoniasolani)引起的莖基腐病[5]等。
灰霉病發生寄主范圍廣,包括蔬菜、果樹、中藥材等1 000多種農作物并遍布全世界,給農業造成了嚴重的經濟損失[6]。中藥材灰霉病有很多報道,李美芽等鑒定出白及葉斑灰霉病的病原菌為灰葡萄孢[7];支葉研究表明,刺五加灰霉病的病原菌為灰葡萄孢[8];馬維思等報道,引起滇重樓花器腐爛的灰霉病病原菌為葡萄孢屬1個新種[9];吳大椿和嚴清平研究發現,引起盾葉薯蕷葉、莖呈暗綠色至黑褐色水漬狀軟腐灰霉病的病原菌為灰葡萄孢[10];陳書珍報道,灰葡萄孢是甘肅省黨參灰霉病的主要病原菌[11];王帆帆等發現,湖北和湖南兩省華重樓灰霉病的病原為灰葡萄孢[12];游景茂等研究發現,湖北省鐵皮石斛葉部灰霉病的病原菌為灰葡萄孢[13]。國內關于黃芩灰霉病的報道很少,發病部位局限于莖稈和葉部,且僅通過形態學特征進行病原菌鑒定[14-15],但關于危害黃芩莖基部和根部的灰霉病的病原菌未見報道。
本試驗對甘肅隴西縣危害黃芩莖基部和根部的灰霉病進行調查,采集癥狀典型的樣品進行病原菌分離鑒定,通過柯赫法則進行致病性測定,開展室內和田間藥效試驗,旨在明確該病害的危害程度、發病癥狀和病原菌種類并篩選出好的藥劑,為該病害的科學診斷及田間防治提供重要參考。
1 材料與方法
1.1 試驗材料
1.1.1樣品采集 2019—2021年連續3年于每年3—5月在黃芩主產區甘肅省隴西縣福星鎮(35°10′46″N,104°34′46″E)、首陽鎮(35°04′51″N,104°26′16″E)、菜子鎮(34°59′20″N,104°28′36″E)和通安驛鎮(35°17′56″N,104°41′31″E),每個地區隨機選取3~5塊田進行病根調查和采集,共獲得30份樣品,觀察并記錄病害相關的癥狀,調查發病情況,將病樣置于自封袋中,保持新鮮狀態,及時帶回實驗室進行病原菌分離。
致病性測定供試黃芩種子及一年生黃芩苗,品種為‘甘肅’黃芩。
1.1.2培養基 馬鈴薯葡萄糖瓊脂(PDA)培養基:參照常規方法制備。1%水瓊脂培養基(1% WA)培養基:瓊脂10 g、蒸餾水1 000 mL,121℃滅菌備用。L-asp培養基:K2HPO41 g,MgSO4·7H2O 1 g溶于30 mL去離子水中,將兩者混合后用10 mL HCl(10 mol·L-1)溶解沉淀,KCl 0.5 g,FeSO4·7H2O 0.01 g,L-天冬酰胺2 g,葡萄糖22 g,瓊脂15 g,加去離子水至1 000 mL,121℃滅菌備用。
1.1.3藥劑 室內毒力測定藥劑:98%腐霉利原藥,江西禾益化工有限公司;97%異菌脲原藥,新興農化工(南通)有限公司;97%咯菌腈原藥,河北冠龍農化有限公司;97%嘧霉胺原藥,江蘇豐登作物保護股份有限公司;98%啶酰菌胺原藥,江蘇省南通嘉禾化工有限公司。
田間防治試驗藥劑:50%腐霉利可濕性粉劑(WP),浙江威爾達化工有限公司;50%啶酰菌胺水分散粒劑(WG),山東兆豐年生物科技有限公司;500 g·L-1異菌脲懸浮劑(SC),江蘇省蘇州富美實植物保護劑有限公司;20%咯菌腈懸浮劑(SC),山東省青島凱源祥化工有限公司。
1.2 試驗方法
1.2.1病原菌分離純化 采用組織分離法[16],將春季不發芽的病株整體挖出,經清水沖洗后,選擇具有典型暗綠色軟腐狀的病根,在病根表皮病健交界處及撕開的木質部病健交界處刮或剪取5 mm × 5 mm的病組織,用1%次氯酸鈉溶液消毒40 s,75%酒精消毒40 s,滅菌水沖洗2次后置于滅菌濾紙上晾干。將病組織移至PDA平板上,每皿4塊,置25℃恒溫培養箱黑暗培養3 d,挑取菌落邊緣菌絲進行純化后轉接PDA斜面,4℃保存備用。
1.2.2病原菌形態觀察 用滅菌打孔器在菌落邊緣打出直徑5 mm的菌餅分別接種在PDA培養基平板中央,設3個重復,置20℃黑暗恒溫條件下培養15 d后觀察菌落、菌核的顏色和形態并在光學顯微鏡(40×)下觀察形態特征及測量大小[17]。
1.2.3致病性測定 改良燒杯水瓊脂法[18]:菌株活化后,在菌落邊緣打取菌餅,置于已滅菌1% WA培養基(30 mL)的一次性小紙杯中央,每杯放入1個菌餅,蓋上滅菌錫箔紙;在20℃、相對濕度60%的人工氣候箱中黑暗培養4 d。黃芩種子先用75%酒精消毒1 min,再用1%NaClO溶液消毒1 min,滅菌水沖洗3次后,置于墊有保濕濾紙的已滅菌玻璃培養皿中,在25℃培養箱中黑暗保濕催芽4 d。挑取發芽一致的種子均勻擺放在帶菌WA培養基上,以不接菌的WA培養基為對照,每杯放入3粒,每個菌株3次重復,用滅菌錫紙封口后放入25℃,16 h光照+20℃,8 h黑暗、相對濕度60%的人工氣候箱中,待黃芩苗長至紙杯口時揭去錫紙。10 d后觀察發病情況,統計發病幼苗數,計算發病率,發病率(%)=發病幼苗數/幼苗總數×100。
離體根部接種法[19]:將純化的菌株接種于PDA平板上,20℃黑暗恒溫培養7 d,用直徑5 mm滅菌打孔器打取菌塊備用。將一年生健康黃芩幼根消毒后置于鋪有滅菌浸濕紗布的鐵盤中,用無菌接種針在黃芩根部表面刺傷四個定點,接種菌株于定點上,以刺傷接種空白PDA培養基為對照CK,每個根上接4個菌餅,每處理重復3次。接菌后用保鮮膜包裹鐵盤,20℃培養箱中黑暗培養、觀察并記錄發病清況。6 d后觀察記錄離體根感病形態并對病變部位進行組織分離,鑒定分離到的病菌是否與原始病菌相同。
1.2.4病原菌分子生物學鑒定 將菌株分別接種于表面平鋪滅菌玻璃紙的PDA平板中央,25℃黑暗培養5 d,收集菌絲于陶瓷研缽中,加入適量液氮研磨成細粉,刮取100 mg粉末于2.0 mL離心管,用試劑盒(OMEGA)提取基因組DNA。
從2019年及2021年分離的菌株中各隨機選取2株,利用ITS,基因G3PDH,HSP60,RPB2進行PCR擴增,引物由生工生物工程(上海)股份有限公司合成,擴增條件見表1。PCR反應體系25 μL:2×PCR Master Mix 12.5 μL,DNA 1 μL,引物各1 μL,ddH2O 9.5 μL。制備1.2%瓊脂糖凝膠,120 V電泳30 min,0.5 μg·mL-1EB溶液中染色10 min,置于凝膠成像儀進行拍照保存。將具特異性條帶PCR產物送上海生工生物工程(上海)股份有限公司測序,所測序列與NCBI的GenBank數據庫中已知核酸序列進行相似性比較,多基因測序結果采用ClustalX 2.0.10將所有基因比對并將比對結果首尾相連,利用BioEdit 5.0.6軟件進行校正;通過MEGA 5.0軟件以鄰接法(Neighbour-Joining)重復1 000次進行聚類分析,構建系統發育樹。

表1 引物序列Table 1 Primer sequences
1.2.5病原菌中B.cinerea的檢測 利用灰葡萄孢特異性檢測引物Bc-f/Bc-r對分離獲得的所有菌株的DNA進行PCR擴增[22],檢測所有菌株中的B.cinerea。引物Bc-f(5′-CAGGAAACACTTTTGGGGATA-3′)和Bc-r(5′-GAGGGACAAGAAAATCGACTAA-3′)均由生工生物工程(上海)股份有限公司合成。PCR反應體系25 μL:2×PCR Master Mix 12.5 μL,DNA 1 μL,引物各1 μL,ddH2O 9.5 μL。PCR反應程序:94℃預變性5 min,94℃變性30 s,56℃復性30 s,72℃延伸60 s,共 27 個循環,72℃延伸10 min,16℃保溫5 min。制備含核酸染料的1.5%瓊脂糖凝膠,120 V電泳20 min,置于凝膠成像儀進行拍照保存。
1.2.6殺菌劑對灰葡萄孢(B.cinerea)菌絲生長的影響 采用菌絲生長抑制率法[23]。用丙酮將原藥配成有效成分濃度為(1×104) mg·L-1的母液用于后續稀釋,每種殺菌劑設5個不同的濃度梯度(表2)。將供試菌株活化培養5 d后,在菌落邊緣打取直徑為5 mm的菌餅,分別接入不同濃度殺菌劑的培養基平板中央,其中腐霉利、啶酰菌胺、異菌脲、咯菌腈使用PDA培養基,嘧霉胺使用L-asp培養基。以不含藥PDA和L-asp培養基為空白對照,每處理3次重復,置于25℃恒溫黑暗培養箱培養觀察,第8 d采用十字交叉法量取菌落直徑,計算菌絲生長抑制率,以殺菌劑濃度的對數值作為自變量(x)和菌絲生長抑制率的幾率值作為因變量(y),利用最小二乘法建立“濃度對數-幾率值”,建立回歸方程y=ax+b,采用Excel 2010、SPSS 17.0數據處理軟件計算得到相關系數(R2)和致死中濃度(EC50),根據EC50分析比較不同殺菌劑對供試病原菌的毒力效果。
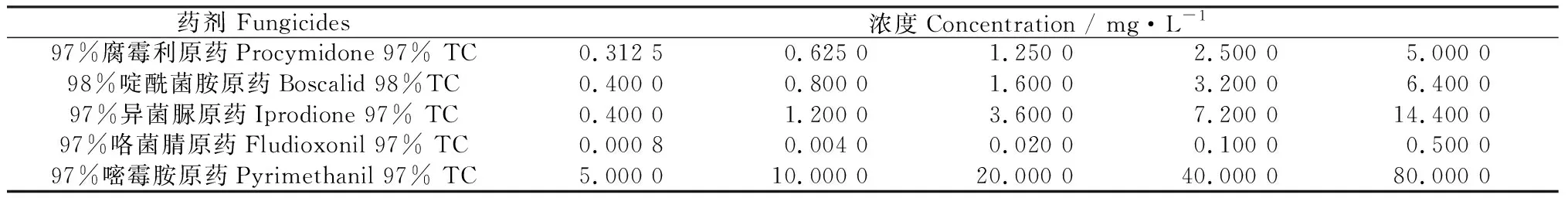
表2 供試藥劑及其濃度Table 2 Different fungicides and their concentrations
1.2.7田間防治試驗 試驗地位于甘肅隴西福星鎮黃芩結籽田,于2021年10月20日黃芩割莖后進行噴藥。選擇室內藥效較好的藥劑,每種藥劑按照推薦濃度噴施,每個小區面積30 m2,每處理3次重復,以噴施清水為空白對照。2022年4月12日調查各處理小區黃芩苗發芽情況,每小區連續調查100株,共300株進行各處理防效調查。記錄調查總株數及病株數,計算病株率和防治效果。病株率(%)=病株數/總調查株數×100;防治效果(%)=(對照病株率-處理病株率)/對照區病株率×100[24]。
2 結果與分析
2.1 黃芩灰霉病田間發病癥狀
該病在2-3年生地塊發生嚴重,病田率50%以上,病株率35%~75%,田塊形成斑禿(圖1A)。莖稈自下而上變為黃褐色,后病斑擴展為中央灰褐色,邊緣黑褐色繞莖一周,濕度大時產生灰色霉層,后期全株失綠枯死(圖1B);地下根部表面呈暗綠色至黑褐色水漬軟腐狀,發病根部由上而下逐漸軟腐,病斑擴大后繞莖一周(圖1C),撕開表皮,木質部變軟呈黃褐色,發病嚴重時整個根內部變褐色腐爛(圖1D,1E)。
2.2 形態學鑒定特征
2019—2021年每年春季分別從甘肅省隴西縣福星鎮、首陽鎮、菜子鎮和通安驛鎮等黃芩主產區采集典型不發芽的病根共計54份,分離純化得到67株菌株(表3)。
PDA培養基20℃恒溫、黑暗培養15 d后,67株菌株的菌落特征表現出明顯差異,其中4株為菌絲型,63株為菌核型,未發現孢子型。初期菌絲稀疏,大多數為白色放射狀,后期菌絲體顏色逐漸加深,形成球狀或不規則的黑色菌核(圖2A~2D)。分生孢子梗細長,淡褐色,直立或稍彎曲,叢生、單支或樹狀分枝;分生孢子梗頂端膨大成球型,并形成小柄,小柄上著生大量分生孢子,形狀似葡萄穗狀(圖2E)。分生孢子為單孢,近圓形、無色,大小約為7~11×6~10 μm(圖2F)。根據形態學特征,將分離獲得的67株菌株初步鑒定為灰葡萄孢菌(B.cinerea)。

圖1 黃芩灰霉病發病癥狀Fig.1 Symptoms of Scutellaria baicalensis grey mould注:A,春季田間發病癥狀;B,莖基部發病;C~E,根部發病Note:A,Field symptoms in the spring;B,Symptoms of stem base;C~E,Symptoms of root

表3 隴西縣不同地區菌株的分離信息Table 3 Isolation of strains in Longxi County
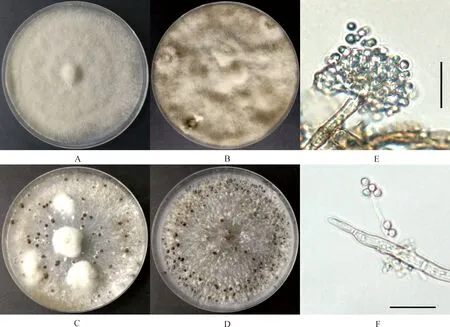
圖2 黃芩灰霉病菌的形態特征Fig.2 Morphological characteristics of Scutellaria baicalensis grey mould注:A~D,菌落形態(PDA,20℃,15 d);E,分生孢子梗和分生孢子;F,分生孢子和菌絲;標尺=20 μmNote:A~D,Colonial morphology(PDA,20℃,15 d);E,Conidiophorand conidia;F,Conidia and hyphae;Scar bars=20 μm
2.3 致病性測定
改良燒杯水瓊脂法致病性測定結果表明,67株菌株均經過柯赫法則驗證,對催芽的黃芩根部和莖全都有極強的致病性,發病率達100%(圖3A),而對照接種沒有發病,黃芩幼苗長勢良好(圖3B)。隨機選取一部分菌株利用離體根部接種法測定菌株致病性,結果表明,接種4 d后,在接種部位產生明顯的暗綠色軟腐病斑(圖3C);隨著病斑逐漸擴展,第6 d整個接種根部呈暗綠色軟腐狀,并有少量的菌絲纏繞或菌核產生,而對照接種根沒有發病(圖3D)。將上述發病根重新分離,分離率為100%,且與原接種菌一致,表明該病原菌是引起黃芩灰霉病的致病菌。

圖3 致病性測定Fig.3 Pathogenicity testing注:A,黃芩幼苗接種10 d后;B,CK-A;C,離體根接種4 d后;D,離體根接種6 d后;E,CK-C和DNote:A,Scutellaria baicalensis seedlings 10 d after inoculation;B,CK-A;C,Inoculation root in vitro after 4 d;D,Inoculation root in vitro after 6 d;E,CK-C and D
2.4 病原菌分子生物學鑒定及親緣關系分析
采用真菌通用引物對隨機挑選的4個菌株rDNA-ITS基因進行PCR擴增后,獲得基因序列并上傳至NCBI獲得GenBank登錄號,其中菌株HQ-5-1和HQ-8-4為2019年病樣,菌株HQ-X-3和HQ-R-31為2021年病樣。BLAST比對發現其與葡萄孢屬(Botrytisspp.)的同源性為100%,構建系統發育樹發現4個菌株均與登錄號為MN589850和MK370689的灰葡萄孢(B.cinerea)聚在一支(圖4);進一步利用G3PDH,HSP60,RPB2基因進行PCR擴增,測序回來的序列采用ClustalX 2.0.10將所有基因比對并將比對結果首尾相連,利用BioEdit 5.0.6軟件進行校正,通過MEGA 5.0軟件構建系統發育樹,結果表明4個菌株均與灰葡萄孢菌MUCL87聚為一支(圖5)。以上通過4個菌株的ITS,G3PDH,HSP60和RPB2序列并結合形態學特征,將病原菌鑒定為灰葡萄孢菌(B.cinerea)。
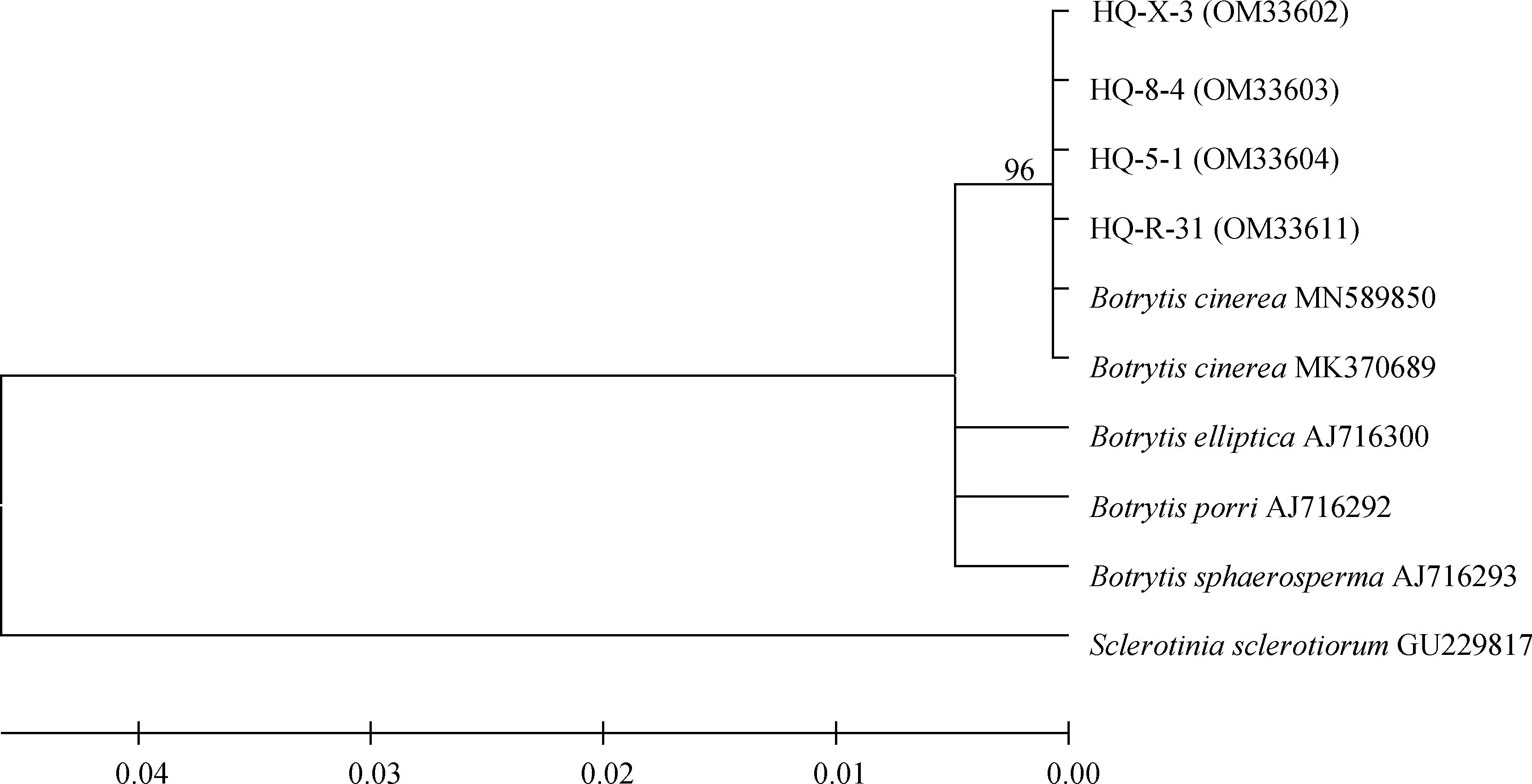
圖4 基于rDNA-ITS序列鄰接法構建系統發育樹Fig.4 Neighbour-Joining phylogenetic tree based on rDNA-ITS gene sequences
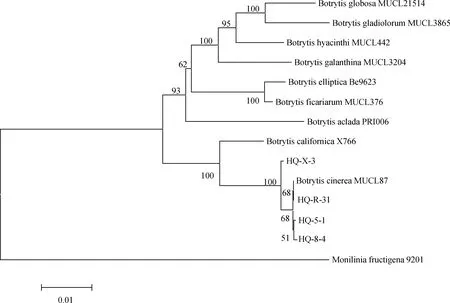
圖5 基于G3PDH,HSP60和RPB2基因序列構建的系統發育樹Fig.5 Phylogenetic tree based on G3PDH,HSP60,and RPB2 gene sequences
2.5 病原菌中B. cinerea的檢測
對67株菌株進行灰葡萄孢特異性引物擴增,結果表明,67株菌株均可由Bc-f/Bc-r引物直接檢測出大小約為300 bp的特異性條帶,表明該菌株均為灰葡萄孢菌(B.cinerea)(圖6)。

圖6 部分菌株經灰葡萄孢菌特異性引物擴增結果Fig.6 PCR amplification results of some strains with specific primers of B. cinerea注:M,Marker II;1~16,菌株為HQ-6-2~HQ-6-23Note:M,Marker II;1~16,Strains HQ-6-2~HQ-6-23
2.6 殺菌劑對灰葡萄孢(B. cinerea)菌絲生長的影響
5種殺菌劑對灰葡萄孢(B.cinerea)菌絲生長均有不同程度的抑制作用,各藥劑對菌絲的抑制作用隨著處理濃度的升高而增加(表4)。在不同藥劑中97%咯菌腈對灰葡萄孢的菌絲抑制作用最強,EC50僅為0.0192 mg·L-1,其次為98%啶酰菌胺和97%腐霉利,EC50分別為1.2480和1.758 5 mg·L-1,97%嘧霉胺抑制效果最差,EC50達60.584 9 mg·L-1。綜合EC50篩選出對灰葡萄孢(B.cinerea)菌絲有較強抑制作用的藥劑為97%咯菌腈、98%啶酰菌胺和97%腐霉利。
2.7 田間藥劑防效測定
田間試驗結果表明(表5),4種藥劑對黃芩灰霉病的防效均在46.01%以上,其中20%咯菌腈懸乳劑的防效最高,達76.07%,與其他3種藥劑差異顯著(P<0.05)。
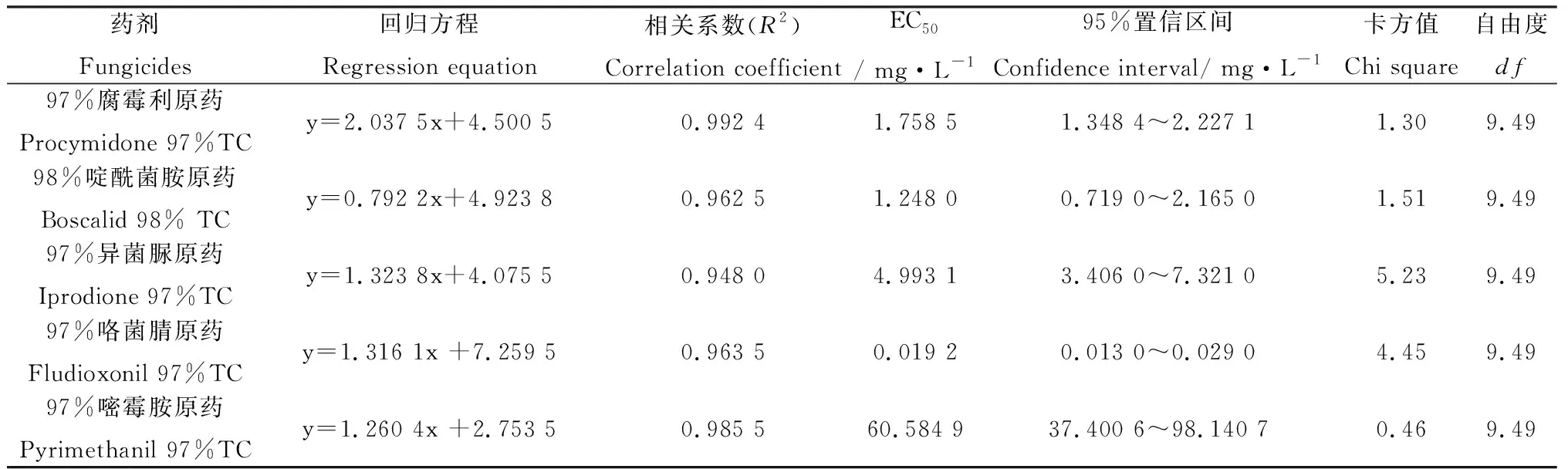
表4 5種殺菌劑對灰葡萄孢菌絲生長的抑制效果Table 4 Inhibition of five fungicides against mycelium growth of B. cinerea
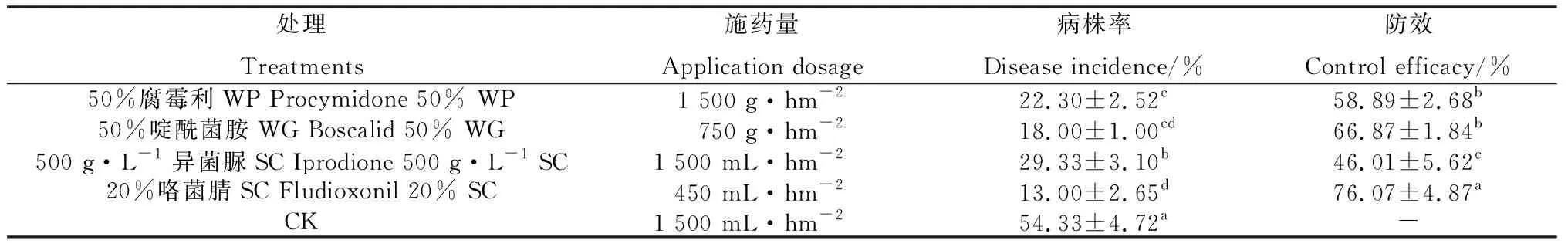
表5 4種殺菌劑對黃芩灰霉病的田間防治效果Table 5 Field control efficacy of four fungicides on Scutellaria baicalensis grey mould
3 討論
葡萄孢屬(Botrytisspp.)是常見的一種病原菌,具有適應強、寄主范圍廣,危害嚴重等特點,該屬真菌包括22個種和1個雜交種,大多數種的寄主范圍較窄,只侵染1個或幾個相似種的寄主[25]。灰葡萄孢(B.cinerea)寄主范圍最廣,可引起生長期和貯藏期200多種植物的灰霉病,表面產生大量的灰色霉層,癥狀表現為花腐、果腐和葉斑等[26]。目前研究表明灰葡萄孢(B.cinerea)可侵染黃芩的葉片、葉柄、嫩莖和花器[27],本試驗首次發現灰霉病菌可以侵染黃芩的莖基部和根部,同時通過形態學和多基因分子生物學特征鑒定出病原菌為灰葡萄孢菌(B.cinerea)。課題組研究發現,鐮孢屬(Fusariumsp.)可危害黃芩根部引起根腐(另文發表),而灰葡萄孢(B.cinerea)也可以危害黃芩的莖基部和根部,但兩者之間有很大的差別,相似處是地上部均表現為葉片發黃,植株萎蔫,而地下部表現的癥狀不同,鐮孢菌危害的黃芩根部表面有黑色或黑褐色的裂紋,受害部位木質部堅硬[28],而灰葡萄孢危害的根表面呈現水漬狀暗綠色,撕開表皮,木質部變軟呈黃褐色,發病嚴重時整個根變褐色腐爛和腐朽;同時鐮孢菌引起的根腐病在黃芩每茬均發生,發病的植株翌年可以成活,而灰葡萄孢引起的灰霉病主要發生在2~3年生黃芩植株莖基部和根部,發病植株冬天枯死或翌年不發芽。
灰葡萄孢菌的菌絲體、分生孢子和菌核都能越冬,成為翌年的初侵染源,分生孢子傳播快,自然孔口或傷口均可侵染[27-28]。割莖是中藥材栽培技術中獲得高產優質的一項有效措施[28-29],黃芩在秋季割莖和采收種子后,病原菌可通過秋季割取黃芩地上部分后殘留在地表附近的植株殘體傷口進行侵染,繼而在越冬時由莖基部侵染到根部,翌年部分植株發病死亡或地上部分不發芽。因此,建議秋季黃芩割莖后噴施藥劑消滅傷口及莖基部的病原菌,對減輕或阻止灰霉病的發生起到重要作用。
毒力回歸方程能有效反映不同濃度殺菌劑與抑菌效果的關系[30],EC50是衡量殺菌劑毒力強弱的標準。咯菌腈屬于苯基吡咯類非內吸性殺菌劑,防病譜較廣,通過抑制菌體葡萄糖磷酰化反應抑制病原菌的生長[31]。腐霉利和異菌脲均屬二甲酰亞胺類殺菌劑,通過抑制菌體內甘油三脂的合成,阻礙菌絲發育,兼保護和治療作用[32]。啶酰菌胺屬于新型煙酰胺類內吸性殺菌劑,通過抑制琥珀酸基質的氧的呼吸妨礙病原菌的能量代謝[33]。嘧霉胺屬于苯并咪唑類殺菌劑,其作用靶點單一,易使病菌產生抗性[34]。本研究發現,咯菌腈、啶酰菌胺和腐霉利對引起黃芩灰霉病的灰葡萄孢菌有較強的抑菌活性和防治效果,該結果與趙建江、張江兆等人在番茄和黃瓜灰霉病菌抗藥性監測結果一致[36-37],建議生產上在黃芩割莖傷口處使用咯菌腈或者與腐霉利、異菌脲和啶酰菌胺這三種藥劑混合交替噴施來預防黃芩莖基部和根部灰霉病。
4 結論
黃芩灰霉病嚴重危害其莖基部和根部,造成植株冬天枯死或翌年不發芽,鑒定其病原菌為灰葡萄孢菌(B.Cinerea);室內毒力測定和田間防效結果表明咯菌腈對黃芩灰霉病的防效最好,建議生產上將咯菌腈與腐霉利等藥劑混合交替噴施防治黃芩灰霉病。

