基于SLAF 標記的大豆遺傳圖譜構建及苗期耐鹽性QTL 定位
陳奕博 楊萬明 岳愛琴 王利祥 杜維俊 王敏
(1. 山西農業大學農學院,太谷 030801;2. 晉中學院生物科學與技術學院,榆次 030619)
土壤鹽漬化是一個全球性的生態問題,會對作物產生嚴重的負面影響。全球鹽漬土和堿性土的面積分別為3.97 億hm2和4.34 億hm2,并且有19.5%的灌溉地和2.1%的旱地受到鹽脅迫的影響[1]。其中,我國鹽堿土面積為0.991 3 億hm2,占種植總面積的4.88%[2],并且呈現局部治理、整體惡化、面積增加的趨勢。可鹽漬地作為我國重要的后備耕地,未來可開墾為農業備用耕地。因此,對當代育種科學家而言,培育耐鹽性強的作物,可保障我國糧食生產安全[3]。
大豆(Glycine max(L.)Merr.)是世界范圍內重要的油料作物和糧食作物,原產于中國,是當今世界最重要的植物蛋白與植物油來源[4],近年來,我國對其需求量與進口量逐年增加。大豆通常被認為是一種鹽敏感作物,當土壤鹽度超過5 dS/m 時,大豆開始受到鹽害,更高濃度的鹽害下會出現減產,嚴重時會絕收[5]。鹽濃度過高通常是由氯化鈉引起的,它會引起2 種不同卻相互關聯的脅迫,滲透脅迫和離子脅迫[6]。在鹽濃度升高時,滲透脅迫立即發生,并抑制水分吸收和細胞擴張。鹽脅迫早期與干旱脅迫[7]相似,且對生長速率的影響大于離子毒性[8],鹽脅迫發生一段時間后,離子脅迫的影響逐漸顯現,有毒的離子在植物體內積累,增加了葉片死亡率,降低了光合作用。這些有害離子不僅直接抑制代謝,而且還通過減少有益營養物質[9]的攝取而破壞離子穩態。鹽脅迫下植物表現出多種癥狀,包括生長抑制、衰老甚至死亡。鹽脅迫是大豆生長發育過程中一種重要的非生物脅迫,會對其生長產生嚴重的負面影響。鹽漬化土壤嚴重影響著大豆的正常生長,會造成大豆產量低下。但隨著世界范圍內鹽漬化的不斷加劇,且改良土壤具有比較高的成本,較難實現,因此,明確大豆耐鹽機制,篩選耐鹽基因,進而培育出耐鹽性優良的大豆品種,是提高大豆產量的重要途徑。
早期研究表明,大豆苗期耐鹽性狀是由單個顯性基因決定,現有研究結果表明,大豆苗期耐鹽性狀是受多個不同基因控制的數量性狀[10]。過去幾十年來,通過正向遺傳學方法獲得大豆耐鹽QTL 或基因,一方面結合構建高密度的分子圖譜,獲得與耐鹽基因連鎖的分子標記,尋找QTL 附近的分子標記去篩選獲取最終的目的基因;另一方面利用不同的遺傳群體、不同的定位指標及方法對大豆耐鹽性狀進行QTL 定位,運用分子標記輔助(marker assisted selection, MAS)育種技術對主效QTL 開展精細定位,從而挖掘出耐鹽相關基因,為大豆耐鹽育種提供基因資源[11]。Guan 等[12]在第3 染色體上進行精細定位,將其命名為GmSALT3,該基因定位于內質網,可以顯著提高大豆耐鹽性。Zhang 等[13]通過QTL定位確定GmCDF1為重要的候選基因,后續試驗表明該基因是大豆萌發期耐鹽性的負調控基因。通過反向遺傳學方法鑒定的大豆耐鹽基因也有很多,基因GmNHX1可將胞質Na+轉運到液泡中[14],在大豆中過表達和擬南芥中異源表達都可以增強轉基因株系的耐鹽能力[15]。Zhao 等[16]在擬南芥中異源表達GmSOS1,可以降低Na+積累,并增加抗氧化酶活性,從而參與擬南芥耐鹽性。Wei 等[17]研究表明,GmCLC1能夠通過調控Cl-的積累增強植物耐鹽性。Chen 等[18]發 現GmHKT1和GmHKT1;4均 可 以 調節Na+和K+的平衡,增強轉基因煙草耐鹽能力。當植物受鹽脅迫時,相關轉錄因子也會參與,如一些MYB[19]、bZIP[20]、WRKY[21]、ERF[22]、NAC[23]等轉錄因子家族成員與大豆耐鹽性相關。由于構建QTL 定位群體需要考慮多方面原因,如群體的遺傳背景、定位時的環境變化、基因與基因互作、標記的準確性。因此,在這些因素變化后,所定位到的QTL 結果也可能會隨之改變。但近年來,隨著QTL精細定位研究工作不斷深入,在了解QTL 的位置及效用機理后,將QTL 定位結果用于挖掘候選基因依然擁有可預見的前景。
前人主要利用溫室和自然環境對大豆苗期耐鹽性進行鑒定研究,定位的耐鹽QTL 大多位于N 連鎖群上,但是,由于鑒定環境的不同和遺傳群體材料遺傳背景的差異,鑒定的相關QTL 位點也存在巨大差異。
本研究以栽培大豆品種晉大53 為母本和野生大豆品種平南為父本雜交衍生的128 個株系的RIL 群體為材料,結合基于SLAF 標記構建的高密度遺傳連鎖圖譜,再以大豆苗期鹽處理后致死濃度(plant death concentration, PDC)作為耐鹽指標,對連續2年大豆苗期耐鹽性進行QTL 分析。發掘控制大豆苗期耐鹽性的新QTL 位點,為大豆耐鹽性的遺傳改良提供參考,促進耐鹽基因在大豆耐鹽育種中的應用。
1 材料與方法
1.1 材料
所用RIL 群體由山西農業大學大豆種質創新與利用實驗室提供,母本栽培大豆晉大53 和父本野生大豆平南。通過單粒傳法獲得由128 個株系組成F2:12重組自交系群體。
1.2 方法
1.2.1 遺傳圖譜的構建 應用北京百邁科生物科技有限公司自主研發的SLAF-seq(Specific-Locus Amplified Fragment Sequencing)技術[24]和High Map軟件[25]對大豆128 份重組自交系群體開發高密度分子標簽,根據大豆參考基因組大小、GC 含量,選擇酶切方案。根據選定的酶切方案,分別對檢測合格的各樣品基因組DNA 進行酶切試驗。處理后選取質檢合格的酶切片段(SLAF 標簽)進行測序。獲得各個樣品的reads,通過對reads 進行評估,使用reads 間聚類的方法,在親本和子代中開發SLAF 標簽。最后利用多態性的SLAF 標簽,構建遺傳圖譜,并進行圖譜評估。
1.2.2 大豆苗期耐鹽性鑒定 2020-2021年連續2年在山西農業大學旱棚內進行試驗,采用王聰等[26]方法進行,將大豆種子播種于35 穴的育苗盤中,蛭石與滅菌土等比例混合后作為基質,采用隨機區組設計,重復3 次,重復內每個家系播1 穴,每穴定苗2 株。待大豆植株長到二葉一心期時,用130 mmol/L NaCl 溶液進行逆境處理(即開始處理時的初始濃度),每次每穴30 mL,每2 d 處理1 次,澆至320 mmol/L NaCl 時(即所有家系均死亡時的最大濃度),試驗完成。
1.2.3 表型數據的調查和分析 待大豆長至二葉一心期開始脅迫處理,每2 d 統計一次,及下次脅迫處理前進行統計,記錄每個家系死亡時NaCl 的濃度,直到該家系所有植株全部死亡,當每個家系植株死亡,NaCl 濃度不同時,取2 個植株死亡時濃度的均值,可計算出該家系的平均致死濃度,即為致死濃度(plant death concentration, PDC),然后以各個家系的致死濃度作為耐鹽指標,致死濃度與耐鹽等級對照如表1 所示,利用SPSS 數據處理系統對表型值進行統計分析。

表1 致死濃度與耐鹽等級對照表Table 1 Comparison between plant death concentration and salt tolerance grade
1.2.4 QTL 定位分析 以復合區間作圖法作圖,以LOD=2.5 為閾值對QTL 進行定位分析。LOD 值≥5.0 即可認為該區間存在一個上位性QTL,并計算QTL 的加性效應、上位性效應及表型貢獻率。QTL 命名方法后面的數字為染色體編號,參照McCouch 等[27]方法。PDC Ⅰ、PDC II、PDC Ⅲ、PDCA 分別表示致死濃度重復一、致死濃度重復二、致死濃度重復三和3 次致死濃度平均值。
2 結果
2.1 SLAF-seq文庫構建
對參考物種基因組(Glycine maxCv. Williams 82.a2.v1)序列進行電子酶切預測,根據酶切方案選擇原則,選擇的酶為HaeⅢ,酶切片段長度為264-364 bp 的序列定義為SLAF 標簽,預測可得到114 027 個SLAF 標簽,位于重復序列區的SLAF 標簽比例為7.11%,SLAF 標簽在基因組各染色體上分布基本均勻,酶切方案可行。對測序數據進行,共獲得260 187 738 reads(52.02 Gb)數據,測序平均Q30 為89.24%,平均GC 含量為41.04%,樣本GC分布正常。綜上所述,數據比對效率、酶切效率和質量均達到目的要求。
2.2 遺傳連鎖圖譜的構建
在進行SLAF 標簽文庫構建時,共獲得140 864個SLAF 標簽,其中,多態性SLAF 標簽有44 298 個,可以用于遺傳圖譜構建的標簽有33 742 個,親本有效多態性為23.95%。為保證遺傳圖譜質量,將多態性SLAF 標簽進行過濾,終得到可用于作圖的SLAF標簽8 223 個。將篩選出的8 223 個SLAF 標簽,及山西農業大學大豆種質創新與利用實驗室提供的可以比對到參考基因組上的SSR 標記39 個共8 266 個,一起進行分群。通過與大豆參考基因組的定位將SLAF 標簽分為20 個連鎖群,以連鎖群(每條染色體)為單位,獲得連鎖群內Marker 的線性排列,并估算相鄰Marker 間的遺傳距離,進行連鎖圖譜的構建。最終,得到一張包括20 個連鎖群共7 945 個Marker的連鎖遺傳圖譜(圖1),該圖譜總圖距為3 148.46 cM,標記完整度為99.56%。各個連鎖群Marker 數目、總圖距、平均圖距、最大Gap 和Gap<5 cM 的比例基本信息統計如表2 所示,其中,第18 染色體的標記數最多(740 個),第1 染色體的標記數最少(57個)。標記間平均距離最大值為3.30,最小值為0.25,分別位于第16 染色體上和第4 染色體上。最大Gap在第18 染色體上,值為27.09,最小在第17 染色體上,值為6.87。
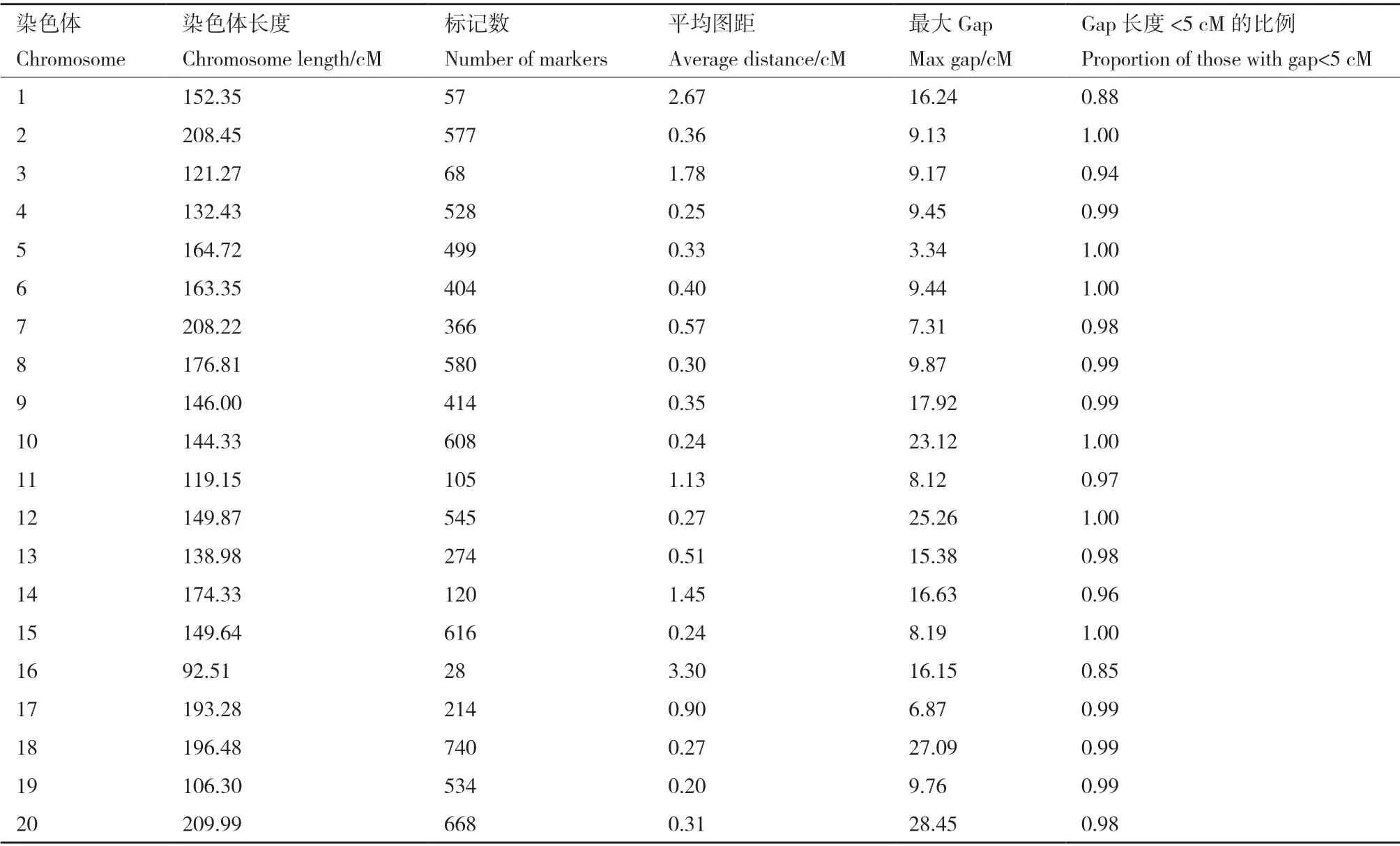
表2 染色體標記信息Table 2 Chromosome marker information
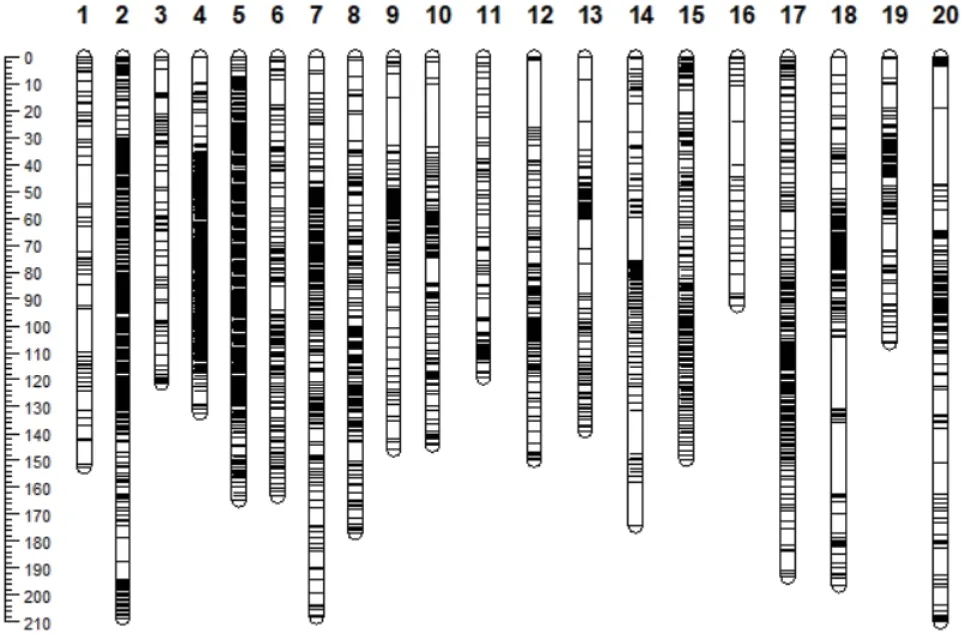
圖1 遺傳圖譜結果圖Fig. 1 Genetic map results
2.3 大豆苗期耐鹽性表型分析
為利用親本平南和晉大53 進行大豆耐鹽性的QTL 定位研究,對雙親連續2年不同環境PDC Ⅰ、PDC II、PDC Ⅲ和PDCA 等4 個耐鹽指標差異進行分析,2年內,晉大53 的PDC Ⅰ、PDC Ⅲ、PDC II和PDCA 的4 個指標均顯著高于平南(P<0.05)。
在2年不同環境下,RIL 群體中各株系的致死濃度(PDC)在160-320 mmol/L 都有分布,且呈連續分布規律,符合數量性狀的特點,從親本致死濃度在群體內的分布來看,存在雙向超親遺傳規律,這也是數量遺傳的典型特征。其中,2020PDC Ⅰ的變異系數最大,為35.1,2020PDCA 的變異系數最小,為22.1,正態分布的適合性檢驗結果表明,2年內致死濃度的偏度和峰度的絕對值均小于1。以上結果表明,耐鹽性狀是一種數量性狀,RIL 群體耐鹽相關性狀數據適合QTL 定位(表3,圖2)。
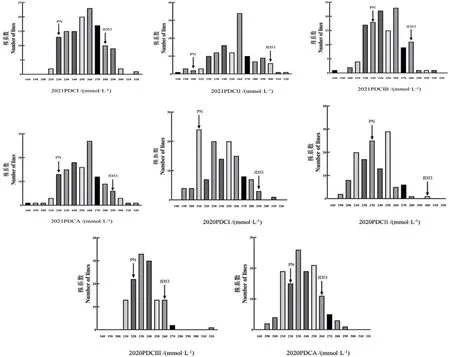
圖2 RIL 群體耐鹽性狀頻次分布Fig. 2 Frequency distribution of salt tolerance traits in RIL population
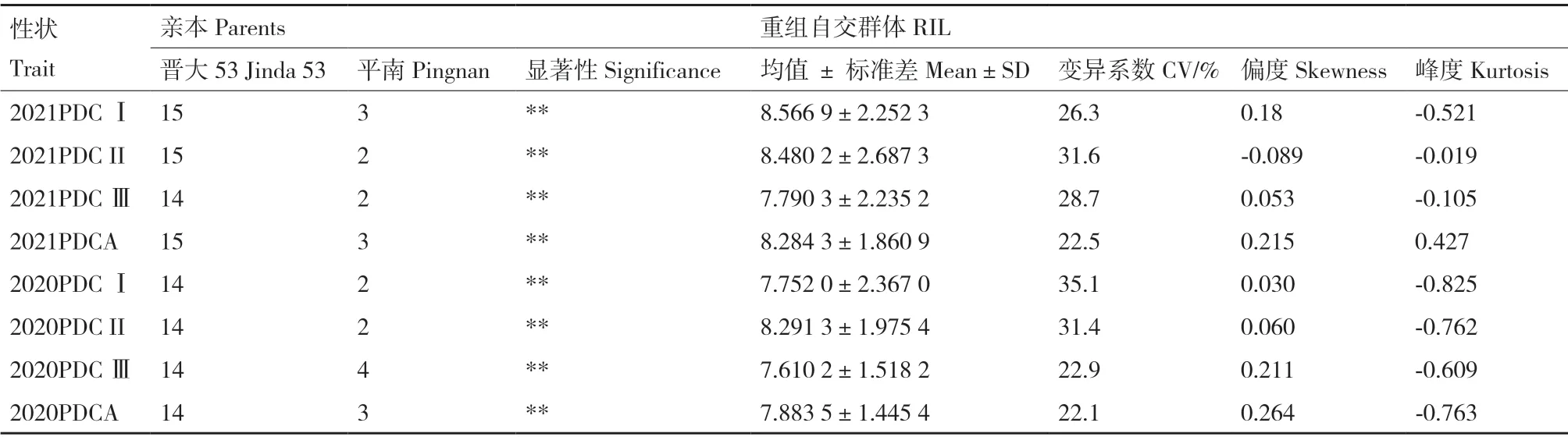
表3 RIL 群體中苗期表型統計Table 3 Phenotypic statistics of RIL population at seedling stage
2.4 RIL群體耐鹽指標的相關性分析
通過對2020-2021年RIL 群體苗期耐鹽性狀進行相關性分析(表4)發現,2020PDC Ⅰ、2020PDC II、2020PDC Ⅲ、2020PDCA 各性狀間多呈顯著正相關,表明鹽脅迫對大豆植株的影響是同向的。由相關性分析可知,2020PDC Ⅰ與2021PDC Ⅰ的相關系數為0.651,2020PDCA 與2021PDCA 的相關系數為0.415 5,各指標間呈正相關關系。綜合2年結果,鹽脅迫對于大豆表型耐鹽性狀影響是一致的,且2年各性狀之間相關性較高,表明不同的自然環境對大豆苗期耐鹽性狀影響不大,說明128 個家系的耐鹽指標可用于大豆苗期耐鹽性的QTL 定位。
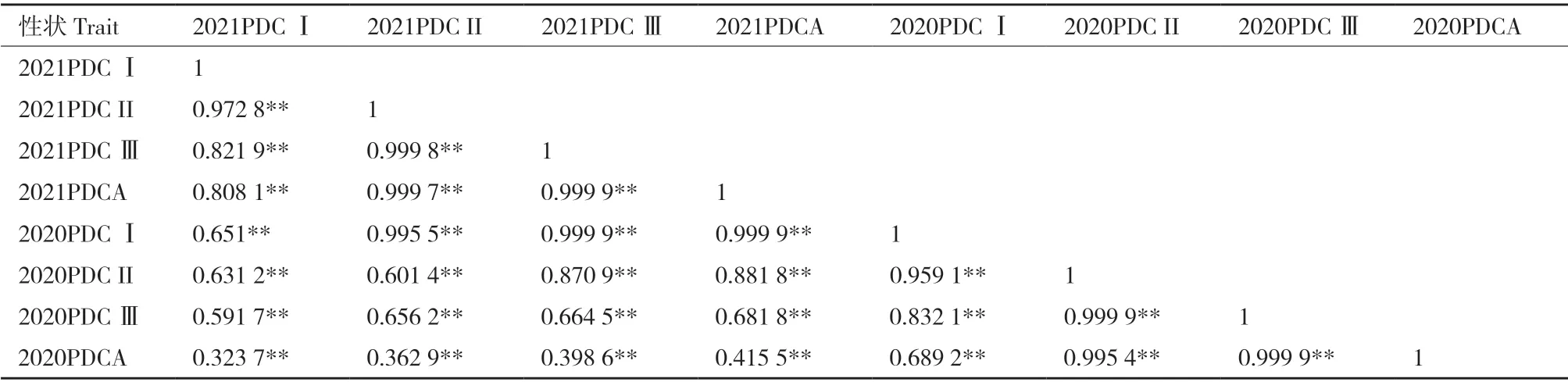
表4 耐鹽性狀的相關性分析Table 4 Correlation analysis of salt tolerance traits
2.5 大豆苗期耐鹽性的QTL定位
通過對2年128 份RIL 群體耐鹽性狀相對值進行QTL 定位分析(圖3),2年共檢測到12 個相關性狀的QTL 位點,分布于第2、3、5、7、9、11、13、15、18 和20 染色體上(表5)。2020年耐鹽性狀共定位到7 個QTL,分布在7 條染色體上,其中,第7 染色體上存在2 個位置相近的QTL 位點,性狀的遺傳變異解釋率為24.58-31.84。2021年耐鹽性狀共定位到5 個QTL,分布于5 條染色體上,其中,第3 染色體上存在2 個位置相近的QTL 位點,性狀的遺傳變異解釋率為31.22-31.22。通過比較2年各性狀定位到的QTL,在第3 染色體上定位到多個QTL 位點,集中于58.81-108.22 cM 位置區間,在第7 染色體上定位到多個QTL 位點,集中于63.68-100.65 cM 位置區間,說明PDC 作為耐鹽生理指標較準確,且在第3 染色體上可能存在耐鹽相關的穩定QTL。對于QTL 加性效應分析發現,2020年qPDC15 為0.71,qPDC7-1 為1.28,qPDC2 為0.42,qPDC7-2 為0.97,2021年qPDC3-1 為0.58,qPDC9為1.20,qPDC20 為0.89,且皆為正值,說明這些位點增效基因來自父本平南,其他QTL 為負值,說明其他位點的增效基因主要來自母本晉大53(表5)。
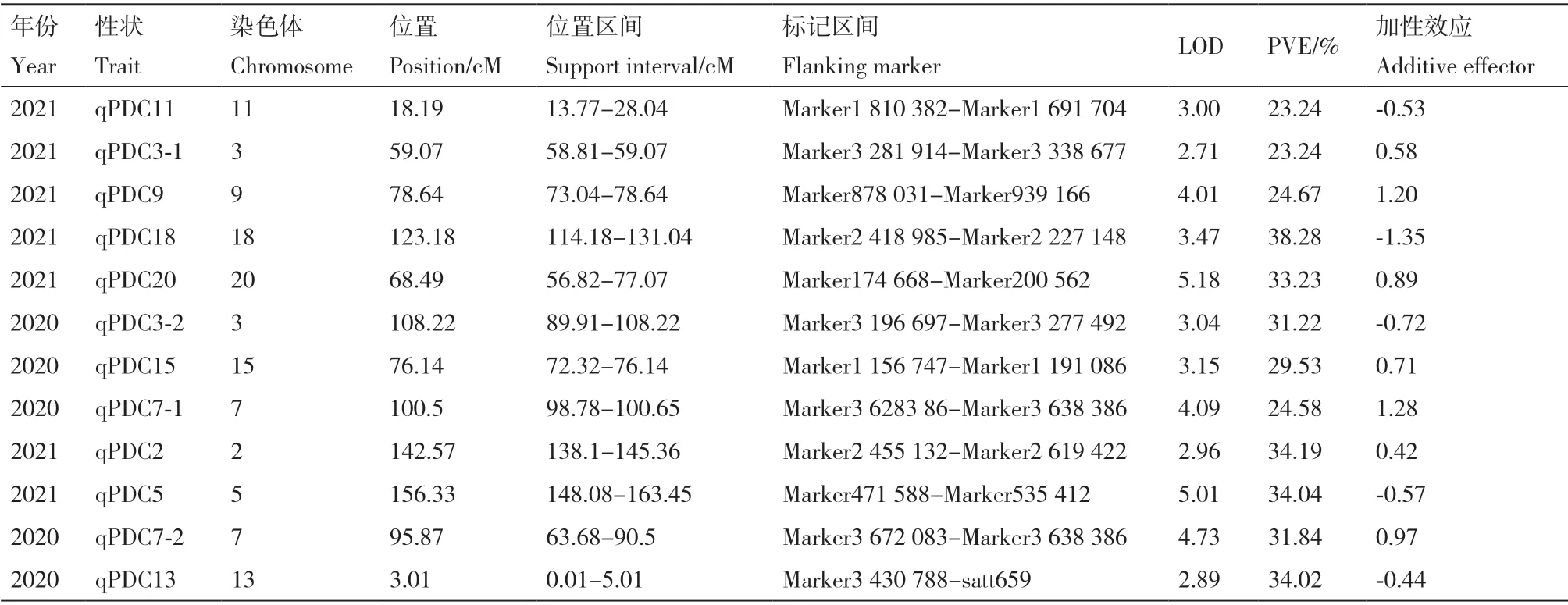
表5 大豆苗期耐鹽性狀QTL 分析Table 5 Analysis of QTL associated with salt tolerance in soybean seedling
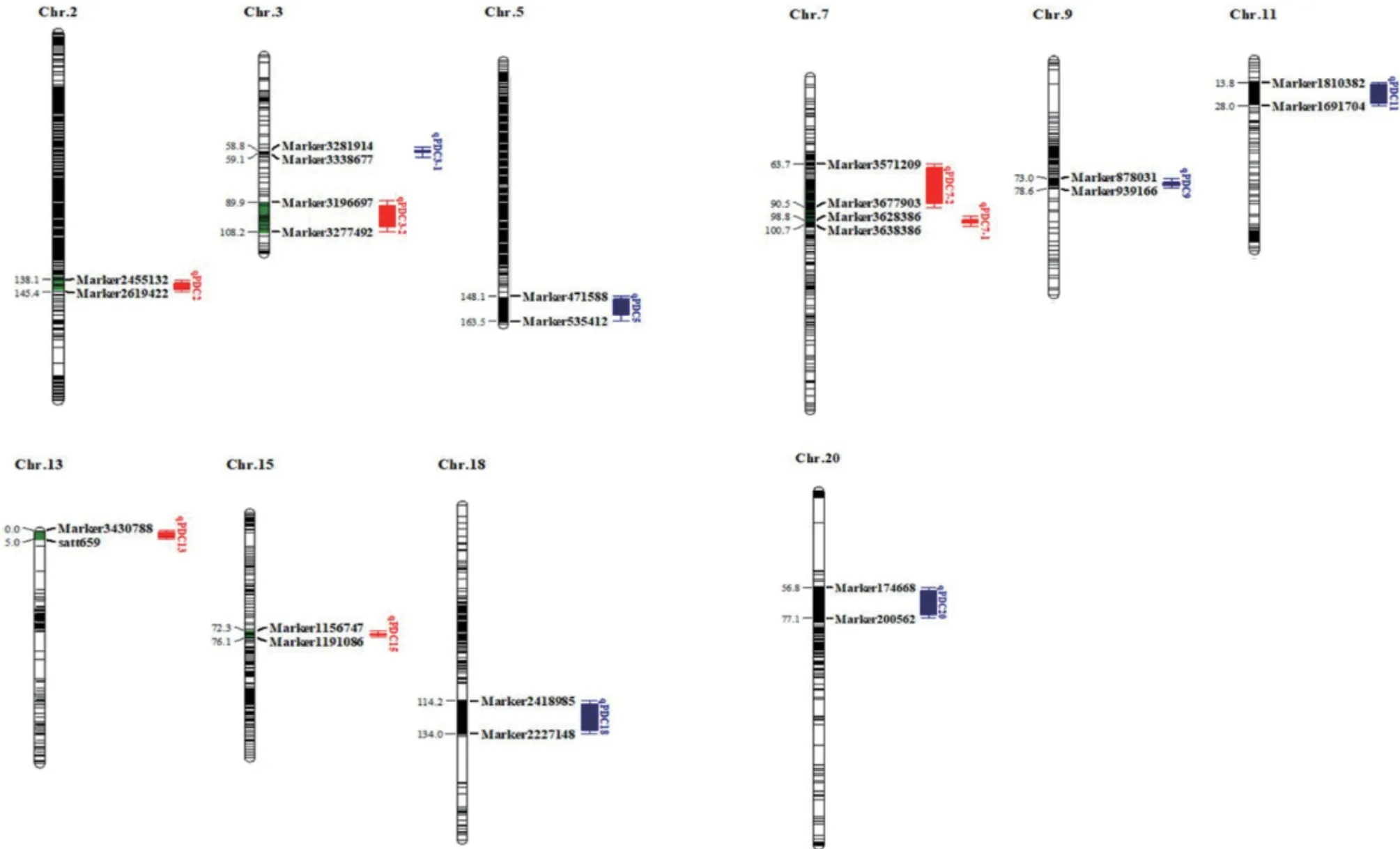
圖3 大豆苗期耐鹽各性狀的QTL 分布Fig. 3 QTL distribution of salt tolerance traits in soybean seedling stage
2.6 上位性QTL定位
檢測到1 對與苗期耐鹽相關的上位性位點(表6),該位點存在于第20 染色體的Marker174 668-Marker200 562,LOD 值為5.18,貢獻率為33.32,上位性效應為0.89。

表6 大豆苗期的上位性位點Table 6 Epistatic loci of soybean at seedling stage
3 討論
目前,在大豆耐鹽QTL 定位和耐鹽機制等方面取得很多進展[28]。近年來,大量研究使用大豆種內或種間重組自交系群體,在不同年份,不同地點,重復多次進行QTL 定位,這樣定位到的結果比較可靠,前人普遍使用沙培或土培的方式進行耐鹽性鑒定,調查的耐鹽性狀大多為葉片SPAD 值、耐鹽系數、葉片受害面積等指標,這些鑒定方式和指標存在一定的合理之處,但也存在許多局限性,為了更好地反映大豆耐鹽性,采用致死濃度作為耐鹽指標進行調查。通過對2年耐鹽性狀的QTL 定位結果分析,各性狀定位到的QTL 分布于不同染色體的不同位置上且2年的QTL 重疊度不高,這可能是由于環境的影響造成定位結果的不穩定。但是本研究在染色體上定位到的QTL 和前人研究結果較為一致,研究定位到的位置相近。
前人對苗期大豆耐鹽QTL 定位研究較多[29]。Lee 等[29]利用S-100×Tokoy 為親本的RILs 群體,以視覺耐鹽等級(visual salt tolerance ratings, STR)作為鹽處理后的耐鹽指標,在N 和L 連鎖群上定位 到6 個 耐 鹽QTL。Hamwieh 等[30]以JWS156-1×Jackson 為親本組成的F2群體,以葉片葉綠素含量SPAD 和STR 為指標在N 連鎖群上定位到2 個QTL,都位于Satt339 分子標記附近。Chen 等[31]以南農1138-2×科豐1 號為親本的RILs 群體,以STR、存活時間和存活率為指標定位出8 個耐鹽QTL,分別位于7 個不同的連鎖群上。Ha 等[32]使用野生大豆品種PI4-83463 與Hutcheson 雜交獲得的106 個RILs 群體進行定位,其與耐鹽相關的QTL基因定位在第3 染色體上Satt255 與BARC-038333-10036 之間。楊燕[33]以重組自交系群體NJRIKY(科豐1 號×南農1138-2)427 個家系為研究對象,結合構建的包含4 737 個重組bin(分子標記)的高密度大豆遺傳圖譜,以相對根長(relative root length,RRL)和相對干重(relative dry weight, RDW)為鑒定指標,一共檢測到16 個大豆幼苗期耐鹽 QTL 位點。陳華濤等[11]以植株鹽處理后的存活時間(plant survival days, PSD)為指標,共檢測到3 個耐鹽QTL,它們分別位于B1、G 和K 三個連鎖群上。據報道在大豆不同生育時期,大豆表現出不同的耐鹽機制[34]。研究結果表明,第3 染色體上QTL,在大豆苗期耐鹽相關性狀定位[35]時,被多名研究人員重復檢測到。其他報道也發現許多與大豆耐鹽相關的新QTL。2008年,Chen 等[31]在大豆苗期耐鹽QTL 定位中,通過田間和溫室試驗定位到8 個QTL分布在6 條染色體上,在大豆第3 染色體上和第18染色體上定位到了穩定的QTL 位點。Kan 等[36]利用由184 份F7:11組成的重組自交系,定位11 個大豆芽期耐鹽相關QTL,同時在第8 染色體上和第18 染色體上定位到了耐鹽顯著相關的QTL。在2018年,Do 等[37]使用Williams 82(中度敏鹽)和Fiskeby III(耐鹽)構建的132 重組自交系群體進行苗期耐鹽相關研究中,在第3 染色體和第13 染色體上都定位到了耐鹽相關QTL。劉謝香[38]利用耐鹽栽培大豆中黃39 與鹽敏感野生大豆NY27-38 雜交后代衍生的142 個家系組建群體 ,定位到2 個大豆出苗期耐鹽性QTL,分別位于第6 和第14 染色體。在實際生產種植上,大豆苗期是大豆生長發育的重要時期,對產量的影響較大。了解大豆苗期耐鹽機制,挖掘耐鹽基因可能成為今后大豆耐鹽育種研究的一個重要方面。
4 結論
2020-2021年連續2年共定位到12 個QTL 位點。7 個QTL 位點具有加性效應,1 個QTL 位點具有上位性效應。有5 個與已報道的大豆耐鹽相關QTL 物理位置相同,其余7 個QTL 則是本研究首次發現的新QTL 位點。在大豆第3 染色體58 cM 處與第18染色體123.18 cM 處定位到的苗期耐鹽QTL 位點為大豆苗期耐鹽主效QTL。