連續靜置培養促進大腸桿菌生長和運動
王 媛, 王芳彬
(合肥工業大學 食品與生物工程學院, 安徽 合肥 230601)
0 引 言
運動性是細菌在環境中移動的一種高效策略,這一過程對于細菌在營養缺乏的條件下生存至關重要[1-2]。文獻[3]研究了大腸桿菌K-12(一種腸道共生菌株的模式生物)在連續5 d培養下的生長動力學,該菌株在體外模擬人類腸道內細菌有規律的營養供應。研究表明大腸桿菌K-12在MH培養基中連續培養,每12 h中到達穩定期的時間縮短,生長速度加快,最終導致穩定期和指數期蛋白表達上存在差異,這些蛋白質可能會影響鞭毛運動的能力。迄今為止,大多數將營養與微生物群聯系起來的研究都集中在細菌的生長上[4],但是關于營養誘導的細菌生長影響其鞭毛運動的研究卻很少。
在大腸桿菌中,鞭毛馬達[5-8]是一種跨膜蛋白,可以推動細菌在液體介質中游動。馬達旋轉由多達11個彼此獨立工作的定子驅動,每個定子由4個單位的MotA蛋白和2個MotB蛋白組成,它的運動方式有2種,即在前進和原地打轉之間交替。當大腸桿菌上的所有鞭毛馬達沿逆時針(counterclock wise,CCW)方向旋轉時,細菌就會前進;而當一個或多個馬達沿順時針(clockwise,CW)方向旋轉時,細菌會原地打轉[9-11]。
本文以E.coliJY26/pKAF131作為模式生物進行研究,對E.coliJY26/pKAF131連續5 d靜置[12]培養,通過紫外分光光度計定時檢測E.coliJY26/pKAF131的生長狀況得到了E.coliJY26/pKAF131連續5 d的生長曲線,并通過乳膠小球粘附在鞭毛馬達上,利用倒置顯微鏡Ti2-E連續5 d觀察E.coliJY26/pKAF131穩定期的有效運動的變化,本文在此運動的基礎上研究了在連續5 d靜置培養下處于穩定期的E.coliJY26/pKAF131的泳動性的變化,并且與另外2種野生型菌株E.coliJY26(ΔfliC)和E.coliJY26(ΔmotB)/pKAF131的泳動性[13]作比較,E.coli的運動性強意味著泳動性比較敏感。同時本文研究了在連續5 d靜置培養下對處于穩定期的E.coliJY26/pKAF131形態的影響。這些生物物理學實驗對深入了解E.coliJY26/pKAF131馬達的運動機制及生物學功能的研究具有一定的作用。
1 材料與方法
1.1 實驗材料
1.1.1 實驗菌株
E.coliJY26/pKAF131、E.coliJY26(ΔfliC)和E.coliJY26/pKAF131(ΔmotB)均由中國科技大學袁軍華實驗室提供。
1.1.2 實驗試劑
Tryptone、Yeast、Sodium chloride、Agar powder(BD公司);磷酸氫二鉀、磷酸二氫鉀、無水乙醇、鹽酸、甘油、過氧化氫(國藥集團化學試劑有限公司);天冬氨酸(天津市東麗區天大化學試劑廠);M Grease(APIEZON);蛋氨酸、乳酸、乙二胺四乙酸(EDTA)、氯化鈉、多聚賴氨酸、RIPA、三磷酸腺苷標準品、磷酸酶抑制劑(美國Sigma公司);氯霉素(GIBCO)。
1.1.3 實驗儀器與設備
SW-CJ-1FD 超凈工作臺(上海智誠);Biophtometer plus分光光度計、Eppendorf Centrifuge 5430R離心機(Eppendorf); DSX-24L手提式高壓蒸汽滅菌器(上海申安); JY 92-Ⅱ超聲波破碎儀(新芝生物科技股份有限公司);TS-2搖床(Kylin-Bell);PHS-3C pH計(濟南前程分析儀器有限公司);Hitech-Sciencetool Master-Q超純水凈化系統(上海和泰儀器有限公司); BSA1245高精密電子天平(Sartorius公司);HSX-150恒溫培養箱(上海海向儀器設備廠);Ti2-E倒置顯微鏡(Nikon); ImageQuantLAS 400 mini 熒光成像系統(GE Healthcare)。
1.2 生長曲線的測定
準備24個50 mL的離心管,分成3組置于離心管架上。配2 L LB培養基,調節pH值到7.3左右,然后分裝到50 mL離心管中,分別加入3個50 mL離心管盛有40 mL LB培養基,6個50 mL離心管分別盛有39、38、37 mL培養基,3個50 mL離心管盛有36 mL培養基。第1天首先將分裝好滅過菌的LB培養基置于超凈臺中,從過夜培養細菌的試管中取出400 μL的菌液,加入到40 mL LB液體培養基中,搖勻以后放在離心管架上,然后放進37 ℃恒溫箱里,每隔2 h測OD值,12 h內測6次OD值,最后一次測完立馬離心,5 000 r/min、5 min、24 ℃下離心后倒入新的39 mL LB培養基中。過夜培養12 h后,第2天早上立馬離心,5 000 r/min、5 min、24 ℃,然后每隔1 h測OD值,第2天大概需要稀釋測OD值,取100 μL菌液加900 μL空培養基放進1.5 mL離心管內,震蕩均勻后轉入比色皿里測OD值,連續12 h中每隔1 h測1次,需要迅速測OD值,12 h后離心倒掉上清,加入38 mL LB液體培養基繼續培養。第3天早上,經過培養12 h后再離心,5 000 r/min、5 min、24 ℃,然后加入新鮮38 mL LB培養基,開始每隔10 min測1次,取50 μL菌液加950 μL空培養基放進1.5 mL離心管內,震蕩均勻后轉入比色皿里去測OD值,等菌液濃度穩定以后每隔2 h測1次即可。12 h后離心倒掉上清,加入37 mL LB空培養基繼續培養。第4天早上,經過培養12 h后再離心,5 000 r/min、5 min、24 ℃,然后加入新鮮37 mL LB培養基,開始每隔10 min測1次,取50 μL菌液加950 μl空培養基放進1.5 mL離心管內,震蕩均勻后轉入比色皿里去測OD值,等菌液濃度穩定以后每隔2 h測1次。12 h后離心倒掉上清,加入36 mL LB空培養基繼續培養。第5天早上,經過培養12 h后再離心,5 000 r/min、5 min、24 ℃,然后加入新鮮36 mL LB培養基,開始每隔10 min測1次,取50 μL菌液加950 μL空培養基放進1.5 mL離心管內,震蕩均勻后轉入比色皿里測OD值,等菌液濃度穩定后每隔2 h測1次。
1.3 運動性實驗
在連續5 d靜置培養E.coliJY26/pKAF131的生長過程中,每天離心后,將新鮮的LB培養基倒入,并在8 h后進入穩定期。然后取出1 mL細菌溶液,并將該細菌溶液稀釋其OD值為0.45~0.50。取1 mL MM溶液洗滌細菌,5 000g離心1 min,將上清液除去,加入1 mL MM溶液,然后重懸。用移液管取出1 mL 細菌溶液,用23號針頭將其吸進注射器。然后用聚苯乙烯軟管連接注射器,將這2個注射器來回擠壓100次。使用小口徑的針頭切去長的細菌鞭毛,從而縮短鞭毛,并使乳膠球更容易粘在鞭毛上。接下來,需要將鞭毛細菌溶液離心至5 000g,離心1 min,除去上清液。最后吸取300 μL MM溶液移到1.5 mL離心管中,并將其與剩余細菌混合,以使細菌均勻地懸浮在300 μL MM溶液中。
用移液槍取出40 μL Sigma的聚賴氨酸溶液,將其緩慢且均勻地放在干燥的蓋玻片上,持續3 min。將雙面膠帶切成2段等長,然后粘貼到載玻片上。雙面膠帶的2個部分之間的距離短于蓋玻片的長度。用鑷子夾住蓋玻片的一個角,然后用純凈水清洗蓋玻片。從蓋玻片上除去多余的聚賴氨酸,自然干燥,然后將蓋玻片粘到處理過的一側。在此實驗中,使用移液器將40 μL細菌懸液吸入切片通道,然后將準備好的切片倒置3 min。這樣可以使蓋玻片位于下方,而載玻片位于上方。讓細菌與聚賴氨酸溶液充分接觸,以便細菌可以粘在蓋玻片上觀察E.coliJY26/pKAF131的運動。3 min后,用移液管吸取100 μL MM溶液,并通過切片通道緩慢洗滌,以去除未粘在蓋玻片上的E.coliJY26/pKAF131。緩慢加入40 μL乳膠顆粒,倒置3 min。然后用移液器吸取100 μL MM溶液,并通過切片通道緩慢洗滌,以洗去未粘附在E.coliJY26/pKAF131鞭毛上的乳膠小球。最后用APIEZON的M型油脂(潤滑脂)密封型材通道的兩端,以備實驗。
使用CMOS相機(DCC3260M)40倍物鏡并且以500幀/s的速度記錄E.coliJY26/pKAF131鞭毛馬達的運動。所有實驗均在23 ℃下進行。
1.4 游動性實驗
首先將配好的Swimming培養基平放在超凈臺上,然后在連續5 d靜置培養大腸桿菌的生長過程中,每天早上離心后倒入新鮮的LB培養基等8 h左右到達穩定期,再取出1 mL菌液,稀釋菌液使其OD值為 0.45~0.50。繼續取出4 μL菌液滴在培養皿的中心位置,吹風1 h左右,直到菌液在培養基表面晾干為止。最后輕輕地放置在37 ℃恒溫箱中孵育24 h,倒置培養,孵育24 h以后將培養皿輕輕地放在凝膠成像儀中拍照。
1.5 形態實驗測定
用乙醇清洗 1 片長×寬為 76.2 mm×25.4 mm的載玻片,然后用純水清洗1 片長×寬為18 mm×18 mm 的蓋玻片,最后自然晾干,準備后續實驗。使用移液槍吸取 40 μL的 Sigma 公司的多聚賴氨酸(polylysine)溶液,緩慢且均勻地涂布在已經晾干的蓋玻片上,靜置3 min。然后將雙面膠截成2段一樣長且等長于蓋玻片粘于載玻片上,2段雙面膠的間距要小于蓋玻片的長度。用鑷子夾住蓋玻片的一角,再用純水清洗蓋玻片,去掉蓋玻片上多余的多聚賴氨酸,自然晾干,經過處理的一面粘住載玻片,這樣就形成了一個通道。在連續5 d靜置培養大腸桿菌的生長過程中,每日早上離心后倒入新鮮的LB培養基,在8 h以后到達穩定期,然后取出1 mL菌液,測菌液的OD值為 0.45~0.50。將稀釋好的菌液用移液槍吸取1 mL,加入1.5 mL離心管中,離心5 000g、1 min,去掉上清。然后取1 mL MM 溶液清洗一遍菌體,離心5 000g、1 min,去掉上清。用移液槍吸取300 μL的MM溶液加入1.5 mL離心管中與剩余菌體混合均勻,使細菌均勻懸浮于 300 μL的MM溶液中。
使用移液槍吸取40 μL 的細菌懸浮液慢慢地打入切片的通道中,接下來將做好的切片倒置處理3 min,即讓蓋玻片在下面,載玻片在上面。讓細菌與多聚賴氨酸(polylysine)溶液充分接觸,便于細菌沾到蓋玻片上,以便觀察大腸桿菌的形態。3 min后再將切片正置放好,吸取100 μL的MM溶液,將其緩慢通過切片通道進行清洗,目的是將沒有粘到蓋玻片上的細菌清洗掉。最后用 APIEZON 公司生產的 M 型油脂(Grease)將切片通道兩端封住,完成了切片的制備。接下來立即將制備好的切片拿到顯微鏡下進行實驗觀察。
2 結果與分析
2.1 E.coliJY26/pKAF131的生長動力學分析
研究表明E.coliK12菌株能在連續靜置的MH培養基中生長速度加快,為此測試E.coliJY26/pKAF131在LB培養基中的生長狀況。本文使用一種名為JY26(ΔfliC)的野生型菌株,該菌株是E.coliK12菌株RP437的衍生物。本文將帶有黏性細絲fliCst的質粒pKAF131轉入到JY26中。E.coliJY26/pKAF131連續5 d的生長曲線如圖1所示。

圖1 E.coliJY26/pKAF131連續5 d的生長曲線
由圖1可知,E.coliJY26/pKAF131的生長速度加快,到達穩定期的時間縮短。第1天連續培養E.coliJY26/pKAF131,8 h以后到達穩定期;第2天連續培養E.coliJY26/pKAF131,2 h到達穩定期;第3~5天連續培養E.coliJY26/pKAF131,1 h以內到達穩定期。結果表明:E.coliJY26/pKAF131在連續5 d的靜置LB培養中,生長速度加快,到達穩定期的時間縮短。
2.2 E.coliJY26/pKAF131的運動性分析
在靜置LB培養中,E.coliJY26/pKAF131的生長動態連續5 d發生變化,因為要了解這是否會影響E.coliJY26/pKAF131的運動性,所以本文選擇連續5 dE.coliJY26/pKAF131生長的穩定期進行研究。本文首先對2種大腸桿菌(野生型大腸桿菌JY26和大腸桿菌JY26/pKAF131)的鞭毛馬達的轉速進行分析,E.coliJY26/pKAF131的鑒定結果如圖 2 所示。因為野生型E.coliJY26(ΔfliC)無鞭毛基因,所以無鞭毛運動,作為對照組;E.coliJY26/pKAF131 是導入了表達鞭毛基因的質粒pKAF131,因此使細菌獲得了運動能力和可以標記乳膠小球的能力。
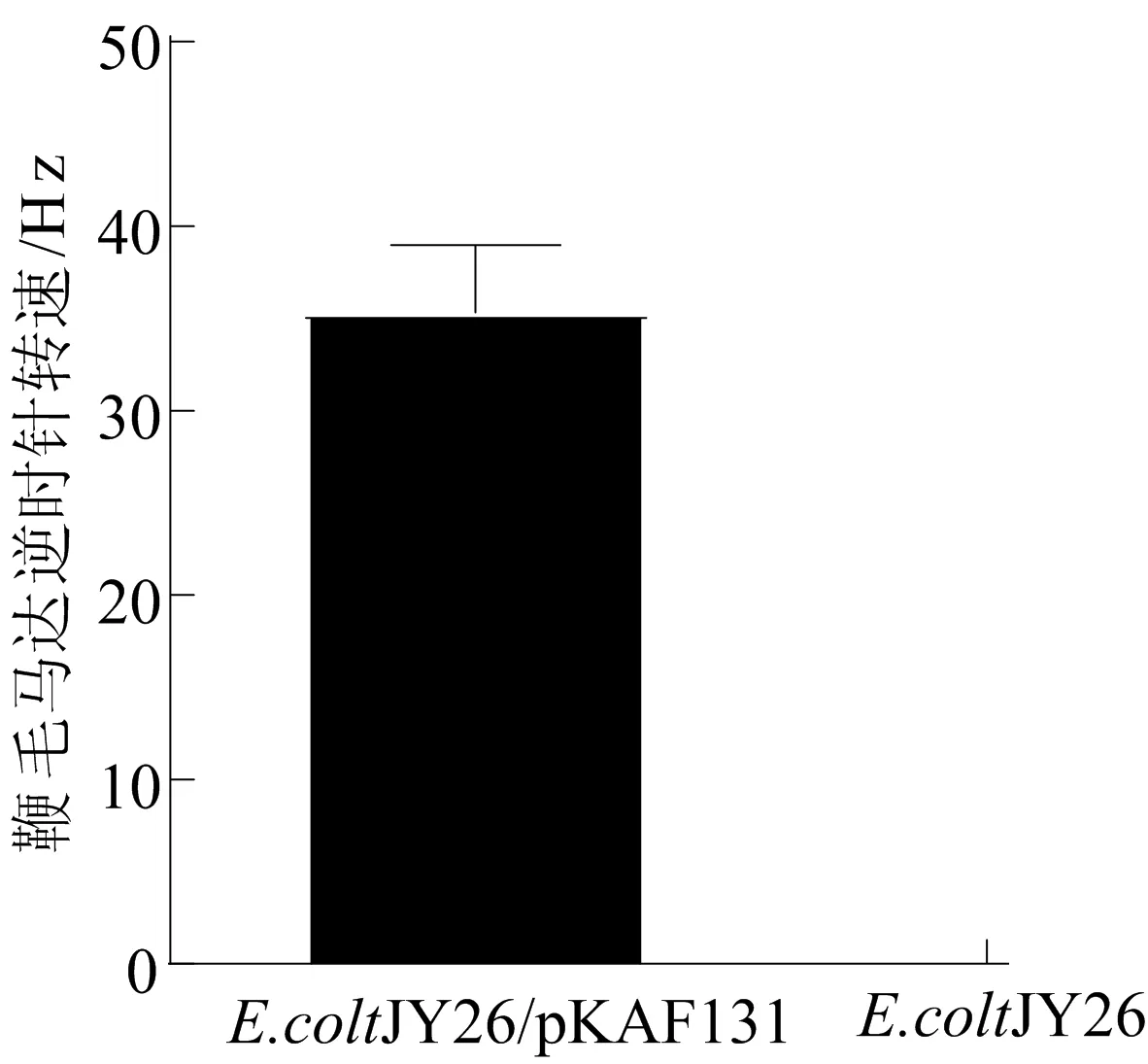
圖2 E.coliJY26/pKAF131的鑒定結果
本文鞭毛馬達的動力學分析需要利用乳膠小球粘附在E.coliJY26/pKAF131的鞭毛上,通過倒置顯微鏡Ti2-E觀察E.coliJY26/pKAF131運動速度的變化。利用E.coliJY26/pKAF131鞭毛馬達的順時針速度和逆時針速度作運動指標,并用MATLAB分析鞭毛馬達的轉速。連續5 d培養E.coliJY26/pKAF131鞭毛馬達的順時針轉速如圖3所示。圖3中:*表示P<0.05;***表示P<0.001,下同。從圖3可以看出,連續靜置培養E.coliJY26/pKAF131的順時針轉速分別為(39.59±4.503)Hz、(51.32±5.076)Hz、(53.05±3.687)Hz、(55.70±4.798)Hz、(69.59 ±4.298)Hz,連續5 d研究的有效細菌數為4、17、21、18、28。E.coliJY26/pKAF131的順時針轉速逐漸提高。
連續5 d培養E.coliJY26/pKAF131鞭毛馬達的逆時針轉速如圖4所示,其中,* *表示P<0.01。從圖4可以看出,連續5 d 的E.coliJY26/pKAF131的逆時針轉速分別為(35.33±3.663)Hz、(50.44±4.846)Hz、(52.34±4.026)Hz、(54.57±5.236)Hz、(74.33±5.530)Hz,每天研究的有效細菌個數分別為21、19、22、21、30。與第1天相比,第2天的逆時針轉速提高了30%;第3、4天與第2天相比沒有顯著性差異,但是轉速有所提高。在第5天時,細菌鞭毛運動的逆時針轉速達到約69.59 Hz,與第4天相比增加了約20%。結果表明:E.coliJY26/pKAF131在連續5 d的靜置LB培養中,運動性增強,E.coliJY26/pKAF131的逆時針轉速連續5 d上升,而順時針轉速表明運動環境的不利因素也在增加,這與E.coliJY26/pKAF131數量的增加是一致的,次生毒性代謝產物也在增加[12]。
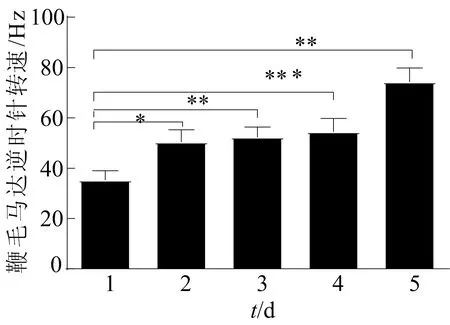
圖4 E.coliJY26/pKAF131鞭毛馬達的逆時針轉速
2.3 MotB和FliC的運動影響分析
為了驗證MotB和FliC在E.coliJY26/pKAF131運動中的重要性,本文將E.coliJY26(ΔfliC)、E.coliJY26(ΔmotB)/pKAF131和E.coliJY26/pKAF131進行連續5 d的靜置LB培養,然后在泳動培養基上觀察細菌游動的直徑。3種E.coli菌株連續5 d的群體運動如圖5所示。圖5中:E.coliJY26為缺少鞭毛FliC基因的菌株;E.coliJY26(ΔmotB)/pKAF131為缺少運動蛋白基因的菌株;E.coliJY26/pKAF131為有運動基因并且有鞭毛的菌株;將培養第1天的菌液穩定期的細菌取出4 μL滴在泳動固體培養基上,37 ℃孵育24 h拍照;第2~5天以此類推。從圖5可以看出,E.coliJY26/pKAF131游動的直徑在連續培養5 d的靜置培養中發生變化,隨著培養天數的增加,E.coliJY26/pKAF131游動的直徑增大。與對照組相比,當同時存在MotB和FliC時,E.coliJY26/pKAF131的運動性才會隨著培養天數的增加而增強。

圖5 3種E.coli菌株連續5 d的群體運動
2.4 E.coliJY26/pKAF131的形態學分析
有研究表明細菌的長寬比與細菌的遷移率有關。在連續5 d的靜置培養中,E.coliJY26/pKAF131的生長速率加快,運動性增強。為了分析E.coliJY26/pKAF131的形態,本文將穩定期的E.coliJY26/pKAF131制成切片利用倒置顯微鏡隨機拍攝,并借助MATLAB分析E.coliJY26/pKAF131的形態和大小。E.coliJY26/pKAF131的測量數據具有統計學意義。連續5 d培養E.coliJY26/pKAF131的菌體長寬比如圖6所示。
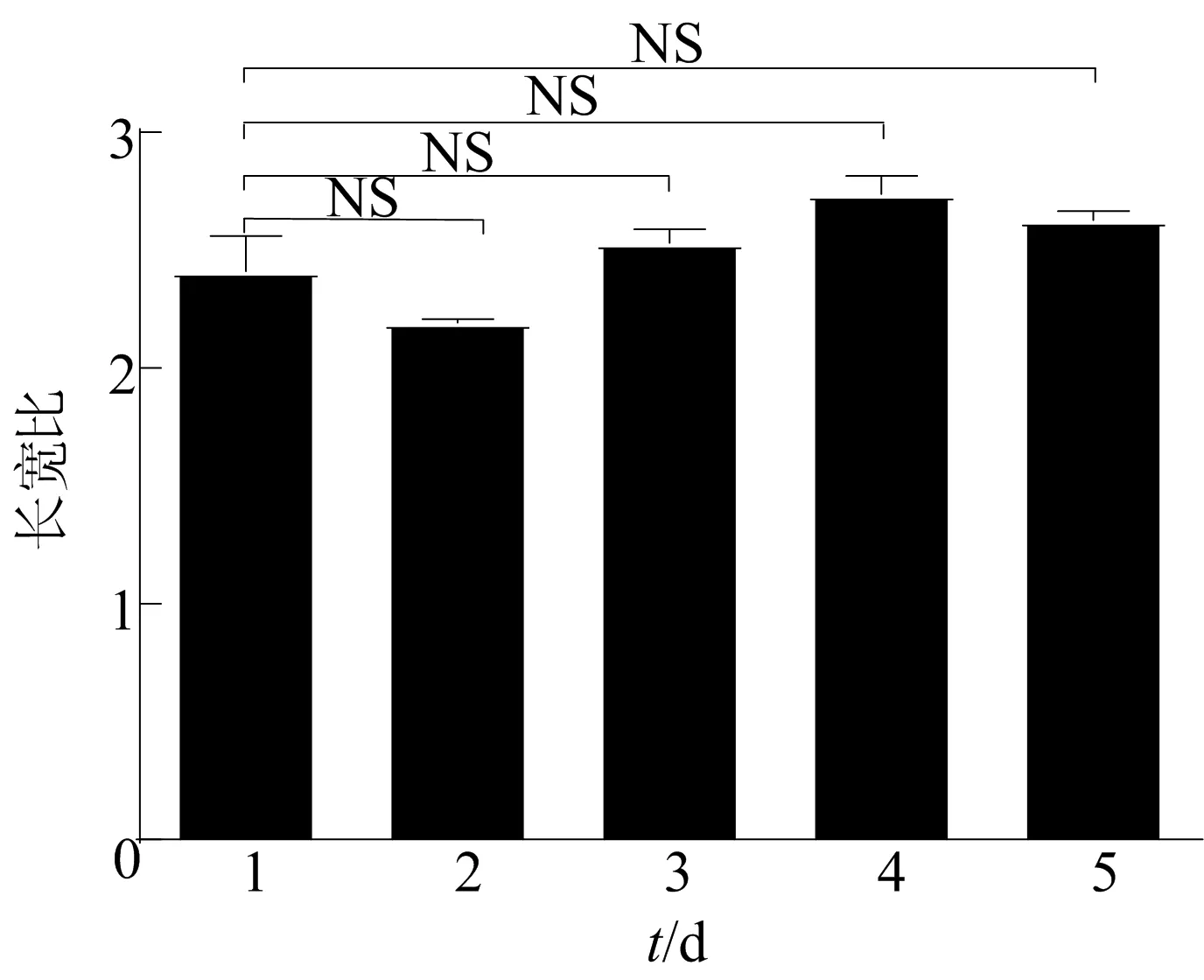
圖6 連續5 d培養E.coliJY26/pKAF131的菌體長寬比
從圖6可以看出,E.coliJY26/pKAF131的長寬比保持在約2.5,沒有顯著性差異,但整體的趨勢與細菌的運動性增強趨勢相吻合。
3 結 論
已有的研究表明E.coli在連續靜置培養中,生長速率加快,并且與E.coli運動相關的一些基因表達量升高。本文分析發現連續 5 d靜置培養E.coliJY26/pKAF131,E.coliJY26/pKAF131的生長到達穩定期的時間縮短,生長速度加快。這些結果與先前的報道一致,表明連續靜置培養對E.coliJY26/pKAF131的生長起著重要作用。除此以外,連續5 d靜置培養E.coliJY26/pKAF131,E.coliJY26/pKAF131的運動性發生變化,并且隨著培養天數的增加運動性增強,泳動性與E.coliJY26/pKAF131的運動有關,泳動性增大,說明E.coliJY26/pKAF131確實在連續5 d的靜置培養中運動性增強。結果表明連續5 d靜置培養可能參與調控E.coliJY26/pKAF131的生長和運動基因的表達,這一發現對更深入地了解腸道有關的細菌在體內的運動以及抗細菌藥物的研發具有一定的指導作用。

