基于分子生物學原理技術檢測肉制品中動物源性成分研究進展
易艷,劉明東,蔣子敬,姜展樾,,馬麗俠,葉德萍,韓國全*,周李華*
1(四川農業大學 食品學院,四川 雅安,625000)2(中國測試技術研究院,四川 成都,610000)
肉中富含優質蛋白質、礦物質、脂肪和維生素(維生素B6、維生素B12和維生素D)等,此外,它含有維持基本生命活動所需的必需氨基酸。近年來,肉及肉制品摻偽摻假事件頻繁發生,已對消費者的權益造成傷害,擾亂社會秩序,侵犯宗教信仰。隨著部分商販及企業摻假手段不斷提高,使得肉制品的多樣性和復雜性日益增加,傳統鑒別技術已不能適應市場監管要求,快速、高通量、準確的動物源性成分檢測方法,不僅能為政府部門監管工作提供技術支持,也為消費者權益提供技術保障。目前國內外已研發多種鑒別肉類摻假的檢測方法,如基于形態學特征的感官鑒定技術、以光譜學為基礎的化學鑒別法、以蛋白質為基礎的免疫學方法及色譜質譜聯用技術。
DNA是生物體組織和細胞內基因儲存、復制和傳遞的重要物質基礎,與蛋白質相比,其穩定性和種間多態性更強,利于物種鑒別。因此,以核酸分子為基礎的生物學技術在物種識別中具有重要意義,已成為肉類種屬鑒別最常用的方法,如普通PCR、數字PCR、多重PCR、實時熒光PCR、限制性片段長度多態性PCR,除此之外,研究人員還開發出環介導等溫擴增、DNA條形碼、高通量測序(next-generation sequencing, NGS)等快速、高通量的檢測方法。目前,主要選擇線粒體DNA和核基因組作為肉制品源性成分的鑒定基因,線粒體DNA是一種雙鏈核外遺傳物質,具有分子質量小、分子進化速度快、物種間差異大,種間穩定性好等特點,廣泛應用于物種鑒定領域[1],常用的目標基因有cytb、ATP6、12S rRNA、D-loop區、16S rRNA 和ATP8[2]等。
1 PCR技術
PCR檢測技術是目前國內肉類成分鑒定的標準方法,我國已陸續頒布一些國家標準、行業標準和地方標準,以熒光PCR技術為主,可用于絕大多數動物源性成分的鑒定,也能滿足食品安全監管部門對檢測技術簡便、準確、高效的基本需求。
1.1 普通PCR定性檢測技術
PCR是一種在生物體外進行的特殊DNA復制,其最顯著的特征是能大量增加DNA的數量,并能根據不同物種的特定基因比對分析,設計適合的特異性引物,實現對物種種源的鑒別[3]。普通PCR是用一對特異性引物對目的片段擴增,是一種常規的肉制品鑒別技術。CALVO等[4]篩選豬的特異性引物,從香腸、餡餅、生熟肉、煙熏肉等豬肉制品中成功檢測出了豬肉。普通PCR方法的應用為物種鑒別開辟了PCR技術的新時代,但普通PCR技術一次只能檢出一個物種,不能滿足高通量的檢測需求。
多重PCR技術(multiplex PCR)又稱復合PCR技術,是一種基于聚合酶鏈式反應的新PCR技術,加入的兩對或以上引物在同一反應體系中擴增不同模板,獲得不同的目標片段。如表1列舉多重PCR技術用于牛、羊、雞、鴨等成分的檢測,檢出限達0.01 ng/μL,最高可同時檢測6種動物源性成分,多重PCR法不僅特異性強、靈敏度高,同時又減少試劑用量,提高檢測效率,節約檢測費用,被廣泛用于動物源性成分的檢測,但該技術引物設計是關鍵,數量過多可能引起交叉反應。

表1 多重PCR檢測技術
1.2 限制性片段長度多態性PCR技術
限制性片段長度多態性PCR(PCR-restriction fragment length polymorphism,PCR-RFLP)將RFLP與PCR兩項技術相結合,經同一限制性內切酶對擴增產物進行酶切,獲得不同長度的酶切片段,用瓊脂糖凝膠電泳法或毛細管電泳法分析酶切片段,從而鑒別樣品中的動物源性成分。已有大量研究將該技術應用于肉制品的鑒別中,如ISLAM等[11]基于PCR-RFLP法,采用4種限制性內切酶分別對64個肉類樣品的12S rRNA基因進行分析,結果表明,所有酶剪切位點在這些樣品中均是保守的,該技術可用于肉類的檢測與鑒別。同時UDDIN等[12]建立了牛、水牛、雞、鴨、山羊、綿羊和豬的七重PCR-RFLP檢測方法,PCR產物經FatⅠ、BfaⅠ、HPY188I酶切鑒定,得到混合肉類的檢出限為0.5%(質量分數),該方法的靈敏度高,穩定性好,利于生鮮肉及加工肉制品中目標物種的鑒別。RFLP方法雖然有很好的檢測效果,但由于內切酶位點隨機變異,使實驗結果的重現性較差,因此設計合適的酶切位點至關重要。
1.3 實時熒光PCR相對定量技術
實時熒光PCR是一種以PCR為基礎的檢測技術,指將熒光基團加入反應體系中,通過連續監測PCR擴增過程中熒光信號的強度來實時監測特定產物的量,并利用標準曲線對其進行定量檢測的過程,可分為熒光探針法和熒光染料法,如圖1所示,此技術已廣泛應用于肉類摻假鑒定[14-15]。基于實時熒光PCR技術的定量分析策略主要通過構建標準質粒、引入校正系數等方案實現動物源成分的準確定量。徐瓊等[16]基于TaqMan實時熒光PCR技術,將朊蛋白基因(PRNP)作為豬特異性基因,使用ΔCt法進行相對定量,豬源性的檢出限為0.25%(質量分數),所配制的豬肉含量為31%、52%、59%和79%的仿冒羊肉樣品,其檢測值與真值差異較小,表明此法能夠精準、穩定地檢測出在羊肉中所摻的豬肉含量。ZHU等[17]建立了常規多重PCR和標準化實時PCR同時檢測5種常見肉類及定量檢測食品中驢肉含量的方法,能快速準確區分驢、羊、牛、豬和馬5種常見的摻假品種。IWOBI等[18]利用肌生長抑制素的通用序列和雙重量化性質,建立一種定量檢測肉糜中牛肉和豬肉組分的三重實時熒光PCR方法,其檢測限為20個基因組當量,能為肉糜的量化提供可靠依據。與數字PCR相比,實時熒光PCR技術具有成本低、儀器平臺廣泛等優勢,但也存在一些不足之處,定量過程需要構建標準曲線,但無法獲得定量準確的標準品。其次,以Ct值作為中間系數,無法準確計算用于定量的靶基因拷貝數與樣品質量分數之間的對應關系,因此一定程度阻礙了該方法在肉類定量檢測中的應用[19]。
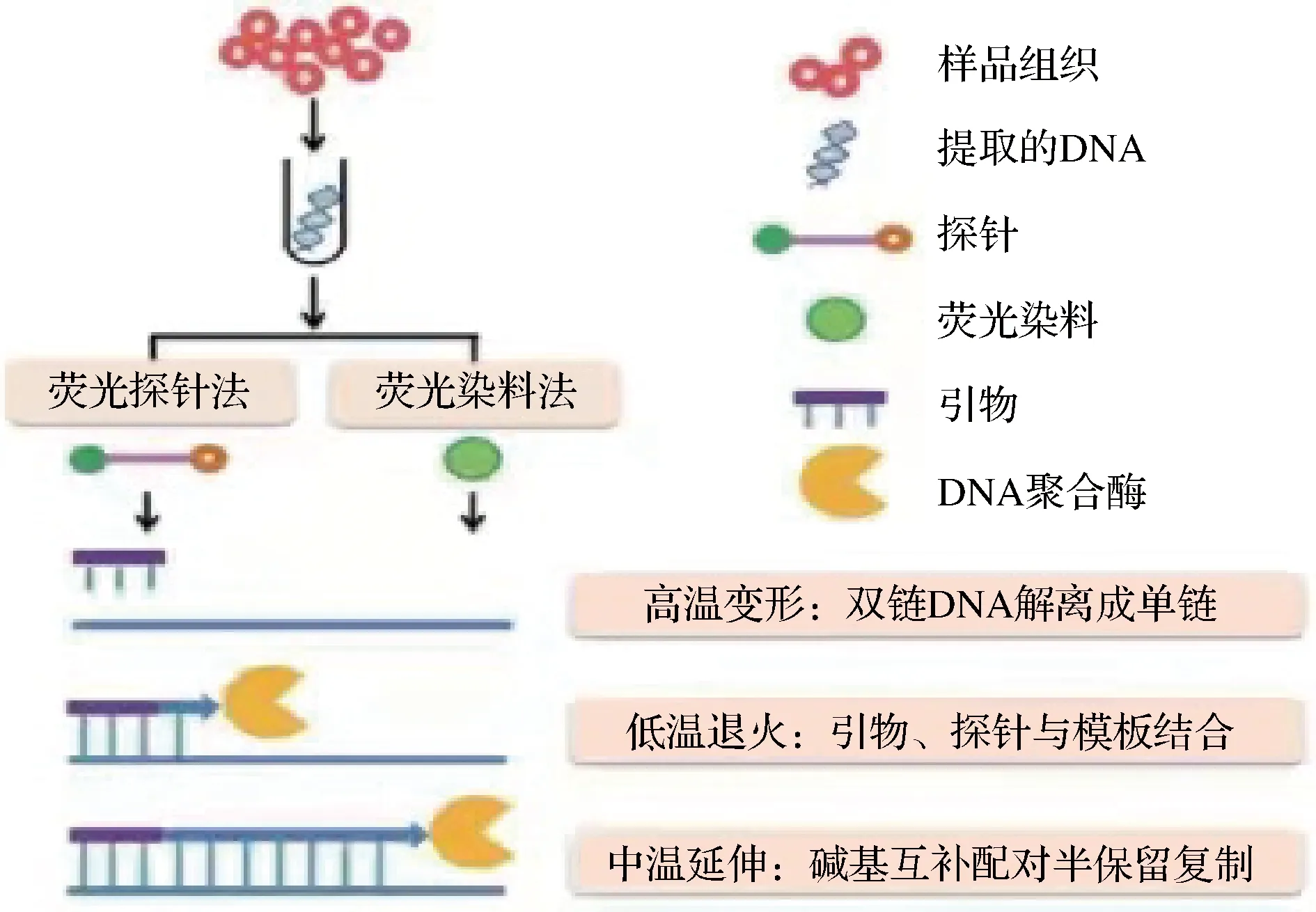
圖1 實時熒光PCR 技術原理圖[13]
1.4 數字PCR絕對定量技術
微滴數字PCR技術(droplet digital PCR, ddPCR)是一種核酸定量檢測方法,通過微滴生成儀把反應體系分散到不同的反應單元中,獨立進行PCR,并依據陽性比例和泊松分布計算出DNA起始濃度,能實現核酸的絕對定量[20],如圖2所示。肉制品定量檢測的關鍵是實現DNA拷貝數與樣品質量分數的轉換,吳海晶等[21]基于微滴式數字PCR建立羊肉中鴨肉組分與拷貝數之間的線性關系,通過測定混合樣品中羊肉與鴨肉的DNA拷貝數,利用結合建立的標準曲線計算出羊肉與鴨肉的質量比,結果表明,該方法準確度高,經多重驗證,與標準樣品的絕對誤差為0.35%;REN等[22]采用微滴數字PCR定量測定綿羊和山羊肉產品中雞肉的含量,并在檢驗過程中引入校正系數k,將動物源成分質量比例轉換為拷貝數的比例,研究結果表明,原料肉的不同部位對所建立方法的定量準確性無影響,且檢測經高溫高壓處理的樣品時,該方法表現出良好的重復性和穩定性。與傳統PCR、熒光定量PCR相比,數字PCR技術準確度和靈敏度更高,不依賴擴增閾值(Ct值),無需考慮不同樣品的引物擴增效率差異造成定量檢測不準確,人為操作因素少,對模板濃度進行精準定量,但實際檢測時,不同來源的肉制品中核基因組DNA或線粒體DNA拷貝數及豐度存在差異,線粒體DNA豐度高且拷貝數大,易造成定量不準確,而核基因組DNA拷貝數恒定,不易受到不同組織細胞的影響,更適用于動物源成分的定量檢測。
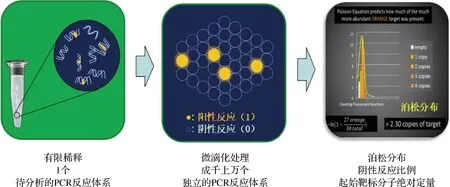
圖2 微滴數字PCR技術原理圖
2 快速檢測技術
隨著全球對肉類鑒別技術越來越高的要求,開發準確高效的現場檢測技術是監管部門執法的關鍵,環介導等溫擴增技術(loop-mediated isothermal amplification,LAMP)是一種新型核酸體外擴增技術,基本原理是DNA在4條特異性引物(內外引物各2條)及鏈置換DNA聚合酶作用下可不斷合成鏈置換DNA,具有可以在恒定溫度下(65 ℃左右)快速高效地擴增目的片段的優勢,由于該方法無DNA變性步驟,因此擺脫了復雜的溫度控制裝備及精密儀器的限制,能滿足現場檢測及執法的需求,耗時較少,結果肉眼可判別,應用于肉類快速檢測具有較好的前景。CAI等[23]研發了一種基于實時LAMP的測定法,此方法可在20 min內檢測出肉制品中豬源成分,檢測限達1.76 pg/μL,比PCR靈敏度高1 000倍,這是首次應用LAMP法檢測商業產品中的豬源成分,其實際應用將有助于打擊食品工業的摻假行為;ZAHRADNIK等[24]采用LAMP法檢測加工食品中馬肉含量,以馬的線粒體基因組設計了特定擴增引物,引物特異性好,未觀察到牛肉、豬肉和雞肉的交叉反應,方法靈敏度高,能從制備的模型香腸中檢測到0.1%的馬肉。于媛媛等[25]以豬、雞、鴨線粒體DNA為靶基因設計特異性引物,對3種源性成分的模擬深加工樣品檢測分析,分析時間為36 min,可實現生鮮肉、加工肉制品肉源成分的快速篩查。目前國內外已有大量研究者將LAMP應用于肉類成分鑒別中。
3 新型分子檢測技術
目前,我國相關標準涉及的方法主要是針對已知目標物種,而在實際檢測中,對于更多未知成分的篩查,傳統方法不適用,為滿足這一需求,有研究者開發了非目標成分檢測的DNA測序技術,該技術可以通過一次測序得到混合樣品尤其是未知樣品中的全部目標片段序列,隨后與基因數據庫進行比對,從而確定物種種類。現存在許多包含核酸序列信息的動物DNA數據庫,有學者實驗室建立了包含2 700多個種的動物數據庫[26],即使沒有參考樣本或參考基因序列,通過數據庫序列信息比對也能確定動物源性。該技術準確、快速、通量高,在肉類摻假檢測中具有較好的發展潛力。
3.1 DNA條形碼技術
DNA條形碼(DNA barcode)技術是由HEBERT等[27]提出并在物種鑒別中開始應用的,其工作原理是使用標準的或已知的基因組DNA基因片段作為分子靶標,在種級水平進行物種鑒定,與超市里識別商品的條形碼相似,DNA barcode主要編碼線粒體COI基因,線粒體COI基因已被證明可作為動物公認條形碼[28],DNA條形碼技術能夠實現對多種未知摻雜成分的快速、高通量的檢測,真正突破了常規分子方法定向測定的局限,它有不可替代的優越性,是一個通用、非定向靶標的檢測方法。而國內關于牛、羊、豬、鴨等肉類DNA條形碼的研究仍處于初級階段[29]。AHMED等[30]以印度不同烹飪方式加工的肉制品為研究對象,測試DNA條形碼的適用性,研究顯示,經烹飪加工的肉制品雖經復雜處理及含有大量香料,但對應用DNA條形碼技術進行物種鑒定無影響,表明其可作為一種可靠的動物源性追溯方法;田晨曦等[31]采用COI-2引物進行PCR擴增及序列比對,建立以COI基因為基礎的肉制品摻假鑒別方法,對牛-豬、羊-豬、牛-鴨和羊-鴨模型摻假物的檢出限分別為5%、8%、1%和4%,方法簡便快速有效;勵炯等[32]基于COI序列建立并優化可鑒別11種生鮮肉的DNA條形碼技術,研究以低價值肉(雞、鴨、馬等)摻入高價值肉類中(牛、羊、兔等)制備18種摻假模型,結果顯示,在18種摻假模型中,牛羊肉與低價值肉摻混的最低檢出率為5%,該方法靈敏度高,可作為高低價值肉類摻雜的有效鑒別方法。目前國際上對于DNA條形碼技術在鑒定雜交物種種屬信息方面存在爭議,但可通過聯合其他分子檢測方法來解決,例如,在某種程度上,采用復合條形碼技術、微型條形碼技術解決了含有多個未知物種的混合樣品的鑒定問題[33]。
3.2 高通量測序技術
21世紀NGS的出現使動物源性成分檢測取得了新突破。NGS可分為靶向測序、全基因組測序和轉錄組測序,NGS可以通過聚合酶或連接酶直接體外合成和測序同時進行,具有高通量、快速、可定量、低成本和高分辨率等優點。一次高通量測序可以讀取400 000~4 000 000條序列,不同的測序平臺可讀取到的堿基數不等[34],目前NGS的主要代表平臺有Illumina公司的Solexa基因組分析儀和ABI的SOLiD測序儀,不同平臺的核心技術有所區別,圖3為BGISEQ原理圖。Solexa聚合酶合成測序的關鍵技術是:“DNA簇”和“可逆性末端終結”[36];SOLiD連接酶測序取代了傳統PCR,可對單拷貝DNA片段進行大規模擴增和高通量測序[37]。
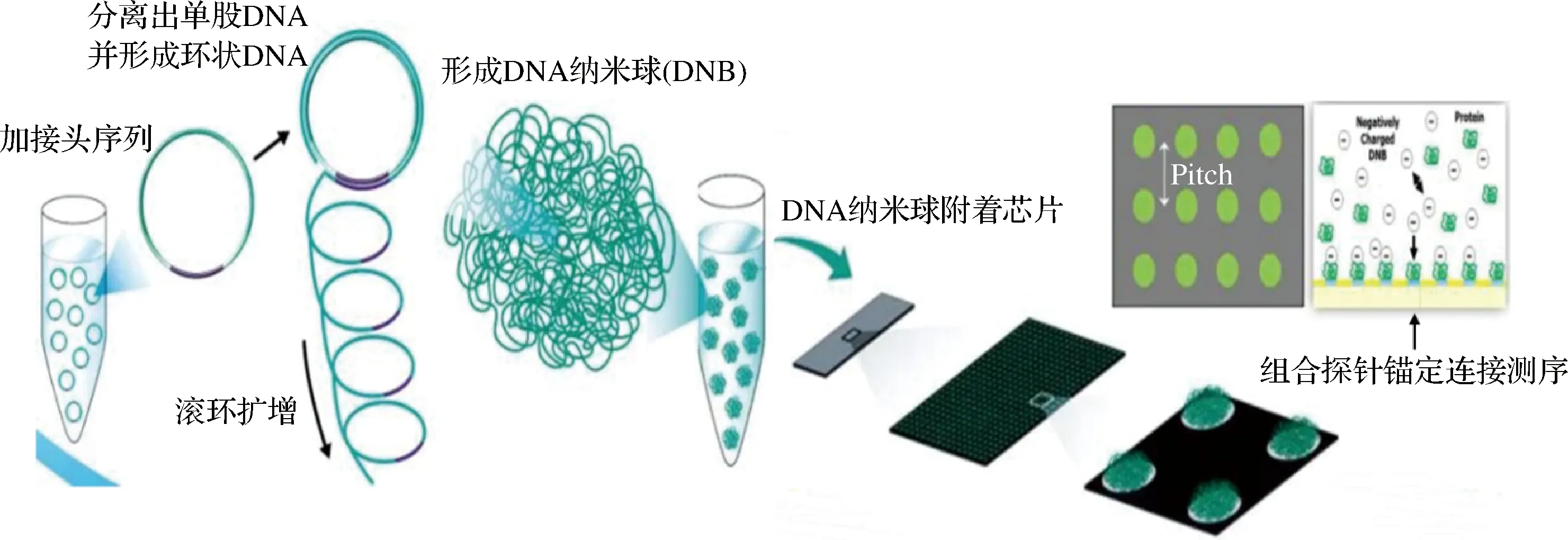
圖3 高通量測序技術原理圖[35]
該項技術已廣泛應用于環境中微生物多樣性分析[38]、病毒鑒別[39]、臨床診斷[40]等。蔡一村等[41]利用二代測序和DNA條形碼技術對哺乳動物、禽類及其他肉類混合樣品進行鑒定,通過擴增線粒體基因16S rRNA區,使用Illumina Miseq二代測序技術獲取所有序列信息,并與GenBank數據庫進行比對,結果顯示,混合樣品中鵝、鴨成分被正確識別,且檢測下限為0.5 ng/μL,該方法準確度高,用途廣泛,實現了混合DNA片段序列的高通量測定;PAN等[42]提出一種能準確識別加工肉制品中豬、牛、家禽等物種的NGS結合DNA微條形碼的方法,基于51種動物的140條序列設計引物,鑒定包含12個物種的鮮肉混合物,經測序、序列比對分析顯示,12個物種序列與目標序列完全一致,說明此方法檢測效率較高。ZHANG等[43]采用NGS結合包含動物2 354個完整的線粒體基因組序列數據庫,對不同含量的豬、牛、羊、雞、兔和小鼠成分的模擬樣品鑒定研究,結果表明該方法能夠檢測肉類中1%的動物源成分,方法的準確率達97.65%,對肉制品中混合動物源性成分或未知成分的識別具有良好的應用前景。NGS具有快捷、成本低、通量高等特點,能一次實現多種動物源成分的檢測,將為食品安全執法監管、摻雜摻假、清真食品的檢測提供新思路。
4 總結與展望
近年來,屢次出現的肉制品摻假事件存在較大的食品安全風險,嚴重影響消費者,破壞社會經濟秩序,研究快速、準確、高效的動物源性成分檢測方法,對保障國家食品安全、社會穩定、人民健康至關重要。目前國內外學者開展的基于分子生物學技術已廣泛應用于肉制品的檢測,不同技術各有優缺點,詳見表2,實驗人員可根據具體條件選擇適當的的方法。未來,在現有檢測技術基礎上,開發低成本的快檢試劑盒、豐富動物基因組序列數據庫、細化雜交物種的DNA條形碼、優化數據分析方法、采用多核苷酸多態性標記等是研究的趨勢,同時,NGS一次可檢測幾百份樣品,具有通量高、快速、準確性好等優勢,為動物源性成分鑒定的發展提供了新方向,必將在大批量、未知摻假成分的肉制品檢測中發揮重要作用。

表2 檢測技術應用場景及特點比較

