廣州市高風險藥品經營企業監督檢查缺陷項目分析
侯珺,閻英,黃炳生,吳生齊
(1.廣東省廣州市食品藥品監督管理局審評認證中心,廣東 廣州 510140;2.廣東省藥品監督管理局審評認證中心,廣東 廣州 510080)
根據廣東省廣州市市場監督管理局2021年藥品經營(批發、連鎖總部)企業《藥品經營質量管理規范》(GSP)監督檢查實施方案,對列為高風險藥品經營的企業進行重點檢查,包括2019年以來嚴重違反和屢次違反GSP的企業,屢次被投訴舉報的企業,抽檢檢出不合格藥品的企業,委托其他企業儲存、運輸藥品的藥品批發企業(零售連鎖總部)及接受委托儲存、運輸的藥品批發企業;2020 年以來嚴重違反GSP 的企業,被省藥監局給予行政處罰的藥品批發企業(零售連鎖總部)。共發現27家高風險藥品經營企業,統計了在檢查中發現的缺陷項目,分析缺陷項目產生原因并提出風險防控措施,為下一步開展有針對性監管提供參考。現報道如下。
1 總體情況
1.1 檢查重點
1)《國家食品藥品監督管理總局關于整治藥品流通領域違法經營行為的公告(2016年第94號)》所列10種違法行為;《國家食品藥品監督管理總局辦公廳關于開展城鄉接合部和農村地區藥店診所藥品質量安全集中整治的通知》(食藥監辦藥化監〔2017〕90號)明確的10項整治內容。
2)強化芬太尼類藥品、第二類精神藥品和含特殊管理藥品復方制劑等的監管。特殊藥品特別是第二類精神藥品,以含可待因復方口服液體制劑、曲馬多、阿普唑侖等流失問題突出的品種為重點,將購買方資質審核、藥品出入庫管理、藥品流向等作為重點檢查內容,重點核查銷往個體診所、私營醫院等醫療機構第二類精神藥品等特殊藥品數量特別大等可疑、異常行為。
3)重點關注疫苗、血液制品、特殊管理藥品、中藥飲片、兒童用藥、終止妊娠藥品、促排卵等雌激素藥品、抗腫瘤藥品、國家組織集中招標采購中選藥品、通過仿制藥質量和療效一致性評價藥品、醫保藥品、國家基本藥物和新型冠狀病毒肺炎疫情防控所需藥品等品種,以及上一年度被行政處罰、有不良行為記錄的企業及單位。規范渠道管理和儲存、運輸管理,防范非法渠道購銷和冷鏈藥品“斷鏈”,防控質量風險隱患。
4)重點核查有無從非法渠道購進藥品,票賬貨款不一致,未入庫或設立賬外賬,使用銀行個人賬戶進行業務往來等情形,以及“兩票制”的實施情況,省市電子監管平臺上傳情況,藥品儲存、溫濕度監控系統運行、冷鏈藥品的儲存與運輸管理情況;有無非法加工中藥飲片、非法渠道購銷中藥飲片,以中藥材及初加工產品冒充中藥飲片銷售或將非藥品冒充藥品銷售,以及超經營方式或超經營范圍經營藥品的情況等。
5)監督檢查缺陷項目的整改落實情況。結合企業提交的整改報告確認報告內容的真實性、完整性,并核實企業是否存在其他違法違規情況[1]。
1.2 檢查結果
27 家企業累計檢查項目6 329 項次,出現嚴重缺陷項目的企業有8 家(29.63%)。所有企業均出現主要缺陷項目,其中出現1 條、2 條、3 條嚴重缺陷項目的企業分別有6家(22.22%)、1家(3.70%)、1家(3.70%)。
2 缺陷項目匯總分析
2.1 缺陷項目分布
27家藥品經營企業共出現缺陷項目248項次,占累計檢查總項目的3.92%。其中,出現嚴重缺陷項目11項次(4.44%),主要缺陷項目185 項次(74.60%),一般缺陷項目52項次(20.97%)。
根據《藥品經營質量管理規范現場檢查指導原則》,嚴重缺陷項目為**+數字,主要缺陷項目為*+數字,一般缺陷項目為數字。監督檢查發現,缺陷條款項次數量較多的章節為質量管理體系文件(12.10%)、校準與驗證(12.10%)、儲存與養護(11.29%)、人員與培訓(11.29%)、設施與設備(10.89%)、機構和質量管理職責(10.89%)。詳見表1。
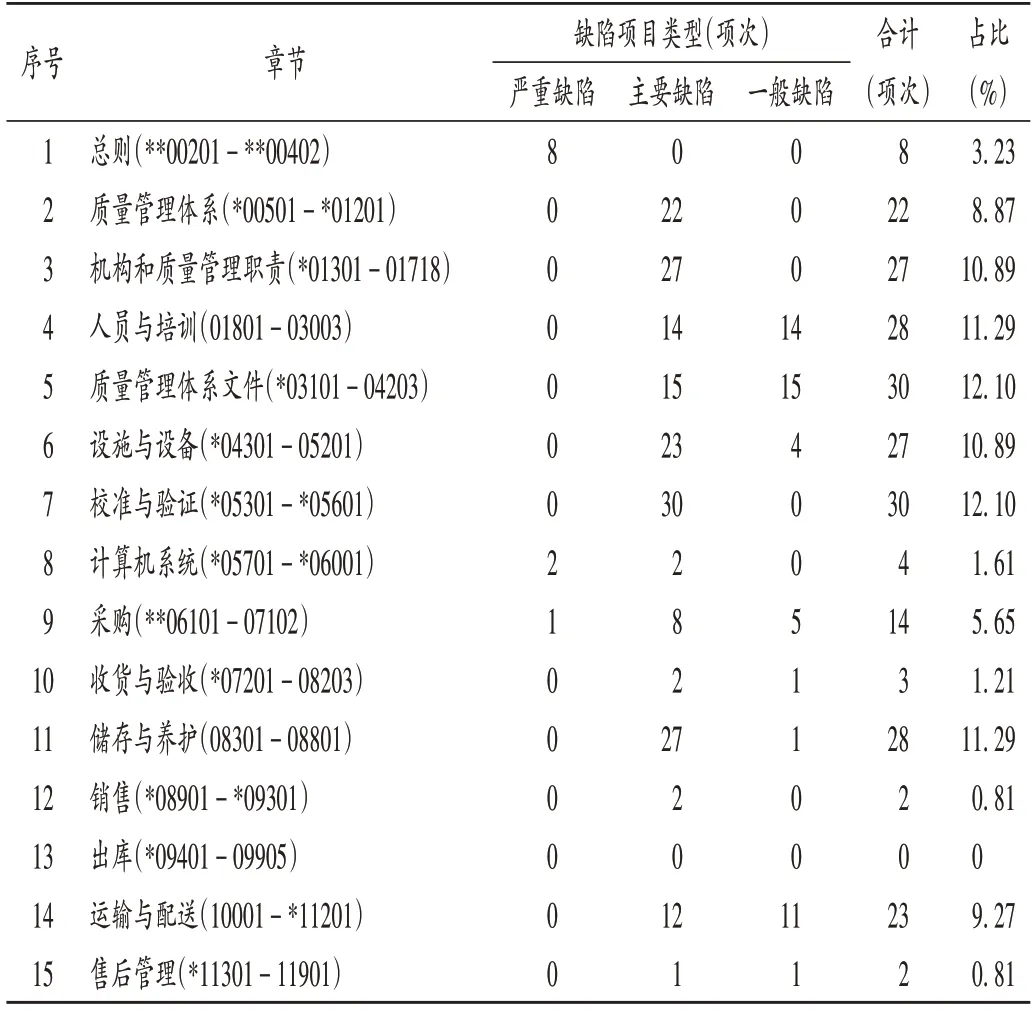
表1 248項次缺陷項目分布Tab.1 Distribution of 248 cases of defective items
2.2 高頻次缺陷條款分布
248項次缺陷項目中,共出現高頻次缺陷項(≥6項次)16項,共計137 項次(55.24%)。高頻次缺陷項見表2,主要涉及以下章節及條款。
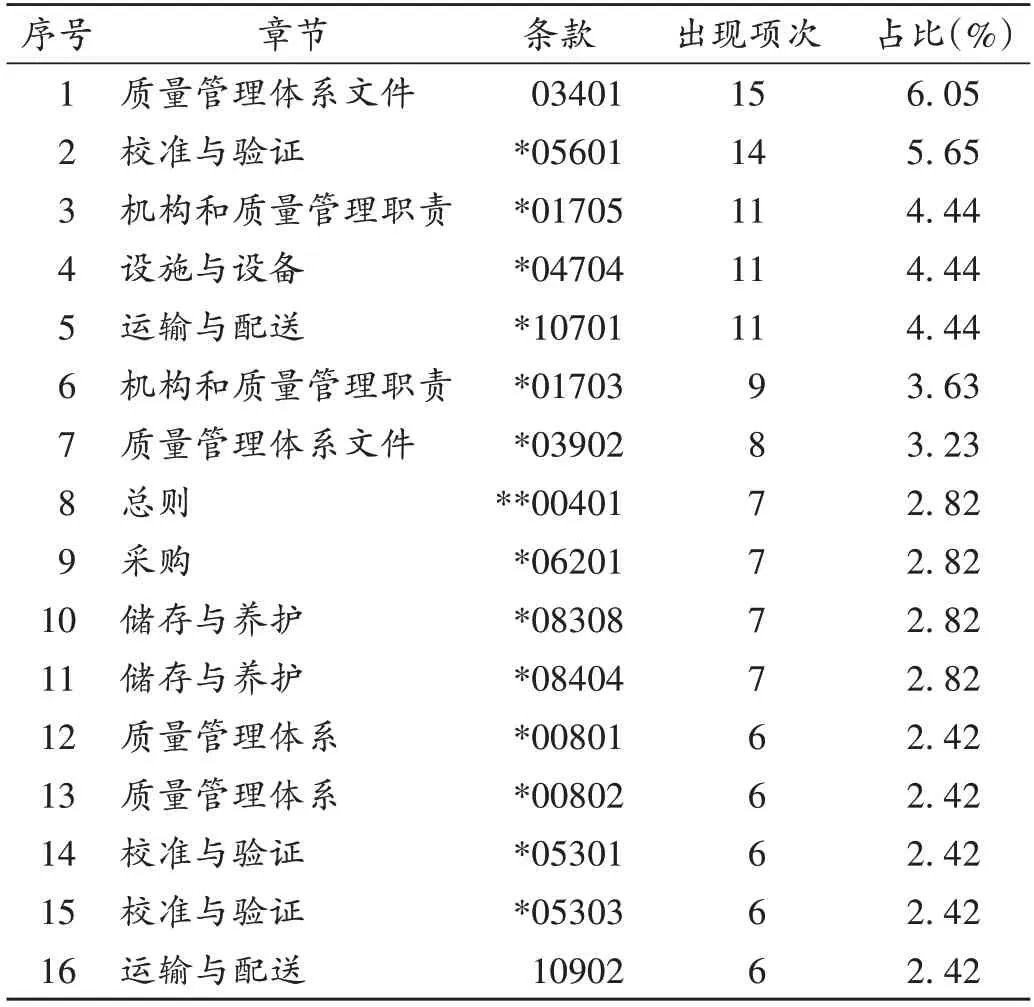
表2 137項次高頻次缺陷項(≥6項次)條款分布Tab.2 Distribution of clauses of 137 cases of high-frequency defective times(≥six cases)
校準與驗證(26 項次):*05601 企業應根據驗證確定的參數及條件,正確、合理使用相關設施設備;*05301 企業應按國家有關規定,對計量器具、溫濕度監測設備等定期進行校準或檢定;*05303 企業應對儲運溫濕度監測系統進行使用前驗證、定期驗證及停用時間超過規定時間的驗證。
質量管理體系文件(23項次):03401企業應定期審核、修訂文件;*03902 企業的記錄應當真實、完整、準確、有效和可追溯。
機構和質量管理職責(20 項次):*01705 企業的質量管理部門應負責藥品的驗收,指導并監督藥品采購、儲存、養護、銷售、退貨、運輸等環節的質量管理工作;*01703 企業的質量管理部門應負責對供貨單位和購貨單位的合法性、購進藥品的合法性及供貨單位銷售人員、購貨單位采購人員的合法資格進行審核,并根據審核內容的變化進行動態管理。
運輸與配送(17 項次):*10701 企業委托其他單位運輸藥品的,應對承運方運輸藥品的質量保障能力進行審計,索取運輸車輛的相關資料,符合GSP 運輸設施設備條件和要求的方可委托;10902 企業的委托運輸記錄應至少包括發貨時間、發貨地址、收貨單位、收貨地址、貨單號、藥品件數、運輸方式、委托經辦人、承運單位等內容,采用車輛運輸的還應載明車牌號,并留存駕駛人員的駕駛證復印件。
儲存與養護(14項次):*08308企業的藥品堆碼間距不小于5 cm,與庫房內墻、頂、溫度調控設備及管道等設施間距不小于30 cm,與地面間距不小于10 cm;*08404企業的養護人員應對庫房溫濕度進行有效監測、調控。
質量管理體系(12 項次):*00801 企業應定期開展質量管理體系內審;*00802 企業應當在質量管理體系關鍵要素發生重大變化時組織開展內審。
設施與設備(11 項次):*04704 企業的庫房應配備自動監測、記錄庫房溫濕度的設備。
總則(7項次):*00401藥品經營企業應依法經營。
采購(7 項次):*06201 首營企業的審核,應查驗加蓋公章原印章的資料,確認真實、有效[2]。
3 存在的主要問題分析
3.1 總體情況
根據以上監督檢查結果發現,部分企業法規意識淡薄,出現未遵守連鎖總部“七統一管理”(統一品牌標識管理、統一藥品質量管理、統一采購管理、統一配送管理、統一財務管理、統一網絡信息管理、統一服務質量管理)及遠程審方等政策要求,以及未依法在核準的注冊、倉庫地址經營方面的嚴重缺陷,部分企業在質量管理體系文件和執行、設施設備使用、校準與驗證、質量管理部門履行職責等方面仍存在較多不足[2-4]。
3.2 嚴重缺陷
8 家企業(29.63%)出現嚴重缺陷項目,其中1 家企業出現3條嚴重缺陷項目。問題主要集中在零售連鎖總部未按GSP 要求對門店實行統一管理,門店私自從其他批發企業購進藥品銷售,計算機系統未能識別和控制不合規采購行為;個別企業還出現未達到連鎖要求規定的門店數量及無法開展總部遠程審方職能等情況。說明部分企業存有僥幸心理,在取得相關資質檢查后放松守法合規經營要求,未能確保企業持續、有效進行藥品經營質量管理。
3.3 質量管理體系文件與執行
14 家企業(51.85%)未依據2019 年修訂的《藥品管理法》《藥品上市許可持有人管理辦法(試行)》等法規要求修訂有關上市許可持有人的內容和藥品不良反應報告制度、藥品召回管理制度等相關文件。10 家企業(37.04%)未進行內審或內審流于形式,未能查找出企業實際存在問題。6家企業(22.22%)未按要求上傳藥品經營監管數據至廣州市“三品一械”(食品、藥品、化妝品、醫療器械)數據監管平臺。說明企業按照GSP要求建立了質量管理體系,配備相應的組織機構、人員、設施設備等,但對質量管理體系文件的執行存在“走過場”現象,未認真核實企業實際情況,文件內容與實際操作不一致。
3.4 設施設備使用、校準與驗證
12 家企業(44.44%)未正確使用溫濕度自動監測系統,相關人員未及時接收倉儲溫濕度報警信息及進行有效養護。13 家企業(48.15%)未依據冷鏈運輸設備驗證的結論制訂相應的操作和使用規程,或現場演示實際操作與驗證結論不符。說明企業對設施設備驗證管理規定的理解還不到位,驗證工作流于形式,為符合要求而驗證,沒有真正理解驗證的目的是為企業制訂操作規程提供依據,并應依規執行,相關崗位人員的實際操作與驗證結論脫節。
3.5 質量管理部門未有效履行職責
16 家企業(59.26%)未有效審核購貨單位的資質文件,印章模板、隨貨同行單樣式等與實際收貨單據有差異。11 家企業(40.74%)未監督藥品采購、儲存、銷售等環節的質量管理工作。說明企業對質量管理風險的認識不足,未將首營資料不符列為高風險經營項,也未將GSP 貫穿于整個企業的運營過程而形成全員共識,造成質量管理部門未能有效履行職責。
3.6 運輸與配送
11 家企業(40.74%)未按要求對承運方運輸藥品的質量保障能力進行審計。6 家企業(22.22%)委托運輸記錄的要求不符合GSP 規定。說明企業對委托運輸藥品承運方的審核規定理解和把握不足,未按照GSP要求逐一審核承運方資質,并詳細記錄委托運輸情況。
3.7 儲存與養護
7 家企業(25.93%)在庫藥品儲存未符合堆碼間距不小于5 cm,與庫房內墻、頂、溫度調控設備及管道等設施間距不小于30 cm,與地面間距不小于10 cm 等“五距”要求。說明企業對倉儲人員的崗前培訓、繼續教育培訓不到位,未嚴格按照企業制訂的管理制度和操作規程開展工作[5];企業統籌規劃不足,配備的庫房容積與經營規模不相適應,出現某一時段“爆倉”現象。
4 對策與建議
4.1 增強企業管理層合規意識
從檢查發現的嚴重缺陷項目可知,部分企業仍存在僥幸心理,對合規管理、防范藥品質量安全風險認識不足。企業要想實現自我完善和自我發展,合規建設必不可少。企業負責人和企業質量負責人等企業管理層決定著質量管理工作的具體實施,管理層合規意識淡薄、GSP 及相關法律法規不熟悉是發生違規行為的前提。只有加強對企業管理層的培訓,提高對合規風險的認識,才能從源頭杜絕違規行為的發生。
4.2 加強對質量管理工作的重視
質量管理是藥品經營的核心內容,是實施GSP 的關鍵環節。企業應提高對質量管理重要性的認識,明確企業是藥品質量安全的第一責任人,運用風險管理的理念開展企業質量管理工作,尤其是對經營過程中容易產生藥品質量風險的環節和因素加以重視,如儲運溫濕度、計算機管理系統、驗證、特殊管理藥品及國家有專門管理要求的藥品在銷售過程中的管控等[6-8]。同時,應加強對員工的培訓,尤其是藥品相關法律法規和崗位操作規程方面的內容。
4.3 完善質量管理體系
只有不斷完善企業的質量管理體系,優化企業組織架構,明確各崗位職責,加強內部培訓,提升質量管理人員的綜合素質,才能有效實現企業的全面質量管理。同時,還要做好各類體系文件的管理、應用及推廣。在文件制訂、修訂時,應充分結合企業經營實際情況[6]。在監督檢查中發現,部分企業未依據企業實際情況制訂相關的管理制度,只是為了應付GSP 監督檢查,為符合要求而制訂,標準操作規程(SOP)可操作性不強,造成員工無章可循。故質量管理部門應對制訂和修訂的文件進行嚴格審查,確保其具有合理性和可行性,經質量負責人審批后再實施[3]。
4.4 完善監管機制
為及時、有效了解企業狀況,監管部門應完善監管機制,將日常監管、GSP監督檢查、專項檢查相結合,盡可能采用飛行檢查方式,加大對企業的巡查力度,嚴厲打擊企業的違法違規行為,以促使企業不斷提高質量管理水平。同時,加大對高風險藥品經營企業的監督檢查力度,堅持以問題為導向、從嚴監管的原則,充分利用信息化監管手段和風險管理方式,針對校準與驗證、質量管理體系和質量管理職責、委托運輸及設施設備管理等問題高發環節實施系統檢查,提高檢查針對性和檢查效率[9]。
4.5 加強對藥品檢查員的培養
藥品安全關系人民群眾的生命健康,藥品檢查員隊伍建設是加強藥品監管、保障藥品安全的重要支撐力量。只有檢查員不斷提高自身素質和專業技能,藥品監管才能持續、良好發展,才能有效解決藥品監管中不斷產生的問題。故藥品監管部門要加強對現有藥品檢查員的專業知識培訓,提高監管人員的素質和專業水平,使其能應對各種突發藥品監管狀況,適應時代發展要求[10]。
4.6 行業協會發揮溝通協調作用
通過藥品行業協會收集、整理、歸納藥品流通領域的現存問題,舉辦研討會、交流會、培訓班等,研究及分析行業現狀與未來發展趨勢,提出改進和發展建議,提升行業水平;同時,也可為藥品監管部門的決策提供數據信息。故應充分利用行業協會的溝通協調機制,搭建企業與監管部門間良好的橋梁紐帶。
通過分析2021 年廣州市27 家高風險藥品經營企業GSP 監督檢查缺陷項目發現,廣州市內的藥品批發企業(零售連鎖總部)基本能按照GSP 要求構建質量管理體系,但質量管理工作的效果還有待提高,部分企業未能深刻理解質量管理工作的重要性,存在為了符合要求而開展質量管理工作的現象。在不斷強化“四個最嚴”要求的背景下,企業只有嚴格按GSP 要求開展經營活動,增強合規意識,自主提高質量管理水平,才能實現長遠發展。藥品監管部門應不斷完善監管機制,采用多種管理手段加強有效監管,同時強化藥品檢查員隊伍建設,打造一支能應對各種突發藥品狀況的高水平專業化隊伍,提高廣州市的藥品監管水平,為行業持續、穩定、健康發展保駕護航。

