LINC00342調控miR-384對肺鱗癌細胞增殖侵襲遷移的影響研究
徐月亮, 王孝彬, 楊堯慶
(空軍軍醫大學唐都醫院胸外科, 陜西 西安 710032)
肺癌是常見的惡性腫瘤之一,非小細胞肺癌、肺鱗癌和肺腺癌為其主要病理類型,與非小細胞肺癌、肺腺癌相比,肺鱗癌的發病機制與治療策略研究明顯滯后,嚴重威脅著人們的生命健康[1]。目前肺鱗癌的治療手段主要有手術、放化療、免疫治療和靶向治療等,但是患者晚期預后較差,化療易產生耐藥性,治療效果并不理想[2]。因此,深入探究肺鱗癌發生發展的機制至關重要。長鏈非編碼RNA(long non-coding RNA,LncRNA)參與并調控包括癌癥在內的多種疾病的發生發展[3,4]。有研究證實,LINC00342在非小細胞肺癌組織和細胞中高表達,可促進癌細胞轉移[5],而miR-384在非小細胞肺癌組織和細胞中的表達水平降低[6]。通過生物信息學分析發現,LINC00342與miR-384可靶向結合。然而,LINC00342對人肺鱗癌細胞惡性生物學行為的影響尚不明確。因此,本研究主要探究LINC00342對肺鱗癌細胞惡性生物學行為的影響及潛在機制。
1 材料與方法
1.1細胞:人肺鱗癌細胞系SK-MES-1購自中科院上海細胞庫。
1.2主要試劑:CCK-8試劑盒(CK04)購自上海經科化學公司;Transwell小室(貨號:3413)購自北京信生元生物醫學科技有限公司;兔源一抗基質金屬蛋白酶-2(matrix metalloproteinase-2,MMP-2)(ab97779)、MMP-9(ab142180)、增殖細胞核抗原(proliferating cell nuclear antigen,PCNA)(ab265585)、半胱氨酸蛋白酶3(caspase-3)(ab4051)均購自英國Abcam公司;LipofectamineTM 2000 Reagent(ab136465)購自美國Invitrogen公司;LINC00342敲低質粒(si-LINC00342)及對照(si-NC),miR-384抑制劑(miR-384 inhibitor)及對照(inhibitor-NC)、miR-384模擬物(miR-384 mimic)及對照(mimic-NC)、LINC00342及miR-384引物購自廣州RiboBio公司。
1.3方 法
1.3.1細胞培養:將SK-MES-1細胞置于含10%胎牛血清、1%青-鏈霉素的DMEM高糖培養基中,在37℃、5% CO2環境下常規培養,每3d更換一次培養基,當細胞融合度達到85%以上時,消化傳代,收集對數期的細胞進行實驗。
1.3.2細胞轉染:將對數期的SK-MES-1細胞分為ctrl組(正常培養的SK-MES-1細胞)、si-NC組(轉染si-NC)、si-LINC00342組(轉染si-LINC00342)、si-LINC00342+inhibitor-NC組(si-LINC00342和inhibitor-NC共轉染)、si-LINC00342+ miR-384 inhibitor組(si-LINC00342和 miR-384 inhibitor共轉染)。轉染嚴格按照LipofectamineTM2000 Transfection Reagent操作步驟進行。
1.3.3RT-qPCR法檢測LINC00342、miR-384表達:使用Trizol提取各組細胞中的總RNA,將RNA逆轉錄為cDNA后,以cDNA為模板上RT-qPCR儀進行擴增。LINC00342:正向引物,5'-CGTTCCAATGTGTTGGGT-3',反向引物,5'-TGGGAGGAGGTTGAGATG-3';miR-384:正向引物,5'-ATTCCTAGAAATTGTTCATA-3';反向引物,5'-GAACATGTCTGCGTATCTC-3';GAPDH:正向引物,5'-CACCCACTCCTCCACCTTTG-3',反向引物,5'-CCACCACCCTGTTGCTGTAG-3';U6:正向引物,5'-GCTCGCTTCGGCAGCACA-3';反向引物,5'-GAGGTATTCGCAGAGGA-3'。分別以GAPDH、U6為內參,采用2-ΔΔCT計算細胞中LINC00342、miR-384的相對表達量。
1.3.4CCK-8法檢測細胞增殖:各組細胞接種到96孔板中,每孔初始接種約1×104個細胞,培養24、48、72h后,棄去細胞上清液,且在指定的時間點向每個孔中加入含有10μL CCK-8溶液的100μL完全培養基。孵育2h后,使用酶標儀檢測吸光度。
1.3.5Transwell實驗檢測細胞侵襲:將基質膠包被在上室,并向上室加入無血清的SK-MES-1細胞重懸液100μL,下室加入含10%胎牛血清的DMEM培養基。在37℃、5% CO2下孵育24h后,取出Transwell小室,棄去孔中的培養基,擦去上部未侵襲的細胞,PBS洗滌,甲醇固定,0.1%結晶紫染色。在光學顯微鏡下計數。
1.3.6劃痕實驗檢測細胞遷移:取各組細胞,置于37℃、5% CO2培養箱中培養24h后,采用20μL移液器槍頭進行劃痕,顯微鏡下記0h細胞的劃痕寬度為W0,記24h時細胞的劃痕寬度為W24。劃痕愈合率(%)=(W0-W24)/W0×100%。
1.3.7流式細胞儀檢測細胞凋亡:收集各組SK-MES-1細胞,PBS洗滌,重懸細胞,再分別添加Annexin V-FITC和PI染液5μL,充分混勻,于室溫下避光染色15min,使用BD流式細胞儀快速檢測細胞凋亡情況。
1.3.8Western blot檢測蛋白表達:利用RIPA裂解緩沖液提取SK-MES-1細胞總蛋白。電泳分離后,100V恒壓轉移蛋白至PVDF膜上,用5%的脫脂牛奶封閉2h,將膜與一抗PCNA、MMP-2、MMP-9、caspase-3、GAPDH,在4℃孵育過夜,再將膜與HRP偶聯的羊抗兔二抗在室溫下孵育2h,棄去液體,洗滌3次,加入ECL試劑觀察蛋白質印跡,Image J軟件評估各組細胞蛋白相對表達水平。
1.3.9雙熒光素酶報告基因實驗:構建LINC00342野生型質粒(LINC00342-WT)和突變型質粒(LINC00342-MUT),將LINC00342-WT和LINC00342-MUT分別與mimic-NC或miR-384 mimic共轉染于SK-MES-1細胞,48h后,檢測熒光素酶活性。
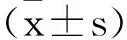
2 結 果
2.1各組SK-MES-1細胞中LINC00342、miR-384表達比較:與ctrl組、si-NC組比較,si-LINC00342組SK-MES-1細胞中miR-384表達升高,LINC00342表達降低(P<0.05);與si-LINC00342組、si-LINC00342+inhibitor-NC組比較,si-LINC00342+ miR-384 inhibitor組SK-MES-1細胞中LINC00342表達變化差異無統計學意義(P>0.05),miR-384表達降低(P<0.05),見表1。
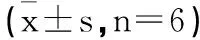
表1 各組SK-MES-1細胞中LINC00342 miR-384表達比較
2.2各組SK-MES-1細胞增殖能力比較:與ctrl組、si-NC組比較,si-LINC00342組SK-MES-1細胞OD450值降低(P<0.05);與si-LINC00342組、si-LINC00342+inhibitor-NC組比較,si-LINC00342+ miR-384 inhibitor組SK-MES-1細胞OD450值升高(P<0.05),見表2。
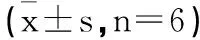
表2 各組SK-MES-1細胞OD450值比較
2.3各組SK-MES-1細胞侵襲情況比較:與ctrl組、si-NC組比較,si-LINC00342組SK-MES-1細胞侵襲數目減少(P<0.05);與si-LINC00342組、si-LINC00342+inhibitor-NC組比較,si-LINC00342+miR-384 inhibitor組SK-MES-1細胞侵襲數目增多(P<0.05),見圖1和表3。

圖1 各組SK-MES-1細胞侵襲情況比較(×400)
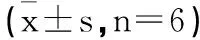
表3 各組SK-MES-1細胞侵襲數目比較
2.4各組SK-MES-1細胞遷移能力比較:與ctrl組、si-NC組比較,si-LINC00342組SK-MES-1細胞劃痕愈合率降低(P<0.05);與si-LINC00342組、si-LINC00342+inhibitor-NC組比較,si-LINC00342+miR-384 inhibitor組SK-MES-1細胞劃痕愈合率升高(P<0.05),見圖2和表4。

圖2 劃痕實驗檢測SK-MES-1細胞遷移
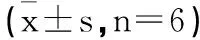
表4 各組SK-MES-1細胞劃痕愈合率比較
2.5各組HN-3細胞凋亡情況比較:與ctrl組、si-NC組比較,si-LINC00342組SK-MES-1細胞凋亡率升高(P<0.05);與si-LINC00342組、si-LINC00342+inhibitor-NC組比較,si-LINC00342+miR-384 inhibitor組SK-MES-1細胞凋亡率降低(P<0.05),見圖3和表5。

圖3 各組SK-MES-1細胞凋亡情況比較
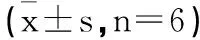
表5 各組SK-MES-1細胞凋亡率比較
2.6各組SK-MES-1細胞中PCNA、MMP-2、MMP-9、caspase-3蛋白表達比較:與ctrl組、si-NC組比較,si-LINC00342組SK-MES-1細胞PCNA、MMP-2、MMP-9蛋白表達降低,caspase-3表達升高(P<0.05);與si-LINC00342組、si-LINC00342+inhibitor-NC組比較,si-LINC00342+miR-384 inhibitor組SK-MES-1細胞PCNA、MMP-2、MMP-9蛋白表達升高,caspase-3表達降低(P<0.05),見圖4和表6。
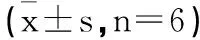
表6 各組SK-MES-1細胞中PCNA MMP-2 MMP-9 caspase-3蛋白表達比較

圖4 Western blot檢測SK-MES-1細胞中PCNA、MMP-2、MMP-9、caspase-3蛋白表達注:A:ctrl組,B:si-NC組,C:si-LINC00342組,D:si-LINC00342+inhibitor-NC組,E:si-LINC00342+miR-384 inhibitor組
2.7雙熒光素酶報告基因檢測結果:查詢Starbase數據庫可知LINC00342與miR-384之間有結合位點,見圖5。與mimic-NC和LINC00342-WT共轉染組比較,miR-384 mimic和LINC00342-WT共轉染組熒光素酶活性降低(P<0.05);與LINC00342-MUT和mimic-NC共轉染組比較,LINC00342-MUT和miR-384 mimic共轉染組熒光素酶活性差異無統計學意義(P>0.05),見表7。
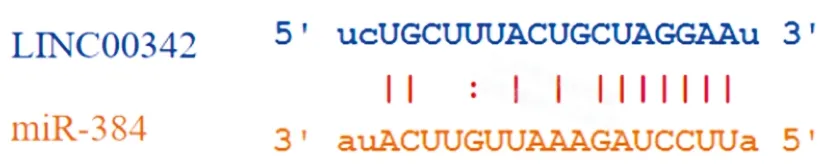
圖5 LINC00342與miR-384的結合位點
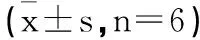
表7 熒光素酶活性比較
3 討 論
LncRNA可調節癌癥的許多重要病理過程,如腫瘤發生、增殖、轉移,在肺鱗癌的機制研究中有著重要地位[7,8]。LINC00342的異常表達在多種癌癥中充當致癌基因,例如,LINC00342表達在胃癌組織和細胞系中上調[9];在結腸腺癌中,LINC00342的高表達與患者預后不良有關,敲低LINC00342可抑制結腸腺癌細胞增殖、遷移和侵襲,促進細胞凋亡[10]。此外,有研究表示,LINC00342在非小細胞肺癌中呈高表達,敲低其表達可抑制非小細胞肺癌細胞增殖[11]。而LINC00342對肺鱗癌的影響尚不清楚,因此,本研究設計轉染si-LINC00342到SK-MES-1細胞中,檢測其對肺鱗癌細胞的影響。研究結果顯示,敲低LINC00342可降低SK-MES-1細胞的OD450值、侵襲數目、劃痕愈合率、PCNA、MMP-2和MMP-9表達,升高了細胞凋亡率、caspase-3表達,提示敲低LINC00342可阻止SK-MES-1細胞的惡性生物學行為,促進細胞凋亡。
LncRNA通過靶向miRNA對癌癥發揮調控作用,例如,LncRNA UNC5B-AS1可充當miR-339-5p的分子海綿,敲低其表達可通過靶向上調miR-339-5p抑制人肺腺癌A549細胞增殖,促進其凋亡[12]。LINC00342過表達可通過抑制miR-15b表達,促進肺腺癌轉移[13]。miR-384已被確定為多種癌癥中與癌癥相關的新型miRNA。有研究證實,miR-384在非小細胞肺癌中呈低表達,上調其表達可誘導非小細胞肺癌細胞凋亡,抑制細胞增殖[14]。本研究發現LINC00342與miR-384存在調控關系,通過si-LINC00342與miR-384 inhibitor共轉染于SK-MES-1細胞探究其對肺鱗癌的影響。結果顯示,抑制miR-384表達減弱了敲低LINC00342對SK-MES-1細胞增殖、侵襲和遷移能力的抑制作用,降低了促細胞凋亡作用。提示敲低LINC00342可能通過上調miR-384抑制SK-MES-1細胞增殖、侵襲和遷移,促進細胞凋亡。
綜上所述,敲低LINC00342可能通過靶向miR-384,抑制肺鱗癌細胞SK-MES-1增殖、侵襲和遷移。LINC00342/miR-384可能成為治療肺鱗癌的一種新的靶點。然而本研究尚存在不足之處,僅僅在細胞水平上驗證了LINC00342/miR-384對SK-MES-1細胞增殖、侵襲和遷移的影響,并未在體內水平上進行探討,后續研究將會在體內水平上進行進一步探索。

