電化學生物傳感器檢測汞離子的研究進展
李云蕊,劉俊杰,艾明雄,孫顯國
(1.云南省楚雄彝族自治州農產品質量檢測中心,云南 楚雄 675000;2.昆明正大豬業有限公司,云南 昆明 650000)
工業生產排放的汞離子(Hg2+)直接破壞自然環境,且通過食物鏈進行生物累積進一步威脅公眾健康。Hg2+對蛋白質和酶中的硫醇基具有高親和性,即使極低劑量的接觸也可能導致認知和運動障礙,增大心血管疾病,甚至癌癥的發生幾率[1-3]。因此,在低濃度下對Hg2+進行靈敏檢測對于環境保護和疾病預防都具有重要意義。Hg2+常見的檢測技術包括原子吸收光譜法[4]、原子熒光光譜法[5]、電感耦合等離子體質譜法[6]、X射線吸收光譜法[7]。然而這些技術不僅需要大型專業儀器和訓練有素的工作人員,而且存在繁瑣、耗時、不適合便攜式使用、無法現場檢測等局限。因此,開發一種簡單、快速、靈敏、選擇性監測Hg2+的高效分析方法的非常必要。
與傳統分析技術相比,電化學生物傳感器在便攜性、低成本、簡單性、選擇性、靈敏度方面更具優勢[8]。近年來,研究人員在構建新型Hg2+電化學生物傳感器方面做出了許多貢獻。特別是,隨著DNA納米技術的發展,將新型DNA納米機器和多種核酸信號放大策略集成到電化學生物傳感器的開發研究中,對Hg2+檢測的特異性優化、靈敏度提升具有重要意義[9-11]。本文闡述了近年來構建的Hg2+電化學生物傳感器的研究進展,主要包括簡單的Hg2+電化學生物傳感器、核酸信號放大策略對Hg2+檢測靈敏度的提升,以及納米機器在Hg2+電化學生物傳感器中的應用。
1 簡單的Hg2+電化學生物傳感器
1.1 電化學生物傳感器原理
電化學生物傳感器主要包括生物識別元件、信號轉換器、數據分析處理系統三部分(圖1)。當生物識別元件與目標分析物特異性結合時,其相互作用經信號轉換器轉化為電流、累積電荷、阻抗或電位的變化,數據分析處理后即可輸出與分析物濃度相關的電信號,實現對分析物的定量檢測[12]。針對不同的檢測需求,全細胞、組織、酶、抗體、適配體、DNA等均可作為生物識別元件,使得電化學生物傳感器在疾病診斷、環境監測、食品質量管理等領域得到廣泛應用[13-15]。
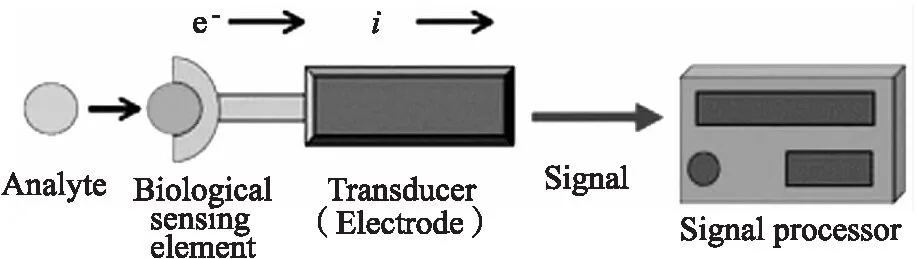
圖1 電化學生物傳感器示意圖
1.2 T-Hg2+-T結構
寡核苷酸是一種高效、環保,具有生物特異性的分析工具。一些重金屬離子對某些DNA堿基具有選擇性,可通過配位鍵形成穩定的堿基對。2004年,Ono和Togashi[16]首次報道了當Hg2+存在時,包含胸腺嘧啶-胸腺嘧啶(T-T)錯配堿基對的DNA雙鏈呈現較強的熱穩定性,而其他重金屬離子,如Cu2+、Ni2+、Pd2+、Co2+、Mn2+、Zn2+、Pb2+等,對T-T錯配DNA雙鏈的熱穩定性并無顯著增強。經核磁共振實驗,進一步證實了Hg2+易與T-T堿基對特異性結合形成T-Hg2+-T結構,其結合的相互作用力甚至高于DNA雙螺旋結構中的T-A沃森-克里克堿基對[17-18]。因此,依賴于Hg2+與T-T錯配堿基的特異性結合可以設計高選擇性的Hg2+電化學生物傳感器。
1.3 基于T-Hg2+-T結構構建的簡單電化學生物傳感器
如圖2所示,Wu等[19]人通過自組裝將富T堿基的DNA單鏈固載在金電極上,利用Hg2+和T堿基之間的特異性結合作用來選擇性地將Hg2+捕獲于電極表面,并采用差分脈沖伏安法對Hg2+進行測定,開發了一種基于T-Hg2+-T結構的簡單傳感器一步實現Hg2+檢測。另外,Niu等[20]人采用兩種T-T堿基錯配的DNA單鏈P1和P2:P1首先固定于電極表面,P2標記有電活性物質二茂鐵(Fc)。Hg2+誘導作用下,P1和P2之間憑借T-Hg2+-T結構,成功在電極表面組裝形成穩定DNA雙鏈,并產生與Hg2+濃度成正比例的Fc電化學信號,實現在 1 nmoL/L~10 μmoL/L 濃度范圍內對Hg2+線性響應[20]。因此,可以說,T-Hg2+-T結構的應用顯著促進了Hg2+電化學生物傳感器的發展[21-22]。
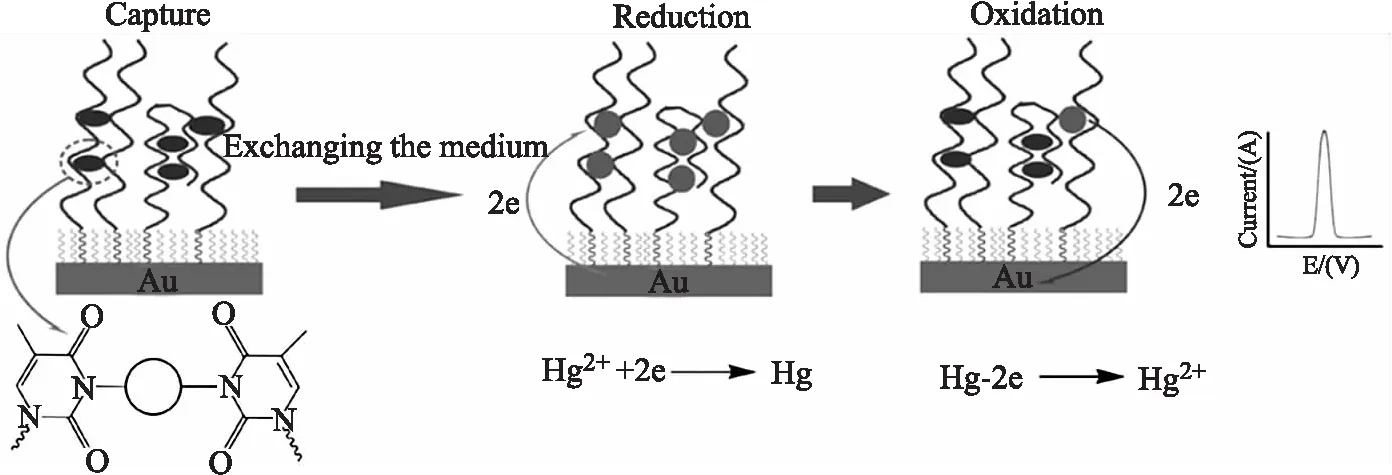
圖2 一步法檢測Hg2+的電化學生物傳感器示意圖
2 核酸信號放大策略對Hg2+檢測靈敏度的提升
基于T-Hg2+-T結構構建的簡單電化學生物傳感器中,多個Hg2+對應一個DNA探針產生較弱的電信號響應,因此靈敏度相對有限。隨著各種信號放大策略不斷被提出[23],研究人員越來越關注核酸信號放大策略在Hg2+電化學生物傳感器中的應用,以追求更優越的性能。
2.1 酶輔助的Hg2+循環放大策略
外切酶Ⅲ(Exo-Ⅲ)不依賴于特定核酸序列,不需要特定的識別位點,具有3’至5’端外切脫氧核糖核酸活性,可以催化具有3’平末端或凹陷末端的雙鏈DNA從3’端逐步降解。利用這一特性,ExoⅢ已被用于輔助Hg2+的循環利用,以放大信號,提高Hg2+檢測的靈敏度[24-27]。在Wu[28]構建的傳感器中(如圖3),一端標記有電活性物質Fc的DNA單鏈P1被固定在金電極表面,Hg2+存在時P1與DNA P2互補形成3’平末端雙鏈,觸發Exo-Ⅲ從3’端逐步降解該雙鏈DNA中的P1,導致電極表面Fc的數量減少,同時釋放出Hg2+。ExoⅢ輔助釋放出的Hg2+繼續參與以上這一過程,使得Hg2+被充分循環利用,實現少量的Hg2+即可減少大量的Fc,產生顯著的Fc信號降低,檢測限低至 6.2 pmoL/L。

圖3 基于Exo-Ⅲ輔助Hg2+循環放大策略的傳感器示意圖
2.2 雜交鏈式反應
雜交鏈式反應(HCR)[29-31]作為一種強有力的信號放大技術,由于非酶性和等溫性而顯示出一定的優勢。HCR由Dirks和Piece率先報道[32],一個典型的HCR(如圖4)包括一對末端有粘性的互補DNA發夾(H1、H2)和一個啟動子(I鏈)。在沒有I鏈的情況下,H1和H2穩定共存。一旦引入I鏈,由于I鏈與H1的粘性末端及莖部堿基互補,H1的發夾結構就會被打開。而打開的H1與H2的粘性末端及莖部堿基也互補,使得H2的發夾結構繼續被打開,從而觸發級聯反應導致H1、H2、H1、H2、H1......依次被循環打開,形成具有H1-H2多重重復結構的長DNA雙鏈聚合物。基于這樣的HCR放大原理,Yu等[33]人結合特異性T-Hg2+-T結構,制備了一種新型的電化學生物傳感器。在目標物Hg2+存在的情況下,T-Hg2+-T作用使得HCR的啟動鏈成功被引入電極表面,觸發H1和H2級聯反應自組裝成長DNA雙鏈聚合物。此過程巧妙地將少量的Hg2+轉化成極長的DNA雙鏈聚合物,DNA雙鏈聚合物中進一步嵌入大量的電活性物質甲苯胺藍TB以輸出放大的信號,實現高效檢測Hg2+,檢測限低至 0.2 pmoL/L。
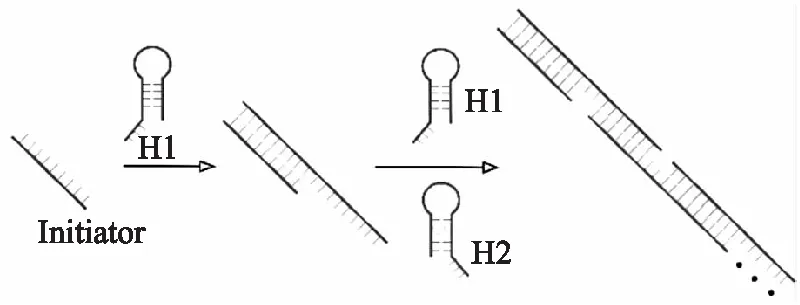
圖4 HCR的工作原理
2.3 DNAzyme輔助的信號放大策略
陽離子特異性DNAzymes,一類功能性核酸,因良好的穩定性、易制備、設計靈活、可循環催化含有核糖核酸堿基rA的DNA底物在rA處裂解成兩段[34],常被用作一種理想的生物催化劑來構建靈敏的非酶分析方法[35-37]。Cai等[38]人通過結合Hg2+誘導激活的Mg2+特異性DNAzyme(Mg2+-DNAzyme)用于信號放大,提出了一種高靈敏度檢測Hg2+的電化學阻抗生物傳感器,并驗證了其在實際樣品分析中具有應用潛力。如圖5所示,圖中A部分首先合成了兩種分別修飾DNA發夾H3和H4的共聚物鏈P1和P2;圖中B部分將Hg2+作為觸發器,在T-Hg2+-T作用下使得D1與D2鏈互補結合形成特定序列的DNAzyme。Mg2+幫助下,DNAzyme選擇性地結合底物H2并在rA處發生裂解作用輸出sDNA片段。值得強調的是,少量的Hg2+輸入雖只能激活少量的DNAzyme,但DNAzyme對H2的裂解作用循環持續發生,可以輸出大量的sDNA,以進一步與電極表面固載的H1雜交,從而觸發P1和P2中發夾DNA之間的HCR,在電極表面組裝形成一層DNA水凝膠。總的來說,Hg2+的輸入經DNAzyme作用產生大量的sDNA,sDNA觸發HCR得到非導電DNA水凝膠,非導電DNA水凝膠極大地阻礙了電子轉移,為構建檢測Hg2+的高靈敏阻抗生物傳感器提供了可能。在最佳條件下,該阻抗型生物傳感器在 0.1 pmoL/L~10 nmoL/L 的濃度范圍內對Hg2+具有良好的響應,檢測限為 0.042 pmoL/L。
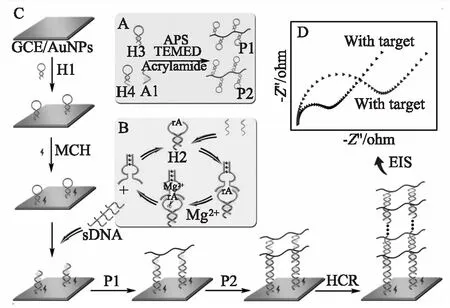
圖5 基于DNAzyme輔助放大信號的傳感器示意圖
2.4 催化發夾自組裝
催化發夾自組裝(CHA)是一種焓驅動的無酶放大技術。與HCR類似,典型的CHA[39]設計了一對互補的DNA發夾(H1和H2),但互補的堿基部分被鎖定在各自的發夾結構中。如圖6所示,當沒有啟動鏈存在時,H1和H2的反應在動力學上受限,以發夾的狀態穩定存在。啟動鏈存在時,啟動鏈與H1的粘性末端和莖部堿基互補,觸發DNA鏈置換反應打開H1的莖部,H1新裸露的單鏈DNA區域繼續與H2的黏性末端和莖部堿基互補觸發第二次鏈置換反應。在第二次鏈置換過程中,H1與H2從發夾結構已經被轉化為H1/H2互補雙鏈,啟動鏈同時也被置換下來繼續催化H1與H2的下一輪雜交。簡而言之,啟動鏈的輸入加速了兩個DNA發夾之間的雜交,轉化為大量H1/H2互補雙鏈輸出,該過程即為CHA。
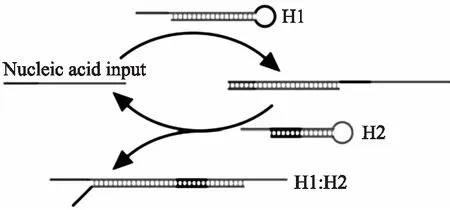
圖6 CHA的工作原理
將目標核酸作為啟動鏈激活CHA已經提出了許多靈敏的核酸檢測方法[40-42]。為了設計一個Hg2+響應型CHA,Zhong等[43]人引入了Helper DNA和三個發夾探針,H1探針兩端用硫醇基修飾,H2和H3用Fc標記。將Hg2+引入體系時,在T-Hg2+-T作用驅動下,Helper DNA打開H1,被打開的H1裸露部分充當啟動鏈誘導發夾H2和H3的催化自組裝,形成剛性DNA三角結構,同時釋放出Hg2+。釋放出的Hg2+繼續調控CHA循環發生,擴增出大量DNA三角結構。輸出的DNA三角結構容易與電極接觸,將Fc引入電極表面產生放大的電化學信號,實現對Hg2+的靈敏檢測,檢測下限低至 0.12 pmoL/L。
3 納米機器在Hg2+電化學生物傳感器中的應用
3.1 納米開關
DNA納米機器具有相對較高的穩定性、靈活的可編程性和良好的生物相容性而被廣泛應用。基于不同的寡核苷酸結構已經設計出了功能多樣的DNA納米器件,比如,依據T-Hg2+-T結構調控的DNA構象轉換,研究人員將富T堿基的適體鏈作為分子開關構建了一個超靈敏控制釋放型適體傳感器[44]。適體鏈為單鏈時,是分子開關的關閉狀態。隨著Hg2+的引入,T-Hg2+-T結構的形成使得適配體彎曲成發夾結構,分子開關被打開,產生與Hg2+的濃度呈正相關電信號響應,實現了對Hg2+的超靈敏定量檢測。
此外,Ma等[45]人利用DNA三向連接結構提出了另一種DNA納米開關。如圖7所示,DNA納米開關由兩個相鄰但不連續的Watson-Crick堿基配對雙莖與一個序列特定的DNA配體識別域共同組成。DNA配體識別域位于雙莖中間,能夠捕獲分析物Hg2+。通過凝膠電泳分析,隨著識別域中T-Hg2+-T結構逐漸形成,雙莖與DNA配體識別域之間的三向連接處會

圖7 基于納米開關的傳感器示意圖
發生細微的構象變化使得DNA納米開關被激活,實現開(電導率增強)與關(電導率抑制)。這種“開”和“關”雙響應的固定化DNA開關能被nmoL/L水平的Hg2+激活,將其用于電化學傳感器中對Hg2+具有靈敏的定量分析能力。
3.2 “蟹爪”狀DNA納米機器
Chang等[46]人巧妙設計了一種簡潔高效的“蟹爪”狀DNA納米機器作為信號放大器,用于Hg2+超靈敏電化學分析。如圖8所示,在目標Hg2+存在下,通過T-Hg2+-T作用調控四條DNA鏈(A、B、C和D)可快速簡潔地自組裝成“蟹爪”狀DNA納米機器,一個“蟹爪”狀DNA納米機器具備四個DNAzyme。Mg2+輔助下,該DNA納米機器可以同時觸發四個相同的DNAzyme循環裂解底物反應,將目標Hg2+的輸入顯著轉化為大量標記有Fc的DNA片段(H1’-Fc),提高了檢測靈敏度。因此,該“蟹爪”狀DNA納米機器經巧妙設計被賦予的強大DNAzyme循環裂解作用輔助電化學傳感平臺實現了在 10 fmoL/L~100 nmoL/L 范圍內對Hg2+簡單而快速的定量檢測,為金屬污染物分析和環境監測系統中DNA納米機器的開發利用提供了參考。
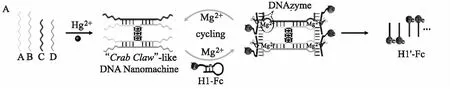
圖8 “蟹爪”狀DNA納米機器的工作原理
典型的Hg2+電化學生物傳感器的相關信息總結于表1中。可以看出,基于T-Hg2+-T結構構建的簡單電化學生物傳感器已經呈現出對Hg2+的高選擇性響應能力;而Exo-Ⅲ輔助Hg2+循環放大策略、HCR、DNAzyme輔助信號放大、CHA等核酸信號放大策略以及納米機器的采用則更是明顯拓寬了Hg2+電化學生物傳感器的線性響應范圍,檢測下限低至pmoL/L級,實現了對Hg2+的靈敏檢測。

表1 不同汞離子電化學生物傳感器對比表
4 結語
綜上所述,通過集成酶輔助Hg2+循環放大策略、雜交鏈式反應、DNAzyme輔助信號放大、催化發夾自組裝等核酸信號放大策略和新型DNA納米機器,電化學生物傳感平臺的檢測靈敏度已經明顯提升,推動Hg2+定量分析取得巨大進展。但在實際應用中,Hg2+電化學生物傳感器仍然存在部分問題亟需解決:1)傳感器生物敏感元件的適用條件較窄,酸堿度及溫度偏離最優條件都會產生影響;2)檢測功能單一,很少有傳感器在滿足Hg2+檢測需求的同時可以同步檢測其他種類離子;3)實際樣品如肉類、蔬菜、水果、谷物等的前處理流程還需要規范和簡化。若處理不當,殘留的樣品雜質會直接干擾傳感器對Hg2+的信號響應,造成傳感器檢測性能嚴重下降。因此,我們仍需在提升和優化電化學生物傳感器的抗干擾能力方面進行努力以增強其實時現場分析能力。未來更加高效、功能多樣化的納米器件的設計與制備將是一個新的研究方向,有助于拓寬電化學生物傳感器的適用范圍,實現多種離子的同步檢測,應對更加復雜的實際樣品。

