含能材料自催化分解特性的快速鑒別方法
平川, 甘強(qiáng), 張蕊, 都振華, 馮長(zhǎng)根
(1.北京理工大學(xué) 爆炸科學(xué)與技術(shù)國(guó)家重點(diǎn)實(shí)驗(yàn)室, 北京 100081; 2.西安航天化學(xué)動(dòng)力有限公司, 陜西 西安 710025;3.陜西應(yīng)用物理化學(xué)研究所 應(yīng)用物理化學(xué)重點(diǎn)實(shí)驗(yàn)室, 陜西 西安 710061)
0 引言
自催化反應(yīng)是指分解產(chǎn)物在反應(yīng)過(guò)程中充當(dāng)催化劑的一種反應(yīng)類型[1],這類反應(yīng)在含能材料的熱分解過(guò)程中很常見(jiàn)[2-5]。自催化分解反應(yīng)通常伴隨著熱量的突然釋放,因此這類反應(yīng)往往非常危險(xiǎn)且難以預(yù)測(cè)。含能材料的自催化分解現(xiàn)象在發(fā)生劇烈反應(yīng)(燃燒或熱爆炸)之前,很長(zhǎng)一段時(shí)間都不會(huì)有明顯的溫升現(xiàn)象,一旦產(chǎn)生明顯的溫升就會(huì)迅速成長(zhǎng)為燃燒或熱爆炸[6],因此如何快速準(zhǔn)確地鑒別自催化反應(yīng)并判斷自催化反應(yīng)強(qiáng)度,一直是研究的熱點(diǎn)和難點(diǎn)[7-9]。
在以往的研究中,往往將具有自催化特性的物質(zhì)按照n級(jí)反應(yīng)進(jìn)行動(dòng)力學(xué)計(jì)算分析[10-12],但會(huì)造成危險(xiǎn)性評(píng)估的偏差。為準(zhǔn)確描述物質(zhì)的自催化反應(yīng),1944年P(guān)rout等[13]提出Prout-Tompkins反應(yīng)模型,描述了高錳酸鉀的自催化熱分解過(guò)程。1994年Dien等[14]基于Prout-Tompkins模型提出了通用性更強(qiáng)的Benito-Perez反應(yīng)模型,并給出了判斷自催化反應(yīng)強(qiáng)弱的依據(jù)。后續(xù)的Kamal-Sourour反應(yīng)模型[15]、Avrami-Erofeev反應(yīng)模型[16-19]等都是基于以上兩種反應(yīng)模型的改進(jìn),以上自催化反應(yīng)模型的提出對(duì)于研究自催化反應(yīng)的進(jìn)程提供了有利條件。
表1給出了常見(jiàn)自催化反應(yīng)動(dòng)力學(xué)模型的機(jī)理函數(shù)表達(dá)式。需要特別指出的是,機(jī)理函數(shù)是定量描述反應(yīng)速率隨反應(yīng)進(jìn)度α變化關(guān)系的函數(shù),并無(wú)分布函數(shù)特性。
1987年Keenan[20]提出了利用差示掃描量熱儀(DSC)或微熱量熱儀(C80)鑒別自催化反應(yīng)的等溫測(cè)量方法,通過(guò)測(cè)量反應(yīng)放熱速率曲線可靠鑒別自催化反應(yīng)。2002年Leila等[21]利用1階動(dòng)力學(xué)反應(yīng)模型擬合計(jì)算出物質(zhì)在初始分解階段的反應(yīng)活化能,認(rèn)為高于220 kJ/mol的物質(zhì)反應(yīng)類型均為自催化反應(yīng)。Malek[22]、Gotor等[23]、Sbirrazzuoli等[24]均提出了基于DSC的自催化反應(yīng)鑒定方法,但此種方法的起始計(jì)量溫度難以確定,起始溫度過(guò)高或過(guò)低均會(huì)對(duì)試驗(yàn)結(jié)果產(chǎn)生較大誤差,影響自催化反應(yīng)的判定。2013年Roduit等[25]研究了初始轉(zhuǎn)換率對(duì)自催化反應(yīng)進(jìn)程的影響。2014年Yang等[26]基于Roduit的研究提出了“中斷回掃法”鑒別自催化反應(yīng)。2016年Wang等[27]利用中斷回掃法完成了部分含能材料自催化反應(yīng)的準(zhǔn)確鑒別,但該方法需要進(jìn)行多次測(cè)量,測(cè)試過(guò)程較為繁瑣。

表1 常見(jiàn)的固體自催化反應(yīng)機(jī)理函數(shù)Table 1 Common autocatalytic reaction mechanism functions for solid
21世紀(jì)以來(lái),絕熱加速量熱儀(ARC)等被大量應(yīng)用于含能材料的熱分解動(dòng)力學(xué)研究中[28-30]。與DSC相比,ARC可以進(jìn)行更大樣品量的試驗(yàn),更接近物質(zhì)反應(yīng)的真實(shí)環(huán)境。2018年Dong等[31]利用ARC對(duì)危險(xiǎn)物質(zhì)的自催化反應(yīng)強(qiáng)度等級(jí)進(jìn)行了分類,該方法需要準(zhǔn)確計(jì)算熱動(dòng)力學(xué)參數(shù)。2020年Zhao等[32]提出了無(wú)需計(jì)算動(dòng)力學(xué)參數(shù)的絕熱環(huán)境自催化反應(yīng)鑒別方法,拓展了絕熱設(shè)備在自催化反應(yīng)研究方面的應(yīng)用,但該方法需要對(duì)物質(zhì)進(jìn)行完整的放熱試驗(yàn),對(duì)于含能材料的試驗(yàn)極有可能造成嚴(yán)重的爆炸事故和精密儀器的損壞。
本文基于絕熱量熱法,提出一種在自催化反應(yīng)初期即可完成自催化反應(yīng)鑒別的方法,并可根據(jù)特征信號(hào)判斷自催化反應(yīng)強(qiáng)度。該方法能夠避免含能材料測(cè)量過(guò)程中的熱爆炸現(xiàn)象發(fā)生,同時(shí)快速準(zhǔn)確地鑒別出含能材料熱分解反應(yīng)類型,并判斷自催化特性強(qiáng)度。
1 鑒別方法的原理分析
1.1 理論依據(jù)
表1所示機(jī)理函數(shù)f(α)體現(xiàn)了反應(yīng)速率與反應(yīng)物(部分包括產(chǎn)物)物質(zhì)的量的相關(guān)性。由于遵循不同的反應(yīng)機(jī)理,在反應(yīng)物轉(zhuǎn)化率發(fā)生變化時(shí),絕熱反應(yīng)體系的反應(yīng)速率必然會(huì)有不同變化。為量化這種變化,選取5種常見(jiàn)的機(jī)理函數(shù)(1級(jí)反應(yīng),2級(jí)反應(yīng),P-T反應(yīng),A-E反應(yīng),Cnm反應(yīng)),為模擬真實(shí)的分解反應(yīng),以α1=0.06為初始計(jì)算點(diǎn),計(jì)算機(jī)理函數(shù)隨轉(zhuǎn)化率變化的比值f(αn)/f(α1),結(jié)果如圖1所示。

圖1 不同機(jī)理函數(shù)f(αn)/f(α1)隨轉(zhuǎn)化率α變化的計(jì)算結(jié)果Fig.1 Calculation of different mechanism functions f(αn)/f(α1) with the conversion rate α
由圖1可見(jiàn),與n級(jí)反應(yīng)相比,自催化反應(yīng)(P-T反應(yīng)、A-E反應(yīng)、Cnm反應(yīng))的f(αn)/f(α1)值會(huì)隨著轉(zhuǎn)化率的增大迅速升高,且存在最大值,到達(dá)最大值后比值進(jìn)入下降區(qū)間,轉(zhuǎn)換率接近1時(shí)f(αn)/f(α1)值無(wú)限逼近于0。在上升區(qū)間內(nèi)自催化反應(yīng)的f(αn)/f(α1)初始值始終大于1。而n級(jí)反應(yīng)的f(αn)/f(α1)始終在1以下。利用這種差異可以鑒別熱分解反應(yīng)的反應(yīng)類型。
針對(duì)不同的反應(yīng)機(jī)理,都有特定的機(jī)理函數(shù)f(α)所決定的特性形狀,這會(huì)體現(xiàn)到反應(yīng)體系的反應(yīng)速率中。反應(yīng)體系的反應(yīng)速率一般可表示為
(1)

由圖1可以看出,f(αn)/f(α1)比值越高,該機(jī)理函數(shù)的數(shù)值增長(zhǎng)速度越快,反應(yīng)自催化特性也就越強(qiáng),反應(yīng)越不容易得到控制,因此f(αn)/f(α1)能夠較好地量化自催化反應(yīng)機(jī)理函數(shù)f(α)的“加速特性”(自催化特性)。此結(jié)論對(duì)具有自催化特性物質(zhì)的鑒別和自催化反應(yīng)強(qiáng)度分類具有重要意義。
1.2 鑒別方法的公式推導(dǎo)
理想絕熱條件下,反應(yīng)物分解放出的熱量全部用于自身溫度的提升,由熱力學(xué)第一定律可知,在絕熱放熱反應(yīng)體系下存在:
dQ=Q∞×dα=cp×m×φ×dT
(2)
式中:dQ為任一時(shí)間段內(nèi)反應(yīng)體系的放熱量;Q∞為反應(yīng)總放熱量;dα為任一時(shí)刻反應(yīng)物的轉(zhuǎn)化率;cp為反應(yīng)物的比熱容,理想絕熱條件下反應(yīng)體系壓強(qiáng)不變,因此選用cp為反應(yīng)物的定壓比熱容;m為反應(yīng)物的比熱容和反應(yīng)物質(zhì)量;φ為絕熱反應(yīng)體系的熱慣性系數(shù),理想狀態(tài)下其值為1;dT為任一時(shí)刻反應(yīng)體系的絕熱溫升。
假設(shè)cp不隨溫度的變化而變化,令c=cpmφ/Q∞,對(duì)于任一確定的反應(yīng)物,c為常數(shù),有
(3)
式中:dt為轉(zhuǎn)化率由α1變化至αn所用的時(shí)間。根據(jù)阿倫尼烏斯定律,有
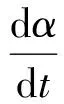
(4)
對(duì)于同一種反應(yīng)物,在不同的轉(zhuǎn)化率變化區(qū)間內(nèi),有

(5)

(6)
式中:T1、T2分別為不同轉(zhuǎn)化率對(duì)應(yīng)的溫度。
令Δt1=Δt2,式(5)與式(6)相除,可得
(7)
結(jié)合式(3)可得
(8)
式(8)的意義在于,在已知反應(yīng)物絕熱放熱反應(yīng)過(guò)程中的活化能Ea和任意兩時(shí)刻反應(yīng)體系溫度及兩時(shí)刻對(duì)應(yīng)的溫度變化速率后,即可獲得機(jī)理函數(shù)隨轉(zhuǎn)化率變化的比值f(αn)/f(α1)。根據(jù)比值f(αn)/f(α1)即可完成自催化反應(yīng)以及反應(yīng)強(qiáng)度的判斷。通過(guò)ARC進(jìn)行的絕熱量熱試驗(yàn)往往很難獲得物質(zhì)精確的Ea,但在f(αn)/f(α1)的計(jì)算過(guò)程中,Ea往往對(duì)反應(yīng)結(jié)果的判斷沒(méi)有較大影響,此結(jié)論在本文第3節(jié)會(huì)有詳細(xì)闡述。為更好地驗(yàn)證公式推導(dǎo)的正確性,本文采用數(shù)值模擬方法對(duì)鑒別方法進(jìn)行驗(yàn)證。
2 絕熱體系分解反應(yīng)模型建立與計(jì)算分析
2.1 絕熱體系分解反應(yīng)模型的建立
參考Zhao等[32]的研究成果,建立對(duì)于絕熱反應(yīng)體系的放熱量關(guān)系式如下:
(9)
式中:Tf為反應(yīng)終止溫度;Ton為反應(yīng)初始放熱溫度;Q0為反應(yīng)初始放熱量;α0為初始轉(zhuǎn)化率。
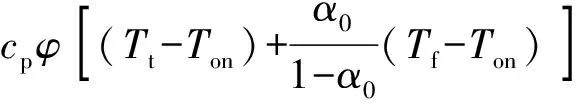
(10)
(11)
式中:Qt、Tt和αt分別為t時(shí)刻反應(yīng)放熱量、反應(yīng)溫度和轉(zhuǎn)化率。由式(11)可得
(12)
根據(jù)阿倫尼烏斯定律,有
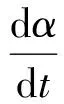
(13)
(14)
由此可得4種常見(jiàn)反應(yīng)類型的dT/dt的表達(dá)式,如表2所示。
由表2可知,根據(jù)式(11)、式(12)以及反應(yīng)機(jī)理函數(shù)f(α),在已知反應(yīng)體系總放熱量Q∞和反應(yīng)初始放熱溫度Ton的情況下,即可完成不同反應(yīng)機(jī)理下絕熱量熱試驗(yàn)過(guò)程的模擬計(jì)算。
2.2 數(shù)值計(jì)算分析
首先計(jì)算φ=1時(shí)1級(jí)反應(yīng)、2級(jí)反應(yīng)、P-T反應(yīng)、Cnm反應(yīng)和A-E反應(yīng)的dT/dt與T之間的關(guān)系,如圖2所示。數(shù)值計(jì)算中用到的參數(shù)如表3所示。由圖2和表3可以看出,P-T、A-E反應(yīng)和Cnm反應(yīng)的放熱速率普遍高于1級(jí)反應(yīng)和2級(jí)反應(yīng)。

表2 4種常見(jiàn)反應(yīng)類型的dT/dt的表達(dá)式Table 2 Expressions for dT/dt for several common reaction types

圖2 φ=1時(shí)dT/dt隨T變化Fig.2 dT/dt varies with T for φ=1

表3 仿真計(jì)算參數(shù)Table 3 Parameters used in the simulations

圖3 不同熱慣性下5種反應(yīng)機(jī)理的dT/dt隨α變化Fig.3 Variation of dT/dt with α for five reaction mechanisms with different thermal inertia
計(jì)算φ取值分別為1、2、3、4、5、6時(shí)1級(jí)反應(yīng)、2級(jí)反應(yīng)、P-T反應(yīng)、Cnm反應(yīng)和A-E反應(yīng)的dT/dt與轉(zhuǎn)化率α之間的關(guān)系,如圖3所示。由于絕熱量熱儀的實(shí)際初始采樣值為0.02 ℃/min,將模擬計(jì)算時(shí)的dT/dt起始計(jì)算點(diǎn)α0也設(shè)置在0.02 ℃/min所對(duì)應(yīng)的轉(zhuǎn)化率。
由圖3可見(jiàn),當(dāng)熱慣性系數(shù)過(guò)大時(shí)(如φ=6),2級(jí)反應(yīng)出現(xiàn)了檢測(cè)不到放熱信號(hào)(反應(yīng)體系的放熱速率始終小于0.02 ℃/min)的情況。表2中dT/dt與熱慣性系數(shù)呈反比。由式(2)可見(jiàn),反應(yīng)體系的絕熱溫升與熱慣性系數(shù)有直接關(guān)系,熱慣性系數(shù)越大,反應(yīng)的絕熱溫升越小。式(11)表明了反應(yīng)體系的絕熱溫升直接影響反應(yīng)體系的實(shí)時(shí)轉(zhuǎn)化率,對(duì)于熱慣性系數(shù)大的反應(yīng)體系,每升高1 ℃對(duì)應(yīng)反應(yīng)體系的轉(zhuǎn)化率增量也就越大,從而解釋了熱慣性過(guò)大時(shí)檢測(cè)不到放熱信號(hào)的現(xiàn)象。因此熱慣性過(guò)大時(shí)(如圖3中φ取值為5、6),可檢測(cè)到放熱信號(hào)時(shí)反應(yīng)體系轉(zhuǎn)化率達(dá)到了一個(gè)較高的值,進(jìn)入了圖1所示轉(zhuǎn)化率α下降區(qū)間內(nèi),造成了dT/dt隨轉(zhuǎn)化率的增加而降低。
圖4所示為熱慣性對(duì)4種反應(yīng)機(jī)理函數(shù)初始轉(zhuǎn)化率的影響規(guī)律。由圖4可見(jiàn),熱慣性越大,起始考察點(diǎn)對(duì)應(yīng)的起始轉(zhuǎn)化率也越大,這是因?yàn)闊釕T性越大,樣品容器升溫所需熱量占總放熱量比例也就越大,導(dǎo)致反應(yīng)體系的升溫速率下降,絕熱溫升降低,進(jìn)而會(huì)出現(xiàn)起始考察點(diǎn)的放熱信號(hào)出現(xiàn)“滯后”的現(xiàn)象。對(duì)比可見(jiàn),Cnm自催化反應(yīng)受熱慣性影響較小,A-E反應(yīng)和P-T反應(yīng)次之,2級(jí)反應(yīng)受熱慣性影響最大。

圖4 熱慣性對(duì)4種反應(yīng)機(jī)理函數(shù)初始轉(zhuǎn)化率的影響Fig.4 Effect of thermal inertia on the initial conversion rate of the four reaction mechanism functions

圖5 不同熱慣性下5種反應(yīng)機(jī)理函數(shù)隨α變化Fig.5 Variation of the five reaction mechanism functions with α for different thermal inertia
圖5為根據(jù)仿真結(jié)果計(jì)算出的不同反應(yīng)機(jī)理函數(shù)和熱慣性系數(shù)下的f(αn)/f(α1)值。由圖5可見(jiàn),無(wú)論是n級(jí)反應(yīng)還是自催化反應(yīng),在轉(zhuǎn)化率接近1時(shí)f(αn)/f(α1)值均無(wú)限接近于0;但n級(jí)反應(yīng)的f(αn)/f(α1)值從初始值1開(kāi)始單調(diào)遞減,自催化反應(yīng)的f(αn)/f(α1)值從初始值1開(kāi)始逐漸上升,到達(dá)一個(gè)峰值后再逐漸下降至0。
表4給出了數(shù)值模擬中5種反應(yīng)機(jī)理函數(shù)不同熱慣性系數(shù)下的f(αn)/f(α1)最大值。由表4可見(jiàn),無(wú)論哪種熱慣性系數(shù)條件下,f(αn)/f(α1)值的大小排序均為Cnm>P-T>A-E,表明3種自催化反應(yīng)機(jī)理函數(shù)的自催化特性強(qiáng)度排序?yàn)镃nm>P-T>A-E。

表4 模擬計(jì)算自催化機(jī)理函數(shù)的 f(αn)/f(α1)最大值Table 4 Calculated maximum value of f(αn)/f(α1) by the autocatalytic mechanism function
在部分較大的熱慣性系數(shù)計(jì)算條件下,自催化反應(yīng)機(jī)理函數(shù)的f(αn)/f(α1)初始值在1以下,這是因?yàn)闊釕T性系數(shù)過(guò)大導(dǎo)致出現(xiàn)初始放熱信號(hào)時(shí)反應(yīng)體系的轉(zhuǎn)化率在機(jī)理函數(shù)數(shù)值的下降區(qū)間內(nèi)。因此,在實(shí)際測(cè)量過(guò)程中應(yīng)適當(dāng)增加樣品量以減小熱慣性,避免起始特征信號(hào)出現(xiàn)在圖5中機(jī)理函數(shù)數(shù)值的下降區(qū)間內(nèi)。
3 含能材料的絕熱量熱試驗(yàn)與結(jié)果分析
3.1 試驗(yàn)樣品
DTBP與甲苯的混合物在放熱過(guò)程中嚴(yán)格遵循1級(jí)反應(yīng)模型[31],因此選取20%DTBP與甲苯的混合溶液、超細(xì)HNS-Ⅳ、BNCP、CL-20、CMC-LA 5種樣品進(jìn)行絕熱量熱試驗(yàn)。本文試驗(yàn)所用20%DTBP與甲苯混合溶液為分析純99.99%,超細(xì)HNS-Ⅳ粉體粒度分布為0.2~20 μm,與普通粒徑HNS-Ⅳ相比,超細(xì)HNS-Ⅳ放熱反應(yīng)更為劇烈,反應(yīng)特征信號(hào)更易辨別[33]。以上材料均為實(shí)驗(yàn)室自制,純度超過(guò)99%。
3.2 試驗(yàn)條件
利用德國(guó)耐馳儀器公司ARC254型絕熱加速量熱儀對(duì)樣品進(jìn)行初始放熱階段的測(cè)量。為精確測(cè)量樣品的放熱信號(hào),選用H-W-S模式,靈敏度為0.02 ℃/min,升溫速率2 ℃/min,升溫臺(tái)階5 ℃。測(cè)試樣品容器選用耐馳NIB010816型Ti質(zhì)樣品球。為防止樣品發(fā)生劇烈的放熱反應(yīng),放熱溫度緊急停止閾值設(shè)置為1.0 ℃/min。
3.3 絕熱量熱試驗(yàn)結(jié)果
考察以上5種材料從0.02 ℃/min~0.50 ℃/min的放熱過(guò)程溫度變化情況。為便于數(shù)據(jù)統(tǒng)一,將5種材料的起始放熱速率考察點(diǎn)設(shè)置為0.02 ℃/min,獲得20%DTBP與甲苯混合溶液、HNS-Ⅳ、BNCP、CL-20、CMC-LA熱分解初始階段放熱曲線如圖6所示。由圖6可見(jiàn),初始分解溫度隨熱慣性系數(shù)的增加而升高,與圖5中的仿真計(jì)算結(jié)果一致。在放熱過(guò)程中,反應(yīng)溫度隨時(shí)間的增長(zhǎng)隨時(shí)間的增長(zhǎng)呈指數(shù)上升,表明0.02 ℃/min~0.50 ℃/min放熱過(guò)程中產(chǎn)物的熱分解均為增速反應(yīng)。
3.4 試驗(yàn)結(jié)果分析
根據(jù)圖6結(jié)果計(jì)算5種測(cè)試樣品的f(αn)/f(α1)值,結(jié)果如圖7所示,由于沒(méi)有準(zhǔn)確計(jì)算各樣品的活化能Ea,暫時(shí)將計(jì)算所需Ea統(tǒng)一設(shè)置為180 kJ/mol。為便于數(shù)據(jù)統(tǒng)一,將5種材料的初始采樣放熱速率設(shè)置在了0.02 ℃/min。
由圖7可以看出,隨著反應(yīng)溫度的升高,20%DTBP與甲苯混合溶液絕熱放熱反應(yīng)的f(αn)/f(α1)值自1開(kāi)始逐漸下降,表明20%DTBP與甲苯混合溶液的放熱反應(yīng)為n級(jí)反應(yīng),與Dong等[31]分析結(jié)果一致。HNS-Ⅳ、BNCP、CL-20、CMC-LA的f(αn)/f(α1)計(jì)算值均在1以上,且該計(jì)算值隨著時(shí)間的增加而增加,表明以上4種含能材料的絕熱熱分解過(guò)程均為自催化反應(yīng),與Lee等[34]、周建華等[35]、王凱等[36]和劉劍超等[37]的研究結(jié)果一致。根據(jù)各個(gè)樣品計(jì)算結(jié)果可見(jiàn),熱慣性越大,f(αn)/f(α1)的值越小,即自催化反應(yīng)的特征信號(hào)隨熱慣性系數(shù)的增大而降低,較大的熱慣性能夠降低自催化反應(yīng)的反應(yīng)強(qiáng)度。
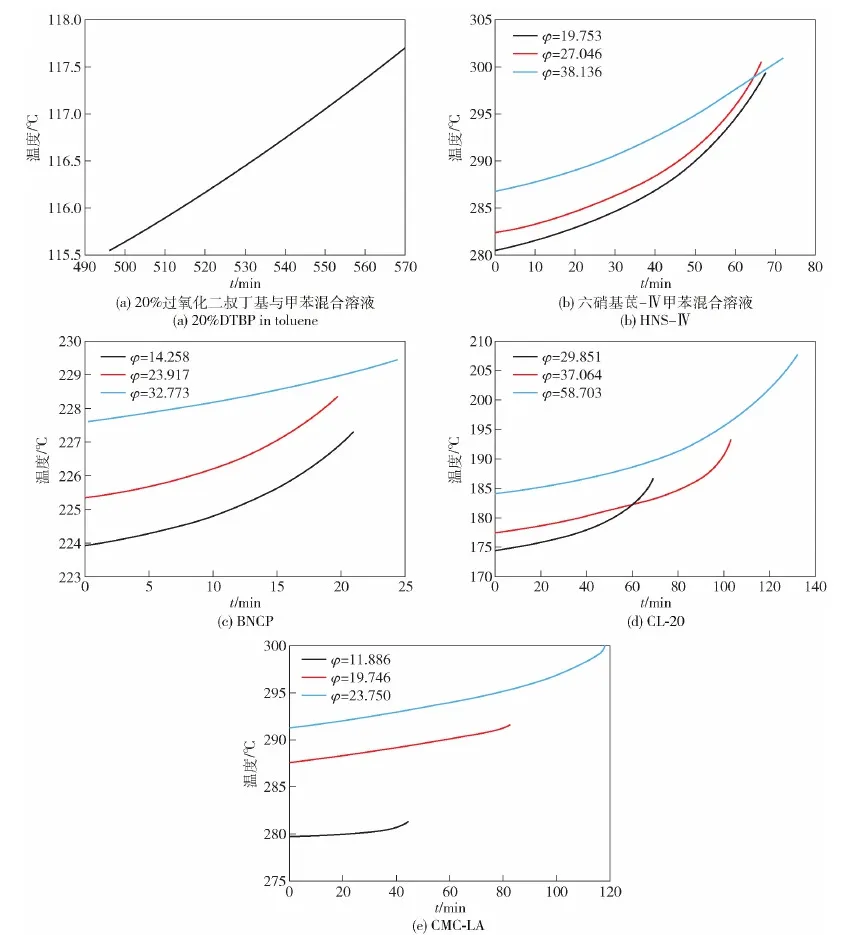
圖6 5種樣品的熱分解初始階段放熱曲線Fig.6 Exothermic curves for the initial stages of thermal decomposition of the five samples
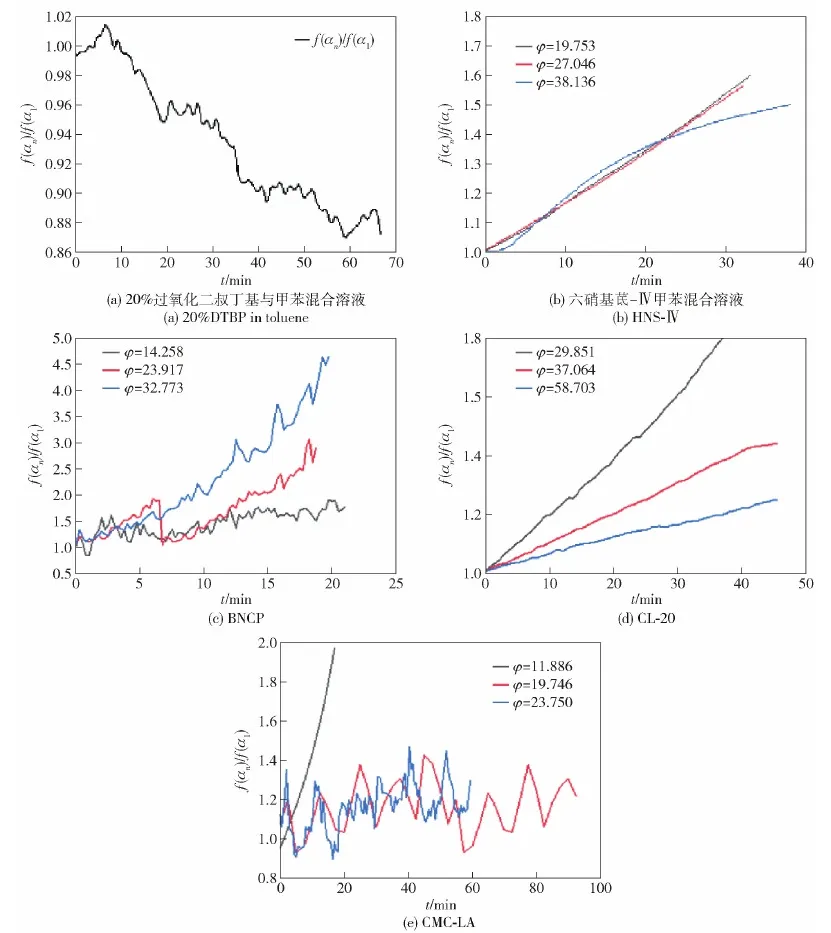
圖7 5種樣品的f(αn)/f(α1)計(jì)算值Fig.7 Calculated values of f(αn)/f(α1) for the five samples
為考察活化能Ea對(duì)f(αn)/f(α1)值的影響,將Ea分別取100 kJ/mol、150 kJ/mol、200 kJ/mol和250 kJ/mol,計(jì)算不同Ea時(shí)f(αn)/f(α1)值。表5 給出了f(αn)/f(α1)值的計(jì)算條件,其中不同活化能數(shù)值用/分隔開(kāi)。根據(jù)表5中的條件計(jì)算得出的f(αn)/f(α1)值見(jiàn)圖8。
由圖8可見(jiàn),f(αn)/f(α1)計(jì)算值與活化能Ea值呈反比,Ea值越大,f(αn)/f(α1)計(jì)算值越小。但無(wú)論是n級(jí)反應(yīng)還是自催化反應(yīng),Ea值均不影響f(αn)/f(α1)計(jì)算值隨時(shí)間變化的總體趨勢(shì),即Ea取不同值時(shí),n級(jí)反應(yīng)的f(αn)/f(α1)計(jì)算值仍為隨時(shí)間單調(diào)遞減,且計(jì)算值全部在1以內(nèi),自催化反應(yīng)的f(αn)/f(α1)計(jì)算值仍為隨時(shí)間單調(diào)遞增,且計(jì)算值全部在1以上。這是因?yàn)榛罨蹺a值代表了反應(yīng)發(fā)生的難易程度,Ea值越大,反應(yīng)越難發(fā)生,反應(yīng)速率趨于平緩,表現(xiàn)在圖8中即為f(αn)/f(α1)值較小。機(jī)理函數(shù)f(α)代表了反應(yīng)進(jìn)行方式與反應(yīng)物消耗的相關(guān)性,Ea值雖能影響反應(yīng)速率卻不能影響反應(yīng)進(jìn)行方式的本質(zhì),因此活化能Ea的取值不影響f(αn)/f(α1)計(jì)算值隨時(shí)間的整體變化趨勢(shì),也不影響基于f(αn)/f(α1)計(jì)算值的反應(yīng)類型判斷。
4 結(jié)論
本文基于絕熱量熱法提出了可快速判斷物質(zhì)自催化分解特性和強(qiáng)度的方法,基于n級(jí)反應(yīng)和自催化反應(yīng)模型研究了熱慣性對(duì)機(jī)理函數(shù)隨時(shí)間變化率的比值f(αn)/f(α1)的影響規(guī)律,利用絕熱量熱法測(cè)量5種樣品并進(jìn)行自催化特性分析。得到如下主要結(jié)論:
1)仿真結(jié)果表明,3種自催化反應(yīng)機(jī)理函數(shù)的自催化特性強(qiáng)度排序?yàn)镃nm反應(yīng)>P-T反應(yīng)>A-E反應(yīng),熱慣性系數(shù)深刻影響著物質(zhì)的絕熱放熱過(guò)程。熱慣性系數(shù)越大,物質(zhì)的放熱反應(yīng)強(qiáng)度越小,與此同時(shí)自催化反應(yīng)的特征信號(hào)越弱。
2)f(αn)/f(α1)計(jì)算值越高,表明該物質(zhì)分解自催化特性越強(qiáng)。計(jì)算表明,20%DTBP與甲苯混合溶液的絕熱熱分解反應(yīng)為n級(jí)反應(yīng),HNS-Ⅳ、BNCP、CL-20和CMC-LA的絕熱放熱反應(yīng)為自催化反應(yīng)。
3)活化能Ea的值不影響f(αn)/f(α1)計(jì)算值隨反應(yīng)時(shí)間的走勢(shì),也不影響基于f(αn)/f(α1)計(jì)算值判斷出的反應(yīng)類型結(jié)果。因此本文方法可迅速完成反應(yīng)類型的鑒別和自催化特性強(qiáng)度的判斷,相對(duì)于等溫法、中斷回掃法等方法可大大減少試驗(yàn)時(shí)間,并降低發(fā)生意外事故的危險(xiǎn)性,可靠性有待進(jìn)一步試驗(yàn)驗(yàn)證。

表5 f(αn)/f(α1)值的計(jì)算條件Table 5 Conditions for calculating the value of f(αn)/f(α1)

圖8 不同活化能下5種樣品f(αn)/f(α1)計(jì)算值Fig.8 Calculated values of f(αn)/f(α1) for the five samples at different activation energies
- 兵工學(xué)報(bào)的其它文章
- 多點(diǎn)支撐結(jié)構(gòu)形變及軸系軸承承載性能分析
- 選區(qū)激光熔化復(fù)合成形鋼銅異質(zhì)結(jié)構(gòu)界面微觀組織與力學(xué)性能
- 基于任務(wù)演化重要度的合成部隊(duì)維修器材兩級(jí)配置優(yōu)化方法
- 面向武器站模塊化基座的多工況與靜動(dòng)態(tài)筋壁結(jié)構(gòu)高效設(shè)計(jì)方法
- 基于微慣性傳感器的高靈敏度隨動(dòng)控制技術(shù)
- BP神經(jīng)網(wǎng)絡(luò)結(jié)合粒子群優(yōu)化卡爾曼濾波的MEMS陀螺隨機(jī)誤差補(bǔ)償方法

