miR-7-5P在口腔鱗癌中表達及其調控CDK-10信號通路對細胞增殖、凋亡與周期的影響
劉倩峰 楊佩璇 龐超 李慶星 周金闊
(河北醫科大學第一醫院 1口腔科,河北 石家莊 050031;2病理科)
口腔鱗狀細胞癌(OSCC)是頭頸部最常見的惡性腫瘤。手術是OSCC患者的一線治療方法。然而,外科治療使患者出現嚴重的口腔功能障礙,導致吞咽困難和構音困難〔1〕。因此,OSCC探索早期診斷和治療方法成為近年來研究的重要方向。研究發現,一些腫瘤基因和抑癌基因可能在促進或啟動OSCC的發展中起著關鍵作用〔2〕。因此,闡明基因組和表觀基因組參與多步驟癌變和OSCC進展的機制具有重要意義。MicroRNA-7-5P(miR-7-5p) 由具有發夾結構的單鏈前體RNA-7-5P經過Dicer酶加工后生成〔3〕,其在OSCC中的研究較少,研究表明miR-7在癌細胞中會發生啟動子甲基化〔4〕。也有研究提出miR-7的異常表達參與了舌鱗狀細胞癌的增殖和凋亡〔5〕。但這些研究證據尚不充足,尤其是miR-7-5p在OSCC中的作用,有待進一步探究。
周期素依賴性激酶(CDK)-10,是細胞分裂周期蛋白(Cdc)2激酶家族的一員,在細胞周期從G2期向M期發展過程中起重要作用〔6〕。研究發現CDK-10在多種腫瘤組織中的表達升高,提示CDK-10是一種抑癌基因〔7〕,然而,CDK-10在OSCC中表達模式及miR-7-5p對CDK-10調控作用尚不清楚。本研究重點探索miR-7-5p在OSCC中的表達及其調控CDK-10對細胞增殖、凋亡與周期影響。
1 資料與方法
1.1臨床標本 收集河北醫科大學第一醫院病理科68例OSCC患者的OSCC樣本組織和匹配的鄰近組織(距腫瘤邊緣至少2 cm)。OSCC患者術前均未接受放療或化療。另收集臨床健康志愿者50例,獲取OSCC患者術前及健康志愿者的空腹血清樣本。樣本均由病理學專家驗證,立即在液氮中冷凍。本研究獲得醫院倫理審查委員會批準,所有患者知情同意。
1.2血清miR-7-5p和CDK-10蛋白表達檢測 采用RT-qPCR分析血清miR-7-5p表達,酶聯免疫吸附試驗(ELISA)分析血清CDK-10蛋白表達。RNA分離與RT-qPCR分析,用QIAzol試劑(德國Duesseldorf,Qiagen)提取總RNA,用cDNA逆轉錄試劑盒(文氏酵母,Waltham,MA)合成cDNA。按商品說明書,使用SYBR-綠色PCR試劑盒(Invitrogen,Carlsbad,CA)進行RT-qPCR。U6 snRNA用于miR-7-5p的正常對照,GAPDH用于OXR1 mRNA的正常對照。ELISA檢測CDK-10蛋白參照試劑盒說明書進行。
1.3細胞系與細胞培養 OSCC細胞株SCC-25細胞在含10%胎牛血清(FBS)的DMEM中培養。收集對數期細胞,接種于6孔板(1×10/孔)中。當細胞達到80%匯合時,按照制造商的程序,使用脂質體2000(Invitrogen)將miR-7-5p-模擬物(mimics)(100 nmol/L)、miR-7-5p-抑制劑(inhibitor,100 nmol/L)和空白質粒(100 nmol/L)轉染細胞,分別作為miR-7-5p過表達組、miR-7-5p抑制組、空白對照組,轉染48 h后取細胞。
1.4Western印跡分析 用細胞裂解試劑(Sigma-Aldrich,St.Louis,MO)裂解細胞,提取總蛋白。蛋白質濃度用Bradford法測定。用10%十二烷基硫酸鈉-聚丙烯酰胺凝膠分離蛋白質,并將其電轉移到聚偏氟乙烯(PVDF)膜(GE Healthcare,Little Chalfont,Buckinghamshire,UK)上,在5%脫脂牛奶中室溫孵育1.5 h。含半胱氨酸的天冬氨酸蛋白水解酶(Caspase)3/8/9抗體,CDK-10抗體、B淋巴細胞瘤-2基因(Bcl-2)相關X蛋白(Bax)抗體、Bcl-2抗體和GAPDH(Sigma-Aldrich,目錄號:SAB2701826)在1∶1 000稀釋,然后在4℃下與膜一起孵育過夜。第2天將辣根過氧化物酶(HPR)-結合的二級抗體添加到膜中并孵育1 h。使用融合SL成像系統(Viber Lourmat,法國)顯色,以GAPDH為內對照。膠片拍照,用凝膠圖像處理系統分析目標帶的光密度(OD)值。
1.5雙熒光素酶報告分析 miR-7-5p和CDK-10的結合位點使用網站http://www.Target Scan.org預測,利用PmiRGLO雙熒光素酶miRNA靶向表達載體(E1330;Promega,Madison,WI)構建miR-7-5p-CDK-10報告基因。分為空白對照組(轉染miR-7-5p NC)和miR-7-5p過表達組(轉染miR-7-5p mimics),用Lipidosome2000(Invitrogen)共轉染HEK293T細胞用雙熒光素酶報告系統(Promega)測定熒光素酶活性。
1.6MTT法和乳酸脫氫酶(LDH)活性檢測 細胞轉染48 h后,收集的細胞種在96孔板(2×10個/孔)。向每個孔中加入20 μl 5 g/L MTT溶液(Sigma,Saint Louis,MO),孵育4 h,然后加入150 μl二甲基亞砜(DMSO),再孵育15 min。在570 nm波長處測量光吸收率。細胞轉染48 h后,收集的細胞種在96孔板(2×10個/孔)。根據試劑和說明書,檢測LDH活性,在450 nm波長處測量光吸收率。
1.7免疫組化 取OSCC組織切片和癌旁組織切片進行常規二甲苯脫蠟,經各級濃度乙醇水化。取一定量pH6.0檸檬酸鹽緩沖液(北京中杉金橋生物技術有限公司),加入微波盒中,醫用微波爐中火加熱切片3 min×2次進行抗原修復,涼至室溫40 min。每張切片加1滴3%過氧化氫(H2O2),室溫下孵育10 min。加1滴稀釋倍數為1∶100的第一抗體(抗CDK-10突變單克隆兔抗體,美國Cell Signaling Technology公司),4℃冰箱過夜。而后加HPR標記的第二抗體(北京中杉金橋生物技術有限公司),37℃溫箱30~40 min。每張切片加1滴新鮮配制的二氨基聯苯胺(DAB)液顯色20 min,用淡蘇木素復染細胞核30 s,各級濃度乙醇快速脫水,二甲苯透明,中性樹脂封片,晾干后觀察。
1.8統計學方法 采用SPSS21.0軟件進行t檢驗、χ2檢驗、Spearman相關性分析。
2 結 果
2.1miR-7-5p和CDK-10在OSCC患者中的表達量 與正常志愿者血清比較,OSCC患者血清中miR-7-5p表達量顯著下降,CDK-10表達量顯著升高(P<0.05)。見表1。CDK-10在OSCC組織中細胞陽性率〔83.8%(57/68)〕明顯高于癌旁組織〔8.8%(6/68)〕。見圖1。OSCC患者血清中miR-7-5p與CDK-10呈負相關(r=-0.682,P<0.05)。見圖2。

表1 miR-7-5p和CDK-10表達

圖1 免疫組化法檢測OSCC組織和癌旁組織中CDK-10 表達(HE染色,陽性細胞為黃褐色或褐色,×200)

圖2 OSCC患者中miR-7-5p與CDK-10呈負相關
2.2miR-7-5p調控OSCC細胞中CDK-10表達量 miR-7-5p與CDK10結合位點見圖3。熒光素酶報告基因實驗結果顯示,與空白對照組(1.02±0.08)相比,miR-7-5p與野生型CDK10 3′UTR共轉染后,檢測到熒光素酶活性顯著降低(0.35±0.13,P<0.01)。而與突變型CDK10 3′UTR共轉染后,熒光素酶活性無明顯變化(1.00±0.00 vs 0.91±0.06,P>0.05)。體外細胞實驗顯示,與空白對照組比較,miR-7-5p過表達組miR-7-5p顯著升高,CDK-10顯著降低(P<0.05)。與miR-7-5p抑制組比較,miR-7-5p過表達組miR-7-5p顯著升高,CDK-10顯著降低(P<0.05)。見表2。
2.3miR-7-5p調控OSCC細胞周期 與miR-7-5p抑制組比較,miR-7-5p過表達組S期、G2M期顯著升高,G0/G1期顯著降低(P<0.05)。見表3。
2.4miR-7-5p調控OSCC細胞caspase-3、caspase-8、caspase-9、Bax、Bcl-2和CDK-10的活性水平 與miR-7-5p抑制組和空白對照組比較,miR-7-5p過表達組caspase-3、8、9及Bax水平顯著升高,Bcl-2、CDK-10顯著降低(P<0.05)。見圖4、表4。

圖3 miR-7-5p與CDK-10結合位點
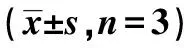
表2 miR-7-5p調控OSCC細胞中 CDK-10表達量

表3 miR-7-5p和CDK-10調控口腔鱗癌細胞 細胞周期(%,n=3)

1~3:空白對照組、miR-7-5p抑制組、miR-7-5p過表達組圖4 Western印跡檢測各組OSCC細胞蛋白表達
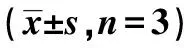
表4 miR-7-5p調控OSCC細胞caspase-3、caspase-8、caspase-9、Bax、Bcl-2和CDK-10的活性水平和光密度值
2.5MTT法和LDH活性檢測miR-7-5p調控OSCC細胞 與miR-7-5p抑制組和空白對照組比較,miR-7-5p過表達組LDH水平顯著升高,MTT顯著降低,(P<0.05)。見表5。
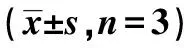
表5 MTT法和LDH活性檢測結果
3 討 論
OSCC是一種在世界范圍內高度流行的癌癥,轉移和放化療耐受是OSCC致死的主要原因〔8〕,研究表明,miR-7-5p異常表達可促進腫瘤發生發展,miR-7-5p是否發生啟動子區域甲基化改變與侵襲性腫瘤的發生和發展有關〔9〕。CDK-10在體外和體內研究中對細胞凋亡和腫瘤發生發展密切相關,其甲基化同淋巴結轉移和臨床分期相關〔10〕。本研究結果顯示,miR-7-5p與CDK-10結合發生結合,CDK-10是miR-7-5p口腔鱗癌重要的靶點。這與miR-7-5p在其他腫瘤中的表達趨勢具有一致性;miR-7-5p可能是OSCC患者重要的靶點,其機制可能與CDK-10具有相關性。
研究表明,miRNAs可以作為腫瘤篩查、診斷和預后的生物標志物〔11〕。有研究發現,miR-7-5P的穩定過表達會伴隨著DNA甲基化和組蛋白修飾。miR-7-5p甲基化的發生也與患者治療后的進展生存期和總體生存率有關〔12〕。也有研究表明,miR-7-5p在結直腸癌的腫瘤組織和細胞中也發生高度的甲基化,miR-7-5p可能是診斷結直腸癌的標志物〔13〕。本研究中,在OSCC患者血清中miR-7-5p表達量顯著下降,說明miR-7-5p在OSCC的發生中起到重要作用。miR-7-5p主要通過影響細胞周期并促進干細胞分化來調節細胞增殖〔14〕,一項研究表明,miR-7-5p通過靶向Bcl-2調節人乳頭狀癌細胞的增殖和轉移,miR-7通過靶向Bax和Sirt2抑制帕金森病模型中神經元細胞的凋亡〔15〕。也有研究發現,miR-7-5p抑制舌鱗狀細胞的增殖,遷移和侵襲〔16〕。本研究結果表明,miR-7-5p可能通過CDK-10調控細胞周期調節細胞增殖與細胞凋亡;miR-7-5p對CDK-10的調節作用,這和通過調節caspase-3及Bax/Bcl2等典型細胞凋亡因子促進細胞凋亡具有相似的作用,miR-7-5p可能是OSCC發生的重要潛在靶點。
CDK-10被證明能促進細胞增殖,具有抑癌作用〔17〕。有研究發現CDK-10在膽管腫瘤和細胞系中的表達均下調,CDK-10過表達或敲除分別抑制或促進細胞增殖、集落形成和遷移〔18〕。研究證實,基因啟動子高頻甲基化是造成惡性腫瘤中CDK-10表達下調的重要原因〔19〕,也有轉錄組學和蛋白質組學研究中發現,癌細胞或表現出加劇分裂的細胞中CDK-10的表達上調〔20〕。本研究發現miR-7-5p過表達可以減少OSCC細胞增殖和增加LDH水平,抑制miR-7-5p可以增加OSCC細胞增殖和減少LDH水平,這與miR-7-5p表達與caspase-3、8、9、Bax、Bcl-2、CDK-10之間的關系的結果具有一致性,說明,CDK-10可能是調控miR-7-5p促進OSCC細胞增殖和凋亡的重要靶點。
綜上,OSCC患者血清中miR-7-5p表達量顯著下降,CDK-10表達量顯著升高,CDK-10可能是miR-7-5p調控OSCC細胞增殖、凋亡與周期的重要靶點。miR-7-5p有希望成為OSCC預后和診斷的評定指標。 但本研究也有一定不足,樣本量較少,實驗方案較為簡單,統計可能存在較大誤差,我們將在后續研究中繼續改進和進一步探究。

