淺析多晶硅雜質引入因素及解決方案
*何敬敬 趙長森 牛強
(內蒙古鄂爾多斯電力冶金集團股份有限公司 內蒙古 016064)
多晶硅是晶硅太陽能電池的基礎原材料,隨著多晶硅技術的成熟和客戶標準的提高,生產商開始規劃生產電子級多晶硅以滿足市場需求。但國內電子級多晶硅在一些技術指標上仍與德國Wacker、韓國OCI、美國Hemlock等標桿企業存在一定差距。研究證實碳(C)、硼(B)、磷(P)等雜質含量是影響電子級多晶硅品質的重要標準,但國內仍缺乏對上述雜質脫除技術的系統研究,特別是匱乏對已有提純技術機理的總結。
本文在前人研究的基礎上,梳理了多晶硅生產流程中雜質引入的因素,概述了近些年國內外關于雜質去除的技術方案,著重探索了雜質脫除機理,旨在為我國高質量制備電子級多晶硅提供一種研發思路。
1.雜質來源
改良西門子法是目前市場主流的多晶硅生產工藝。大量生產實踐表明,整個生產流程中,硅粉、氫氣等原輔料、設備、附件備品和設施環境等是引入C、B、P等雜質的主要因素[1]。
(1)硅粉:雖然采購硅粉中的B、P等雜質都有一定的含量要求,硅粉也會經過后續提純工序,但還會有微量的B、P及金屬雜質等進入鹵硅烷(一般含有三氯氫硅SiHCl3、四氯化硅SiCl4、二氯二氫硅SiH2Cl2等,以下簡稱HGS),且隨著反歧化或者還原等工藝的進行,雜質還會以其它形式的副產物停留在體系中。
(2)氫氣:一部分來源于尾氣的回收利用,不可避免的含有許多CO、CO2、CH4等碳雜質氣體,對產品中的C含量指標造成明顯的影響。
(3)設備及附備件:與硅粉、HGS等物料直接接觸的氫化塔、精餾塔、還原爐等生產設備及管道、閥也會直接影響產品的純度;硅芯、石墨夾具及電極頭等輔助備品會帶來C雜質。
(4)環境設施:產品中的表金屬雜質大多來自于生產、包裝環境的污染。生產設施中的還原爐室,硅棒運輸通道,以及多晶硅后處理區域的破碎間、清洗間、包裝間、庫存管理間等廠房的潔凈度也是把控雜質引入的重要因素。
2.提純技術
隨著原料、設備、人為操作和環境設施等方面的嚴格把控,以及自動技術的引入,外在因素引入雜質的幾率逐步降低;但整個生產體系中,無論是HGS合成,還是后續還原,直至尾氣回收,提純技術對雜質的去除仍是重中之重。
(1)精餾法。精餾法是有效去除HGS雜質的最重要的方法,國內現有雜質去除均是通過多級精餾。部分雜質,如Fe、Cu、Mn等的化合物可以較易通過精餾除去,但B、P雜質的化合物種類繁多,且部分B、P化合物的性質與HGS相似,使得單純的精餾難以達到脫除要求。
(2)絡合法。通過在HGS中加入絡合劑,使B、P雜質被絡合成與原始HGS沸點相差很大的穩定絡合物,通過后續精餾去除的方式為絡合法。絡合劑的篩選依據是Lewis酸堿理論。
如脫除B、P中,利用雜質PCl5的Lewis堿性質,M.Whelan等首次利用Lewis酸AlCl3對其絡合形成AlPCl8高沸點絡合物去除。工業上采用Cl2氧化PCl3成PCl5,再絡合AlCl3進行雜質脫除,反應機理為PCl3+Cl2→PCl5;PCl5+AlCl3→AlPCl8。雖然該方法除P效果比較明顯,但會引入鋁雜質[2]。
Pechiney SA公司沿用上述Lewis酸堿絡合的思路,采用鹵素Cl或Br先將HGS中的P雜質氧化到+5價態,然后加入SnCl4或TiCl4形成PX5·MCl4(M為Sn或Ti)絡合物,隨后再加入三苯基氯甲烷,同時與含B雜質以及過量的SnCl4或TiCl4絡合,不僅避免引入絡合劑的二次污染,而且通過后續處理可以同時將B、P雜質去除[3]。
黃等[4]采用Lewis酸PtCl4對SiHCl3中的P進行去除,主要是基于PCl3極易與PtCl4形成四氯化鉑型Pt(PCl3)xCl4(x=0~4)配位化合物,易于后期精餾去除。結果表明,該絡合劑除P耗時短,除P效果可達99.8%以上。
江蘇鑫華利用表面富含穩固羥基的TiO2等金屬氧化物與SiHCl3反應,轉化為分子量較大的Cl2HSi-OCH2SiHCl2、Cl2HSi-O-CHCl2雜質和HCl、H2等小分子雜質,后續通過脫重精餾得到高純SiHCl3產品,反應機理為X-OH+SiHCl3→X-H+HO-SiHCl2;HO-SiHCl2+CH2Cl2→Cl2HSi-O-CHCl2+HCl;HO-SiHCl2+CH3SiHCl2→Cl2HSi-O-CH2SiHCl2+H2(X為金屬氧化物微球)[5]。
Darnell等提出一種用氧絡合提純SiHCl3的方法。SiHCl3與少量的氧或硅氧化合物接觸發生部分氧化絡合,生成含Si-OH的[HOSiCl3]+中間絡合物和氧自由基(O·)。該中間絡合物可迅速與BCl3、PCl3等雜質反應,生成聚硅氧烷高沸點化合物,反應機理為BCl3+[HOSiCl3]+→Cl2B-O-SiCl3+HCl;PCl3+[HOSiCl3]+→Cl2P-O-SiCl3+HCl;H2B-OH+SiHCl3→H2B-O-SiHCl2+HCl[3]。
(3)固體吸附法。固體吸附主要是利用高比面積的多孔固體吸附劑對HGS中含B、P和金屬雜質進行吸附分離。常用的吸附劑主要有:活性炭、硅酸鹽、胺型離子交換樹脂、分子篩和氧化物等。
其中,具有大比表面和豐富孔結構的硅膠為無定型的SiO2,均由硅-氧四面體堆積而成,其表面富含羥基不僅適合化學接枝改性,且硅羥基可與BCl3直接反應吸附,機理為Si-OH+BCl3→Si-OBCl2+HCl。Tzou等[6]將硅膠負載具有較強絡P能力的CuCl2銅鹽,使含P雜質滯留在硅膠載體上,且CuCl2的負載增大與HGS中雜質的接觸面積,大幅提升硅膠除雜能力。
活性Al2O3具有豐富的孔性結構和大的比表面積,較大的表面羥基直接或對其負載改性之后可作為載體來吸附B、P。其中,堿性Al2O3是通過把中性Al2O3表面的羥基替換為陽離子和O-親核物質與含B雜質穩定結合;酸性Al2O3是把中性Al2O3表面羥基替換為Cl-與含P雜質穩定結合。
分子篩(沸石)是一種常見的吸附分離材料。Li[7]用HCl、HNO3、H3PO4和H2SO4對Cu負載的ZSM-5型沸石進行酸改性,結果無機含氧酸的修飾不僅提升沸石的吸附性能,同時有助于Cu2+對H2S和PH3雜質的氧化吸附,高效脫除H2S和PH3(圖1b)。

圖1 (a)西門子法制備多晶硅;(b)酸對Cu/ZSM-5型沸石進行改性機理
(4)部分水解法。BCl3、B2H6等雜質的水解均優先于HGS中Si-H和Si-C鍵水解,形成高沸物被脫除;另外,水與HGS充分接觸發生局部水解反應,生成HSiCl2(OH)、HSiCl(OH)2、SiCl3(OH)以及硅膠等主要產物[6]。這些水解物亦可與B、P絡合形成穩定化合物,后續通過精餾等方法易于脫除,涉及的反應有:
另外,選擇具有自由水的多孔硅膠或水合Al2O3、水合Fe2O3等水合氧化物為吸附劑,吸附劑中的水與B/P雜質發生水解生成高沸物,同時具有多孔結構的硅膠及上述水合氧化物能牢固吸附B/P氯化物以及高沸物,使純化后的HGS達到電子級水平[8]。
(5)催化反應。HGC含有的C雜質在一定條件下會轉化為甲基二氯硅烷(CH3Cl2SiH)、二甲基氯硅烷(C2H6ClSi)等含碳有機物雜質。催化反應目前是去除含碳有機物雜質較為有效的一種方法;通常先通過催化發生化學反應,后續再結合精餾、吸附等方法去除雜質。
Jean-Luc Lepage[9]公布了利用陰離子交換樹脂催化CH3Cl2SiH與SiCl4反應生成硅烷氣體和甲基三氯硅烷(CH3SiCl3)的方法,CH3Cl2SiH+SiCl4→CH3SiCl3+SiH4。遺憾的是該反應的催化劑催化效率較低,且不能重復利用。
后續萬燁等人[10]使用光催化反應,以氯氣為氯源,將原料中的低氯含量的CH3SiHCl2通過Si-H和C-H斷裂氯化反應轉化為高氯含量的CH3SiCl3,產品的碳含量小于3×1015atoms/cm3,達到電子一級品指標,機理為:CH3SiHCl2+Cl2→CH3SiCl3+HCl;CH3SiHCl2+Cl2→CH2ClSiCl2+HCl。同時,若有氧存在的情況下,施主和受主雜質發生化學反應形成Si-O-B鍵或Si-O-P鍵,B、P等將轉化為高沸絡合物,可進一步精餾提純。
光催化法讓CH3SiHCl2和劇毒氯源發生反應轉化為CH3SiCl3具有一定的安全隱患。對此,天大選用具有催化作用的樹脂、硅鋁凝膠、改性活性炭吸附劑裝填到甲基二氯硅烷-氯源反應吸附塔中,這種催化吸附劑能同時進行氯化反應和氣相吸附,將甲基二氯硅烷轉化為甲基三氯硅烷高沸物,從而達到除碳的目的[11]。
綜合以上,相應的多晶硅提純技術的基本作用機理如表1所示。
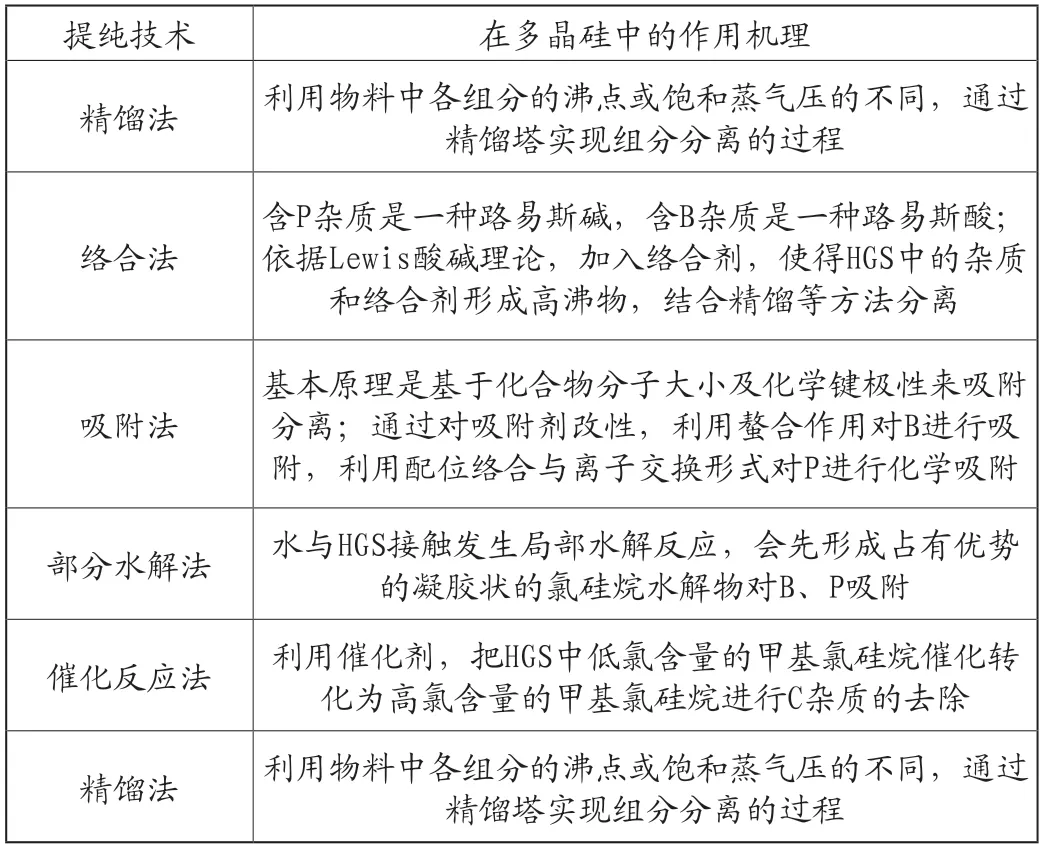
表1 提純技術在多晶硅中的作用機理
3.總結及展望
目前國內以大全集團、亞洲硅業、洛陽中硅為代表的多晶硅生產企業發表的文章很少涉及除雜機理的研究,而在國內朝向電子級多晶硅完全生產的趨勢下,需要加強對HGS雜質去除技術的自主研發及創新,后續應著重從以下幾點研究:
(1)建立HGS中痕量雜質的分析檢測技術,結合分子模擬與實驗測定,研究典型工藝條件下HGS中雜質的種類及分子結構特征,為提純工藝提供強有力的理論基礎。
(2)基于雜質與絡合劑、吸附劑的反應機理,構建高效絡合劑及吸附劑結合的改性方法。
(3)遵從流程簡單、能耗較低層面設計原則,從反應→絡合→吸附→精餾出發,優化組合不同提純工藝方案,從而高效、有序的進行提純工序。

