采后外源脫落酸處理對霧培微型馬鈴薯周皮木栓化的影響及其機理
張志鵬,譚蕓秀,李寶軍,李永才,畢陽,李守強,王小晶,張宇,胡丹
采后外源脫落酸處理對霧培微型馬鈴薯周皮木栓化的影響及其機理

1甘肅農業大學食品科學與工程學院,蘭州 730070;2甘肅省農業科學院農產品貯藏加工研究所,蘭州 730070;3甘肅省種子總站,蘭州 730070

霧培微型薯;脫落酸;木栓化;苯丙烷代謝;活性氧代謝
0 引言
【研究意義】馬鈴薯(L.)屬茄科一年生草本植物,是重要的糧菜兼用作物,其加工用途多,產業鏈條長,在保障糧食安全和農業產業轉型升級中發揮著至關重要的作用[1]。但馬鈴薯在種植生產中易受病蟲害的侵襲和非生物脅迫影響,輕則減產,重則絕產[2],嚴重影響了農業發展和農民的經濟收入。馬鈴薯屬無性繁殖作物,優質種薯可以減輕在種植過程中造成的損失,保障馬鈴薯穩產增收。目前,國內主要采用基質栽培法、水培法、霧培法生產馬鈴薯種薯,而霧培法是近幾年生產馬鈴薯種薯的一種新型無土栽培技術,生產自動化程度高,不受氣候的限制,可以全年全季進行種薯生產[3]。另外,霧培馬鈴薯結薯率高,由于生產中不需土壤覆蓋,有效降低了存在于土壤中的病菌、病毒以及蟲害的侵害,使種薯的質量和活力得到保障,因此被廣泛應用于馬鈴薯原原種的生產[4]。但由于霧培馬鈴薯塊莖生長在密閉保濕空間中,且定期噴灑營養液,導致塊莖采收前一直處于高濕度的環境中,使塊莖體內含水量較高,皮孔較大,表皮脆嫩,采收后極易擦傷,使表皮遭到破壞形成傷口,導致塊莖采后失水和病原物侵染,造成塊莖采后腐爛損失嚴重。因此,研發適于霧培微型馬鈴薯種薯采后周皮快速木栓化的方法,在保持采后種薯品質和活力方面具有重要作用。【前人研究進展】周皮木栓化指在適宜條件下,木栓質在植物周皮細胞壁或植物表面損傷部位細胞壁上沉積而形成的生物學過程[5]。而周皮細胞發生木栓化后,細胞不透水、不透氣,可以有效地避免果蔬采后或創傷后體內水分和養分的流失,并且可以阻止外界病原菌及非生物脅迫對果實的二次損害。馬鈴薯采后在適宜環境條件下,塊莖表皮發生木栓化形成周皮組織,有效避免了塊莖采后因失水和病原物入侵而造成的損失,保持了塊莖采后的品質[6]。而大多數農戶通常將馬鈴薯塊莖采摘后在自然條件下進行晾曬,以此來完成周皮木栓化過程,通常需要3—4周時間;長時間露天晾曬不僅會增加塊莖體內龍葵素的含量,使塊莖出現變綠現象并影響食用安全;而且容易遭受突變低溫,造成馬鈴薯冷害。同時受環境條件影響會導致部分塊莖周皮木栓化無法完全形成,為病原菌入侵提供了通道造成塊莖腐爛,使貯藏期間塊莖的腐爛率高居不下,且影響種薯的活力[7]。脫落酸(abscisic acid,ABA)是一種重要的半萜類植物激素,可以調控植物果實采后的抗逆性過程,目前在果蔬采后保鮮方面也得到了廣泛應用[8]。而在采后使用外源脫落酸處理會加速馬鈴薯塊莖周皮木栓化進程,有效地降低塊莖在采后貯藏期間的損失。研究發現,采后使用外源ABA浸泡馬鈴薯塊莖,能促進塊莖周皮組織中聚酚軟木脂(suberin polyphenolic,SPP)和聚酯軟木脂(suberin polyaliphatic,SPA)的積累,提高塊莖的早期抗病能力[9]。李雪等[10]研究表明,采后外源ABA處理馬鈴薯塊莖可以促進酚類物質的合成,激活塊莖愈傷組織中苯丙氨酸解氨酶(phenylalnine ammonia-lyase, PAL)和過氧化物酶(peroxidase,POD)活性,加速軟木脂的聚合,促進馬鈴薯塊莖傷口周皮的形成。外源ABA處理獼猴桃果實,激活了愈傷組織的苯丙烷代謝,通過提高PAL、肉桂醇脫氫酶(cinnamyl alcohol dehydrogenase,CAD)和POD的活性來刺激損傷部位細胞發生木栓化,從而加速受傷獼猴桃果實的傷口愈合[11]。陶曉亞等[12]研究發現采后使用外源ABA處理‘新太陽’番茄果實,促進了果實愈傷組織細胞中木栓質的合成,提高了愈傷組織中POD、超氧化物歧化酶(super oxide dismutase,SOD)和過氧化氫酶(catalase,CAT)活性,從而加速了采后番茄果實的傷口愈合。張一冉等[13]研究發現采后ABA處理李果實后,激活了果實愈傷組織中還原型輔酶Ⅱ(NADPH oxidase,NOX)、SOD、CAT酶活性,維持活性氧代謝的平衡,加速了果實采后傷口木栓化形成愈傷組織,保持了果實采后的品質。【本研究切入點】雖然已有研究表明外源ABA處理可以促進采后果蔬周皮細胞發生木栓化,加速傷口愈合,但采后使用外源ABA處理霧培微型馬鈴薯,加速塊莖周皮木栓化進程及其調控機理尚未揭示。【擬解決的關鍵問題】本研究以‘通薯1號’霧培微型馬鈴薯為研究對象,使用外源ABA浸泡處理后,于15℃(RH86%—88%)黑暗環境下進行預貯,通過測定貯藏期間塊莖的失重率、觀察軟木脂和木栓質在塊莖周皮組織中的沉積過程,分析塊莖周皮組織中苯丙烷和活性氧代謝相關酶活性的變化,探討使用外源ABA處理促進采后霧培微型馬鈴薯塊莖周皮木栓化的機理,為采后霧培微型馬鈴薯塊莖快速完成周皮木栓化提供理論依據和技術支持。
1 材料與方法
試驗于2021年在甘肅農業大學果蔬采后生物學技術實驗室進行。
1.1 材料與試劑
供試材料‘通薯1號’原原種于2021年7月23日采自甘肅定西市馬鈴薯研究所,當日運抵實驗室,在(4±2)℃下貯藏待用。
丙酮、氯化鋁、鹽酸羥胺、溴乙酰,國藥集團;中性紅、甲苯胺藍、2-甲氧基酚,上海澤葉生物科技有限公司;-巰基乙醇,武漢榮恩偉業化工有限公司;L-苯丙氨酸、-香豆酸,南京聚輝化學試劑公司;F8010 Folin-Phenol、Triton X-100及苯丙烷關鍵酶提取液,上海源葉有限公司。
1.2 儀器與設備
LRH-105F型恒溫培養箱,深圳市奧德瑪電子科技有限公司;DW-86L416G型超低溫冰箱,青島海爾股份有限公司;KH20R-II低溫高速離心機,湖南凱達儀器有限公司;U-LH100-3型熒光顯微鏡,西安華宏光電科技有限公司;UV-5BIO型紫外分光光度計,梅特勒科技有限公司;MULTISKA-FC型酶標儀,賽默飛世爾儀器有限公司;DDS-307A型電導儀,上海雷磁儀器有限公司。
1.3 試驗方法
1.3.1 ABA溶液配制 參考李雪等[10]的方法并稍作修改。用純度為99%的外源ABA粉末,配制成濃度分別為25、50和100 mg·L-1的穩定溶液,低溫避光保存待用。
1.3.2 塊莖處理 塊莖回溫24 h,挑選大小均勻、無損傷的霧培微型馬鈴薯塊莖,用1.5%的次氯酸鈉溶液清洗消毒2—3 min后,用自來水再沖洗一遍,晾干。然后將塊莖分別浸入不同濃度的ABA溶液中浸泡處理10 min,取出自然晾干,按處理濃度分別裝入黑色聚乙烯塑料袋中,在溫度為15℃、環境濕度為86%—88%的條件下進行貯藏。每組處理使用霧培微型馬鈴薯塊莖200個,以清水浸泡作為對照組。在塊莖貯藏的第0、1、3、5、7、14和21天進行取樣分析。
1.3.3 周皮木栓化效果評價
1.3.3.1 失重率的測定 采用稱重法。每個處理用3個塊莖,重復9次。
1.3.3.2 軟木脂和木質素沉積的觀察 聚酚軟木脂(suberin polyphenolic,SPP)、聚酯軟木脂(suberin polyaliphatic,SPA)和木質素的沉積參照張志鵬等[14]的方法,進行染色拍照觀察。拍攝得到的照片參照VAN OIRSCHOT等[15]的方法,使用IS Capture軟件對塊莖周皮組織細胞中軟木脂和木質素的沉積厚度進行量化分析。
1.3.4 生化取樣 參照JIANG等[16]的方法并修改。以塊莖愈傷的第0、1、3、5、7、14和21天為時間點,刮取塊莖表面及以下2—3 mm的周皮組織,迅速放入液氮中冷凍,研磨成粉末狀保存于-80℃待測。
1.3.5 木質素、總酚、類黃酮含量的測定 木質素、總酚、類黃酮的含量參照張志鵬等[14]的方法進行提取測定,木質素含量以OD280·g-1FW表示,總酚含量以GAE mg/100 g FW表示,類黃酮含量以CE mg/100 g FW表示。
1.3.6 苯丙烷代謝關鍵酶活性的測定 PAL活性的測定參照張志鵬等[14]的方法,以U?h-1?g-1FW表示。
4-香豆酸輔酶A連接酶(4-coumarate coenzyme A ligase,4CL)活性的測定參照VOO等[17]的方法,以U?min-1?g-1FW表示。
肉桂酸-4-羥化酶(Cinnamic acid 4-hydroxylase,C4H)活性測定參照LAMB等[18]的方法,以U?min-1?g-1FW表示。
CAD活性參照GOFFNER等[19]的方法,以U·min-1·g-1FW表示。
1.3.7 細胞膜透率和丙二醛含量的測定 細胞膜透率的測定參照REN等[20]的方法。將塊莖分割為1 cm×0.5 cm×0.5 cm左右的長方體組織,去離子水沖洗3遍后,浸泡3 h(25℃),用電導儀記錄起始值E0和終止值E1。沸水浴30 min,置于冰上進行冷卻,測定電導率E2。計算公式為:細胞膜滲透率(%)=(E1-E0)/ E2×100。
MDA含量的測定參照REN等[20]的方法并修改。稱取1 g冷凍樣品,加入3 mL 5% TCA,浸提10 min后在4℃,8 000×離心30 min。分離上清液2 mL,加入2 mL 0.67%的TBA,90—95℃水浴30 min。用自來水冷卻后,分別測定波長在600、450和532 nm的混合液OD值。MDA含量=[6.45×(OD532-OD600)- (0.56×OD450)]×Vt×Vr/(Vs×m)。Vt、Vr和Vs分別表示反應體系中提取液、反應混合物溶液和提取液的總體積,m表示樣品質量。MDA含量以μmol?mg-1FW表示。

1.3.9 ROS代謝關鍵酶活性的測定 NOX、SOD、CAT活性用蘇州科銘生物試劑盒,測定波長在600 nm(NOX)、560 nm(SOD)和240 nm(CAT)處吸光值,酶活性按樣品質量計算,NOX和SOD活性以U?g-1FW表示,CAT活性以nmol?min-1?g-1FW表示。
POD活性的測定參照張志鵬等[14]的方法,以ΔOD470?min-1?g-1FW表示。
1.3.10 AsA-GSH循環代謝酶活性的測定 抗壞血酸過氧化物酶(ascorbate peroxidase,APX)、單脫氫抗壞血酸還原酶(monodehydroascorbate reductase,MDHAR)、脫氫抗壞血酸還原酶(dehydroascorbate reductase,DHAR)、谷胱甘肽還原酶(glutathione reductase,GR)活性用蘇州科銘生物試劑盒測定。測定波長在290 nm(APX)、340 nm(MDHAR)、265 nm(DHAR)和340 nm(GR)處吸光值,酶活性按樣品質量計算,APX、MDHAR、DHAR、GR活性均以nmol?min-1?g-1FW表示。
1.3.11 AsA-GSH循環底物含量的測定 抗壞血酸(ascorbic acid,ASA)、脫氫抗壞血酸(dehydroascorbate,DHA)、還原型谷胱甘肽(reduced glutathione,GSH)、氧化型谷胱甘肽(glutathione,GSSG)的含量用蘇州科銘生物試劑盒測定。測定波長在420 nm(ASA)、265 nm(DHA)和412 nm(GSH和GSSG)處吸光度值,含量按樣品質量計算,ASA含量以μg?g-1FW表示,DHA含量以nmol?g-1FW表示,GSH和GSSG含量以μmol?g-1FW表示。
1.4 數據分析
每一項指標至少重復測定3次。使用 Microsoft Excel 2010進行結果計算、SPSS Statistics 25顯著性差異分析、Origin2018進行圖表繪制(<0.05)。
2 結果
2.1 ABA處理對霧培微型馬鈴薯塊莖貯藏期間失重率的影響
隨著貯藏時間的延長,馬鈴薯塊莖的失重率均逐漸上升,但ABA處理的塊莖失重明顯低于對照(圖1)。其中25 mg?L-1ABA處理塊莖的失重率顯著低于其他濃度處理的塊莖,第7天時,25 mg?L-1ABA處理塊莖的失重率分別較50和100 mg?L-1ABA處理和對照塊莖低40.94%、27.31%和65.59%(<0.05),表明25 mg?L-1ABA處理能有效控制采后塊莖木栓化期間的失重率。
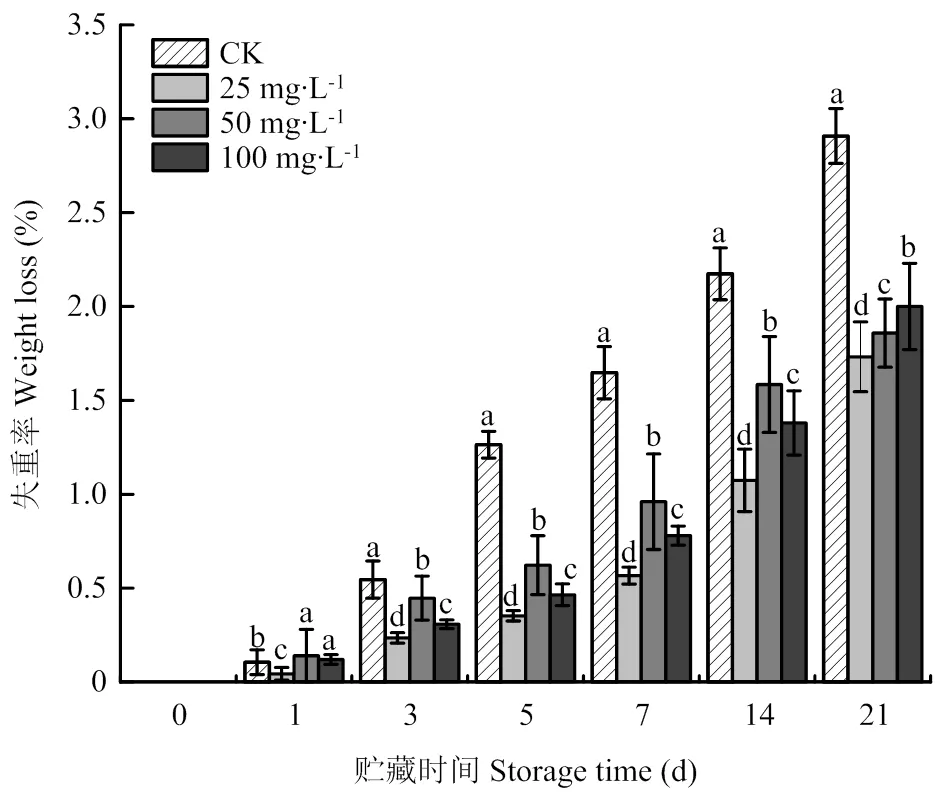
不同字母表示同一貯藏時間不同組別差異顯著(P<0.05)。下同
2.2 ABA處理對霧培微型馬鈴薯塊莖貯藏期間周皮處軟木脂沉積的影響
ABA處理能促進塊莖周皮細胞中SPP和SPA積累(圖2-A、B)。其中25 mg?L-1ABA處理的塊莖,貯藏期間周皮中軟木脂的積累量顯著高于其他處理,第21天時,25 mg?L-1ABA處理塊莖的SPP積累量,分別較50和100 mg?L-1ABA處理和對照塊莖高23.84%、20.32%和27.50%(<0.05)(圖3-A),25 mg?L-1ABA處理塊莖的SPA積累量也顯著高于其他處理(圖3-B)。貯藏期間,木栓質的積累速度和積累量也隨貯藏時間的延長逐漸增加(圖2-C,圖3-C),在第21天時,25 mg?L-1ABA處理塊莖的木栓質積累量,分別較50和100 mg?L-1ABA處理和對照塊莖高15.16%、13.99%、19.02%(<0.05)(圖3-C)。
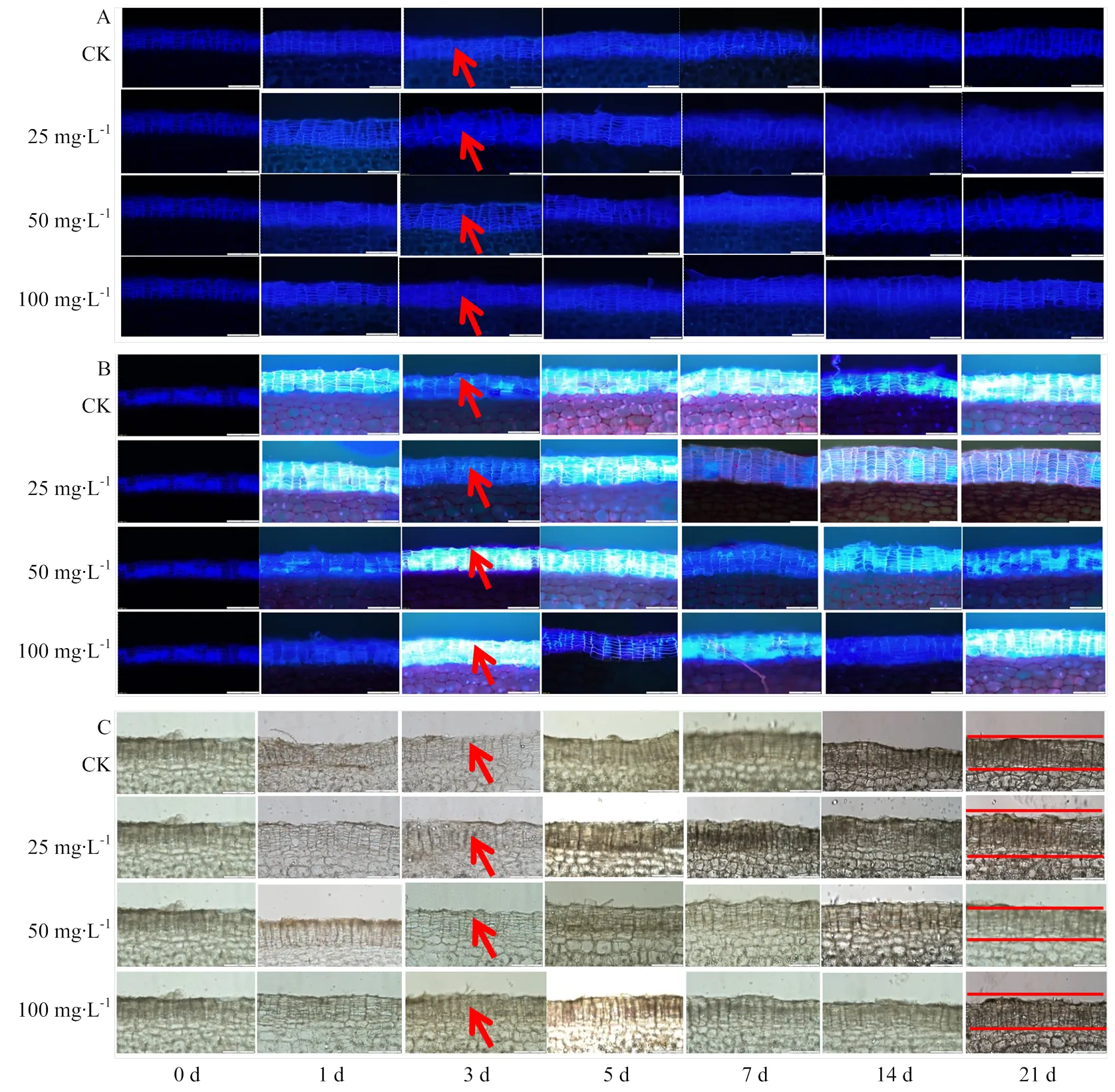
圖2 ABA處理對貯藏期間塊莖周皮處SPP(A)、SPA(B)和木質素(C)積累的影響(箭頭所指為SPP、SPA和木栓化沉積,比例尺:200 μm)
2.3 ABA處理對霧培微型馬鈴薯塊莖周皮組織中木質素含量的影響
貯藏期間,塊莖周皮組織中木質素的含量隨貯藏時間的延長而持續增加(圖4)。ABA處理塊莖周皮組織中木質素含量顯著高于對照,第21天時,比對照高6.13%(<0.05)。

不同小寫字母表示差異顯著(P<0.05)

*表示同一貯藏時間不同組別差異顯著(P<0.05)。下同
2.4 ABA處理對霧培微型馬鈴薯塊莖周皮組織中總酚類黃酮含量的影響
總酚和類黃酮的積累反映了苯丙烷代謝途徑次生代謝物的生物合成。貯藏期間,塊莖周皮組織中總酚和類黃酮的含量逐漸積累(圖5)。其中ABA處理塊莖總酚和類黃酮的積累量顯著高于對照。第14天時,總酚含量比對照高13.96%(<0.05)(圖5-A),類黃酮含量比對照高20.37%(<0.05)(圖5-B)。
2.5 ABA處理對霧培微型馬鈴薯塊莖周皮組織中苯丙烷代謝關鍵酶的影響
貯藏期間,塊莖周皮組織中PAL、4CL、C4H和CAD的活性均逐漸升高(圖6)。其中經ABA處理的塊莖周皮組織中PAL活性顯著高于對照,貯藏第21天時,高于對照79.02%(<0.05)(圖6-A)。4CL活性呈先上升后下降的趨勢,但始終高于對照,在貯藏第3天時,比對照高4.78%(<0.05)(圖6-B)。而C4H和CAD活性隨貯藏時間的延長,處理塊莖均顯著高于對照,在貯藏第21天,C4H活性高于對照12.99%(圖6-C)(<0.05),CAD活性比對照高11.54%(圖6-D)(<0.05)。
2.6 ABA處理對霧培微型馬鈴薯塊莖周皮組織細胞膜透率和MDA含量的影響
貯藏期間,各處理塊莖周皮處的細胞膜透率均呈上升趨勢(圖7-A),ABA處理塊莖的細胞膜透率顯著低于對照。第21天時,處理塊莖的細胞膜透率低于對照22.13%(<0.05)。各處理塊莖周皮處的MDA含量呈逐漸下降的趨勢(圖7-B),處理顯著低于對照。第21天,處理塊莖周皮處的MDA含量比對照低11.14%(<0.05)。

圖5 ABA處理對貯藏期間塊莖周皮處總酚(A)和類黃酮(B)含量的影響

圖7 ABA處理對貯藏期間塊莖周皮處細胞膜透率(A)和MDA含量(B)的影響
2.7 ABA處理對霧培微型馬鈴薯塊莖周皮組織中的H2O2和含量的影響
H2O2和的積累反映了塊莖貯藏期間ROS代謝水平,貯藏期間,塊莖周皮組織中H2O2含量隨貯藏時間的延長而積累量增加(圖8-A),處理塊莖顯著高于對照,第21天時達到峰值,高于對照67.37%(<0.05)。而塊莖周皮組織中含量隨貯藏時間的延長,前期迅速升高,中期趨于平穩,在末期又呈下降趨勢(圖8-B),但貯藏期間ABA處理塊莖的含量顯著高于對照,第14天時,比對照高7.69%(<0.05)。
2.8 ABA處理對霧培微型馬鈴薯塊莖周皮組織中ROS代謝關鍵酶活性的影響
貯藏期間,塊莖周皮組織中ROS代謝關鍵酶活性均呈上升狀態,其中塊莖周皮組織中NOX活性被激活,隨貯藏時間的延長,酶活性顯著升高(圖9-A)。ABA處理顯著提高了塊莖周皮組織處的NOX活性,21 d時,高于對照47.33%(<0.05)。塊莖周皮組織中的SOD活性也隨處理時間的延長而逐漸上升(圖9-B),第21天,處理SOD活性高于對照8.61%(<0.05)。塊莖周皮處CAT活性呈先升高后下降的趨勢(圖9-C);處理顯著高于對照,峰值出現在愈傷第7天,處理高出對照30.43%(<0.05)。貯藏期間,塊莖周皮組織中的POD活性隨貯藏時間的延長而逐漸升高(圖9-D),ABA處理顯著提高了POD活性。貯藏第21天,處理塊莖的POD活性高于對照14.50%(<0.05)。
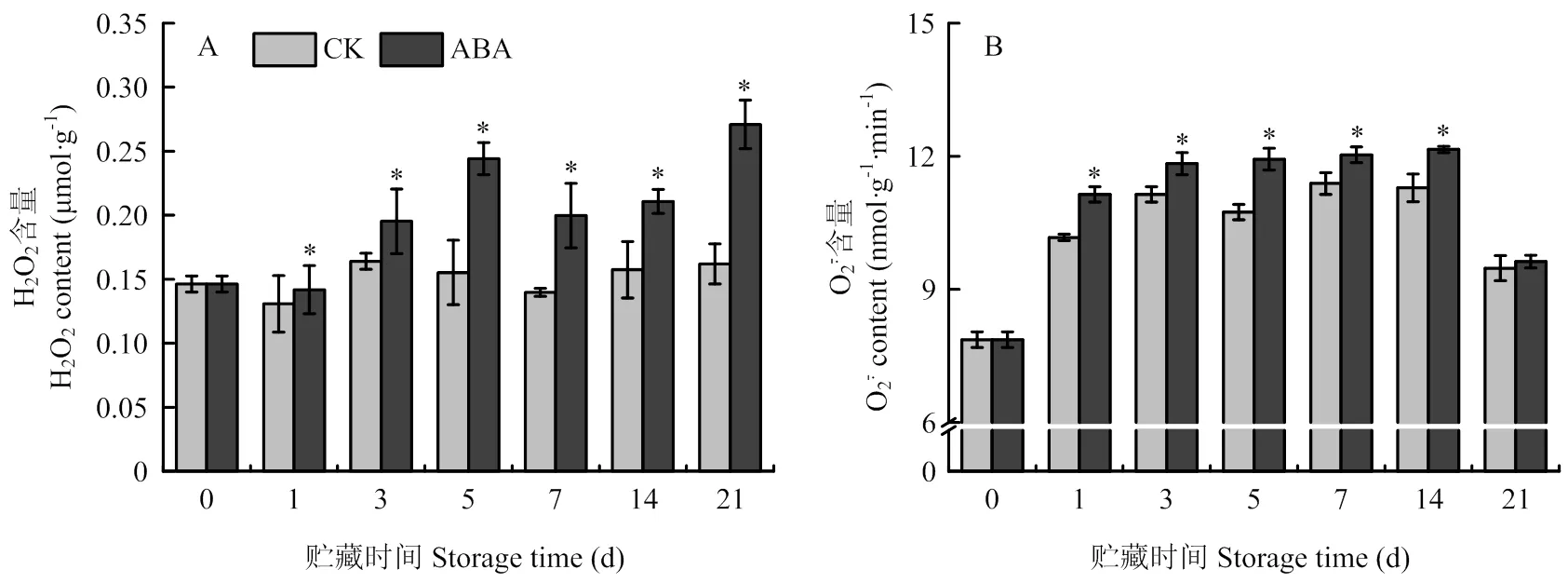
圖8 ABA處理對貯藏期間塊莖周皮處H2O2(A)和 (B)含量的影響

圖9 ABA處理對貯藏期間塊莖周皮處NOX(A)、SOD(B)、CAT(C)和POD(D)活性的影響
2.9 ABA處理對霧培微型馬鈴薯塊莖貯藏期間AsA-GSH循環酶活性的影響
APX、MDHAR、DHAR和GR是AsA-GSH循環的關鍵酶。貯藏期間,塊莖周皮組織中APX的活性隨貯藏時間的延長先升高后下降再升高(圖10-A)。貯藏前期,對照顯著高于處理,到貯藏14 d,ABA處理顯著提高了塊莖周皮組織處APX的活性,處理高于對照44.64%(<0.05)。塊莖周皮組織中MDHAR活性在處理期間逐漸上升(圖10-B)。除第1天外,處理顯著高于對照,第14天達到峰值,高于對照8.99%(<0.05)。期間塊莖周皮處DHAR活性逐漸升高(圖10-C)。處理均高于對照,在貯藏第14天活性最高,高于對照17.21%(<0.05)。而塊莖周皮組織中GR的活性隨貯藏時間的延長呈先升高再下降的趨勢(圖10-D),除第21天外,處理均高于對照。愈傷第5天出現峰值,高于對照54.24%(<0.05)。

圖10 ABA處理對貯藏期間塊莖周皮處APX(A)、MDHAR(B)、DHAR(C)和GR(D)活性的影響
2.10 ABA處理對霧培微型馬鈴薯塊莖貯藏期間AsA-GSH循環相關物質含量影響
ASA、DHA、GSH和GSSG含量的高低反映組織的氧化還原水平。貯藏期間,塊莖周皮組織中ASA的含量隨貯藏時間的延長而逐漸積累(圖11-A)。ABA處理顯著提高了塊莖周皮組織處ASA的含量,第14天時,高于對照7.31%(<0.05)。塊莖周皮組織中DHA的含量呈現先升高后下降再升高的趨勢(圖11-B)。除第1天外,對照均高于處理,貯藏第14天時,處理低于對照25.00%(<0.05)。貯藏期間,塊莖周皮處GSH含量逐漸升高(圖11-C),處理均高于對照,第21天,高于對照21.89%(<0.05)。而塊莖周皮組織中GSSG的含量隨貯藏時間的延長呈下降的趨勢(圖11-D),除第7天外,處理顯著低于對照;貯藏第21天,處理塊莖的GSSG活性低于對照45.76%(<0.05)。

圖11 ABA處理對貯藏期間塊莖周皮處ASA(A)、DHA(B)、GSH(C)和GSSG(D)含量的影響
3 討論
3.1 苯丙烷代謝在果蔬采后周皮木栓化過程中的作用
作為植物生長發育過程中重要的“脅迫激素”,ABA對采后果蔬抗逆性的調控具有重要的作用[21]。苯丙烷代謝在果蔬采后愈傷或周皮組織木栓化進程中具有重要作用[10]。總酚和類黃酮作為木栓化過程中一種重要的次生代謝產物,具有專一的抗菌性,在阻止外界病原菌侵染果實的過程中發揮了重要的作用[22-23]。木質素是苯丙烷途徑重要的次生代謝產物,結合果蔬組織中的多糖,沉積在傷口周圍細胞壁上,使傷口細胞壁的機械強度增加,有效降低了組織失水且防止了真菌病原物的侵染[24]。本研究發現,采后外源ABA處理促進了霧培微型馬鈴薯塊莖貯藏期間周皮組織中總酚、類黃酮以及木質素等次生代謝物的積累,加速了采后塊莖傷口周皮木栓化的形成。李雪等[10]研究發現采后外源ABA處理‘隴薯3號’馬鈴薯塊莖,促進了周皮傷口部位細胞中軟木脂和木質素的積累,總酚和類黃酮的含量也顯著增加,加速了采后塊莖的傷口木栓化進程,與本研究結果相似。PAL是苯丙烷代謝的關鍵酶,催化L-苯丙氨酸生成反式肉桂酸,為形成塊莖傷口木栓層的聚酚醛類(SPP)或聚芳香類(SPA)提供了底物,加速了傷口周皮的形成[5]。且SPP和SPA具有專一的抗菌性,SPP可以抵抗細菌類病原菌對塊莖的侵染,SPA可以抵抗真菌性病原菌塊莖的侵染[25]。KUMAR等[9]研究表明,采后外源ABA處理可以顯著提高馬鈴薯塊莖愈傷組織中PAL的酶活性,加速酚類物質和芳香類的生成,促進采后馬鈴薯塊莖傷口周皮木栓化的形成,與本研究結果類似。C4H是參與苯丙烷代謝途徑的第一個氧化反應的關鍵酶,催化反式肉桂酸氧化生成P-香豆酸,為木質素和類黃酮等次生代謝物的合成提供了前體物質[26]。BENVENISTE等[27]研究發現采后菊芋塊莖在貯藏期間的C4H活性呈上升趨勢,顯著高于剛采收的塊莖,本研究也得到一致的結論。4CL是苯丙烷代謝最后一步反應的關鍵酶,催化酚酸單體轉化成相應的酚酸–CoA,為木質素合成途徑提供底物[28]。在4CL的催化作用下,苯丙烷代謝分別向各次生代謝分支途徑轉折,生成總酚、類黃酮、木質素等次生代謝物[29]。CAD是木質素合成途徑中的限速酶,催化香豆醛等芳香類物質生成相應的醇單體和脂肪酸單體,然后在POD和H2O2的作用下發生氧化鉸鏈聚合反應生成木質素和軟木脂[30-31]。研究發現,采后甘薯塊莖貯藏過程中,CAD活性顯著提高,周皮組織中木質素的含量也顯著增加,從而加速了甘薯塊莖采后木栓化進程[32]。本研究發現采后使用外源ABA浸泡霧培微型馬鈴薯塊莖,顯著提高了塊莖中C4H、4CL和CAD活性,加速了采后塊莖周皮木栓化進程。
3.2 活性氧代謝在果蔬采后周皮木栓化過程中的作用
活性氧代謝是果蔬采后周皮木栓化形成過程中必不可少的途徑,ROS的產生不僅能作為信號分子傳遞愈傷信號提高相關酶活性,而且參與了傷口周皮中軟木脂和木質素的形成,在果蔬采后周皮木栓化期間發揮了重要的作用[33]。采后果蔬木栓化期間體內的ROS主要來源于NOX途徑,在NOX途徑的作用下將果蔬體內的O2還原為,而存活時間較短,隨后被SOD歧化產生為相對穩定的H2O2[34]。隨著H2O2的積累,CAT的活性被激活,CAT是果蔬體內清除H2O2的重要酶,在CAT的作用下,果蔬體內多余的H2O2還原成H2O和O2[35]。POD是果蔬損傷細胞發生木栓化加速形成愈傷組織的關鍵酶,不僅參與了反式肉桂酸前期的催化形成酚單體,而且在H2O2的作用下通過氧化交聯的方式,使愈傷組織中生成的酚類單體和芳香類物質聚合生成軟木脂和木質素,沉積在塊莖周皮組織細胞壁上,加速周皮組織細胞的栓化進程,形成愈傷周皮[36]。張一冉等[13]研究發現采后使用ABA處理李果實后,果實體內活性氧代謝相關酶NOX、SOD、CAT和POD的活性均顯著提高,促進了李果實采后周皮傷口愈合。BAJJI等[37]研究報道,采后馬鈴薯塊莖傷口愈合過程中,激活了塊莖周皮栓化組織中活性氧代謝,使塊莖周皮組織中的H2O2與POD活性提高,加速了塊莖周皮栓化組織中SPP的聚合,促進了采后早期馬鈴薯的栓化進程。陶曉亞等[12]研究發現,采后使用外源ABA處理‘新太陽’番茄果實,提高了番茄果實中POD、SOD和CAT酶活性,清除了果實體內多余的ROS,維持了果實體內活性氧平衡,加速了番茄采后愈傷。本研究發現,采后外源ABA處理激發了霧培微型馬鈴薯塊莖周皮組織中的活性氧代謝,提高了塊莖周皮組織中NOX、SOD、CAT和POD的活性,促進了和H2O2合成并有效清除了多余的ROS,使貯藏期間周皮組織中的ROS處于動態平衡,從而有效地促進了霧培微型馬鈴薯塊莖采后周皮木栓化進程,與上述研究結果一致。果蔬采后愈傷期間,細胞膜透率可以反映活性氧對周皮組織細胞膜膜脂氧化的程度,可通過測定細胞膜透率來量化細胞膜的抗氧化程度[38]。ROS積累過多,會激活脂氧合酶和磷脂酶的活性,加快細胞膜膜脂氧化,導致果實體內多不飽和脂肪酸被降解,膜通透性增大[33]。果蔬采后周皮木栓化激活了周皮組織內活性氧代謝,加速果蔬體內ROS的積累,而ROS積累過多導致細胞膜膜脂過氧化,形成MDA等超氧化物,使果蔬體內MDA含量迅速上升。本研究發現,采后外源ABA處理霧培微型馬鈴薯塊莖激活了采后塊莖周皮組織中的活性氧途徑和抗氧化系統,使周皮組織中的ROS處于動態平衡狀態,有效降低了塊莖周皮組織中MAD的含量,并且有效保護了周皮組織細胞的細胞膜不受氧化破壞,促進了馬鈴薯塊莖采后的木栓化程度。陶曉亞等[12]研究發現采后外源ABA處理番茄果實降低了愈傷期間果實體內MDA的含量和體內細胞的細胞膜透率,促進了番茄果實愈傷進程,與本研究結果相似。
3.3 AsA-GSH循環相關酶活性對果蔬采后周皮木栓化的影響
APX、DHAR、GR和CAT等都是植物體內主要的抗氧化酶,這些酶活性的升高或下降可以反映植物體內抗氧化水平[39]。當果蔬體內ROS的積累量過多時,激活ASA-GSH循環的防御活性,在APX、DHAR和GR等抗氧化酶的作用下將積累多余的ROS直接氧化生成ASA、DHA、GSH和GSSG等相應的氧化還原底物[40]。在ASA-GSH循環中,由NOX途徑產生而積累過多的H2O2在APX的催化作用下生成H2O和MDHA,而生成的MDHA在MDHAR的氧化作用下生成DHA,DHAR又催化DHA轉化為AsA,GSH在DHAR作用下轉變為GSSG,GSSG在GR和NADPH作用下最終被還原為GSH[41],由此可知果實體內抗氧化酶在ROS的防御系統中具有非常重要的作用。本試驗中采后外源ABA處理激活了AsA-GSH循環,提高了塊莖周皮組織中APX、MDHAR、DHAR和GR的活性及增加了ASA、DHA、GSH和GSSG等相應的氧化還原底物的含量,參與了采后霧培微型馬鈴薯塊莖木栓化過程中ROS的產生和清除過程,使采后塊莖在周皮木栓化過程中的周皮組織中ROS水平處于動態平衡,能有效促進塊莖采后周皮形成且保障組織細胞不受傷害。在果蔬采后愈傷過程中或采后周皮木栓化過程中,由于活性氧代謝被激活使果蔬體內抗氧化酶的活性總體都顯著提高,但各種抗氧化酶互相之間的變化趨勢并不完全一致,這并不影響不同抗氧化酶參與果實體內ROS的調控。本研究發現外源ABA處理后,采后塊莖周皮組織中APX和CAT的活性隨著貯藏時間的延長總體呈上升狀態,雖然這兩種酶的變化趨勢與H2O2的變化趨勢并不完全相同,但是這兩種酶都參與了采后塊莖周皮木栓化過程中活性氧的清除。而這一變化與段園園等[42]研究采后外源ABA處理鎖陽莖切口木栓化及體內抗氧化酶活性變化的結果一致,推測采后霧培微型馬鈴薯塊莖周皮組織木栓化過程中,AsA-GSH循環防御系統的激活發揮了重要的作用。
4 結論
采后25 mg?L-1外源ABA處理能有效控制采后霧培微型馬鈴薯塊莖的失重,促進塊莖周皮組織處軟木脂和木質素的積累,并且激活了塊莖周皮組織處苯丙烷和活性氧代謝,提高了PAL、4CL、C4H和CAD酶活性;增加了總酚、類黃酮的含量,降低了霧培微型馬鈴薯塊莖采后周皮木栓化組織中細胞膜透率和MDA含量;激活了塊莖周皮組織處NOX活性,促進了H2O2和的合成,同時提高了SOD、POD和CAT的活性;激活了塊莖體內AsA-GSH循環,清除了周皮組織處過量的ROS,降低了膜脂過氧化,維持了細胞膜的完整性,促進了采后霧培微型馬鈴薯塊莖周皮組織木栓化的進程。
[1] 薦紅舉, 張梅花, 尚麗娜, 王季春, 胡柏耿, Vadim Khassanov, 呂典秋. 利用WGCNA篩選馬鈴薯塊莖發育候選基因. 作物學報, 2022, 48(7): 1658-1668.
JIAN H J, ZHANG M H, SHANG L N, WANG J C, HU B G, KHASSANOV V, Lü D Q. Screening candidate genes involved in potato tuber development using WGCNA. Acta Agronomica Sinica, 2022, 48(7): 1658-1668. (in Chinese)
[2] 陳巧玲, 程群, 高劍華, 徐怡, 葉興枝, 陳火云. 氣霧栽培在脫毒馬鈴薯生產應用中的研究進展. 湖北農業科學, 2019, 58(S2): 58-60.
CHEN Q L, CHENG Q, GAO J H, XU Y, YE X Z, CHEN H Y. Advances in research on aeroponics culture in the production of potato virus-free seed. Hubei Agricultural Sciences, 2019, 58(S2): 58-60. (in Chinese)
[3] 張德銀, 廖霏霏, 劉興貴, 劉曉, 周力. 脫毒馬鈴薯霧化生產研究進展. 現代農業科技, 2018(20): 60-61, 63.
ZHANG D Y, LIAO F F, LIU X G, LIU X, ZHOU L. Research progress on atomization production of virus-free potato. XianDai NongYe KeJi, 2018(20): 60-61, 63. (in Chinese)
[4] 劉悅善. 淺析原原種“霧培法”生產技術對甘肅省馬鈴薯種薯產業發展的影響. 種子科技, 2019, 37(16): 121-122.
LIU Y S. Analysis on the influence of the original seed “fog culture” production technology on the development of potato seed potato industry in Gansu Province. Seed Science & Technology, 2019, 37(16): 121-122. (in Chinese)
[5] LULAI E C. Skin-set wound healing, and related defects// Vreugdenhil D. Potato biology and biotechnology: Advances and perspectives. Amsterdam, The Netherlands: Elsevier Limited, 2007: 471-496.
[6] 包改紅, 畢陽, 李永才, 吳覺天, 寇宗紅, 葛永紅, 王毅, 王蒂. 不同愈傷時間對低溫貯藏期間馬鈴薯塊莖采后病害及品質的影響. 食品工業科技, 2013, 34(11): 330-334.
BAO G H, BI Y, LI Y C, WU J T, KOU Z H, GE Y H, WANG Y, WANG D. Effect of curing duration on incidence and quality of potato tuber during storage at low temperature. Science and Technology of Food Industry, 2013, 34(11): 330-334. (in Chinese)
[7] LI Y C, BI Y, GE Y H, SUN X J, WANG Y. Antifungal activity of sodium silicate onand its effect on dry rot of potato tubers. Journal of Food Science, 2009, 74(5): 213-218.
[8] 郭文雅, 趙京獻, 郭偉珍. 脫落酸(ABA)生物學作用研究進展. 中國農學通報, 2014, 30(21): 205-210.
GUO W Y, ZHAO J X, GUO W Z. Advance of research on biological function of abscisic acid (ABA). Chinese Agricultural Science Bulletin, 2014, 30(21): 205-210. (in Chinese)
[9] KUMAR G N M, LULAI E C, SUTTLE J C, KNOWLES N R. Age-induced loss of wound-healing ability in potato tubers is partly regulated by ABA. Planta, 2010, 232(6): 1433-1445.
[10] 李雪, 吳覺天, 王毅, 姜紅, 畢陽, 司敏, 張靜榮, 徐潔. 采后ABA處理促進‘隴薯3號’馬鈴薯塊莖愈傷形成. 中國農業科學, 2017, 50(20): 4003-4011. doi: 10.3864/j.issn.0578-1752.2017.20.014.
LI X, WU J T, WANG Y, JIANG H, BI Y, SI M, ZHANG J R, XU J. Postharvest ABA treatment promote wound healing of potato ‘Longshu No.3’ tubers. Scientia Agricultura Sinica, 2017, 50(20): 4003-4011. doi: 10.3864/j.issn.0578-1752.2017.20.014.(in Chinese)
[11] HAN X Y, MAO L C, WEI X P, LU W J. Stimulatory involvement of abscisic acid in wound suberization of postharvest kiwifruit. Scientia Horticulturae, 2017, 224:244-250.
[12] 陶曉亞, 李家寅, 韓雪源, 黃斯, 茅林春. 脫落酸對采后番茄愈傷次生代謝物質合成的影響. 食品工業科技, 2016, 37(16): 330-334.
TAO X Y, LI J Y, HAN X Y, HUANG S, MAO L C. Effect of abscisic acid on secondary metabolite production during wound-healing in postharvest tomato fruit. Science and Technology of Food Industry, 2016, 37(16): 330-334. (in Chinese)
[13] 張一冉, 王雅楠, 楊楊, 韓育梅. 脫落酸與水楊酸處理調節李果實抗冷性及氧化酶活性. 江蘇農業學報, 2020, 36(2): 471-476.
ZHANG Y R, WANG Y N, YANG Y, HAN Y M. Regulation of abscisic acid and salicylic acid treatments on chilling resist-ance and oxidase activity of plum fruit. Jiangsu Journal of Agricultural Sciences, 2020, 36(2): 471-476. (in Chinese)
[14] 張志鵬, 譚蕓秀, 李寶軍, 李永才, 畢陽, 李守強, 王小晶, 張宇, 胡丹. 采后不同溫度預貯對霧培微型馬鈴薯的愈傷效果及其機理. 食品科學, 2021, 43(21): 297-304.
ZHANG Z P, TAN Y X, LI B J, LI Y C, BI Y, LI S Q, WANG X J, ZHANG Y, HU D. Effect and possible mechanism of postharvest pre-storage temperature on wound healing of potato minitubers grown in aeroponic system. Food Science, 2021, 43(21): 297-304. (in Chinese)
[15] VAN OIRSCHOT Q E A, REES D, AKED J, KIHURANI A. Sweet potato cultivars differ in efficiency of wound healing. Postharvest Biology and Technology, 2006, 42(1): 65-74.
[16] JIANG H, WANG B, MA L, ZHENG X Y, GONG D, XUE H L, BI Y, WANG Y, ZHANG Z, PRUSKY D. Benzo-(1,2,3)-thiadiazole-7- carbothioic acid s-methyl ester (BTH) promotes tuber wound healing of potato by elevation of phenylpropanoid metabolism. Postharvest Biology and Technology, 2019, 153: 125-132.
[17] VOO K S, WHETTEN R W, O'MALLEY D M, SEDEROFF R R. 4-coumarate: coenzyme a ligase from loblolly pine xylem. Isolation, characterization, and complementary DNA cloning. Plant Physiology, 1995, 108(1): 85-97.
[18] LAMB C J, RUBERY P H. A spectrophotometric assay for trans- cinnamic acid 4-hydroxylase activity. Analytical Biochemistry, 1975, 68(2): 554-561.
[19] GOFFNER D, JOFFROY I, GRIMA-PETTENATI J, HALPIN C, KNIGHT M E, SCHUCH W, BOUDET A M. Purification and characterization of isoforms of cinnamyl alcohol dehydrogenase from. Planta, 1992, 188(1): 48-53.
[20] Ren Y L, Wang Y F, Bi Y, GE Y H, wang y, fan c f, li d q, DENG H W. Postharvest BTH treatment induced disease resistance and enhanced reactive oxygen species metabolism in muskmelon (L.) fruit. European Food Research and Technology, 2012, 234: 963-971.
[21] SOLIDAY C L, DEAN B B, KOLATTUKUDY P E. Suberization: inhibition by washing and stimulation by abscisic acid in potato disks and tissue culture. Plant Physiology, 1978, 61(2): 170-174. doi:10. 1104/pp.61.2.170.
[22] JIMéNEZ-AGUILAR D M, GRUSAK M A. Minerals, vitamin C, phenolics, flavonoids and antioxidant activity ofleafy vegetables. Journal of Food Composition & Analysis, 2017, 58: 33-39.
[23] REYES L F, CISNEROS-ZEVALLOS L. Wounding stress increases the phenolic content and antioxidant capacity of purple-flesh potatoes (L.). Journal of Agricultural and Food Chemistry, 2003, 51(18): 5296-5300.
[24] KOBAYASHI M, OHURA I, KAWAKITA K, YOKOTA N, FUJIWARA M, SHIMAMOTO K, DOKE N, YOSHIOKA H. Calcium-dependent protein kinases regulate the production of reactive oxygen species by potato NADPH oxidase. The Plant Cell, 2007, 19(3): 1065-1080.
[25] KOLATTUKUDY P E. Biochemistry and function of cutin and suberin. Canadian Journal of Botany, 2011, 62(12): 2918-2933.
[26] CHEN J X, MAO L C, MI H B, LU W J, YING T J, LUO Z S. Involvement of abscisic acid in postharvest water-deficit stress associated with the accumulation of anthocyanins in strawberry fruit. Postharvest Biology and Technology, 2016, 111: 99-105.
[27] BENVENISTE I, SALAUN J P, DURST F. Wounding-induced cinnamic acid hydroxylase in Jerusalem artichoke tuber. Phytochemistry, 1977, 16(1): 69-73.
[28] 趙淑娟, 劉滌, 胡之璧. 植物4-香豆酸:輔酶A連接酶. 植物生理學報, 2006, 42(3): 529-538.
ZHAO S J, LIU D, HU Z B. 4-Coumarate: coenzyme a ligase in plant. Chinese Journal of Plant Physiology, 2006, 42(3): 529-538. (in Chinese)
[29] 范存斐, 畢陽, 王云飛, 任亞琳, 楊志敏, 王毅. 水楊酸對厚皮甜瓜采后病害及苯丙烷代謝的影響. 中國農業科學, 2012, 45(3): 584-589. doi: 10.3864/j.issn.0578-1752.2012.03.022.
FAN C F, BI Y, WANG Y F, REN Y L, YANG Z M, WANG Y. Effect of salicylic acid dipping on postharvest diseases and phenylpropanoid pathway in muskmelon fruits. Scientia Agricultura Sinica, 2012, 45(3): 584-589. doi: 10.3864/j.issn.0578-1752.2012.03.022.(in Chinese)
[30] 張魯斌, 谷會, 弓德強, 常金梅. 植物肉桂醇脫氫酶及其基因研究進展. 西北植物學報, 2011, 31(1): 204-211.
ZHANG L B, GU H, GONG D Q, CHANG J M. Research progress of cinnamyl alcohol dehydrogenase and its gene. Acta Botanica Boreali-Occidentalia Sinica, 2011, 31(1): 204-211. (in Chinese)
[31] 劉尊英. 綠蘆筍(L.)木質化的生理生化基礎及其調控技術研究[D]. 北京: 中國農業大學, 2003.
LIU Z Y. Study on physiological and biochemical basis of lignification of asparagus (L.) and its regulation technology [D]. Beijing: China Agricultural University, 2003. (in Chinese)
[32] KIM Y H, BAE J M, HUH G H. Transcriptional regulation of the cinnamyl alcohol dehydrogenase gene from sweet potato in response to plant developmental stage and environmental stress. Plant Cell Reports, 2010, 29(7): 779-791.
[33] JIANG H, WANG Y, LI C J, WANG B, MA L, REN Y Y, BI Y, LI Y C, XUE H L, PRUSKY D. The effect of benzo-(1,2,3)-thiadiazole-7- carbothioic acid S-methyl ester (BTH) treatment on regulation of reactive oxygen species metabolism involved in wound healing of potato tubers during postharvest. Food Chemistry, 2020, 309: 125608.
[34] JAKUBOWSKA D, JANICKA M. The role of brassinosteroids in the regulation of the plasma membrane H(+)-ATPase and NADPH oxidase under cadmium stress. Plant Science: An International Journal of Experimental Plant Biology, 2017, 264: 37-47.
[35] WEI M L, GE Y H, LI C Y, HAN X, QIN S C, CHEN Y R, TANG Q, LI J R. G6PDH regulated NADPH production and reactive oxygen species metabolism to enhance disease resistance against blue mold in apple fruit by acibenzolar-S-methyl. Postharvest Biology and Technology, 2019, 148: 228-235.
[36] BERNARDS M A, SUSAG L M, BEDGAR D L, ANTEROLA A M, LEWIS N G. Induced phenylpropanoid metabolism during suberization and lignification: a comparative analysis. Journal of Plant Physiology, 2000, 157(6): 601-607.
[37] BAJJI M, M′HAMDI M, GASTINY F, DELAPLACE P, FAUCONNIER M L, DU JARDIN P. Catalase inhibition alters suberization and wound healing in potato () tubers. Physiologia Plantarum, 2007, 129(3): 472-483.
[38] WANG C, GAO Y, TAO Y, WU X Z, CUI Z B. Influence of-irradiation on the reactive-oxygen metabolism of blueberry fruit during cold storage. Innovative Food Science and Emerging Technologies, 2017, 41: 397-403.
[39] TIAN S, QIN G, LI B, WANG Q, MENG X H. Effects of salicylic acid on disease resistance and postharvest decay control of fruits. Stewart Postharvest Review, 2007, 3(6): 1-7.
[40] MA Y H, MA F W, ZHANG J K, LI M J, WANG Y H, LIANG D. Effects of high temperature on activities and gene expression of enzymes involved in ascorbate-glutathione cycle in apple leaves. Plant Science, 2008, 175(6): 761-766.
[41] GE Y H, DENG H W, BI Y, LI C Y, LIU Y Y, DONG B Y. Postharvest ASM dipping and DPI pre-treatment regulated reactive oxygen species metabolism in muskmelon (L.) fruit. Postharvest Biology and Technology, 2015, 99: 160-167.
[42] 段園園, 岳鑫, 陳貴林. 脫落酸對鎖陽莖切口愈合及抗氧化酶活性的影響. 植物生理學報, 2012, 48(3): 298-302.
DUAN Y Y, YUE X, CHEN G L. Effect of abscisic acid on wound healing and antioxidant enzyme activities ofstem. Plant Physiology Journal, 2012, 48(3): 298-302. (in Chinese)
Effects of Exogenous Abscisic Acid Treatment on Periderm Suberification of Postharvest Mini-Tuber Potato from Aeroponic System and Its Possible Mechanisms

1College of Food Science and Engineering, Gansu Agricultural University, Lanzhou 730070;2Institute of Agricultural Products Storage and Processing, Gansu Academy of Agricultural Sciences, Lanzhou 730070;3Gansu Seed Station, Lanzhou 730070
【Objective】The aim of this study was to evaluate the effect of exogenous abscisic acid treatment on periderm suberification of postharvest potato mini-tuber from aeroponic system, and to further explore its mechanism.【Method】The original seed potato mini-tubers of Tongshu No. 1, free of artificial damage, were pre-stored at 15℃ (RH86-88%) respectively in dark environment for wound healingafter dipping in exogenous abscisic acid (ABA) for 10 min. The weight loss rate of tuber during wound healing was measured, the accumulation of suberin and cork in pericardium cells was observed, and the phenylpropane and reactive oxygen metabolism in pericardium tissue of potato tuber were also analyzed.【Result】25 mg?L-1ABA treatment and prestorage at 15℃ significantly reduced weight loss rate of microtuber, accelerated the accumulation of suberin and corkification in perituber tissue.Further studies showed that the key enzyme activities ofphenylpropane metabolism and the content of total phenols, flavonoids and lignin of tuber tissues were significantly increased after ABA treatment, the enzyme activities of phenylalnine ammonia-lyase (PAL), 4-coumarate coenzyme A ligase (4CL), cinnamic acid 4-hydroxylase (C4H) and cinnamyl alcohol dehydrogenase (CAD) were significantly increased by 79.02%, 3.21%, 12.99% and 11.54%, respectively, compared with that of the control 21 days after storage. At the same time, ABA treatment decreased cell membrane permeability and malondialdehyde content, and increasedand H2O2content and enzyme activities of NADPH oxidase (NOX), super oxide dismutase (SOD), catalase (CAT) and peroxidase (POD), the enzyme activities of NOX, SOD, CAT and POD in treated tubers were increased by 47.33%, 8.61%, 27.27% and 14.50%, respectively, 21 days after storage.In addition, ABA treatment also activated antioxidant system AsA-GSH cycle and effectively maintained the intracellular redox balance. 【Conclusion】Postharvest ABA treatment could promote the accumulation of suberin and corkification in perituber tissue by activating the metabolism of phenylpropanoid and reactive oxygen species in periderm tissue, and accelerated the postharvest suberification process of aeroponic cultivated micro-potato tubers.
aeroponic mini-tubers potato; abscisic acid; suberification; phenylpropanoid metabolism;reactive oxygen metabolism

10.3864/j.issn.0578-1752.2023.06.011
2022-05-17;
2022-11-15
甘肅省重點研發計劃(GNKJ-2020-2)、甘肅省重大項目(21ZD4NA016)、國家自然科學基金(31860459)、財政部和農業農村部:國家現代農業產業技術體系資助(CARS-09-P26)
張志鵬,Tel:18298335807;E-mail:156467921@qq.com。通信作者李永才,Tel:13639341449;E-mail:lyc@gsau.edu.cn
(責任編輯 趙伶俐)

