硫酸阿米卡星多囊脂質體的制備及評價
張淼 鄧盛齊 張亦斌 鄭林 陶靜


摘要:目的 制備硫酸阿米卡星多囊脂質體(amikacin sulfate multivesicular liposomes, AMK-MVLs),對其進行質量評價,并考察了其體外抗菌活性。方法 采用復乳法制備AMK-MVLs混懸液Ⅰ,Box-Behnken效應面法優化篩選最佳處方,采用生理鹽水洗滌后調整藥物濃度得AMK-MVLs混懸液。采用光學顯微鏡、激光粒度儀、差示掃描量熱(differential scanning calorimeter,DSC)考察制劑的理化性質,采用透析法考察其體外釋放規律,通過微量稀釋法初步考察其體外抗菌活性。結果 優化得到AMK-MVLs混懸液Ⅰ的最佳處方為:大豆磷脂與膽固醇質量比為1.91:1,三油酸甘油酯用量為1.02%,PVA用量為0.62%。AMK-MVLs呈堆疊有無數囊泡的非同心球狀,AMK-MVLs混懸液包封率(87.12±1.55)%,平均粒徑為11.93 μm。DSC結果表明,AMK以無定型狀態存在于脂質體內。體外釋放結果顯示AMK-MVLs混懸液在72 h時釋藥約80%。體外溶血實驗表明,AMK-MVLs脂質體粒子濃度低于400 μg/mL時無溶血風險。體外抗菌實驗結果顯示,相較于AMK溶液,AMK-MVLs混懸液對E. coli、P.aeruginosa、S. aureus 3種細菌具有更好的抗菌效果。結論 成功制備了一種硫酸阿米卡星多囊脂質體,其粒徑分布均勻、包封率高,釋藥規律符合Higuchi動力學模型,具有增強的抗菌活性。
關鍵詞:硫酸阿米卡星;多囊脂質體;復乳法;Box-Behnken
中圖分類號:R978.1文獻標志碼:A
Abstract Objective To prepare amikacin sulfate multivesicular liposomes (AMK-MVLs), to evaluate their quality, and to investigate their antibacterial activity in vitro. Methods The AMK-MVLs suspension Ⅰ were prepared by the double-emulsion method. The response surface method of Box-Behnken Design was used to optimize the initial prescription. The AMK-MVLs suspension were obtained by adjusting the drug concentration after washing with saline. The morphology was characterized by optical microscopy and the particle size with its distribution was characterized by the laser granulometer. Differential scanning calorimeter (DSC) was used for phase analysis. The in vitro release behavior was determined by dialysis. Their antibacterial activity in vitro was examined using the microdilution method. Results The optimal formulation process for AMK-MVLs suspension I was as followed: The mass ratio of phospholipid to cholesterol was 1.91:1, the dosage of triolein was 1.02%, and the dosage of PVA was 0.62%. AMK-MVLs were non-concentric spheroids stacked with numerous vesicles. The encapsulation efficiency of AMK-MVLs suspension was 87.12%±1.55%. The average particle size of AMK-MVLs was 11.93 μm. DSC results indicated that the drug was dispersed in liposomes in an amorphous state. The in vitro drug release of AMK-MVLs suspension in 72 h was 80%. The hemolytic test showed that there was no risk of hemolysis when the concentration of AMK-MVLs particles was lower than 400 μg/mL. The in vitro antibacterial activities of AMK-MVLs suspension on E. coli, P. aeruginosa, and S. aureus were significantly stronger than those of the free AMK. Conclusion An amikacin sulfate multivesicular liposomes was successfully prepared with uniform particle size, good dispersibility, high encapsulation efficiency, sustained drug release behavior, and enhanced antibacterial activity.
Key words Amikacin sulfate; Multivesicular liposomes; Double-emulsion method; Box-Behnken
阿米卡星是kanamycin-A的半合成衍生物[1],具有免受氨基糖苷鈍化酶破壞的特殊結構,因此對革蘭陰性菌和許多對其他氨基糖苷類耐藥的菌株具有廣譜的抗菌活性[2-3]。其作用機制是通過與細菌胞內核糖體30S亞基的16S rRNA解碼區A位點緊密結合來抑制細菌蛋白質的合成[4],也可改變細菌細胞壁的通透性,使細胞內鹽類及營養物質外漏,導致細菌迅速死亡[5]。臨床多以肌注和靜滴為主,其注射液個體體內生物半衰期差異大、時間短[6],用量大,且存在劑量依賴性的耳腎和神經肌肉阻滯等毒副作用[7]。因此,延長AMK作用時間,減少用量,降低毒副作用是氨基糖苷類藥物新型制劑研發的方向。
多囊脂質體(multivesicular liposomes,MVLs)是一種內部包裹有大量水性囊狀腔室,彼此之間緊密堆積的泡沫球狀聚集體[8-9]。因此,其作為水溶性藥物的優良載體[10-11],包封率高且能夠有效延長藥物半衰期,減少用量,降低毒副作用。利用多囊脂質體包載阿米卡星是一種有效解決阿米卡星問題的方法。
本研究以AMK為模型藥物,采用復乳法制備了AMK-MVLs混懸液Ⅰ,優選天然磷脂作為成膜材料,硬脂胺和聚乙烯醇作為膜穩定劑,對其進行處方工藝的優化,進一步制備AMK-MVLs混懸液和AMK-MVLs凍干品,并對其理化性質表征,體外釋放研究以及體外抗菌活性進行考察。
1 材料與儀器
1.1 儀器
高效液相色譜儀(Agilent 1260);VOSHIN92-Ⅱ型超聲波細胞破碎儀(無錫沃信儀器有限公司);DF-101S型集熱式恒溫加熱磁力攪拌器(鄭州長城科工貿有限公司);092ZY619型pH酸度計(Mettler Toledo儀器有限公司);TGL-22S型臺式高速冷凍離心機(四川科蜀儀器有限公司);VORTEX3型渦旋混合儀(德國IKA公司);THZ-92A型氣浴恒溫振蕩器(博訊實業有限公司);LS909型激光粒度分析儀(歐美克);NIB 600型生物顯微鏡(寧波永新光學股份有限公司);DSC214型差示掃描量熱儀(德國耐馳公司);BPN-500H型細菌恒溫培養箱(上海一恒科學儀器有限公司);Bio Tek ELx808型酶標儀(美國博騰公司);LDZM-80KCS-II型立式壓力蒸汽滅菌鍋(上海申安醫療器械廠);SW-CJ-1D型單人凈化工作臺(滬凈凈化有限公司);CPA225D型十萬分之一電子分析天平(德國Sartorius公司);ME-204型萬分之一電子分析天平(Mettler Toledo儀器有限公司)。
1.2 藥品與試劑
硫酸阿米卡星(批號20180702)來源于四川抗菌素工業研究所,質量分數>98%;大豆磷脂(SPC-98A,純度98%)、膽固醇(批號B80859)購自上海艾偉拓醫藥科技有限公司;三油酸甘油酯(批號F20090911)購自國藥集團化學試劑有限公司;硬脂胺(批號E2026029)購自上海Aladdin公司;聚乙烯醇購自美國Sigma-Aldrich公司;金黃色葡萄球菌(S. aureus,CMCC26003)購自中國醫學細菌保藏管理中心;大腸埃希菌(E. coli)、銅綠假單胞菌(P. aeruginosa)購自廣東環凱微生物科技有限公司;LB、TSB培養基購自北京奧博星生物技術有限責任公司;瓊脂粉、生理鹽水、分析級葡萄糖、蔗糖、磷酸二氫鉀、磷酸、辛烷磺酸鈉、無水硫酸鈉、氫氧化鈉、氯仿購自成都科龍試劑有限公司;色譜級乙腈購自美國Thermo Fisher Scientific公司。
2 方法與結果
2.1 AMK-MVLs的制備
采用復乳法(W/O/W)[10-12]制備AMK-MVLs混懸液Ⅰ。稱取處方量的大豆磷脂、膽固醇、三油酸甘油酯、硬脂胺,加入3 mL氯仿,37℃~40℃恒溫水浴下加熱溶解,作為油相;將AMK溶解于等體積7%蔗糖水溶液中,作為內水相;用注射器吸取內水相緩慢注入持續攪拌的油相中,在冰水浴下,探頭超聲乳化分散,形成穩定的W/O型初乳;用帶細針頭的注射器吸取初乳1 mL快速注入5%葡萄糖和一定濃度PVA混合溶液(外水相)2.5 mL中,渦旋混合形成W/O/W型復乳,將復乳轉移至蒸發皿中,置于(37±2)℃水浴上同時液面通氮氣20 min,即得外觀呈淡乳白色的AMK-MVLs混懸液Ⅰ。
2.2 AMK含量測定方法的建立
2.2.1 色譜條件
色譜柱Spursil? -C18(4.6 mm×250 mm,5 μm),流速1.3 mL/min,柱溫40℃,檢測波長200 nm,進樣量10 μL,流動相:取辛烷磺酸鈉1.8 g和無水硫酸鈉20.0 g,加pH3.0的0.2 mol/L磷酸鹽緩沖液(0.2 mol/L磷酸二氫鉀溶液,用0.2 mol/L磷酸溶液調節pH值至3.0)50 mL和水875 mL溶解加乙腈75 mL混勻。
2.2.2 溶液的制備
對照儲備液:取AMK原料藥適量,精密稱定,加流動相溶解并定量稀釋制成約10 mg/mL的AMK對照儲備液;對照溶液:量取對照儲備液2.5 mL至10 mL容量瓶中,加流動相稀釋制成約2.5 mg/mL的AMK對照溶液,過濾備用;供試品溶液:精密量取0.5 mL AMK-MVLs混懸液至5 mL容量瓶中,加入2.5 mL 10% Triton X-100溶液,搖勻,超聲15 min,加流動相稀釋至刻度線,搖勻使藥物溶解,過濾即得;Blank MVLs溶液:精密量取0.5 mL Blank MVLs混懸液至5 mL容量瓶中,加入2.5 mL 10% Triton X-100溶液,搖勻,超聲15 min,加流動相稀釋至刻度線,搖勻后過濾即得。
2.2.3 專屬性考察
分別取“2.2.2”項下對照溶液,Blank MVLs溶液,供試品溶液,按照“2.2.1”項下色譜條件分別進樣測定。結果如圖1所示,Blank MVLs中破乳劑、磷脂、膽固醇等脂質材料對AMK的測定無干擾,表明該方法專屬性良好。
2.2.4 線性范圍和進樣精密度考察
精密移取AMK對照儲備液,用流動相稀釋,配制0.20、1.00、1.50、2.01、2.51和3.01 mg/mL系列濃度的溶液,按照“2.2.1”項下色譜條件分別進樣,以峰面積(A)和質量濃度(C)進行線性回歸,得回歸方程為A=1940.4C-3.6337,R?=0.9994(n=6),表明AMK在0.20~3.01 mg/mL濃度范圍內線性關系良好。取“2.2.2”項下對照溶液,按照“2.2.1”項下色譜條件連續重復進樣6次,AMK峰面積RSD值為1.19%,小于2%,表明進樣精密度良好。
2.2.5 重復性實驗
平行制備6份供試品溶液,分別進樣測定,AMK峰面積RSD值為1.60%,符合測定要求。
2.2.6 方法回收率實驗
精密量取0.5 mL Blank MVLs混懸液至5 mL容量瓶中,分別精密移取一定體積的對照儲備液,制成低、中和高3個不同質量濃度(2.00、2.50和3.00 mg/mL)的AMK溶液(n=3),加適量10% Triton X-100,流動相定容,按“2.2.1”項下色譜條件分別進樣測定。結果表明,平均回收率分別為101.01%、98.96%和100.20%,且回收率的RSD值均小于2%,表明該方法準確度良好。
2.2.7 包封率和載藥量的測定
采用低速離心法測定多囊脂質體的包封率和載藥量[13]。取2 mL AMK-MVLs混懸液至離心管內,在3000 r/min離心5 min,取上清液1 mL至5 mL容量瓶內,加入10% Triton X-100,搖勻,超聲15 min后加流動相定容,按“2.2.1”項下色譜條件進樣測定游離AMK含量,記為W游。取0.5 mL AMK-MVLs混懸液至5 mL容量瓶內,加入10% Triton X-100,搖勻,超聲破乳15 min后加流動相定容,按“2.2.1”項下色譜條件進樣測定AMK-MVLs的總藥量,記為W總,空白載體的質量記為W脂。計算公式如下:
包封率(EE%) = (W總-W游) /W總× 100%(1)
載藥量(DL%) = (W總- W游) / (W總-W游+W脂) × 100%(2)
2.3 AMK-MVLs混懸液Ⅰ處方優化
2.3.1 Box-Behnken Design優化處方
在單因素實驗的基礎上,優化AMK-MVLs混懸液Ⅰ處方,選取超聲功率300 W、時間6 min,選擇渦旋速度2300 r/min,時間50 s作為工藝條件,選擇對AMK-MVLs混懸液Ⅰ影響較大的3個因素,即大豆磷脂與膽固醇比例(A)、三油酸甘油酯用量(B)和PVA用量(C),通過Box-Behnken Design設計3因素3水平的優化實驗,具體因素水平見表1。根據實驗安排分別制備AMK-MVLs混懸液Ⅰ,以包封率(R1)、載藥量(R2)作為評價指標,篩選最優處方,實驗結果見表2。
2.3.2 模型擬合及方差分析
采用Design-Expert V8.0.6軟件對實驗結果進行多元線性回歸和二項式擬合,得擬合方程分別為R1=-94.78+45.15×A+32.30×B+314.40×C+13.22×AB-32.13×AC-18.39×BC-10.63×A2-23.08×B2-208.11×C2(R2=0.8703,P<0.05);R2=-50.64+14.79×A-8.52×B+267.37×C+12.94×AB-30.38×AC-18.65×BC-3.56×A2-4.43×B2-170.43×C2(R2=0.8267,P<0.05)。從擬合方程的R2和P值可知,二次多項式擬合較好,可用此模型對AMK-MVLs混懸液Ⅰ進行預測和分析。模型回歸方程系數的顯著性檢驗見表3,表明模型R1中PVA用量的一次項、二次項達到顯著水平(P<0.05),三油酸甘油酯用量的二次項達到顯著水平(P<0.05);模型R2中PVA用量的一次項、二次項達到顯著水平(P<0.05)。
2.3.3 響應面優化分析
采用Design-Expert V8.0.6軟件繪制3D效應面圖,由圖2效應面圖可知,包封率隨著大豆磷脂與膽固醇比例、三油酸甘油酯用量和PVA用量的增加先變大后變小;由圖3可知載藥量主要受PVA用量的影響,隨著用量的增加先增后減。各因素的預測優選處方值分別為:大豆磷脂:膽固醇=1.91:1、三油酸甘油酯用量為1.02%、PVA用量為0.62%,預測樣品包封率為53.29%,載藥量為29.11%。
2.3.4 處方驗證
根據最優處方制備3批AMK-MVLs混懸液Ⅰ樣品,對其包封率和載藥量進行測定,結果見表4。包封率和載藥量的實測值與預測值接近,說明模型擬合成功,結果可靠,可較好地用于AMK-MVLs的處方優化。
2.4 AMK-MVLs混懸液及凍干品的制備
取AMK-MVLs混懸液Ⅰ,與等體積生理鹽水攪拌混勻,離心(3000 r/min)5 min,收集沉淀部分,用生理鹽水洗滌沉淀3次并稀釋制得藥物濃度為9 mg/mL的AMK-MVLs混懸液。在AMK-MVLs混懸液中加入3%甘露醇作為凍干保護劑,攪拌溶解,各取2 mL AMK-MVLs混懸液分裝于西林瓶中,置于冷凍干燥機內,設置預凍時間為4 h,采用程序升溫法設置-45℃、-30℃、-10℃、0℃和20℃個溫度梯度,維持35 h,制得AMK-MVLs凍干品。
2.5 AMK-MVLs混懸液的質量評價
2.5.1 形態觀察和粒徑的測定
采用光學顯微鏡觀察AMK-MVLs的形態(40×10倍)。采用濕法測定法,以400 mL生理鹽水作為分散介質,通過攪拌使分散體系成穩定狀態,樣品量達到檢測器遮光度范圍的8%~20%,設置分析范圍為0.02 ~2100 μm,測定其平均粒徑及粒度分布,結果如圖4。由圖可見,AMK-MVLs外部圓潤光滑,無黏連,呈現典型的內部堆疊有無數囊泡的非同心球狀結構;平均粒徑為11.93 μm,粒徑分布均勻。
2.5.2 包封率的測定
取3批AMK-MVLs混懸液按“2.2.7”項下方法測定包封率,測得AMK-MVLs混懸液包封率分別為88.89%、86.09%和86.36%,按該處方制備的AMK-MVLs混懸液可獲得高的包封率且重現性好。
2.5.3 差示掃描量熱法分析
采用差示掃描量熱儀測定AMK與MVLs物理混合物及AMK-MVLs凍干品的熱行為。依次將待測樣品放置于相對應的鋁盤內,稱重記錄后,給以1 mL/min氮氣,以10℃/min的加熱速率從35℃升溫至400℃,進行DSC掃描分析。結果見圖5。由圖5可知,在物理混合物與AMK-MVLs凍干品圖譜中,200℃~250℃溫度范圍內對應的吸收峰值有不同,可能是由于AMK的晶體結構在脂質體的載藥和制備過程中已轉變為無定型狀態存在,這表明藥物在載體中被包埋。
2.5.4體外釋放研究
分別精密移取AMK-MVLs混懸液、AMK溶液(與AMK-MVLs混懸液藥物濃度等量)各3 mL于清洗干凈的透析袋(MW=14000)內,排盡透析袋內氣泡并將兩端扎緊,置于盛有10 mL pH 5.5和pH 7.4的磷酸鹽緩沖液的離心管中,將離心管放置于恒溫氣浴振蕩器中,在37℃條件下以50 r/min振蕩速率恒溫振蕩72 h。分別于0.5、1、2、4、10、20、24、48和72 h取樣2 mL并補加等溫同體積的新鮮釋放介質,樣品按照“2.2.1”項下色譜條件進樣測定其中AMK的含量,并計算藥物累積釋放百分率,繪制釋放曲線如圖6所示。
結果表明,AMK-MVLs混懸液在10 h釋放約35%,24 h釋放約55%,72 h釋放約80%,基本釋放完全,具有緩釋作用。在兩種釋放介質中表現出相似的釋放行為,無突釋效應。另累積釋藥曲線方程擬合結果顯示,AMK-MVLs混懸液在pH5.5和pH7.4兩種釋放介質中的釋藥規律均符合Higuchi動力學模型。
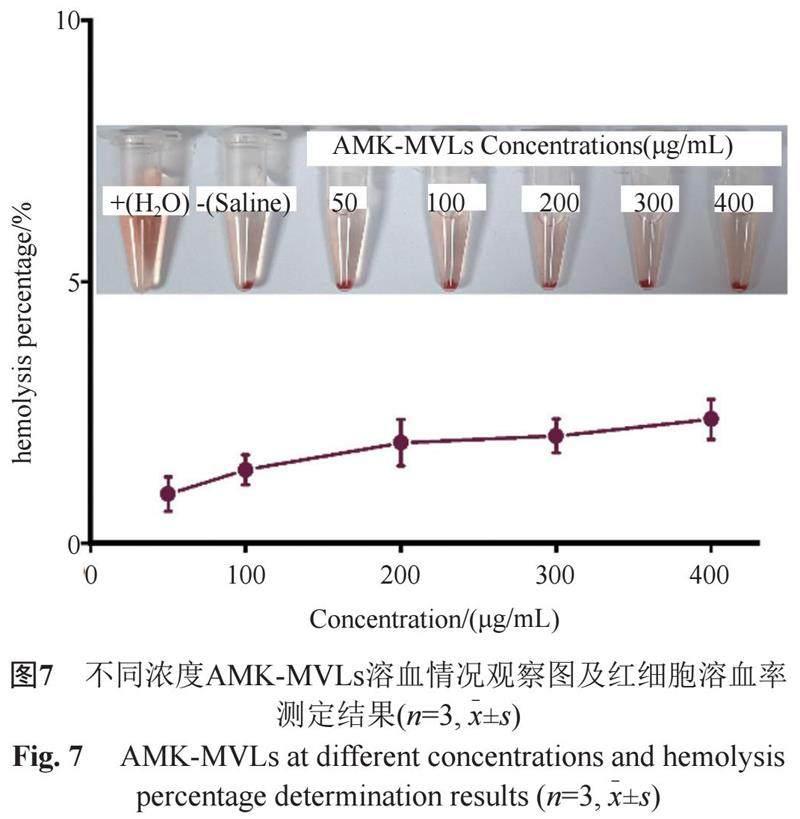
2.6 體外紅細胞溶血
采用體外紅細胞溶血實驗來考察脂質體材料的安全性[14]。稱取AMK-MVLs凍干粉5 mg于5 mL容量瓶中,用生理鹽水溶解并定容至刻度線,即得AMK-MVLs儲備液,用生理鹽水將儲備液依次稀釋為400、300、200、100和50 μg/mL。取500 μL上述多囊脂質體稀釋液分別加到500 μL 2.0% SD大鼠紅細胞懸液中,置于恒溫氣浴震蕩器(37±0.5)℃中孵育2 h后,2500 r/min條件下離心6 min,在紫外-可見分光光度計541 nm處測定各組離心后上清液的吸光度,其中陽性對照為超純水,陰性對照為生理鹽水,各組重復3次,并通過公式3計算AMK-MVLs的紅細胞溶血率(%)。
紅細胞溶血率(HR)%=(A藥物組-A陰性對照組)/(A陽性對照組-A陰性對照組)×100% (3)
由圖7可知,陽性對照組產生了全溶血現象,而陰性對照組與各藥物組未出現溶血及凝集現象。紅細胞溶血率數據結果表明,當AMK-MVLs脂質體粒子濃度達到400 μg/mL時,其紅細胞溶血率為2.4%,小于5%,該結果與肉眼觀察結果一致,表明AMK-MVLs是無溶血作用的。
2.7? ? AMK-MVLs的體外抗菌活性研究
配制LB、TSB液體培養基和固體培養基,對其進行滅菌處理后于4℃條件下儲存,并將已標好濃度的S. aureus、E. coli和P. aeruginosa 3種菌用無菌生理鹽水調整菌液濃度分別為3×106、3×108和2×108 CFU/mL。其中,LB作為S.aureus和E. coli的培養基,TSB作為P. aeruginosa的培養基。
2.7.1 細菌生長抑制率的測定
采用微量稀釋法測定藥物的細菌生長抑制率以研究其對細菌的生長抑制情況[15-16]。分別向96孔板中加入100 μL上述稀釋后的菌液,再將AMK溶液和AMK-MVLs混懸液分別用LB肉湯培養基和TSB培養基倍比稀釋后取100 μL分別加入各孔中。其中陰性對照組為培養基,空白對照組為對應濃度的Blank MVLs。將96孔板置于恒溫培養箱37℃下孵育24 h,使用酶標儀測定600 nm下的吸光度值(A600),通過公式4計算細菌生長抑制率。
細菌生長抑制率%=(A600陰性對照組-A600藥物組) / (A600陰性對照組)×100%(4)
由圖8可知,對于3種菌來說,在一定藥物濃度范圍內,AMK溶液和AMK-MVLs混懸液的細菌生長抑制率隨著藥物濃度的增加而增大,表明兩者抑菌作用均具有一定濃度依賴性,且AMK-MVLs混懸液在低濃度時,表現出更好的抑菌效果。
2.7.2 細菌生長抑制率-時間曲線
為研究AMK溶液和AMK-MVLs混懸液對3種細菌生長抑制作用隨時間變化情況,本實驗以加入培養基作為陰性對照組,Blank MVLs作為空白對照組,其中藥物組分別設置5個濃度梯度,給藥劑量和菌液濃度同“2.7.1”。分別于給藥后0、1、2、4、10、16和24 h時使用酶標儀檢測600 nm處的吸光度值(A600),最后以細菌生長抑制率-時間作圖即得。
由圖9可知,在達到一定藥物濃度時,隨著時間延長,AMK溶液的細菌生長抑制率逐漸趨于平穩,各濃度具有相似的時間曲線,而AMK-MVLs組在給藥后24 h內生長抑制率呈逐漸上升趨勢。
2.7.3 細菌鋪板
為了進一步證明AMK溶液和AMK-MVLs混懸液對3種菌的抗菌活性是有效的。將培養24 h的96孔板中S. aureus、P. aeruginosa和E. coli菌液用無菌生理鹽水稀釋100倍后分別吸取200 μL接種至瓊脂平板上,于37℃恒溫培養箱中倒置培養24 h,觀察不同處理情況下細菌的數量以及生長情況。
如圖10可以看出,與空白對照組和陰性對照組相比,AMK溶液和AMK-MVLs混懸液在一定的濃度范圍內,細菌在固體培養基上形成的菌落圖像具有一定趨勢。當達到一定濃度時,基本無法形成菌落。
3 討論
多囊脂質體具有生物相容性好[17],能夠在給藥部位形成藥物貯庫,延長藥物釋放時間,防止突釋現象發生等優勢[18],是一種具有良好發展前景的新型給藥系統。本文優選的成膜材料天然磷脂,與常用的合成磷脂比,生物相容性更好,相轉變溫度低,制備條件相對溫和。采用硬脂胺代替負電荷磷脂作為膜穩定劑,可以成功制備出多囊脂質體,同時降低成本。本文使用的多囊脂質體的制備方法操作簡便,可以得到粒徑分布均勻的多囊脂質體粒子。
本文采用Box-Behnken效應面法對影響AMK-MVLs混懸液Ⅰ制備過程中重要的處方因素進行優化,得到AMK-MVLs混懸液Ⅰ包封率為52.15%,載藥量為27.99%,純化后包封率為87.12%。
為考察AMK-MVLs混懸液的體外抗菌活性,本文首先以24 h細菌生長抑制率為指標,對比AMK溶液和AMK-MVLs混懸液對革蘭陽性菌金黃色葡萄球菌和革蘭陰性菌大腸埃希菌和銅綠假單胞菌生長的抑制作用,結果發現低濃度時AMK-MVLs混懸液表現出更好的抗菌效果,但并未有顯著的提高;接著考察了不同時間點,AMK溶液與AMK-MVLs混懸液的細菌生長抑制率,在給相同劑量藥物時,AMK-MVLs混懸液在24 h達到與AMK溶液相同的抗菌效果。結合釋放特性分析,24 h AMK-MVLs混懸液的累積釋放率約達50%,并未達到完全釋放,說明AMK-MVLs混懸液具有更好的抗菌活性。此外,結合溶血性實驗結果分析,AMK-MVLs混懸液在發揮有效抗菌活性范圍內是無溶血風險的。
參考文獻
Kawaguchi H, Naito T, Nakagawa S, et al. BB-K 8, a new semisynthetic aminoglycoside antibiotic[J]. J Antibiot, 1973, 25(12): 695-708.
Tripathi K D. Essentials of medical pharmacology[M]. Uttar Pradesh India: JP Medical Ltd., 2012.
Fatima S, Panda A K, Talegaonkar S, et al. Optimization and designing of amikacin-loaded poly D, L-Lactide-co-glycolide nanoparticles for effective and sustained drug delivery[J]. J Pharm Bioallied Sci, 2019, 11(1): 83-95.
Rosenberg C R, Fang X, Allison K R. Potentiating aminoglycoside antibiotics to reduce their toxic side effects[J]. PLoS One, 2020, 15(9): e0237948.
諸玲玲, 孟現民, 張永信. 氨基糖苷類藥物的發展歷程[J]. 上海醫藥, 2011, 32(7): 322-326.
Black F O, Gianna-Poulin C, Pesznecker S C. Recovery from vestibular ototoxicity[J]. Otol Neurotol, 2001, 22(5): 662-671.
Xie J, Talaska A E, Schacht J. New developments in aminoglycoside therapy and ototoxicity[J]. Hearing Res, 2011, 281(1-2): 28-37.
Kim S, Turker M S, Chi E Y, et al. Preparation of multivesicular liposomes[J]. BBA-Biomembranes, 1983, 728(3): 339-348.
李曉鋒. 多囊系統在藥物遞送中的研究進展[J]. 中國新藥雜志, 2019, 28(14): 1704-1712.
Li N, Shi A, Wang Q, et al. Multivesicular liposomes for the sustained release of angiotensin l-converting enzyme(ACE) inhibitory peptides from peanuts: Design, characterization, and in vitro evaluation[J]. Molecules, 2019, 24(9): 1746-1761.
Abuzar S M, Park E J, Seo Y, et al. Preparation and evaluation of intraperitoneal long-acting oxaliplatin-loaded multi-vesicular liposomal depot for colorectal cancer treatment[J]. Pharmaceutics, 2020, 12(8): 736-753.
李海剛, 徐佳敏, 徐康. 野黃芩苷內水相增稠多囊脂質體的制備及其穩定性的初步考察[J]. 中國醫藥工業雜志, 2018, 49(8): 1129-1135.
Roehrborn A A, Hansbrough J F, Gualdoni B, et al. Lipid-based slow-release formulation of amikacin sulfate reduces foreign body-associated infections in mice[J]. Antimicrob Agents Chemother, 1995, 39(8): 1752-1755.
Li S Y, Cheng H, Xie B R, et al. Cancer cell membrane camouflaged cascade bioreactor for cancer targeted starvation and photodynamic therapy[J]. ACS Nano, 2017, 11(7): 7006-7018.
楊謙. 光響應茶皂苷元衍生物陽離子脂質體的制備及其抗菌活性研究[D]. 廣州: 華南理工大學, 2018.
吳佳禾. 基于銀納米粒的酸響應型納米藥物的構建及其抗耐藥細菌感染的研究[D]. 浙江大學, 2020.
Mu H, Wang Y, Chu Y, et al. Multivesicular liposomes for sustained release of bevacizumab in treating laser-induced choroidal neovascularization[J]. Toxicol Lett, 2018, 294(1): 166-176.
Manna S, Wu Y, Wang Y, et al. Probing the mechanism of bupivacaine drug release from multivesicular liposomes[J]. J Control Release, 2019, 294(28): 279-287.
作者簡介:張淼,女,生于1996年,在讀碩士研究生,主要研究方向為藥物新劑型與新技術,E-mail: zhangmiao_223@163.com

