肝動脈灌注化療及其綜合治療方案對中晚期肝細(xì)胞癌患者的臨床療效及預(yù)后因素分析
戴文聰 臧夢雅 袁國盛 李祺 李榕 李文利 董書語 陳錦章
摘要:
目的 本研究旨在觀察FOLFOX方案持續(xù)肝動脈灌注化療(HAIC)及其綜合治療方案對中晚期肝細(xì)胞癌患者的臨床療效并分析影響預(yù)后的因素。方法 回顧性收集南方醫(yī)科大學(xué)南方醫(yī)院2018年9月—2021年11月行FOLFOX方案持續(xù)HAIC的66例中晚期肝細(xì)胞癌患者臨床資料。觀察治療后患者的客觀緩解率、疾病控制率、中位無疾病進(jìn)展生存時間(mPFS)和中位生存時間(mOS)并記錄治療相關(guān)不良反應(yīng)。針對伴有門靜脈癌栓的患者,評價治療對門靜脈癌栓的療效。采用Kaplan-Meier法進(jìn)行生存分析。采用Cox回歸分析影響預(yù)后的因素。結(jié)果 按照RECIST1.1標(biāo)準(zhǔn),F(xiàn)OLFOX-HAIC及其綜合治療方案治療66例中晚期肝細(xì)胞癌患者的客觀緩解率和疾病控制率分別為33.3%(22/66)、86.4%(57/66),mPFS和mOS分別為8.2個月和22.1個月。其中39例合并門靜脈癌栓的肝癌患者中完全緩解2例,部分緩解8例,穩(wěn)定24例,進(jìn)展5例。客觀緩解率為25.6%(10/39),疾病控制率為87.2%(34/39)。不良反應(yīng)主要為消化道反應(yīng)16.7%(11/66)、發(fā)熱12.1%(8/66)、肝區(qū)疼痛10.6%(7/66)、骨髓抑制3.0%(2/66)和造影劑過敏3.0%(2/66)。無Ⅳ級以上的毒副反應(yīng)。無并發(fā)癥導(dǎo)致的死亡。Cox分析顯示肝外轉(zhuǎn)移(HR=2.668,95%CI:1.357~5.245)和凝血酶原時間(HR=1.282,95%CI:1.080~1.630)是影響患者PFS的獨(dú)立危險因素(P值均<0.05), AST水平(HR=1.008,95%CI:1.002~1.013)和凝血酶原時間(HR=1.303,95%CI:1.046~1.630)是影響患者OS的獨(dú)立危險因素(P值均<0.05)。結(jié)論 FOLFOX-HAIC及其綜合治療方案治療中晚期肝細(xì)胞癌有一定的療效,不良反應(yīng)可控。
關(guān)鍵詞:癌, 肝細(xì)胞; 分子靶向治療; 預(yù)后
基金項(xiàng)目:
廣東省自然科學(xué)基金(2022A1515010526); 南方醫(yī)科大學(xué)南方醫(yī)院院長基金(2018C006)
Efficacy of hepatic arterial infusion chemotherapy and its multimodality therapeutic regimens in treatment of patients with advanced hepatocellular carcinoma and related prognostic factors
DAI Wencong1, ZANG Mengya1, YUAN Guosheng1, LI Qi1, LI Rong1, LI Wenli1, DONG Shuyu2, CHEN Jinzhang1. (1. Department of Infectious Diseases and Hepatology Unit, Nanfang Hospital, Southern Medical University, State Key Laboratory of Organ Failure Research, Guangdong Provincial Key Laboratory of Viral Hepatitis Research, Guangdong Provincial Institute of Liver Diseases, Guangzhou 510515, China; 2. The First Clinical Medical College, Southern Medical University, Guangzhou 510515, China)
Corresponding author:
CHEN Jinzhang, chenjinzhang@smu.edu.cn (ORCID:0000-0003-4964-2218)
Abstract:
Objective To investigate the efficacy of continuous hepatic arterial infusion chemotherapy (HAIC) with the FOLFOX regimen and its multimodality therapeutic regimen in the treatment of patients with advanced hepatocellular carcinoma, as well as the influencing factors for prognosis. Methods A retrospective analysis was performed for the clinical data of 66 patients with advanced hepatocellular carcinoma who received continuous HAIC with FOLFOX regimen in Nanfang Hospital, Southern Medical University, from September 2018 to November 2021. The patients were observed in terms of objective response rate (ORR), disease control rate (DCR), median progression-free survival (mPFS), and median overall survival (mOS) after treatment, and treatment-related adverse reactions were recorded. For the patients with portal vein tumor thrombus, the effect of the treatment on portal vein tumor thrombus was assessed. The Kaplan-Meier method was used for survival analysis, and the Cox regression analysis was used to investigate the influencing factors for prognosis. Results According to the RECIST1.1 criteria, FOLFOX-HAIC and its multimodality therapeutic regimen achieved an ORR of 33.3% (22/66) and a DCR of 86.4% (57/66) in the treatment of 66 patients with advanced hepatocellular carcinoma, with an mPFS time of 8.2 months and an mOS time of 22.1 months. Among the 39 patients with portal vein tumor thrombus, 2 achieved complete remission, 8 achieved partial remission, 24 achieved stable disease, and 5 had disease progression, with an ORR of 25.6% (10/39) and a DCR of 87.2% (34/39). The main adverse reactions included gastrointestinal reactions (16.7%, 11/66), pyrexia (12.1%, 8/66), liver area pain (10.6%, 7/66), bone marrow suppression (3.0%, 2/66), and contrast agent allergy (3.0%, 2/66), and there were no grade >Ⅳ toxic or side effects or deaths caused by such complications. The Cox regression analysis showed that extrahepatic metastasis (hazard ratio [HR]=2.668, 95% confidence interval [CI]: 1.357-5.245, P<0.05) and prothrombin time (PT) (HR=1.282, 95%CI: 1.080-1.630, P<0.05) were independent risk factors for PFS, and aspartate aminotransferase level (HR=1.008, 95%CI: 1.002-1.013, P<0.05) and PT (HR=1.303, 95%CI: 1.046-1.630, P<0.05) were independent risk factors for OS. Conclusion FOLFOX-HAIC and its multimodality therapeutic regimen has a certain clinical effect with controllable adverse reactions in the treatment of advanced hepatocellular carcinoma.
Key words:
Carcinoma, Hepatocellular; Molecular Targeted Therapy; Prognosis
Research funding:
Natural Science Foundation of Guangdong Province (2022A1515010526); President Foundation of Nanfang Hospital, Southern Medical University (2018C006)
原發(fā)性肝癌是全球第六大最常見的惡性腫瘤,病死率位列第四位,給家庭和社會帶來沉重負(fù)擔(dān)[1-2]。我國的肝癌發(fā)病率及病死率約占全球一半以上[3]。其中肝細(xì)胞癌(HCC)約占原發(fā)性肝癌的90%,患者確診時往往已達(dá)中晚期,常規(guī)治療手段中位生存時間不足10個月。因此,不斷探索并尋求中晚期肝癌的綜合治療方案是改善患者總體生存率的關(guān)鍵[4-5]。
目前國內(nèi)外指南中一致推薦索拉非尼和侖伐替尼作為晚期HCC的一線靶向治療藥物[6-7]。此外,在不可行手術(shù)切除、局部消融、經(jīng)肝動脈栓塞化療(transcatheter arterial chemoembolization, TACE),或已經(jīng)出現(xiàn)血管侵犯等的晚期HCC患者中,肝動脈灌注化療(hepatic artery infusion chemotherapy,HAIC)也是重要的治療方法之一[8-9]。在亞洲的大部分國家和地區(qū),HAIC已作為晚期HCC的標(biāo)準(zhǔn)治療方案之一納入了臨床診療指南中[10]。然而HAIC的化療方案眾多,目前尚未明確推薦最優(yōu)的化療方案。在日韓地區(qū),常使用的是以順鉑為基礎(chǔ)的化療方案[11-12]。在我國,以往常采用TACE聯(lián)合HAIC作為晚期HCC的輔助治療方式,不同地區(qū)不同中心的化療方案不盡相同,常用的化療藥物有:順鉑、洛鉑、奧沙利鉑、雷替曲塞、阿霉素、表阿霉素、絲裂霉素等[13]。
近年來,中國學(xué)者創(chuàng)新性地以奧沙利鉑為基礎(chǔ)的FOLFOX化療方案應(yīng)用于肝癌的HAIC中,已有的數(shù)據(jù)提示FOLFOX-HAIC可以顯著提高腫瘤的反應(yīng)率和患者生存率,得到了國內(nèi)越來越多臨床醫(yī)生的關(guān)注[14-16]。以FOLFOX-HAIC為核心的綜合治療方案,如FOLFOX-HAIC聯(lián)合靶向治療或免疫治療或三聯(lián)治療也成為目前熱點(diǎn)的研究方向。然而,F(xiàn)OLFOX-HAIC在國內(nèi)的普及應(yīng)用時間尚短,以FOLFOX-HAIC為核心的聯(lián)合治療方案還有待進(jìn)一步探索及優(yōu)化。本研究旨在分析FOLFOX-HAIC及其綜合治療方案治療中晚期HCC患者的臨床效果并進(jìn)一步分析影響患者預(yù)后的因素,為優(yōu)化其臨床應(yīng)用提供可靠的數(shù)據(jù)。
1 資料與方法
1.1 研究對象 回顧性分析2018年9月—2021年11月南方醫(yī)科大學(xué)南方醫(yī)院行FOLFOX方案HAIC及其綜合治療方案治療的中晚期肝癌患者臨床資料。原發(fā)性肝癌臨床診斷標(biāo)準(zhǔn)參照國家衛(wèi)生健康委發(fā)布的《原發(fā)性肝癌診療指南(2022版)》[17]。
納入標(biāo)準(zhǔn):(1)有完整的臨床及實(shí)驗(yàn)室檢查資料、影像資料以及隨訪資料;(2)美國東部腫瘤協(xié)作組(ECOG)體力狀況(PS)評分≤2分;(3)Child-Pugh A級或B級;(4)無化療禁忌證。
排除標(biāo)準(zhǔn):(1)首次治療伴有其他系統(tǒng)惡性腫瘤史者;(2)資料不全者;(3)只行1次HAIC治療者;(4)嚴(yán)重且不可糾正的凝血功能障礙;(5)肝功能嚴(yán)重失代償,合并難治性腹水、肝性腦病、消化道出血等;(6)惡病質(zhì)或多器官功能衰竭;(7)HAIC治療間隔時間超過4周。
1.2 治療方法 HAIC治療采用Seldinger技術(shù)穿刺股動脈。根據(jù)腫瘤的動脈供血情況,超選擇性地將導(dǎo)管置入到腫瘤的主要供血動脈。導(dǎo)管放置完畢后,外露部分用無菌紗布覆蓋。患者臥床接受持續(xù)的化療藥物動脈灌注,嚴(yán)格按照化療方案的劑量和時間注入化療藥物,全部輸注完畢后再拔出導(dǎo)管。FOLFOX-HAIC化療方案具體為:奧沙利鉑 85 mg/m2 動脈滴注2~3 h,亞葉酸鈣 400 mg/m2動脈滴注1~2 h,5-氟尿嘧啶 400 mg/m2 動脈團(tuán)注后再以2 400 mg/m2持續(xù)動脈灌注46 h。HAIC術(shù)后給予護(hù)胃、止吐、保肝、補(bǔ)液等治療,必要時給予止痛治療,觀察并記錄術(shù)后不良反應(yīng)。術(shù)后3 d復(fù)查肝腎功能及血常規(guī)。靶向治療藥物包括:索拉非尼、侖伐替尼、阿帕替尼、瑞戈非尼;免疫治療藥物包括:信迪利單抗、卡瑞利珠單抗、特瑞普利單抗、替雷利珠單抗和帕博利珠單抗。
1.3 療效評價 每2個周期HAIC后復(fù)查上腹部增強(qiáng)CT或增強(qiáng)MRI評價病灶情況,采用RECIST1.1標(biāo)準(zhǔn)進(jìn)行實(shí)體瘤療效評價。完全緩解(CR):腫瘤完全消失;部分緩解(PR):腫瘤最大徑之和縮小≥30%,并至少維持4周;穩(wěn)定(SD):腫瘤最大徑之和縮小未達(dá)到PR,或增大未達(dá)PD;進(jìn)展(PD):最大徑增大≥20%或出現(xiàn)新病灶。客觀緩解率(ORR)=CR+PR,疾病控制率(DCR)=CR+PR+SD。長期生存時間(overall survival, OS):開始對腫瘤進(jìn)行HAIC治療至死亡或末次隨訪時間差值。無疾病進(jìn)展生存時間(progression-free survival, PFS):開始對腫瘤進(jìn)行HAIC治療到腫瘤進(jìn)展的時間。不良反應(yīng)參照世界衛(wèi)生組織抗腫瘤藥物劑急性或亞急性毒性反應(yīng)分度評價標(biāo)準(zhǔn)。
1.4 統(tǒng)計學(xué)方法 采用SPSS 20.0軟件進(jìn)行統(tǒng)計學(xué)分析。符合正態(tài)分布的計量資料采用x±s表示,不符合正態(tài)分布的采用M(P25~P75)表示。計數(shù)資料患者比例采用例(%)形式表示;Kaplan-Meier曲線分析生存率。單因素和多因素回歸分析采用Cox回歸分析,單因素分析P<0.1的指標(biāo)納入多因素分析。
P<0.05為差異有統(tǒng)計學(xué)意義。
2 結(jié)果
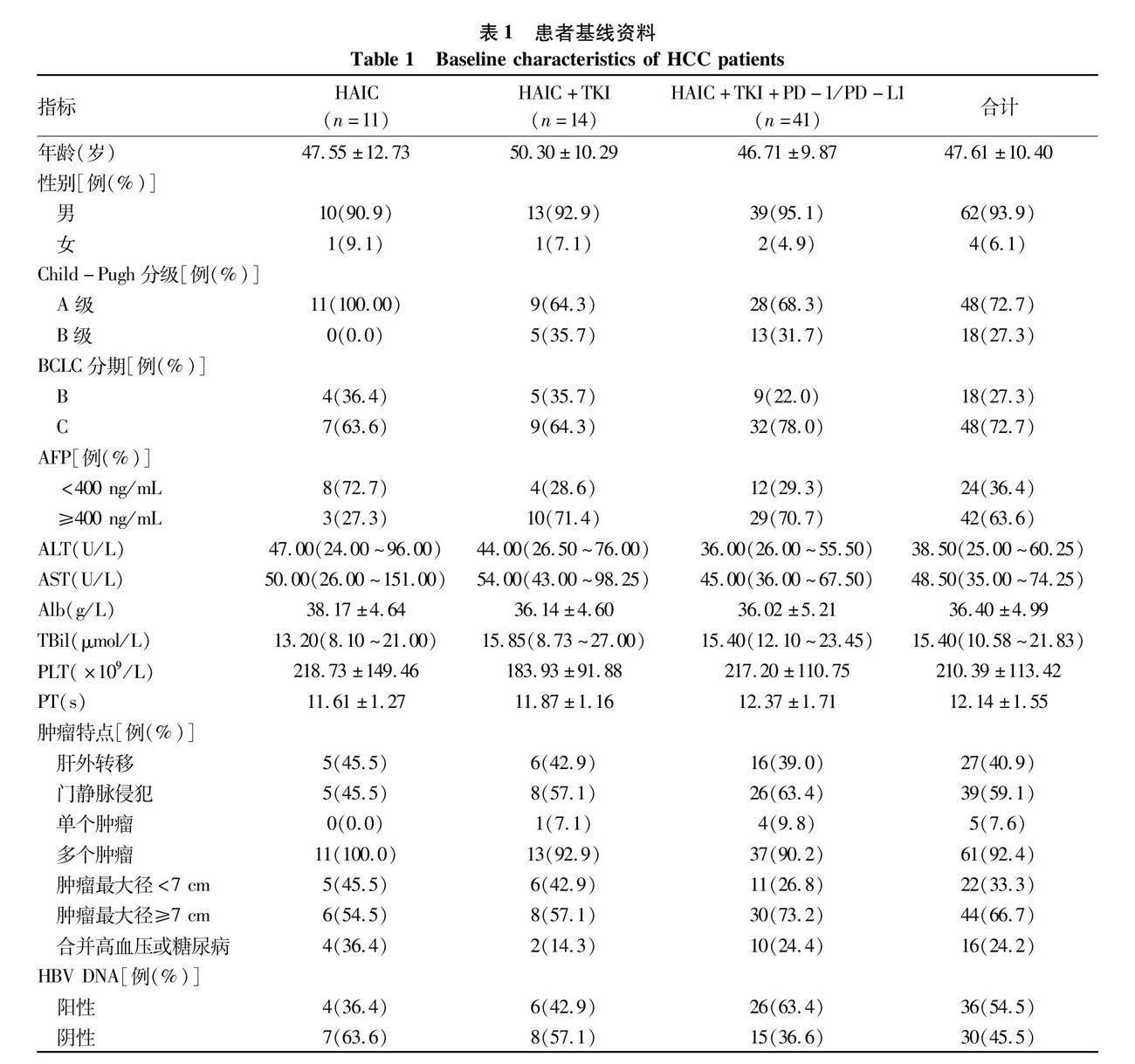
2.1 患者基線資料 共納入66例中晚期HCC患者,其中單獨(dú)行HAIC治療11例,HAIC聯(lián)合靶向治療(HAIC+TKI)14例,HAIC聯(lián)合靶向同時聯(lián)合免疫治療[HAIC+酪氨酸激酶抑制劑(TKI)+程序性死亡受體1及其配體(PD-1/PD-L1)]41例。平均年齡(47.61±10.40)歲,其中男62例(93.9%),BCLC分期C期48例(72.7%),肝功能Child-Pugh分級A級48例(72.7%),AFP≥400 ng/mL的42例(63.6%),HBV DNA陽性36例(54.5%)。腫瘤最大徑≥7 cm的44例(66.7%),合并門靜脈侵犯39例(59.1%),合并肝外轉(zhuǎn)移27例(40.9%),多發(fā)腫瘤61例(92.4%)(表1)。
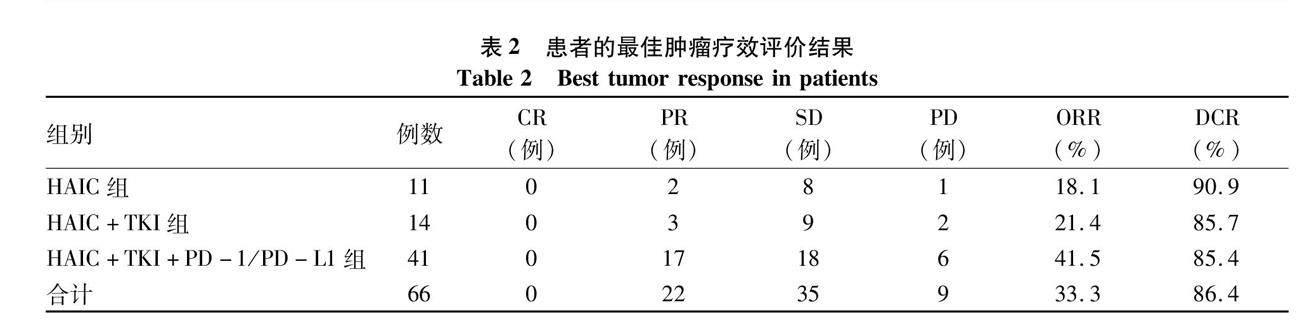
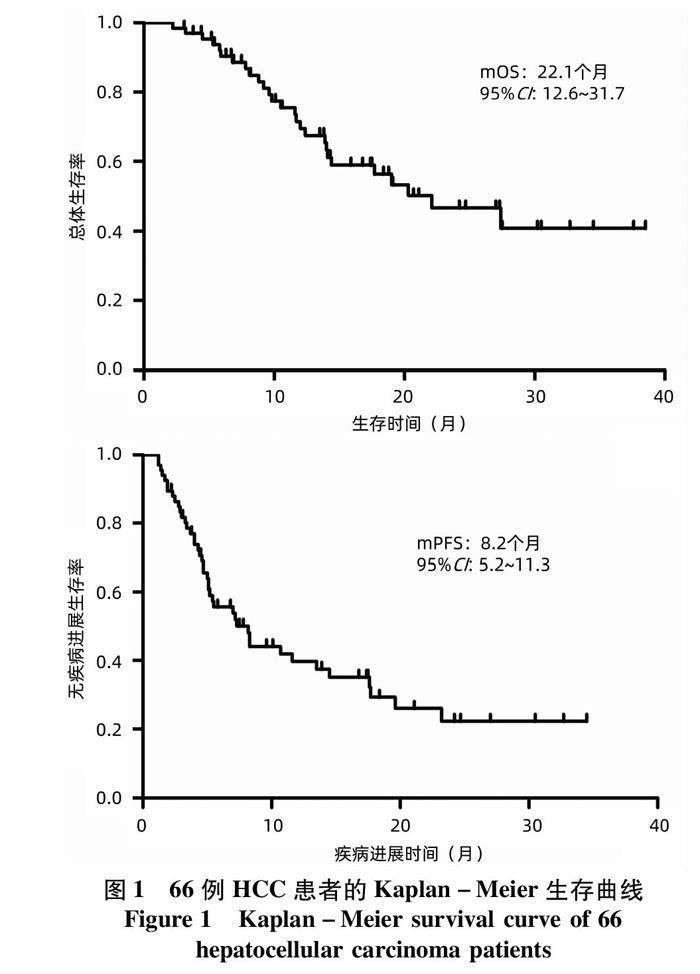
2.2 療效評價 納入的66例中晚期HCC患者的HAIC次數(shù)為2~6次,中位HAIC次數(shù)為3.7次。按照RECIST1.1標(biāo)準(zhǔn),從HAIC治療開始到HAIC治療結(jié)束后1個月內(nèi)腫瘤療效評價的最佳結(jié)果進(jìn)行分析,顯示66例患者的ORR和DCR分別為33.3%(22/66)、86.4%(57/66)。其中單獨(dú)HAIC組ORR和DCR分別為18.1%(2/11)和90.9%(10/11),HAIC+TKI組ORR和DCR分別為21.4%(3/14)和85.7%(12/14),HAIC+TKI+PD-1/PD-L1組ORR和DCR分別為41.5%(17/41)和85.4%(35/41)(表2)。66例中晚期HCC患者的中位無疾病進(jìn)展生存時間(mPFS)和中位生存時間(mOS)分別為8.2個月和22.1個月(圖1)。此外,針對合并門靜脈癌栓的這部分患者進(jìn)一步分析了治療對門靜脈癌栓的影響,按照RECIST1.1標(biāo)準(zhǔn),結(jié)果顯示39例合并門靜脈癌栓的肝癌患者中CR 2例,PR 8例,SD 24例,PD 5例。ORR為25.6%(10/39),DCR為87.2%(34/39)(圖2)。
2.3 不良反應(yīng) 在所有患者中,主要不良反應(yīng)為消化道反應(yīng)16.7%(11/66)、發(fā)熱12.1%(8/66)、肝區(qū)疼痛10.6%(7/66)、骨髓抑制3%(2/66)和造影劑過敏3%(2/66)。無Ⅳ級以上的毒副反應(yīng)。無并發(fā)癥導(dǎo)致的死亡。
2.4 影響患者PFS的可能因素 單因素分析結(jié)果顯示,肝外轉(zhuǎn)移(HR=2.907,95%CI:1.536~5.500,P=0.001)、HBV DNA陽性(HR=2.151,95%CI:1.126~4.110,P=0.020)和凝血酶原時間(PT)(HR=1.254,95%CI:1.024~1.535,P=0.028)與患者的PFS有關(guān)。將上述危險因素引入Cox比例風(fēng)險回歸模型,分析結(jié)果顯示肝外轉(zhuǎn)移和PT是影響患者PFS的獨(dú)立危險因素(P值均<0.05)(表3)。
2.5 影響患者OS的可能因素 單因素分析結(jié)果顯示,年齡(HR=0.964,95%CI:0.931~0.999,P=0.042)、AST水平(HR=1.007,95%CI:1.002~1.013,P=0.007)和PT(HR=1.276,95%CI:1.036~1.572,P=0.022)可能是患者OS的影響因素。將上述危險因素引入Cox比例風(fēng)險回歸模型,分析結(jié)果顯示AST水平和PT是影響患者OS的獨(dú)立危險因素(P值均<0.05)(表4)。
3 討論
HCC是我國最常見的惡性腫瘤之一[18],其發(fā)病率高且預(yù)后較差。肝移植、外科手術(shù)切除及局部消融治療是根治早期肝癌的重要手段[19],然而在我國大多數(shù)患者確診時已是中晚期,失去了根治性治療的最佳時機(jī),無干預(yù)情況下mOS僅為半年。目前,國內(nèi)外指南大多數(shù)推薦使用索拉非尼及侖伐替尼作為晚期HCC的一線標(biāo)準(zhǔn)治療方案[17,20]。此外,日本指南[10]推薦將順鉑為主的HAIC作為晚期HCC的標(biāo)準(zhǔn)治療方案之一。2021年,中國抗癌協(xié)會肝癌專業(yè)委員會也發(fā)布了HAIC治療HCC的中國專家共識[21]。共識中指出以FOLFOX方案為核心的HAIC是一種安全且有效的晚期HCC治療方法,其對機(jī)體的創(chuàng)傷較小、傷口愈合快、不良反應(yīng)率低且住院時間短,與TACE相比,HAIC發(fā)生栓塞后綜合征的概率顯著降低[22]。
HAIC是利用腫瘤血供95%來源于肝動脈的特點(diǎn),通過皮下置入動脈泵或者直接經(jīng)導(dǎo)管給藥的方法,將化療藥物經(jīng)肝動脈送達(dá)腫瘤區(qū)域,使得腫瘤內(nèi)部的藥物濃度提高,從而降低了化療藥物的全身毒副作用,可以顯著地提高腫瘤反應(yīng)率和患者生存率。2019年,中山大學(xué)附屬腫瘤防治中心團(tuán)隊(duì)研究[23]發(fā)現(xiàn)FOLFOX-HAIC聯(lián)合索拉非尼治療晚期肝癌相較于單純的索拉非尼靶向治療,在mOS(13.37個月vs 7.13個月)、mPFS(7.03個月vs 2.60個月)、ORR(40.8% vs 2.5%)等方面都有顯著優(yōu)勢。此外有報道[11-12]指出,晚期HCC患者接受HAIC治療可獲得7.6~17.6個月的mOS。Mei等[24]研究發(fā)現(xiàn)在HAIC基礎(chǔ)上聯(lián)合免疫治療可以進(jìn)一步提升HAIC效果,mOS從14.6個月提高到18個月,mPFS從5.6個月提升到10個月,DCR從66%提高至83%。此外,HAIC聯(lián)合靶向及免疫治療的三聯(lián)方案也展現(xiàn)出良好的療效和安全性。有研究[25]結(jié)果顯示,HAIC聯(lián)合侖伐替尼及免疫治療的三聯(lián)方案較單用侖伐替尼獲得了更長的mPFS(11.1個月vs 5.1個月)和mOS(未到達(dá)vs 11.1個月),更高的ORR(59.2% vs 9.3%)和DCR(90.1% vs 72.1%)。在本研究中,納入的66例中晚期HCC患者接受了FOFLOX-HAIC及以其為基礎(chǔ)的綜合治療方案,mPFS和mOS為8.2個月和22.1個月,這與既往的研究結(jié)果較為接近。此外,盡管有樣本例數(shù)的限制,仍然觀察到了HAIC聯(lián)合靶向及免疫治療三聯(lián)方案較HAIC聯(lián)合靶向治療、單純HAIC治療有著更高的ORR(41.5% vs 21.4% vs 18.1%),這與既往的研究結(jié)論也是比較一致的[24-25]。但是在DCR方面,本研究未觀察到HAIC聯(lián)合靶向及免疫治療三聯(lián)方案較其他兩組有著更高的DCR(85.4% vs 85.7% vs 90.9%)。
值得一提的是,在本研究中,伴有門靜脈癌栓的患者比例達(dá)到59.1%。本研究進(jìn)一步觀察了治療對門靜脈癌栓的影響,結(jié)果顯示,39例合并門靜脈癌栓的肝癌患者中CR 2例,PR 8例,SD 24例,PD 5例。ORR為25.6%(10/39),DCR為87.2%(34/39)。既往有研究也提示HAIC對原發(fā)性肝癌患者的門靜脈癌栓有一定療效。在50例確診原發(fā)性肝癌合并門靜脈癌栓并接受FOLFOX-HAIC治療的患者中,70%的患者門靜脈癌栓較治療前有所改善[26]。柯映平等[27]通過臨床觀察發(fā)現(xiàn)TACE聯(lián)合FOFLOX-HAIC治療對比TACE治療,在門靜脈癌栓DCR方面顯示出更好的療效(80% vs 54%)。此外,在分析影響患者預(yù)后因素方面,本研究發(fā)現(xiàn)肝外轉(zhuǎn)移是影響患者PFS的獨(dú)立危險因素之一。這在某種程度上提示,HAIC作為一種局部灌注的治療方法可以較好地控制肝內(nèi)病變,但其對于合并肝外轉(zhuǎn)移患者的控制時間相對有限。此外,本研究發(fā)現(xiàn)AST水平而非ALT水平是影響患者OS的獨(dú)立危險因素之一,這與Mei等[24]的研究結(jié)果一致。但是具體的機(jī)制還有待進(jìn)一步探討。
本研究是回顧性單中心研究,且樣本例數(shù)有限。再者,由于回顧性研究的局限性,后續(xù)治療不受控制,治療方案在某種程度上對生存率有影響。盡管尚存在不足,但FOFLOX-HAIC及其綜合治療方案療效是肯定的且不良反應(yīng)可控,對于合并門靜脈癌栓的患者也有良好的效果。期待未來有更多前瞻性多中心研究不斷優(yōu)化治療策略及探索治療優(yōu)勢人群。
倫理學(xué)聲明:本研究方案于2020年7月9日經(jīng)由南方醫(yī)科大學(xué)南方醫(yī)院倫理委員會審批,批號:NFEC-2020-130。所有患者均知情并簽署知情同意書。
利益沖突聲明:本文不存在任何利益沖突。
作者貢獻(xiàn)聲明:戴文聰、臧夢雅負(fù)責(zé)分析數(shù)據(jù),撰寫論文;袁國盛、李祺、李榕、李文利、董書語負(fù)責(zé)查閱資料,修改稿件;陳錦章負(fù)責(zé)選題,指導(dǎo)撰稿及修改并最后定稿。
參考文獻(xiàn):
[1]
Global Burden of Disease Liver Cancer Collaboration, AKINYEMIJU T, ABERA S, et al. The burden of primary liver cancer and underlying etiologies from 1990 to 2015 at the global, regional, and national level: Results from the global burden of disease study 2015[J]. JAMA Oncol, 2017, 3(12): 1683-1691. DOI: 10.1001/jamaoncol.2017.3055.
[2]BRAY F, FERLAY J, SOERJOMATARAM I, et al. Global cancer statistics 2018: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J]. CA Cancer J Clin, 2018, 68(6): 394-424. DOI: 10.3322/caac.21492.
[3]ZHENG R, ZENG H, ZHANG S, et al. Estimates of cancer incidence and mortality in China, 2013[J]. Chin J Cancer, 2017, 36(1): 66. DOI: 10.1186/s40880-017-0234-3.
[4]WU T, CHEN L. New advances in the precision diagnosis and treatment of liver cancer[J]. J Clin Hepatol, 2022, 38(3): 497-498. DOI: 10.3969/j.issn.1001-5256.2022.03.001.
吳彤, 陳磊. 肝癌精準(zhǔn)診療新進(jìn)展[J]. 臨床肝膽病雜志, 2022, 38(3): 497-498. DOI: 10.3969/j.issn.1001-5256.2022.03.001.
[5]LI Z, ZHU JY. Interpretation of Standard for diagnosis and treatment of primary liver cancer (2022 edition) [J]. J Clin Hepatol, 2022, 38(5): 1027-1029. DOI: 10.3969/j.issn.1001-5256.2022.05.010.
李照, 朱繼業(yè). 《原發(fā)性肝癌診療指南(2022年版)》解讀[J]. 臨床肝膽病雜志, 2022, 38(5): 1027-1029. DOI: 10.3969/j.issn.1001-5256.2022.05.010.
[6]CHENG AL, KANG YK, CHEN Z, et al. Efficacy and safety of sorafenib in patients in the Asia-Pacific region with advanced hepatocellular carcinoma: a phase III randomised, double-blind, placebo-controlled trial[J]. Lancet Oncol, 2009, 10(1): 25-34. DOI: 10.1016/S1470-2045(08)70285-7.
[7]KUDO M, FINN RS, QIN S, et al. Lenvatinib versus sorafenib in first-line treatment of patients with unresectable hepatocellular carcinoma: a randomised phase 3 non-inferiority trial[J]. Lancet, 2018, 391(10126): 1163-1173. DOI: 10.1016/S0140-6736(18)30207-1.
[8]LYU N, KONG Y, PAN T, et al. Hepatic arterial infusion of oxaliplatin, fluorouracil, and leucovorin in hepatocellular cancer with extrahepatic spread[J]. J Vasc Interv Radiol, 2019, 30(3): 349-357.e2. DOI: 10.1016/j.jvir.2018.09.004.
[9]HE MK, LIANG RB, ZHAO Y, et al. Lenvatinib, toripalimab, plus hepatic arterial infusion chemotherapy versus lenvatinib alone for advanced hepatocellular carcinoma[J]. Ther Adv Med Oncol, 2021, 13: 17588359211002720. DOI: 10.1177/17588359211002720.
[10]KOKUDO N, HASEGAWA K, AKAHANE M, et al. Evidence-based clinical practice guidelines for hepatocellular carcinoma: The Japan Society of Hepatology 2013 update (3rd JSH-HCC Guidelines)[J]. Hepatol Res, 2015, 45(2). DOI: 10.1111/hepr.12464.
[11]IKEDA M, OKUSAKA T, FURUSE J, et al. A multi-institutional phase II trial of hepatic arterial infusion chemotherapy with cisplatin for advanced hepatocellular carcinoma with portal vein tumor thrombosis[J]. Cancer Chemother Pharmacol, 2013, 72(2): 463-470. DOI: 10.1007/s00280-013-2222-x.
[12]NOUSO K, MIYAHARA K, UCHIDA D, et al. Effect of hepatic arterial infusion chemotherapy of 5-fluorouracil and cisplatin for advanced hepatocellular carcinoma in the Nationwide Survey of Primary Liver Cancer in Japan[J]. Br J Cancer, 2013, 109(7): 1904-1907. DOI: 10.1038/bjc.2013.542.
[13]Tumor Interventional Expert Committee of Chinese Anti-Cancer Association. Chinese tumor intervention expert consensus on the application principles of transcatheter arterial infusion chemotherapy[J]. J Intervent Radiol, 2017, 26(11): 963-970. DOI: 10.3969/j.issn.1008-794X.2017.11.001.
中國抗癌協(xié)會腫瘤介入專家委員會. 經(jīng)導(dǎo)管動脈灌注化療藥物應(yīng)用原則——中國腫瘤介入專家共識[J]. 介入放射學(xué)雜志, 2017, 26(11): 963-970. DOI: 10.3969/j.issn.1008-794X.2017.11.001.
[14]ZHAO M. Hepatic arterial infusion Chemotherapy in the Era of Precise[J].? J Sun Yat-Sen Univ(Medical Sciences), 2019, 40(5): 648-656. DOI: 1672-3554(2019)05-0648-09.
趙明. 精準(zhǔn)醫(yī)療時代背景下的肝動脈灌注化療[J]. 中山大學(xué)學(xué)報(醫(yī)學(xué)科學(xué)版), 2019, 40(5): 648-656. DOI: 1672-3554(2019)05-0648-09.
[15]LI QJ, HE MK, CHEN HW, et al. Hepatic arterial infusion of oxaliplatin, fluorouracil, and leucovorin versus transarterial chemoembolization for large hepatocellular carcinoma: A Randomized Phase III Trial[J]. J Clin Oncol, 2022, 40(2): 150-160. DOI: 10.1200/JCO.21.00608.
[16]SIDAWAY P. FOLFOX-HAIC active in large HCC[J]. Nat Rev Clin Oncol, 2022, 19(1): 5. DOI: 10.1038/s41571-021-00577-y.
[17]General Office of National Health Commission. Standard for diagnosis and treatment of primary liver cancer (2022 edition)[J]. J Clin Hepatol, 2022, 38(2): 288-303. DOI:? 10.3969/j.issn.1001-5256.2022.02.009.
國家衛(wèi)生健康委辦公廳. 原發(fā)性肝癌診療指南(2022年版)[J]. 臨床肝膽病雜志, 2022, 38(2): 288-303. DOI:? 10.3969/j.issn.1001-5256.2022.02.009.
[18]Chinese College of Transplant Doctors, Liver Transplantation Group, Chinese Society of Organ Transplantation, Chinese Medical Association. Chinese clinical practice guidelines on liver transplantation for hepatocellular carcinoma (2021edition)[J]. Chin J Dig Surg, 2022, 21(4): 433-443. DOI: 10.3760/cma.j.cn115610-20220316-00135.
中國醫(yī)師協(xié)會器官移植醫(yī)師分會, 中華醫(yī)學(xué)會器官移植學(xué)分會肝移植學(xué)組. 中國肝癌肝移植臨床實(shí)踐指南(2021版)[J]. 中華消化外科雜志, 2022, 21(4): 433-443. DOI: 10.3760/cma.j.cn115610-20220316-00135.
[19]LIU YY. New progress of hepatocellular carcinoma treatment[J]. Chin J Dig Surg, 2022, 21(1): 15-18. DOI: 10.3760/cma.j.cn115610-20220107-00020.
劉允怡. 肝細(xì)胞癌治療的新發(fā)展[J]. 中華消化外科雜志, 2022, 21(1): 15-18. DOI: 10.3760/cma.j.cn115610-20220107-00020.
[20]European Association for the Study of the Liver. EASL clinical practice guidelines: Management of hepatocellular carcinoma[J]. J Hepatol, 2018, 69(1): 182-236. DOI: 10.1016/j.jhep.2018.03.019.
[21]Liver Cancer Professional Committee of Chinese Anti-Cancer Association. Chinese expert consensus on hepatic arterial infusion chemotherapy for hepatocellular carcinoma (2021 edition) [J]. J Chin J Dig Surg, 2021, 20(7): 754-759. DOI: 10.3760/cma.j.cn115610-20210618-00288.
中國抗癌協(xié)會肝癌專業(yè)委員會. 肝動脈灌注化療治療肝細(xì)胞癌中國專家共識(2021版)[J]. 中華消化外科雜志, 2021, 20(7): 754-759. DOI: 10.3760/cma.j.cn115610-20210618-00288.
[22]HE MK, LE Y, LI QJ, et al. Hepatic artery infusion chemotherapy using mFOLFOX versus transarterial chemoembolization for massive unresectable hepatocellular carcinoma: a prospective non-randomized study[J]. Chin J Cancer, 2017, 36(1): 83. DOI: 10.1186/s40880-017-0251-2.
[23]HE M, LI Q, ZOU R, et al. Sorafenib plus hepatic arterial infusion of oxaliplatin, fluorouracil, and leucovorin vs sorafenib alone for hepatocellular carcinoma with portal vein invasion: A randomized clinical trial[J]. JAMA Oncol, 2019, 5(7): 953-960. DOI: 10.1001/jamaoncol.2019.0250.
[24]MEI J, LI SH, LI QJ, et al. Anti-PD-1 immunotherapy improves the efficacy of hepatic artery infusion chemotherapy in advanced hepatocellular carcinoma[J]. J Hepatocell Carcinoma, 2021, 8: 167-176. DOI: 10.2147/JHC.S298538.
[25]MEI J, TANG YH, WEI W, et al. Hepatic arterial infusion chemotherapy combined With PD-1 inhibitors plus lenvatinib versus PD-1 inhibitors plus lenvatinib for advanced hepatocellular carcinoma[J]. Front Oncol, 2021, 11: 618206. DOI: 10.3389/fonc.2021.618206.
[26]WU YB, WU ZQ, HUANG JL, et al. Hepatic arterial infusion chemotherapy for primary liver cancer effect of portal vein tumor thrombus[J]. China Health Standard Management, 2022, 13(12): 109-112. DOI: 10.3969/j.issn.1674-9316.2022.12.027.
吳義波, 吳卓瓊, 黃潔麗, 等. 肝動脈灌注化療對原發(fā)性肝癌合并門靜脈癌栓的效果[J]. 中國衛(wèi)生標(biāo)準(zhǔn)管理, 2022, 13(12): 109-112. DOI: 10.3969/j.issn.1674-9316.2022.12.027.
[27]KE YP, YE SG, LU SB. Short-term efficacy of transcatheter arterial embolization combined with FOLFOX4 regimen of continuous arterial infusion chemotherapy on hepatocellular carcinoma patients with portal vein tumor thrombus[J]. China Med Pharm, 2022, 12(16): 156-159. DOI: 10.3969/j.issn.2095-0616.2022.16.040.
柯映平, 葉紹光, 盧舜彬. 肝動脈栓塞術(shù)聯(lián)合FOLFOX4方案持續(xù)動脈灌注化療對肝細(xì)胞癌門靜脈癌栓患者的近期療效[J]. 中國醫(yī)藥科學(xué), 2022, 12(16): 156-159. DOI: 10.3969/j.issn.2095-0616.2022.16.040.
收稿日期:
2022-11-30;錄用日期:2023-01-06
本文編輯:王亞南
引證本文:
DAI WC, ZANG MY, YUAN GS, et al.
Efficacy of hepatic arterial infusion chemotherapy and its multimodality therapeutic regimens in treatment of patients with advanced hepatocellular carcinoma and related prognostic factors
[J]. J Clin Hepatol, 2023, 39(7): 1592-1599.
戴文聰, 臧夢雅, 袁國盛,? 等.
肝動脈灌注化療及其綜合治療方案對中晚期肝細(xì)胞癌患者的臨床療效及預(yù)后因素分析
[J]. 臨床肝膽病雜志, 2023, 39(7): 1592-1599.

