細菌外膜囊泡介導水平基因轉移機制研究進展
李俊 李倩茹 吉星 何濤 魏瑞成 王冉
摘要:細菌可以通過多種水平基因轉移方式,如自然轉化、轉導、接合等,在微生物種群內交換遺傳物質,進行細菌種內和種間交流。外膜囊泡是新發現的一種水平基因轉移方式,它是細菌在自然生長過程中分泌的納米級球狀結構,可以作為載體攜帶核酸、酶、毒素和毒力因子等多種生物分子進行遠距離運輸。目前已有多項研究報道了細菌外膜囊泡的組成成分、生物合成和轉移傳播機制。本文就外膜囊泡在水平基因轉移機制方面的研究進展進行綜述。
關鍵詞:細菌;外膜囊泡;生物發生;水平基因轉移;耐藥性;毒力
中圖分類號:R378? ? ? ? 文獻標志碼:A? ? ? ? ?文章編號:1001-8751(2023)03-0178-07
Research Progress of Mechanisms of Bacterial Outer Membrane Vesicles Mediated Horizontal Gene Transfer
Li Jun1, Li Qian-ru1,2,? Ji Xing1, He Tao1,Wei Rui-cheng1,Wang Ran1
(1 Key Laboratory of Food Quality and Safety of Jiangsu Province-State Key Laboratory Breeding Base,
Key Laboratory of Agro-Product Safety Risk Evaluation (Nanjing) of Ministry of Agriculture and Rural Affairs,
Institute of Agricultural Product Safety and Nutrition, Jiangsu Academy of Agricultural Sciences,? ?Nanjing? 210014;
2 School of Animal Science and Technology, Guangxi University,? ?Nanning? ?530004)
Abstract: Bacteria have evolved many ways to horizontal transfer their genetic materials within the microbial world, such as natural transformation, transduction, conjugation, etc. Bacterial outer membrane vesicle is a newly found method for the horizontal gene transfer. Outer membrane vesicles are nanoscale spherical bag-like structures, released predominantly by bacteria during their growth and reproduction. Many kinds of biological molecules, such as nucleic acid, enzymes, toxins, virulence factors can be carried by outer membrane vesicles for long distance transmission. There has been many papers reporting the components, biosynthesis and transmission of outer membrane vesicles. This review summarized the recent progresses on the horizontal gene transfer of bacterial outer membrane vesicles.
Key words: bacteria;? ?outer membrane vesicles;? ?biogenesis;? ?horizontal gene transfer;? ?antimicrobial resistance;? ?virulence
多重耐藥菌感染是全球公共衛生面臨的嚴重問題,因耐藥菌感染導致的死亡人數在發展中國家的致死性疾病中排名第二位[1]。抗生素耐藥基因可以通過多種水平基因轉移方式傳播[2],如自然轉化,轉導和接合等。自然轉化是指從環境中獲得游離DNA,即從活細菌和死細菌中釋放的DNA[3];但是細菌必須處于感受態狀態才能獲得細胞外的DNA,目前研究發現細菌的感受態狀態由20多個基因共同調控[4],大約1%的細菌物種可以發生自然轉化[5]。轉導是噬菌體通過感染細菌將DNA轉移給細菌,噬菌體可以攜帶多達100 kb的DNA,但是其侵襲的宿主具有特異性[6]。接合需要細菌間的直接接觸,由連接供體菌和受體菌的性菌毛介導,質粒轉移系統嚴格依賴于轉移的遺傳物質的特性[7]。
這些已知的水平基因轉移機制有助于細菌之間的基因交換,但具有一定限制性,如有限的遺傳負荷、宿主特異性和轉移的遺傳物質的種類等。近期研究發現一種由外膜囊泡(OMV)介導的新型基因轉移方式。OMV是細菌自然生長過程中產生的球狀納米級結構(50~500 nm)[8],在細菌毒力、調節宿主免疫反應和細胞通訊中發揮重要作用[9],但對其在水平基因轉移中的作用知之甚少。本文就目前OMV在水平基因轉移中的作用和機制進展進行綜述。
1 OMV的生物發生過程
OMV是由細菌外膜出芽形成的[8]。目前就OMV的產生過程存在三種假說[10]。第一個模型由Burdett提出,即細菌外膜和肽聚糖層之間共價連接的缺失或轉移促進了OMV形成[11]。通過Braun脂蛋白[12]、大腸埃希菌Tol-Pal系統[13]和腦膜炎奈瑟菌RmpM[14]的突變證實外膜肽聚糖連接結構對于提高OMV產量的重要性。第二個模型為周質空間中肽聚糖片段或折疊不良蛋白質的累積對外膜施加壓力,導致膜的彎曲率和最終出芽[15]。第三個模型中,Mashburn等確定了誘導膜曲率的分子,如假單胞菌喹諾酮信號(PQS)和B型脂多糖(LPS)等[16-17]。PQS不僅是OMV的誘導信號,還是OMV形成的直接效應子[18],可誘導膜彎曲、結合磷脂和LPS[19]。PQS可螯合帶正電荷的化合物(Mg2+和Ca2+鹽),排斥LPS的陰離子,導致OMV產生[20]。此外,銅綠假單胞菌B型LPS的存在導致了膜的彎曲,從而誘導排斥LPS[21]。Berry等發現銅綠假單胞菌的細胞壁突變株不能合成B型LPS,因此其OMV產量降低[22]。
OMV的生物發生始于指數生長期,在穩定生長期達到最大峰值[23-24]。然而,許多因素(如溫度、培養基、抗生素等)可定性或定量地影響OMV的產生。Baumgarten等[25]發現熱應力條件下(55 ℃)惡臭假單胞菌OMV的產量顯著增加。另有研究發現營養限制和處于化學或物理壓力誘導因素會促使OMV增加[26]。細菌產生OMV是其應激反應機制之一,以提高細菌存活率,是細菌感染期間對宿主環境的適應機制[27]。
2 OMV的組成成分
OMV是雙層膜納米級球形結構,大小為50~500 nm,外膜主要由LPS、磷脂、膜蛋白和肽聚糖成分組成,囊泡腔內含有周質蛋白、胞質組分和核酸[28]。OMV的組成成分因細菌生長條件而不同,還受到宿主和細菌之間相互作用的調節[29-30]。研究表明,OMV中存在外膜蛋白、周質蛋白和不同的毒力因子,它們參與細菌對宿主的粘附和侵襲過程[23]。通過蛋白組學可以鑒定出OMV相關蛋白種類,主要分為兩大類:(1)外膜蛋白。包括膜蛋白,如孔蛋白、轉運系統成分、粘附素、磷脂酶和蛋白酶等。銅綠假單胞菌的外膜囊泡中廣泛鑒定出的孔蛋白是OprF和OprH/OprG[31],腦膜炎奈瑟菌的OMV中含量最多的是孔蛋白A,H因子結合蛋白和不透明相關蛋白C[32],在福氏志賀菌的OMV中檢測到外膜磷脂酶A[33],牙密螺旋體的OMV中含有對宿主細胞造成損害的活性蛋白酶[34]。(2)囊腔蛋白。主要由毒素組成,如霍亂弧菌的霍亂毒素、腸毒性大腸埃希菌的溶細胞素A、幽門螺桿菌的空泡形成細胞毒素、空腸彎曲桿菌的細胞致死擴張毒素[35],以及酶類,如蛋白酶、糖苷酶和脲酶等[36]。
脂質在OMV的結構中起重要作用,由磷脂和LPS組成。磷脂構成外膜的內層,LPS僅位于外膜的外表面上。大腸埃希菌OMV的磷脂主要由磷脂酰乙醇胺、磷脂酰甘油和溶血磷脂酰乙醇胺組成[37]。腦膜炎奈瑟氏菌OMV主要包括磷脂酰甘油和磷脂酰乙醇胺[32]。在銅綠假單胞菌OMV中,大量檢測到磷脂酰甘油和硬脂酸,證明OMV具有更強的剛性[25]。幽門螺桿菌的OMV以心磷脂為主要脂質成分[23]。OMV上存在的LPS條帶類型取決于出芽的部位[8]。LPS擁有兩種不同類型的O多糖,即A型和B型的LPS,其不同的化學成分賦予了不同的表面和抗原特性。在銅綠假單胞菌的OMV中,僅發現B型LPS,而在牙齦卟啉單胞菌中,OMV主要由A型LPS組成[38]。
OMV的外膜表面或囊泡腔中可攜帶DNA和RNA。用DNase I和RNase處理OMV可以觀察到明顯的區別[24]。多項研究報道大腸埃希菌[39]、淋病奈瑟菌[40]、銅綠假單胞菌[41]、鮑曼不動桿菌[42]等分泌的OMV攜帶DNA。在霍亂弧菌和銅綠假單胞菌OMV中還檢測到RNA序列[43],OMV相關的RNA可通過降低宿主的免疫反應來促進銅綠假單胞菌的致病性[43]。最近在衣原體和軍團菌菌株的OMV中還發現了tRNA片段,直接參與破壞宿主菌基因翻譯和mRNA穩定性[44]。
3 OMV的生物功能
OMV可攜帶核酸、酶、毒素和毒力因子等生物分子進行遠距離運輸,保護它們免受降解和稀釋,OMV介導細菌種內和種間進行交流,并有助于與宿主的相互作用[9]。此外,OMV還參與營養物質的獲取、應激反應以及病原菌生存所必需的微環境的形成等[30, 45]。OMV中蛋白酶、磷酸酶和糖苷酶的包裝在復雜分子的降解中起重要作用,促進了營養物質的吸收利用[36]。黃色粘球菌OMV中的堿性磷酸酶會導致磷酸鹽的釋放,從而促進微生物菌群的平衡[46]。此外,OMV表面相關的蛋白質和DNA是細菌生長過程中碳和氮的重要來源[13]。
OMV在微生物毒力和調節宿主免疫反應中發揮重要作用[30]。OMV通過釋放胞外多糖參與生物被膜基質的形成,從而促進細菌聚集[47]。在囊性纖維化患者中,銅綠假單胞菌能夠形成生物被膜,導致手術部位感染、骨科種植體周圍骨感染和肺部感染。研究發現PQS通過在生物被膜發育過程中以高度動態的生物物理機制誘導銅綠假單胞菌和其他假單胞菌屬物種的OMV形成。值得注意的是,與細菌生物被膜附著和成熟階段相比,OMV的產量在生物被膜分散過程中顯著上升,可能由于PQS誘導的OMV增強了銅綠假單胞菌感染中的生物被膜分散,從而促進了生物被膜的分解[16]。另有研究報道氣單胞菌屬OMV可劑量依賴性地促進生物被膜形成[48]。Bielaszewska等[49]發現OMV增加了細菌對腸上皮的粘附,以幫助它們抵抗物理消除。OMV攜帶的毒素和毒力因子比它們的可溶物形式更為活躍[15]。OMV中包含多種致病分子,包括孔蛋白和LPS等[50],可強烈調節免疫反應,導致細胞因子和趨化因子的產生,從而誘導炎癥反應的激活[51]。
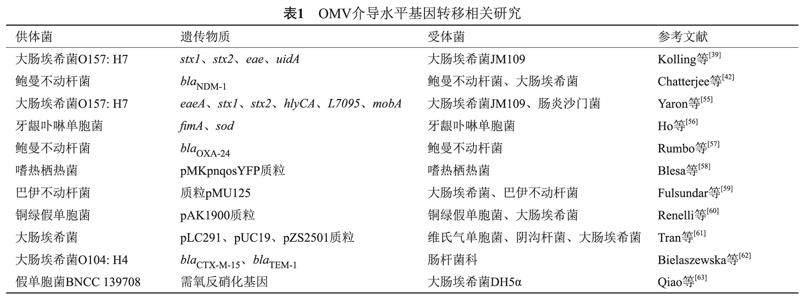
OMV還被認為是基因轉移的載體[52],已有多項研究在OMV中檢測到質粒、染色體DNA片段、噬菌體DNA和RNA片段[53-54]。本文著重對OMV在水平基因轉移中的作用研究進展進行綜述探討(表1)。
4 OMV介導的水平基因轉移
目前研究發現,水平基因轉移可以通過轉化、轉導,接合以及新發現的OMV方式進行[3]。Kolling等[39]首先發現OMV可以作為水平基因轉移的載體,他們純化了大腸埃希菌O157: H7的OMV,用DNase I處理OMV證實了囊泡內部攜帶基因,通過聚合酶鏈反應(PCR)在外膜囊腔中檢測到eae、uidA、stx1和stx2等毒力基因,這些基因可通過OMV轉移到受體菌大腸埃希菌JM109,并且在JM109轉化子中鑒定到毒力基因,證實了OMV可介導毒力基因的水平轉移過程。這些初步發現為其他研究奠定了基礎,深化了OMV在水平基因轉移機制中的作用。隨后Yaron等[55]研究證明OMV可介導遺傳物質在不同菌種之間發生交換。研究人員從大腸埃希菌O157: H7的培養上清液中分離出OMV,經DNase I處理和PCR鑒定在OMV內檢測到染色體基因eaeA和uidA,噬菌體相關基因stx1和stx2,pO157、pO157和p4821質粒相關基因hlyCA, L7095和mobA。以大腸埃希菌JM109和腸炎沙門菌為受體菌進行轉化實驗,通過菌落PCR擴增鑒定到靶基因,轉化子對Vero細胞毒性比受體菌提升6倍,表明轉化子獲得毒力基因后,致病性增加。
除大腸埃希菌外,其他革蘭陰性菌也可利用OMV作為水平基因轉移載體。Ho等[56]證明,牙齦卟啉單胞菌的OMV可介導同一菌種之間毒力基因的轉移。OMV內腔中攜帶菌毛和超氧化物歧化酶的編碼基因fimA和sod。在轉移實驗中,將2.1 kb的紅霉素抗性基因ermF-ermAM融合入fimA基因進行標記,牙齦卟啉單胞菌49417通過產生OMV將紅霉素抗性基因ermF-ermAM和毒力基因fimA轉移給敏感菌株33277。
Rumbo等[57]首次發現OMV可以介導耐藥質粒水平轉移。研究人員以攜帶碳青霉烯類blaOXA-24質粒的鮑曼不動桿菌臨床菌株為對象,通過DNase I處理和點印跡實驗證明blaOXA-24基因存在于耐碳青霉烯類臨床菌株產生的OMV中。通過與碳青霉烯類敏感的鮑曼不動桿菌共孵育實現OMV介導的耐藥質粒轉化,獲得耐藥質粒后,敏感受體菌的MIC達到>32 μg/mL。并且轉化過程非常迅速,3 h內即可發生,24 h內達到平臺期[57]。Chatterjee等[42]研究了鮑曼不動桿菌菌株A_115產生的OMV介導blaNDM-1基因傳播的能力。通過DNase I處理、PCR和點印跡分析證明blaNDM-1基因存在于OMV內腔中。采用不同濃度的OMV與鮑曼不動桿菌和大腸埃希菌JM109的β-內酰胺敏感菌株進行轉化。轉化子數量與OMV濃度成正比關系,當使用50 μg的OMV與鮑曼不動桿菌ATCC 19606共孵育,轉化效率最高,達到4.62×109 CFU/mL。轉化子blaNDM-1基因呈陽性,對β-內酰胺類抗生素呈現廣泛耐藥,同時MIC值更高。使用游離質粒與β-內酰胺敏感菌株一起孵育時,沒有獲得轉化子,證明轉移完全由OMV介導[42]。
將DNA裝載到OMV中可保護其免受不利環境條件的影響。例如,在熱環境中,細胞外DNA的完整性受到高溫和DNase I作用的影響,而OMV內的DNA仍可以發生水平轉移,這是細菌額外的生存優勢。Blesa等[58]在嗜熱棲熱菌中發現了基于OMV的水平基因轉移途徑。研究人員收集了攜帶pMKpnqosYFP質粒的嗜熱棲熱菌產生的OMV,在對OMV采用DNase I處理后,通過瓊脂糖凝膠電泳和Hind III消化質粒證實了OMV中質粒的完整性,表明OMV為其中的DNA提供了保護。使用ΔpilQ和ΔpilA4嗜熱棲熱菌作為受體菌進行轉化實驗,在熱環境和存在DNase I的情況下,與游離DNA相比,OMV介導的轉化效率更高,證實OMV在不利條件下可作為載體為水平基因轉移提供保護[58]。
5 OMV介導水平基因轉移的影響因素
目前多項研究探索了OMV在水平基因轉移中的作用,但轉移的分子機制以及該過程的影響因素尚不清楚。Fulsundar等[59]發現高溫、干燥、營養缺乏、紫外線和抗生素暴露導致巴伊不動桿菌OMV釋放增加。當細菌用氯霉素和慶大霉素處理并在沒有營養物的情況下生長時,觀察到OMV中質粒的數量顯著增加,從而增加了質粒的轉移頻率。抗生素和營養缺乏條件處理,導致細菌OMV直徑顯著增加。與其他處理相比,慶大霉素作用下產生的OMV的zeta電位顯示出更多的負值。這些研究結果證明應激因素會影響OMV釋放、DNA含量以及OMV大小。
Tran等[61]系統評估了質粒類型和受體/供體菌株對轉移效率的影響。以pLC291、pUC19和pZS2501質粒轉化大腸埃希菌菌株,三種質粒大小相似,但復制起點不同。pLC291和pUC19是高拷貝質粒,pZS2501是低拷貝質粒。通過PCR分析證實這三種質粒均可分泌于大腸埃希菌OMV。三種OMV的蛋白含量相似,但含有pZS2501質粒的OMV體積增大。通過實時定量PCR分析評估質粒在OMV中的陽性率,發現低拷貝質粒的負載能力低,每pg蛋白的OMV中攜帶0.49×103拷貝的質粒。高拷貝pLC291和pUC19質粒顯示出高負載潛力,每pg蛋白OMV分別有2.58×103和482.7×103拷貝。這些發現表明質粒特征影響OMV的直徑和質粒負載量。此外,他們還研究了不同菌株釋放OMV的特征。在轉化實驗中,使用維氏氣單胞菌,陰溝桿菌和大腸埃希菌作為受體菌株。用攜帶pLC291質粒的大腸埃希菌作為供體菌。不同受體菌株接收pLC291質粒后,釋放的OMV中含有相同的蛋白質和質粒量并且具有相似的大小。進而評估了OMV進行細菌種間水平基因轉移的潛力。從維氏氣單胞菌,陰溝桿菌和大腸埃希菌中分離出含有pLC291的OMV,再將其與五種不同的受體菌(維氏氣單胞菌,陰溝桿菌,大腸埃希菌,紫色桿菌和銅綠假單胞菌)進行轉化,對質粒轉移時間進行量化。維氏氣單胞菌通過OMV在更短的時間內將pLC291質粒轉移到不同的受體菌株。無論供體菌種如何,銅綠假單胞菌在較短的時間內獲得了抗生素耐藥性。維氏氣單胞菌比陰溝桿菌、大腸埃希菌和紫色桿菌更快地接收質粒。這些結果表明,獲得DNA的能力由供體/受體細菌的種類共同決定[61]。
Tran等[64]后續深入研究了質粒特征(質粒拷貝數、質粒大小和復制起點)對OMV介導的水平基因轉移的影響。在pSC101質粒復制起點引入三個特定點突變以增加質粒拷貝數。將拷貝數增加的pSC101+、pSC101++和 pSC101+++電轉到供體大腸埃希菌菌株中。增加的質粒拷貝數不會影響純化的OMV的大小和數量,但會改變包載到OMV中的質粒數量。轉移實驗表明,質粒轉移時間隨著質粒拷貝數的增加而減少。此外,研究評估了質粒大小對OMV負載的影響。基于質粒pLC291,通過插入非功能性λ噬菌體DNA產生了四種不同大小的質粒。獲得的質粒大小分別為3.5、7、10和15 kb,分別命名為pLC-3.5、pLC-7、pLC10和pLC15。用每種質粒轉化大腸埃希菌菌株,并純化OMV。隨著質粒大小的增加,OMV的產量幾乎沒有增加。動態光散射分析表明OMV尺寸與質粒大小無關。此外,熒光定量qPCR結果表明,質粒大小與OMV中質粒拷貝數成反比。為了評估質粒來源對OMV產生的影響,他們基于質粒pLC291構建了三個大小相同(3.5 kb)但來源不同的質粒:pMB1、具有RK2和ColE1雙重來源的pLC和SC101,轉化入大腸埃希菌后,純化OMV。不同來源質粒的大腸埃希菌產生的OMV的大小相近。不同來源的質粒(pMB1、pLC和SC101)在OMV中的負載不同:對于pMB1,每pg蛋白的OMV中攜帶364.45×103拷貝,而對于pLC和SC101,每pg蛋白OMV中攜帶3.13×103和1.12×103拷貝。隨后進行了OMV介導的水平基因轉移實驗,使用大腸埃希菌作為受體菌株,并添加相同數量的OMV。研究發現基因轉移頻率受到質粒復制起點的強烈影響。攜帶pLC質粒的OMV的轉移頻率大約是攜帶pMB1和SC101質粒的OMV的10倍。由此可見,質粒的數量和大小影響了OMV的包載效率,而復制起點影響了OMV的轉化頻率[64]。
6 總結
水平基因轉移促進細菌之間遺傳物質的交換,并在許多微生物的進化中發揮重要作用。已知的水平基因轉移方式(自然轉化、轉導和接合)對細菌物種之間的遺傳多樣性具有重要貢獻。近期研究發現OMV是水平基因轉移的新型途徑。OMV不僅參與微生物毒力,調節宿主免疫反應,還可通過攜帶質粒、染色體DNA片段、噬菌體DNA和RNA片段水平基因轉移,介導遺傳元素在微生物群體間傳播交換。并且供體/受體菌株種類,遺傳物質類型,外界環境條件(高溫、營養缺乏、紫外線和抗生素)等均會影響OMV介導的水平基因轉移頻率。目前OMV分泌的調控機制,包載物質的選擇性,與受體細胞膜融合的方式等尚不清楚,需要更進一步深入研究。
參 考 文 獻
Talebi B A, Rizvanov A A, Haertlé T, et al. World health organization report: current crisis of antibiotic resistance[J]. BioNanoScience, 2019, 9(4): 778-788.
Deng Y, Xu H, Su Y, et al. Horizontal gene transfer contributes to virulence and antibiotic resistance of Vibrio harveyi 345 based on complete genome sequence analysis[J]. BMC Genomics, 2019, 20(1): 1-19.
Johnston C, Martin B, Fichant G, et al. Bacterial transformation: distribution, shared mechanisms and divergent control[J]. Nat Rev Microbiol, 2014, 12(3): 181-196.
Mell J C, Redfield R J. Natural competence and the evolution of DNA uptake specificity[J]. J Bacteriol, 2014, 196(8): 1471-1483.
Nazarian P, Tran F, Boedicker J Q. Modeling multispecies gene flow dynamics reveals the unique roles of different horizontal gene transfer mechanisms[J]. Front Microbiol, 2018, 9: 2978.
Chiang Y N, Penadés J R, Chen J. Genetic transduction by phages and chromosomal islands: The new and noncanonical[J]. PLoS Pathog, 2019, 15(8): e1007878.
Cabezón E, Ripoll-Rozada J, Pe?a A, et al. Towards an integrated model of bacterial conjugation[J]. FEMS Microbiol Rev, 2015, 39(1): 81-95.
Kulp A, Kuehn M J. Biological functions and biogenesis of secreted bacterial outer membrane vesicles[J]. Annu Rev Microbiol, 2010, 64: 163-184.
Berleman J, Auer M. The role of bacterial outer membrane vesicles for intra- and interspecies delivery[J]. Environ Microbiol, 2013, 15(2): 347-354.
Schwechheimer C, Sullivan C J, Kuehn M J. Envelope control of outer membrane vesicle production in Gram-negative bacteria[J]. Biochemistry, 2013, 52(18): 3031-3040.
Burdett I D, Murray R G. Electron microscope study of septum formation in Escherichia coli strains B and B-r during synchronous growth[J]. J Bacteriol, 1974, 119(3): 1039-1056.
Eddy J L, Gieldal M, Caulfield A J, et al. Production of outer membrane vesicles by the plague pathogen Yersinia pestis[J]. PLoS One, 2014, 9(9): e107002.
Roier S, Zingl F G, Cakar F, et al. A novel mechanism for the biogenesis of outer membrane vesicles in Gram-negative bacteria[J]. Nat Commun, 2016, 7: 10515.
Gerritzen M J H, Maas R H W, Van D I J, et al. High dissolved oxygen tension triggers outer membrane vesicle formation by Neisseria meningitidis[J]. Microb Cell Fact, 2018, 17(1): 157.
Schwechheimer C, Kuehn M J. Outer-membrane vesicles from Gram-negative bacteria: biogenesis and functions[J]. Nat Rev Microbiol, 2015, 13(10): 605-619.
Cooke A C, Florez C, Dunshee E B, et al. Pseudomonas quinolone signal-induced outer membrane vesicles enhance biofilm dispersion in Pseudomonas aeruginosa[J]. mSphere, 2020, 5(6):1109-1120.
Florez C, Raab J E, Cooke A C, et al. Membrane distribution of the Pseudomonas quinolone signal modulates outer membrane vesicle production in Pseudomonas aeruginosa[J]. mBio, 2017, 8(4):e01034-17.
Wessel A K, Liew J, Kwon T, et al. Role of Pseudomonas aeruginosa peptidoglycan-associated outer membrane proteins in vesicle formation[J]. J Bacteriol, 2013, 195(2): 213-219.
Mashburn-Warren L, Howe J, Garidel P, et al. Interaction of quorum signals with outer membrane lipids: insights into prokaryotic membrane vesicle formation[J]. Mol Microbiol, 2008, 69(2): 491-502.
Li A, Scherizer J W, Yong X. Molecular dynamics modeling of Pseudomonas aeruginosa outer membranes[J]. Phys Chem Chem Phys, 2018, 20(36): 23635-23648.
Ellis T N, Leiman S A, Kuehn M J. Naturally produced outer membrane vesicles from Pseudomonas aeruginosa elicit a potent innate immune response via combined sensing of both lipopolysaccharide and protein components[J]. Infect Immun, 2010, 78(9): 3822-3831.
Beveridge T J. Structures of gram-negative cell walls and their derived membrane vesicles[J]. J Bacteriol, 1999, 181(16): 4725-4733.
Yu Y J, Wang X H, Fan G C. Versatile effects of bacterium-released membrane vesicles on mammalian cells and infectious/inflammatory diseases[J]. Acta Pharmacol Sin, 2018, 39(4): 514-533.
Jan A T. Outer Membrane Vesicles (OMVs) of Gram-negative bacteria: A perspective update[J]. Front Microbiol, 2017, 8: 1053.
Baumgarten T, Sperling S, Seifert J, et al. Membrane vesicle formation as a multiple-stress response mechanism enhances Pseudomonas putida DOT-T1E cell surface hydrophobicity and biofilm formation[J]. Appl Environ Microbiol, 2012, 78(17): 6217-6224.
Bauwens A, Kunsmann L, Marejková M, et al. Intrahost milieu modulates production of outer membrane vesicles, vesicle-associated Shiga toxin 2a and cytotoxicity in Escherichia coli O157:H7 and O104:H4[J]. Environ Microbiol Rep, 2017, 9(5): 626-634.
Macdonald I A, Kuehn M J. Stress-induced outer membrane vesicle production by Pseudomonas aeruginosa[J]. J Bacteriol, 2013, 195(13): 2971-2981.
Qing G, Gong N, Chen X, et al. Natural and engineered bacterial outer membrane vesicles[J]. Biophysics Reports, 2019, 5(4): 184-198.
Orench-Rivera N, Kuehn M J. Environmentally controlled bacterial vesicle-mediated export[J]. Cell Microbiol, 2016, 18(11): 1525-1536.
Cecil J D, Sirisaengtaksin N, O'brien-Simpson N M, et al. Outer membrane vesicle-host cell interactions[J]. Microbiol Spectr, 2019, 7(1):PSIB-0001-2018.
Chevalier S, Bouffartigues E, Bodilis J, et al. Structure, function and regulation of Pseudomonas aeruginosa porins[J]. FEMS Microbiol Rev, 2017, 41(5): 698-722.
Gerritzen M J H, Stangowez L, Van D W B, et al. Continuous production of Neisseria meningitidis outer membrane vesicles[J]. Appl Microbiol Biotechnol, 2019, 103(23-24): 9401-9410.
Wang X, Jiang F, Zheng J, et al. The outer membrane phospholipase A is essential for membrane integrity and type Ⅲ secretion in Shigella flexneri[J]. Open Biol, 2016, 6(9):160073.
Chi B, Qi M, Kuramitsu H K. Role of dentilisin in Treponema denticola epithelial cell layer penetration[J]. Res Microbiol, 2003, 154(9): 637-643.
Van D P L, Stork M, Van D L P. Outer membrane vesicles as platform vaccine technology[J]. Biotechnol J, 2015, 10(11): 1689-1706.
Valguarnera E, Scott N E, Azimzadeh P, et al. Surface exposure and packing of lipoproteins into outer membrane vesicles are coupled processes in bacteroides[J]. mSphere, 2018, 3(6):e00559-18.
Tashiro Y, Inagaki A, Shimizu M, et al. Characterization of phospholipids in membrane vesicles derived from Pseudomonas aeruginosa[J]. Biosci Biotechnol Biochem, 2011, 75(3): 605-607.
Veith P D, Chen Y Y, Gorasia D G, et al. Porphyromonas gingivalis outer membrane vesicles exclusively contain outer membrane and periplasmic proteins and carry a cargo enriched with virulence factors[J]. J Proteome Res, 2014, 13(5): 2420-2432.
Kolling G L, Matthews K R. Export of virulence genes and Shiga toxin by membrane vesicles of Escherichia coli O157:H7[J]. Appl Environ Microbiol, 1999, 65(5): 1843-1848.
Pérez-Cruz C, Delgado L, López-Iglesias C, et al. Outer-inner membrane vesicles naturally secreted by gram-negative pathogenic bacteria[J]. PLoS One, 2015, 10(1): e0116896.
Bitto N J, Chapman R, Pidot S, et al. Bacterial membrane vesicles transport their DNA cargo into host cells[J]. Sci Rep, 2017, 7(1): 7072.
Chatterjee S, Mondal A, Mitra S, et al. Acinetobacter baumannii transfers the blaNDM-1 gene via outer membrane vesicles[J]. J Antimicrob Chemother, 2017, 72(8): 2201-2207.
Koeppen K, Hampton T H, Jarek M, et al. A novel mechanism of host-pathogen interaction through sRNA in bacterial outer membrane vesicles[J]. PLoS Pathog, 2016, 12(6): e1005672.
Furuse Y, Finethy R, Saka H A, et al. Search for microRNAs expressed by intracellular bacterial pathogens in infected mammalian cells[J]. PLoS One, 2014, 9(9): e106434.
Yá?ez-Mó M, Silhander P R, Andreu Z, et al. Biological properties of extracellular vesicles and their physiological functions[J]. J Extracell Vesicles, 2015, 4: 27066.
Berleman J E, Allen S, Danielewicz M A, et al. The lethal cargo of Myxococcus xanthus outer membrane vesicles[J]. Front Microbiol, 2014, 5: 474.
Cooke A C, Nello A V, Ernst R K, et al. Analysis of Pseudomonas aeruginosa biofilm membrane vesicles supports multiple mechanisms of biogenesis[J]. PLoS One, 2019, 14(2): e0212275.
Seike S, Kobayashi H, Ueda M, et al. Outer membrane vesicles released from Aeromonas strains are involved in the biofilm formation[J]. Front Microbiol, 2020, 11: 613650.
Bielaszewska M, Marejková M, Bauwens A, et al. Enterohemorrhagic Escherichia coli O157 outer membrane vesicles induce interleukin 8 production in human intestinal epithelial cells by signaling via Toll-like receptors TLR4 and TLR5 and activation of the nuclear factor NF-κB[J]. Int J Med Microbiol, 2018, 308(7): 882-889.
Cai W, Kesavan D K, Wan J, et al. Bacterial outer membrane vesicles, a potential vaccine candidate in interactions with host cells based[J]. Diagn Pathol, 2018, 13(1): 95.
Kaparakis-Liaskos M, Ferrero R L. Immune modulation by bacterial outer membrane vesicles[J]. Nat Rev Immunol, 2015, 15(6): 375-387.
Domingues S, Nielsen K M. Membrane vesicles and horizontal gene transfer in prokaryotes[J]. Curr Opin Microbiol, 2017, 38: 16-21.
Velimirov B, Ranftler C. Unexpected aspects in the dynamics of horizontal gene transfer of prokaryotes: the impact of outer membrane vesicles[J]. Wiener Medizinische Wochenschrift, 2018, 168(11-12): 307-313.
Gaudin M, Krupovic M, Marguet E, et al. Extracellular membrane vesicles harbouring viral genomes[J]. Environ Microbiol, 2014, 16(4): 1167-1175.
Yaron S, Kolling G L, Simon L, et al. Vesicle-mediated transfer of virulence genes from Escherichia coli O157:H7 to other enteric bacteria[J]. Appl Environ Microbiol, 2000, 66(10): 4414-4420.
Ho M H, Chen C H, Goodwin J S, et al. Functional advantages of Porphyromonas gingivalis vesicles[J]. PLoS One, 2015, 10(4): e0123448.
Rumbo C, Fernandez-Moreira E, Merino M, et al. Horizontal transfer of the OXA-24 carbapenemase gene via outer membrane vesicles: a new mechanism of dissemination of carbapenem resistance genes in Acinetobacter baumannii[J]. Antimicrob Agents Ch, 2011, 55(7): 3084-3090.
Blesa A, Berrenguer J. Contribution of vesicle-protected extracellular DNA to horizontal gene transfer in Thermus spp[J]. Int Microbiol, 2015, 18(3): 177-187.
Fulsundar S, Harms K, Flaten G E, et al. Gene transfer potential of outer membrane vesicles of Acinetobacter baylyi and effects of stress on vesiculation[J]. Appl Environ Microbiol, 2014, 80(11): 3469-3483.
Renelli M, Matias V, Lo R Y, et al. DNA-containing membrane vesicles of Pseudomonas aeruginosa PAO1 and their genetic transformation potential[J]. Microbiology (Reading), 2004, 150(Pt 7): 2161-2169.
Tran F, Boedicker J Q. Genetic cargo and bacterial species set the rate of vesicle-mediated horizontal gene transfer[J]. Sci Rep, 2017, 7(1): 8813.
Bielaszewska M, Daniel O, Karch H, et al. Dissemination of the blaCTX-M-15 gene among Enterobacteriaceae via outer membrane vesicles[J]. J Antimicrob Chemother, 2020, 75(9): 2442-2451.
Qiao W, Wang L, Luo Y, et al. Outer membrane vesicles mediated horizontal transfer of an aerobic denitrification gene between Escherichia coli[J]. Biodegradation, 2021, 32(4): 435-448.
Tran F, Boedicker J Q. Plasmid characteristics modulate the propensity of gene exchange in bacterial vesicles[J]. J Bacteriol, 2019, 201(7):e00430-18.
收稿日期:2022-10-26
基金項目:國家自然科學基金項目(32102728);江蘇省農業科學院探索性顛覆性創新項目(ZX(21)1224);
江蘇省自然科學基金(BK20200056);江蘇省自主創新項目(CX(20)1011-1)。
作者簡介:李俊,博士,助理研究員,主要從事細菌耐藥性分子機制及防控策略研究。
李倩茹(并列第一作者),本科,主要從事細菌耐藥性研究。
*通訊作者:何濤,博士,副研究員,主要從事細菌耐藥性產生及傳播分子機制研究。

