細菌Ⅲ型分泌系統及其抑制劑研究進展
陳棟梁 班曼曼 朱夢晗 王霄旸 王春梅 周文 張可煜
摘要:隨著耐藥性的發展,抗生素的應用面臨著嚴峻挑戰,通過抑制劑來抑制細菌生長而不尋求直接殺滅細菌成為一種新的抗細菌感染策略。細菌分泌系統是效應蛋白轉運的通道,在效應蛋白分泌過程中發揮重要作用,在抗細菌感染策略中被作為優先選擇對象。其中細菌Ⅲ型分泌系統(T3SS)結構復雜,功能卻相對保守,是眾多重要效應分子轉運的必經路徑,已成為抑制劑選擇的熱點靶標。本文就細菌Ⅲ型分泌系統的結構、功能研究進展及其抑制劑的發展進行闡述,為其通過抑制T3SS的抗細菌感染,新型抑制劑開發以及減緩細菌耐藥的研究提供理論依據。
關鍵詞:細菌分泌系統;T3SS;抑制劑;耐藥性; 細菌;化合物
中圖分類號:R978.1? ? ? ? 文獻標志碼:A? ? ? ? ?文章編號:1001-8751(2023)03-0192-10
Research Progress of Bacterial Type Ⅲ Secretion System and its Inhibitors
Chen Dong-liang1,? ?Ban Man-man2,? ?Zhu Meng-han1,? ?Wang Xiao-yang1,
Wang Chun-mei1,? ?Zhou Wen1,? ?Zhang Ke-yu1
(1 Key Laboratory of veterinary chemicals and preparations, Ministry of agriculture and rural areas,
Shanghai Institute of veterinary medicine, Chinese Academy of Agricultural Sciences, Shanghai 200241;
2? Henan Animal Quarantine Station,Zhengzhou? 450008)
Abstract: With the development of drug resistance, the application of antibiotics is facing challenges. Instead of seeking to kill bacteria, inhibiting the growth of bacteria through inhibitors has become a new anti-infection strategy. The bacterial secretion system is the channel of effector protein transport, which plays an important role in the process of effector protein secretion, and has become the preferred target of bacteriostatic strategy. The type Ⅲ secretion system, which is a necessary pathway for the transport of many important effector molecules, has become a hot target for inhibitor selection. In this paper, the structure and function of the type Ⅲ secretion system of bacteria and the development of inhibitors are reviewed, so as to provide a theoretical basis for the study of anti-bacterial infection by inhibiting the type Ⅲ secretion system, the development of new inhibitors and the mitigation of bacterial drug resistance.
Key words: bacterial secretion system; T3SS;inhibitor; antibiotic resistance;bacteria;antibiotic
1 前言
當前細菌耐藥性愈發嚴重,已經成為人類迫切需要解決的全球公共衛生問題。以新型抗菌靶點研發新的抗菌藥物的耐藥性應對策略不僅需要耗費大量成本和時間,也會帶來誘發新的耐藥表型和機制的潛在威脅[1-2]。老藥新用的策略也存在篩選庫容量有限,命中率低以及老藥本身所具有的副作用可能危害機體等問題[3]。近年來,隨著研究的深入,不尋求直接殺滅病原菌,而是通過抑制病原菌的致病力,減輕或緩解病原菌對機體造成的直接危害,并依靠自身防御系統恢復機體健康,已經逐步成為一種新型抗耐藥細菌感染的策略[4]。這是因為病原菌對抗生素產生耐藥性的根本驅動力可歸因于抗生素對其生長的脅迫作用巨大,而抑制病原菌的致病力作為一種選擇壓力較小,不直接影響細菌生長的抗感染方式,理論上細菌對其產生耐藥抵抗的驅動力很小。病原菌的致病力主要依賴于毒力因子,常見的毒力因子包括毒素、細胞溶素、蛋白酶等毒性分子以及分泌系統、菌毛、鞭毛等細菌特有的毒性裝置[5]。其中細菌分泌系統(Bacterial secretion system)是細菌重要的毒力因子,承擔著胞內效應分子轉運至宿主的重要功能,是一種選擇壓力較小,理論上不易產生耐藥性的優良抗感染途徑。因此,細菌分泌系統及其抑制藥物研究越來越受重視,成為當前抗菌感染藥物研究的重點。
細菌分泌系統是一類存在于細菌細胞膜上由大分子復合物組成的分子機器,承擔各種致病相關效應蛋白和遺傳物質的分泌和轉運,為多種細菌的效應物提供分泌途徑[6]。分泌系統的有些結構對于細菌病原體來說是獨一無二的,對細菌毒力乃至至關重要,并影響著細菌的生存及致病能力。這些重要的作用促進了人們對細菌分泌系統的研究不斷深入。目前已經發現了9種細菌分泌系統(即T1SS~T9SS)[7],其中Ⅲ型分泌系統(Type Ⅲ secretory system,T3SS)主要存在于革蘭陰性菌中[8],因其復雜的結構與功能,成為近年來分泌系統研究的重點,相應地也出現了許多能抑制T3SS組成和功能的抑制劑。本文從T3SS結構特點、分泌過程、潛在作用靶點、抑制劑等方面進行綜述,為新型T3SS抑制劑的進一步探索和發現提供理論依據。
2 T3SS的結構
T3SS是形狀類似于小注射器,由多種蛋白組成的分子機器,在進化和結構上與細菌鞭毛有關[9],其功能與細菌定植、存活和復制有關[10]。革蘭陰性菌通常可表達兩類T3SSs,一類被注入復合體或針狀復合物,簡稱iT3SS,可將細菌胞質中的效應蛋白或毒力因子轉運至宿主細胞,從而調控宿主細胞的代謝過程及細菌與宿主細胞的相互作用[8];另一類是編碼細菌的鞭毛,簡稱fT3SS,可調控細菌的運動能力[11]。本文主要介紹的是iT3SS。
形似于小注射器的T3SS含有許多高度保守的結構成分,主要由針狀復合物、轉運孔、內桿蛋白、胞質環與分選平臺、底物輸出裝置、基底等裝置組成[12],是9種分泌系統中最為復雜的一種[7]。由于組成T3SS各結構成分在不同物種間命名不同,其中在耶爾森菌系統中編碼分泌裝置的基因被命名為Ysc,研究人員在此基礎上使用其后綴,將Ⅲ型分泌系統分泌裝置基因稱為Sct,用于分泌和細胞易位,本文則采用標準化的“Sct”進行描述。
2.1 針狀復合物
T3SS的核心結構為針復合物(Needle complex , NC),是一種低聚膜包埋復合物,它是一種大型的圓柱形大分子復合物,嵌入細菌的內膜和外膜中,跨越質周空間,并通過針絲延伸到細胞外環境[13]。這些絲狀結構允許這些病原體通過宿主細胞黏液屏障,在與靶細胞接觸時,在宿主膜中組裝一個易位孔[12],通過該易位孔注入效應蛋白[14]。
2.2 轉運孔
轉運孔是由T3SS轉運子SctB和SctE在宿主細胞膜脂質雙分子層中形成的異源低聚復合體。SctB和SctE是親水性的,能夠插入宿主質膜上,然后它們寡聚形成易位子孔[15]。研究發現,轉運孔的組裝和對接需要借助宿主細胞的趨化因子受體、表面硫酸化和巖藻糖化、波形中間絲蛋白等。
2.3 內桿蛋白
內桿蛋白由SctI亞基螺旋組裝而成,通過“插座”結構連接到內膜環上,可將針狀復合物錨定到基體[16]。研究表明,SctR和SctT的周質結構域與內桿蛋白SctI有一定聯系。SctR、SctT和SctI的密切相互作用可能會為底物易位創建連續的導管,其中SctI可以作為適配器將內膜的扁平易位孔與螺旋針絲連接起來,從而為底物從細菌細胞質易位到宿主細胞創造了連續的管道[17]。
2.4 胞質環與分選平臺
胞質環(SctQ)也稱C環[15],位于底物輸出裝置下方,與ATPase 復合體(SctN、SctO和SctL)一起組成底物的裝載和分選平臺[18],是一種對于T3SS至關重要的外周膜相關蛋白[15]。其中,胞質環負責底物的裝載與卸載,ATPase復合體為整個T3SS的運行提供能量。在分選平臺中,ATPase復合體中的SctN由連接蛋白SctO錨定在SctV的異構環上,從而連接ATPase復合體與底物輸出裝置[19]。而SctQ和 SctK位于SctL的輻條末端,為SctN提供對接位點,將SctN錨定在胞質環上,并調節其活性[15, 20]。
2.5 輸出裝置
底物輸出裝置位于基底下方,嵌入在內膜中,充當底物的入口,由SctR、SctS、SctT、SctU和SctV等5種膜蛋白組裝而成[17]。SctV及其同系物的大細胞質結構域形成一個非絳化環,在底物的切換和易位中發揮重要作用[21];SctU及其同系物在早期分泌到中晚期底物分泌的特異性轉換中起作用;基本輸出裝置組分SctR、SctS和SctT在針復合物的組裝和分泌過程中起著重要作用,組分中五個SctR和一個SctT組成一個環狀結構。另外,實驗證實SctR、SctS、SctT、SctU的復合物在摻入針復合物基質之前在體內組裝,并且這四個輸出裝置組件在SctR五聚體能夠形成具有多種相互作用的緊湊組件[9, 17]。實驗研究還表明,SctS,SctT和SctU不纏繞在SctR五聚體周圍,而是在SctR的一側形成一個緊湊的組件,其中SctS是與所有其他組件接觸的中心組件。SctS,SctT和SctU形成的組裝還可以促進SctR孔的門控,這對于防止營養和離子泄漏穿過細菌內膜產生有害影響具有重要作用[17]。
2.6 基底
T3SS基底是嵌在細菌內外膜上的一系列環狀結構,主要由SctC(InvG)、SctD(PrgH)和SctJ(PrgK)構成,其中SctC形成外膜環,SctJ和SctD在內膜上形成同心環。三者都含有1個結構保守的楔形折疊,這是內膜環和外膜環共同的成環基序,有助于環的組裝[7, 22]。SctC的N端結構域深入周質,與SctD直接接觸,實現內外膜的連接。
SctC位于細菌外膜內,是細菌分泌系統中不可缺少的細胞外環境的大門戶。SctC結構是一個巨大的雙層β管狀結構,其結構域形成一個八鏈β夾,在細胞外末端分開。外層β片構成外壁,內層β片形成一個紐結的反平行桶,即支撐外壁又形成內部的“周質門”[23]。同源性區域由N端周質區域和高度保守的蛋白酶耐藥C端區域組成。不僅為細菌蛋白在內膜的擠出提供了通道,而且還在其周圍質面上與各種輸出裝置的其他組分提供了關鍵的結構界面[22]。在這些結構的出現對“注射體”的整體組裝和穩定產生了巨大作用。
3 T3SS的調節分泌
細菌分泌系統的重要功能就是將效應蛋白的特定子集分泌到宿主細胞中,分泌過程中所分泌的效應蛋白不在胞漿間隙中停留,也不被切割,而是直接從胞質運輸到宿主細胞中。對分泌過程和機制的研究認為,整個分泌過程可進一步細分為一步分泌機制和兩步分泌機制[24]。一步分泌是效應蛋白在分泌過程中不依賴一般(Secretion,Sec)分泌或雙精氨酸易位(Twin-arginine translocation,Tat)途徑,可直接將底物從細菌細胞質靶向宿主;兩步分泌則需要Sec的傳輸,在分泌過程中首先在細胞內膜上依靠轉運體發生易位,一旦進入周質外,底物就會被靶向其中一個分泌系統,然后通過某個分泌系統介導穿過外膜將底物運輸釋放到細菌細胞外[6]。
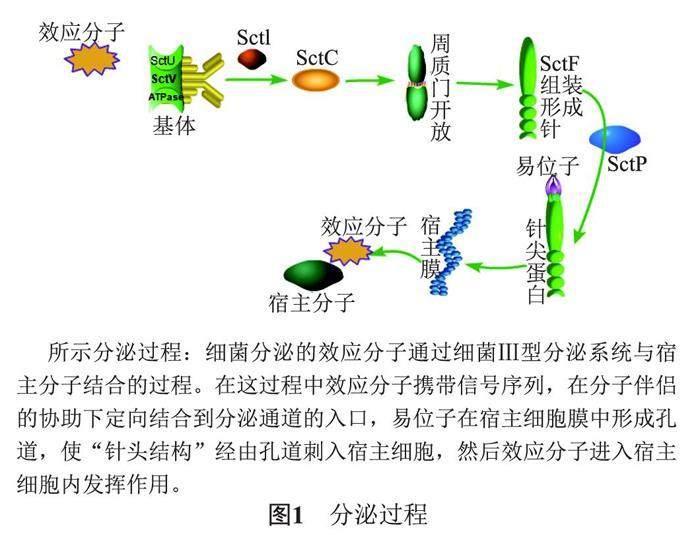
T3SS分泌體系由跨越內膜和外膜的復雜蛋白質結構組成,不依賴于Sec途徑,可以將分泌蛋白直接注入宿主細胞,屬于一步分泌。當細菌與真核宿主細胞接觸后,外界環境因子首先刺激產生分泌信號。Ⅲ型分泌底物的N端攜帶Sec-非依賴性信號序列,在分子伴侶的協助下定向結合到分泌通道的入口。轉位器在真核宿主細胞膜中形成孔道,使“針頭結構”經由孔道刺入宿主細胞,然后效應蛋白通過“針頭結構”進入宿主細胞內發揮作用,分泌過程見圖1。
3.1 識別定位
T3SS分泌蛋白在其N端含有不可清除的信號序列,出口設備組件SctU和SctV,胞質環,ATP酶復合物和SctW負責介導分泌途徑中的分泌順序,膜靶向和導出[25]。
3.2 通道開放
通過注射體的蛋白質分泌以連續的步驟進行,不同的切換機制確保了分泌層次結構。有兩種分泌模型:第一種是內桿SctI在輸出裝置的周質與SctU相互作用,導致其易位到基底體并與分泌素SctC結合[15]。之后,SctI以某種方式調節針的長度并促進SctU的自體蛋白水解;第二種是,一旦針或細絲結構達到正確的長度,完全擴展的SctP錨定在其上的SctU的自體蛋白發生溶解[25]。而守門的SctW在中后期底物分泌過程中起著重要作用,沒有SctW,易位子(中間底物)不分泌,效應子(晚期底物)過度分泌。并且它與易位子相互作用,能夠促進分泌,促進易位子孔打開。一旦宿主質膜中的易位子孔形成,離子流到細菌細胞質可能改變局部電位,也因電位改變導致SctW從膜上分泌,SctW從膜上脫落驅動了晚期底物的分泌[15]。
3.3 靶向受體
在靶向受體過程中,主要是輸出裝置SctV的主要成分與伴侶—分泌蛋白復合物之間的相互作用。研究表明,SctU和SctW的構象改變及膜電位的局部變化可能改變SctV與伴侶—分泌蛋白復合物的親和力,從而對分泌步驟有一定的調節作用[15]。
4 抑制T3SS功能可能的靶點
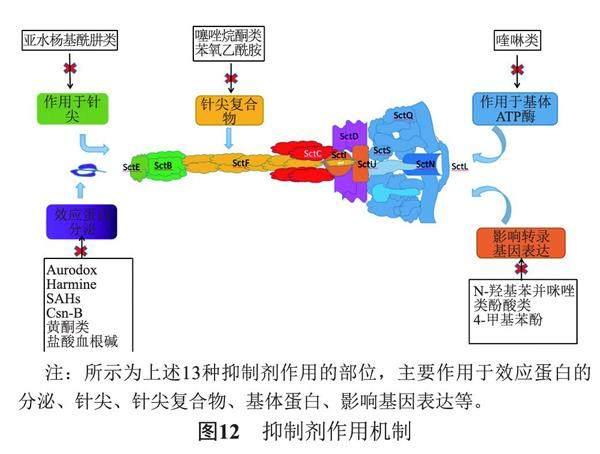
干擾T3SS發揮分泌功能進程的每個階段都可能減少或阻斷細菌的毒力效應因子的釋放。現有研究資料表明,T3SS的針尖結構、基底組裝的過程調控以及效應蛋白是最主要的抑制T3SS功能可能的靶點。
4.1 作用于針尖蛋白
主要由于針尖蛋白的特殊結構,小分子抑制劑能夠與針尖蛋白結合。抑制劑在結合過程中會以不同的形式阻塞效應分子通過針尖孔道,主要形式有:小分子抑制劑直接阻塞針孔道[26];抑制劑在不阻塞孔隙的情況下與針尖結合,使效應分子不能夠順利到達宿主膜上;還有一種是小分子抑制劑與針尖結合,使針尖蛋白的構象發生改變[27],造成其效應分子不能通過孔道。
4.2 影響基底的組裝過程
T3SS結構形式“注射器”樣,但細致劃分出來是由許多亞基組裝而成,各個亞基之間相互協同,相互作用,共同調節著效應分子的分泌。對于基底的抑制,一種是抑制基底的組裝。研究發現,抑制組裝的任何一個步驟都可能阻止針的形成,從而阻止效應分子分泌到宿主細胞中[28]。另一種是抑制周質門,在基體的SctC內,有一個周質門,它參與針的形成,它通常有閉合、半開放、開放等三種構象。當處于閉合狀態時,針不能伸出,效應分子也就不能夠與宿主分子結合;當處于開放狀態則能夠順利分泌到宿主[29]。因此,對于周質門的調節主要由于SctC構象的改變。典型的噻唑烷酮類抑制劑則是通過影響SctC構象的改變,阻止周質門的開放,抑制針的形成,進而有效阻止效應分子分泌到宿主細胞。
4.3 阻斷效應分子靶向宿主
細菌分泌的毒力或效應分子蛋白等通過分泌系統針狀孔道進入宿主,并與宿主結合,發揮作用。可以抑制效應分子的黏附、內化和干擾效應分子的伴侶蛋白等途徑來抑制效應分子與宿主的結合[30],從而達到抑制分泌效應功能的目的。對于黏附過程的抑制,主要是效應分子易位的黏附素受體(Tir)的N端與黏附素的結合,C端則會與多個宿主因子相互作用,最終調節效應分子的分泌[31];對于內化的抑制過程,主要是效應分子與宿主因子的結合,導致肌動蛋白重排和聚合,肌動蛋白重排導致膜褶皺的形成[32],之后則會吞噬細菌細胞,發生內化。效應分子能否順利通過針孔通道進入宿主,還需要有一個關鍵蛋白,即分子伴侶蛋白[33]。在伴侶蛋白存在的情況下,效應分子會與伴侶蛋白結合,進而使效應分子通過T3SS進行分泌[34]。對效應分子伴侶蛋白的抑制也能有效抑制效應分子順利通過針孔通道。
5 T3SS抑制劑
T3SS分泌系統抑制劑根據其作用機制大致可分為3類[35]:(1)轉錄抑制劑。菌體與宿主結合后,系統的相關轉錄被激活,而在轉錄過程中起重要作用的是ExsA轉錄因子。Marsden等發現N-羥基苯并咪唑能夠結合ExsA,并抑制它的轉錄激活活性,從而降低細胞毒性作用[36]。(2)外毒素抑制劑。T3SS分泌毒性最大的外毒素為ExoU,它作用于宿主的磷脂酶A2可引起宿主的死亡,研究發現磺胺類藥物能夠高強度抑制ExoU酶活性。(3)針管狀結構蛋白抑制劑。在細菌的外表面,存在一種針管狀的復合物[37],其能夠將外毒素轉運至細胞。位于針管狀結構尖端的一種轉運蛋白PcrV可以控制菌體通過T3SS分泌外毒素。針對PcrV抑制劑的研究多數集中在單克隆抗體上[35]。
5.1 水楊基酰肼類
水楊酰肼類及其衍生物(主要包括磺酰氨基苯甲酰苯胺、水楊酰亞胺和水楊酰肼等三種化合物,圖2)是研究較早的一類小分子T3SS抑制劑[38]。不同化合物對轉錄和運動性有著不同的影響,進而產生不同的靶標和作用機制。磺酰氨基苯甲酰苯胺不影響T3SS的運動性和一般的轉錄調控[29];水楊酰亞胺對運動沒有影響,可能通過影響雙組分信號傳導,從而間接影響T3SS分泌,同時對轉錄激活也有一定影響,抑制T3SS基因的轉錄[39];而水楊酰肼能夠影響其分泌和運動,但不會影響轉錄[40]。在大腸埃希菌中,該類抑制劑可以靶向WrbA,Tpx和Flox等T3SS調節蛋白,通過直接結合和干擾T3SS基礎裝置相關的蛋白來發揮作用[39]。
5.2 噻唑烷酮類
噻唑烷酮是一種飽和雜環噻唑,含有羰基官能團(圖3),主要有噻唑烷-2-酮、噻唑烷-4-酮和噻唑烷-5-酮[41]。在對沙門菌研究過程中,鑒定出2-亞氨基-5-芳基噻唑烷酮是T3SS的廣譜抑制劑,其雜環在一系列連接子末端顯示為二聚體,一些二聚體則對于毒力蛋白的分泌起到抑制作用[42]。通過純化沙門菌的針狀復合物,研究人員發現化合物處理的樣品具有較低水平的針狀成分,但全細胞水平不變[40]。由此可見,該化合物通過破壞分泌素之間的相互作用起作用,從而影響針狀復合物的組裝和穩定性,但對纖毛系統沒有影響[40]。研究還發現,該化合物能夠通過靶向多蛋白系統的外膜環蛋白來阻止毒力蛋白的分泌[43]。
5.3 苯氧乙酰胺
苯氧乙酰胺衍生物(圖4)能夠特異性地影響某些T3SS效應因子的分泌和轉運,從降低T3SS介導的細胞毒作用,并促進細胞中細菌的內化[44]。該抑制劑與靶蛋白結合后,能夠干擾影響感染持久性、擴散性的效應蛋白ExoS或ExoU的分泌或轉運。2014年,Bowlin等發現苯氧乙酰胺等衍生物對突變株T3SS針狀復合物PscF基因有一定影響,能夠影響T3SS的分泌和易位[45]。該研究表明,苯氧乙酰胺抑制劑與組裝的PscF針狀復合物結合[34, 46],一方面通過影響亞基之間的相互作用來抑制針狀復合物的組裝和穩定性;另一方面通過與針腔結合來改變其親水性來抑制其功能,從而阻斷T3SS功能[45]。
5.4 喹啉類
VirF是一種AraC家族轉錄激活劑,能夠直接激活icsA和virB毒力基因的表達,是T3SS表達所必需的。喹啉是一種AraC家族抑制劑(圖5),它選擇地抑制兩個AraC家族激活劑RhaS和RhaR。在對于喹啉類T3SS抑制劑的研究發現,該化合物有效地抑制了VirF與DNA的結合,從而抑制AraC家族在體內激活轉錄的能力。一種類似物8-羥基喹啉類抑制劑在發揮作用過程中能夠阻斷負調控因子ExsE經T3SS向胞外分泌,不利于胞內ExsC-ExsD復合物的形成,使得ExsA無法激活T3SS基因的轉錄[47]。研究還發現其化合物能夠作用于鞭毛和T3SS的注射體中的ATP酶,能夠抑制ExoS和FliC的分泌以及鞭毛的運動。此外,羥基喹啉保護真核細胞免受T3SS介導的細胞毒性,并抑制半胱天冬酶的活性和在吞噬細胞中的IL-1β釋放[44]。
5.5 N-羥基苯并咪唑類
通過計算機篩選與屬于AraC家族的大腸埃希菌中基因表達調節因子的DNA結合結構域相互作用的小分子,發現N-羥基苯并咪唑類藥物是以多重適應反應(MAR)蛋白(如E.coli的MarA、SoxS和Rob等)為靶標的小分子抑制劑。MAP蛋白的特征是兩個高度保守的雙螺旋DNA結合結構域,能夠控制細菌引起的感染,抵抗抗生素和適應外部環境的能力。AraC家族的蛋白質可以通過調控對抗生素和氧化應激的抗性、T3SS的表達、毒素產生以及感染期間相關重要過程來調節毒力[48]。N-羥基苯并咪唑及其衍生物(圖6)可以結合一些轉錄因子(LcrF、ExsA等)的DNA結合域后[49],如能夠與ExsA的羧基末端結構域相互作用。另外還存在變構機制,如N-羥基苯并咪唑結合誘導DNA結合結構域的結構改變[50],阻止其與DNA上的啟動子位點結合[44],從而抑制ExsA-DNA復合物的形成[51]。
5.6 酚酸類
除亞水楊基酰肼和羥基苯并咪唑衍生物能夠抑制T3SS基因表達外,某些天然來源的酚酸類成分(圖7)也有類似的活性[47]。研究發現,P-香豆酸、O-香豆酸、反式肉桂酸等能夠抑制植物病原體的T3SS基因的表達[52],通過操縱T3SS的表達來防御細菌病原體[53]。對于許多細菌能夠使用調控系統GacS/A和由T3SS基因簇中心的基因HrpX/Y編碼的雙組分系統(TCS)來感知其環境并調節基因以響應環境變化;對于香豆素則通過T3SS的核心調節器HrpX/Y雙組分系統抑制了T3SS調控基因的表達[54],而不是通過調節劑GacS/A來間接調節T3SS。
5.7 4-甲基苯酚
T3SS的基質由稱為Ysc(Yop分泌)的蛋白組成,從基部延伸出來的是一個空心針狀結構,由YscF的重復亞基組成。針末端的孔由LcrV、YopB、YopD三種蛋白組成。4-甲基苯酚化合物(圖8)能夠與YopD相互作用從而有效抑制Yop的分泌[55]。
5.8 Aurodox
Aurodox是最初于1973年被發現的一種抗生素化合物,對革蘭陽性菌具有抗菌作用。在新型T3SS抑制特性的研究表明,Aurodox能夠下調腸出血性大腸埃希菌(Enterohemorrhagic Escherichia coli,EHEC)T3SS的表達[56];轉錄組學分析表明,其作用于腸細胞消失位點(Locus of enterocyte effacement, LEE)基因主調控因子Ler的上游[25],而不是直接作用于分泌系統本身。研究發現:(1)Aurodox能夠抑制T3SS相關效應蛋白的易位;(2)抑制EHEC附著于上皮細胞和去除上皮細胞的能力;(3)抑制多種毒力基因的表達,如能夠抑制LEE基因中包括主調節因子Ler和grlA在內的25個基因表達[57]。對于Ler的調節機制,一方面可能直接抑制Ler的表達;另一方面可能與T3SS的組分結合導致Ler的負反饋,從而影響Ler的上游調節器。此外,還抑制了編碼T3SS分泌的非編碼效應蛋白的基因的表達,如NleB和EspG[58]。
5.9 Csn-B
Csn-B(Cytosporone B,圖9)通過 Hha–H-NS–HilD–HilC–RtsA–HilA 調節途徑影響鼠傷寒沙門菌染色體插入物沙門菌毒力島1(SPI-1)相關基因的轉錄[59]。Csn-B及其衍生物對SPI-1介導的HeLa細胞侵襲表現出很強的抑制作用[60],但未觀察到對細菌有毒性。類核蛋白Hha和H-NS與SPI-1調節基因hilD,hilC和rtsA的啟動子結合以抑制其表達,從而調節SPI-1裝置和效應基因的表達[61]。研究結果發現Csn-B上調了hha和hns的轉錄。另外,Csn-B及其類似物能夠阻斷沙門菌SPI-1相關效應蛋白的分泌,但不影響鞭毛蛋白FilC在體外的分泌[62]。
5.10 黃酮類
Guo等[63]研究發現,異戊二烯化類黃酮及其類似物對沙門菌SPI-1相關效應蛋白的分泌具有抑制作用,但不會影響鞭毛蛋白FilC的分泌和細菌的生長;另外黃酮類似物檸檬黃酮醇能夠通過調節AicA/InvF基因的轉錄和效應蛋白SipC的轉運,從而對SPI-1效應蛋白的分泌起到抑制作用[64]。
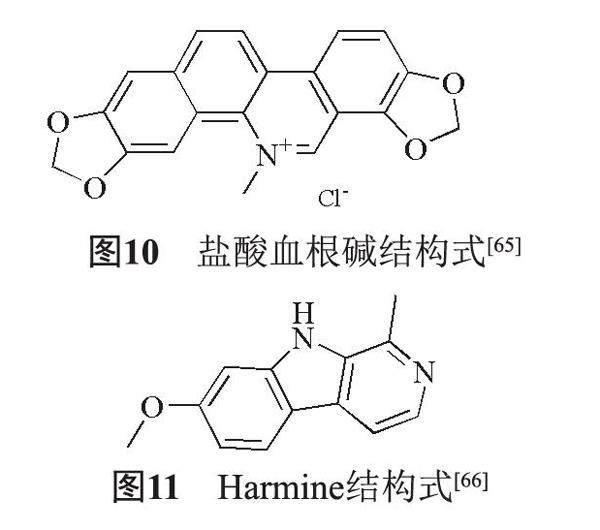
5.11 鹽酸血根堿
研究發現天然化合物鹽酸血根堿(圖10)可以減少SPI-1編碼的Ⅲ型分泌系統主要毒力蛋白SipA和SipB的產生,并防止鼠傷寒沙門菌侵襲HeLa細胞的能力,而不會影響沙門菌的生長[65]。
5.12 Harmine
研究發現,Harmine(圖11)能夠抑制T3SS調節基因HilA的轉錄和表達,降低鼠傷寒沙門菌T3SS效應蛋白Sipa、SipB和SipC的表達,從而抑制T3SS效應蛋白的分泌和表達,最終減弱鼠傷寒沙門菌的侵襲力[66],是T3SS靶向抑制劑。
5.13 SAHs
SAHs首次發現在2003年,該化合物及其衍生物對結核桿菌、鼠傷寒沙門菌、鏈球菌T3SS具有抑制作用[25],能夠降低鼠傷寒沙門菌和鏈球菌感染期間的巨噬細胞毒性和上皮細胞侵襲[67]。Hudson等[68]研究發現能夠抑制SPI-1編碼的T3SS在鼠傷寒沙門菌中的分泌以及SPI-1介導的分泌和炎癥反應。目前對于該化合物的具體作用機制尚不清楚,可能是通過多種細菌蛋白來抑制T3SS,對多種途徑進行干擾。
6 總結與展望
近年來,隨著超級耐藥菌的層出不窮,抗生素耐藥性也急劇增加,已成為全球關注的重大公共衛生問題。鑒于新型抗菌藥物研究周期長、成本高以及細菌極易對抗生素產生耐藥等問題,研究人員逐漸由之前殺死細菌向抑制細菌毒力方向轉變。細菌分泌系統恰是分泌毒力因子等效應蛋白所必需的通道,抑制效應蛋白的分泌,在分泌過程中阻斷細菌毒力的傳播,成為一個很不錯的選擇。革蘭陰性菌在生產生活中危害極大,而T3SS是革蘭陰性菌主要的毒力裝置,在革蘭陰性菌感染過程中發揮重要作用,自然成為抗毒力策略的重要選擇目標。
目前,盡管T3SS抑制劑取得了一定進展,已經涌現出一些具有前景的T3SS抑制劑(圖12)。但是T3SS抑制劑的研究仍較為緩慢,多是在老藥的基礎上進行改造,研制其衍生物,由于其作用的機制研究不夠深入,所以抑制機理也不是完全清楚。當前中藥有效成分等天然產物是一個超級龐大的化合物庫,有關T3SS抑制劑的篩選研究已逐漸轉向從天然產物中開發可能的新型抑制劑,這又為T3SS等細菌分泌系統抑制劑的篩選和應用注入了新的源泉。總之,對于T3SS及其抑制劑的研究仍有廣闊的空間和應用前景,需要進一步發掘其新的分泌機制與新的抑制手段,對未來新型抗生素的研發,藥物“佐劑”的應用具有重要的作用,為抑制劑從研究走向運用奠定基礎。
參 考 文 獻
Miller B J, Wilensky G. New drugs, new ideas: Payment policy innovations for high-cost pharmaceuticals [J]. Milbank, 2019, 97(4):922-925.
黃祺, 唐洪波, 胡明冬, 等. 抗菌藥物耐藥性應對策略研究進展 [J]. 實用醫藥雜志, 2019, 36(04): 367-370.
Huang B, Zhang Y. Teaching an old dog new tricks: Drug discovery by repositioning natural products and their derivatives [J]. Drug Discov Today, 2022, 27(7): 1936-1944.
Chang R Y K, Nang S C, Chan H K, et al. Novel antimicrobial agents for combating antibiotic-resistant bacteria [J]. Advanced Drug Delivery Reviews, 2022, 187:114378.
Hotinger J A, May A E. Antibodies inhibiting the typeⅢ secretion system of Gram-negative pathogenic bacteria [J]. Antibodies, 2020,? 9(3):35.
Green E R, Mecsas J, Kudva I T. Bacterial secretion systems: An overview [J]. Microbiol Spectr, 2016,? 4(1):10.
劉靜, 張昭寰, 吳倩, 等. 細菌分泌系統的結構及作用機制研究進展 [J]. 生物化學與生物物理進展, 2022, 1:28.
劉偉, 龐建, 劉占英, 等. 革蘭氏陰性細菌蛋白分泌系統研究進展 [J]. 微生物學通報, 2022, 49(02): 781-793.
Zilkenat S, Franz-Wachtel M, Stierhof Y D, et al. Determination of the stoichiometry of the complete bacterial typeⅢ secretion needle complex using a combined quantitative proteomic approach [J]. Mol Cell Proteomics,? 2016, 15(5): 1598-1609.
Horna G, Ruiz J. Type 3 secretion system of Pseudomonas aeruginosa [J]. Microbiol Res, 2021, 246: 126719.
Bitter W, Kuijl C. Targeting bacterial virulence: the coming out of typeⅦ secretion inhibitors [J]. Cell Host Microbe, 2014, 16(4): 430-432.
Selim H, Radwan T E E, Reyad A M. Regulation of T3SS synthesis, assembly and secretion in Pseudomonas aeruginosa [J]. Archives of Microbiology, 2022, 204(8):468.
Hotinger J A, Pendergrass H A, May A E. Molecular targets and strategies for inhibition of the bacterial typeⅢ secretion system (T3SS); inhibitors directly binding to T3SS components [J]. Biomolecules, 2021, 11(2):316.
Gaytan M O, Martinez-Santos Ⅵ , Soto E, et al. Type three secretion system in attaching and effacing pathogens [J]. Front Cell Infect Microbiol, 2016, 6: 129.
Portaliou A G, Tsolis K C, Loos M S, et al. TypeⅢ secretion: building and operating a remarkable nanomachine [J]. Trends Biochem Sci, 2016, 41(2): 175-189.
Lam H N, Lau T, Lentz A, et al. Developing cyclic peptomers as broad-spectrum typeⅢ secretion system inhibitors in Gram-negative bacteria [J]. Antimicrob Agents Ch, 2021, 65(7):e01690-20.
Dietsche T, Tesfazgi Mebrhatu M, Brunner M J, et al. Structural and functional characterization of the bacterial typeⅢ secretion export apparatus [J]. PLoS Pathog, 2016, 12(12): e1006071.
Hu B, Morado D R, Margolin W, et al. Visualization of the typeⅢ secretion sorting platform of Shigella flexneri [J]. Proc Natl Acad Sci U S A,? 2015, 112(4): 1047-1052.
Case H B, Mattock D S, Miller B R, et al. Novel noncompetitive type three secretion system ATPase inhibitors shut down Shigella effector secretion [J]. Biochemistry, 2020, 59(28): 2667-2678.
Imada K, Minamino T, Uchida Y, et al. Insight into the flagella typeⅢ export revealed by the complex structure of the type Ⅲ ATPase and its regulator [J]. Proc Natl Acad Sci U S A, 2016, 113(13): 3633-3638.
Notti R Q, Stebbins C E. The structure and function of typeⅢ secretion systems [J]. Microbiol Spectr, 2016, 4(1):1-25.
Spreter T, Yip C K, Sanowar S, et al. A conserved structural motif mediates formation of the periplasmic rings in the typeⅢ secretion system [J]. Nat Struct Mol Biol, 2009, 16(5): 468-476.
Worrall L J, Hong C, Vuckovic M, et al. Near-atomic-resolution cryo-EM analysis of the Salmonella T3S injectisome basal body [J]. Nature, 2016, 540(7634): 597-601.
Yuan X, Yu M, Yang C H. Innovation and application of the typeⅢ secretion system inhibitors in plant pathogenic bacteria [J]. Microorganisms, 2020, 8(12):1956.
Marshall N C, Finlay B B. Targeting the typeⅢ secretion system to treat bacterial infections [J]. Expert Opin Ther Targets, 2014, 18(2): 137-152.
Shao W B, Wang P Y, Fang Z M, et al. Synthesis and biological evaluation of 1,2,4-triazole thioethers as both potential virulence factor inhibitors against plant bacterial diseases and agricultural antiviral agents against tobacco mosaic virus infections [J]. J Agric Food Chem, 2021, 69(50): 15108-15122.
Bergeron J R C, Fernández L, Wasney G A, et al. The structure of a type 3 secretion system (T3SS) ruler protein suggests a molecular mechanism for needle length sensing [J]. J Biol Chem, 2016, 291(4): 1676-1691.
Feng C, Huang Y, He W, et al. Tanshinones: First-in-class inhibitors of the biogenesis of the type 3 secretion system needle of Pseudomonas aeruginosa for antibiotic therapy [J]. ACS Cent Sci, 2019, 5(7): 1278-1288.
Horna G, Ruiz J. Type 3 secretion system as an anti-Pseudomonal target [J]. Microb Pathog, 2021, 155: 104907.
Khanifar J, Hosseini R H, Kazemi R, et al. Prevention of EHEC infection by chitosan nano-structure coupled with synthetic recombinant antigen [J]. J Microbiol Methods, 2019, 157: 100-107.
The role of the eae gene of enterohemorrhagic Escherichia coli in intimate attachment in vitro and in a porcine model [J].J Clin? Invest, 1993, 92(3):1418-1424.
Liebl D, Qi X, Zhe Y, et al. SopB-mediated recruitment of SNX18 facilitates Salmonella typhimurium internalization by the host cell [J]. Frontiers in Cellular and Infection Microbiology, 2017, 7:257.
Runte C S, Jain U, Getz L J, et al. Tandem tyrosine phosphosites in the enteropathogenic Escherichia coli chaperone CesT are required for differential typeⅢ effector translocation and virulence [J]. Molecular Microbiology, 2018, 108(5): 536-550.
Moir D T, Opperman T J, Aron Z D, et al. Adjunctive therapy for multidrug-resistant bacterial infections: TypeⅢ secretion system and efflux inhibitors [J]. Drug Discov Today, 2021, 26(9):2173-2181.
唐小麗, 封毅, 卓少元, 等. 銅綠假單胞菌感染的非抗生素治療研究進展 [J]. 微生物與感染, 2021, 16(02): 129-136.
Hu H, Liu M, Sun S. Pore-forming toxins during bacterial infection: Molecular mechanisms and potential therapeutic targets [J]. Drug Des Devel Ther, 2021, 15: 3773-3781.
Wu L, Li L, Yin X, et al. A SARS-CoV-2 oral vaccine development strategy based on the attenuated Salmonella typeⅢ secretion system [J]. J Appl Microbiol, 2022, 133(4): 2484-2500.
Puigvert M, Sole M, Lopez-Garcia B, et al. TypeⅢ secretion inhibitors for the management of bacterial plant diseases [J]. Mol Plant Pathol, 2019, 20(1): 20-32.
Sharma P, Elofsson M, Roy S. Attenuation of Pseudomonas aeruginosa infection by INP0341, a salicylidene acylhydrazide, in a murine model of keratitis [J]. Virulence, 2020, 11(1): 795-804.
Tsou L K, Dossa P D, Hang H C. Small molecules aimed at typeⅢ secretion systems to inhibit bacterial virulence [J]. Medchemcomm, 2013, 4(1): 68-79.
Hart D, Legoabe L J, Jesumoroti O J, et al. Nitrothiazole‐thiazolidinone hybrids: synthesis and in vitro antimicrobial evaluation [J]. Chemistry Biodiversity, 2022, 19(11):e202200729.
Kline T, Barry K C, Jackson S R, et al. Tethered thiazolidinone dimers as inhibitors of the bacterial typeⅢ secretion system [J]. Bioorganic Medicinal Chemistry Letters, 2009, 19(5): 1340-1343.
Felise H B, Nguyen H V, Pfuetzner R A, et al. An inhibitor of gram-negative bacterial virulence protein secretion [J]. Cell Host Microbe, 2008, 4(4): 325-336.
Anantharajah A, Mingeot-Leclercq M P, Van Bambeke F. Targeting the type three secretion system in Pseudomonas aeruginosa [J]. Trends Pharmacol Sci, 2016, 37(9): 734-749.
Bowlin N O, Williams J D, Knoten C A, et al. Mutations in the Pseudomonas aeruginosa needle protein gene pscF confer resistance to phenoxyacetamide inhibitors of the typeⅢ secretion system [J]. Antimicrob Agents Chemother, 2014, 58(4): 2211-2220.
Moir D T, Bowlin N O, Berube B J, et al. A structure-function-inhibition analysis of the Pseudomonas aeruginosa typeⅢ secretion needle protein pscF [J]. J Bacteriology, 2020, 202(18):e00055-20.
單淇, 鄭忠輝, 王玉成. 革蘭陰性菌分泌系統小分子抑制劑的研發進展 [J]. 現代藥物與臨床, 2019, 34(12): 3786-3797.
Boonyom R, Roytrakul S, Thinwang P. A small molecule, C24H17ClN4O2S, inhibits the function of the typeⅢ secretion system in Salmonella typhimurium [J]. J Genet Eng Biotechnol, 2022, 20(1): 54.
Kim O K, Garrity-Ryan L K, Bartlett V J, et al. N-hydroxybenzimidazole inhibitors of the transcription factor LcrF in Yersinia: novel antivirulence agents [J]. J Med Chem, 2009, 52(18): 5626-5634.
Goldberg J B, Crisan C V, Luu J M. Pseudomonas aeruginosa antivirulence strategies: targeting the typeⅢ secretion system [J]. Adv Exp Med Biol, 2022, 1386: 257-280.
Marsden A E, King J M, Spies M A, et al. Inhibition of Pseudomonas aeruginosa ExsA DNA-binding activity by N-hydroxybenzimidazoles [J]. Antimicrob Agents Ch, 2016, 60(2): 766-776.
Jiang S, Li H, Ahmed W, et al. Discovery of ethyl 2-nitro-3-arylacrylates molecules as T3SS inhibitor reducing the virulence of plant pathogenic bacteria xanthomonas [J]. Front Microbiol, 2019, 10: 1874.
Gutierrez-del-Rio I, Fernandez J, Lombo F. Plant nutraceuticals as antimicrobial agents in food preservation: terpenoids, polyphenols and thiols [J]. Int J Antimicrob Ag, 2018, 52(3): 309-315.
Hu A, Hu M, Chen S, et al. Five plant natural products are potential typeⅢ secretion system inhibitors to effectively control soft-rot disease caused by dickeya [J]. Front Microbiol,? 2022, 13: 839025.
Jessen D L, Bradley D S, Nilles M L. A typeⅢ secretion system inhibitor targets YopD while revealing differential regulation of secretion in calcium-blind mutants of Yersinia pestis [J]. Antimicrob Agents Chemother, 2014, 58(2): 839-850.
Kimishima A, Hagimoto D, Honsho M, et al. Insights into the structure–activity relationship of a typeⅢ secretion system inhibitor, aurodox [J]. Bioorganic Medicinal Chemistry Letters, 2022, 69:128779.
Iyoda S, Koizumi N, Satou H, et al. The GrlR-GrlA regulatory system coordinately controls the expression of flagellar and lEE-encoded typeⅢ protein secretion systems in enterohemorrhagic Escherichia coli [J]. J Bacteriology, 2006, 188(16): 5682-5692.
McHugh R E, OBoyle N, Connolly J P R, et al. Characterization of the mode of action of aurodox, a typeⅢ secretion system inhibitor from streptomyces goldiniensis [J]. Infection and Immunity, 2019, 87(2):e00595-18.
Song Y, Xu G, Li C, et al. Structural optimization of natural product fusaric acid to discover novel T3SS inhibitors of Salmonella [J]. Biochem Biophys Res Commun, 2021, 582: 72-76.
Hussain S, Ouyang P, Zhu Y, et al. Type 3 secretion system 1 of Salmonella typhimurium and its inhibitors: a novel strategy to combat salmonellosis [J]. Environ Sci Pollut Res Int, 2021, 28(26): 34154-34166.
Pendergrass H A, May A E. Natural product typeⅢ secretion system inhibitors [J]. Antibiotics (Basel), 2019, 8(4):162.
Li J F, Lv C, Sun W Y, et al. Cytosporone B, an inhibitor of the typeⅢ secretion system of Salmonella enterica serovar typhimurium [J]. Antimicrob Agents Ch, 2013, 57(5): 2191-2198.
Curtiss R, Wanda SY, Gunn BM, et al. Salmonella enterica serovar typhimurium strains with regulated delayed attenuation in vivo [J]. Infect Immun, 2009, 77(3): 1071-1082.
Guo Z, Li X, Li J, et al. Licoflavonol is an inhibitor of the type three secretion system of Salmonella enterica serovar typhimurium [J]. Biochem Bioph Res Co, 2016, 477(4): 998-1004.
Zhang Y, Liu Y, Wang TT, et al. Natural compound sanguinarine chloride targets the typeⅢ secretion system of Salmonella enterica serovar typhimurium [J]. Biochem Biophys Rep, 2018, 14: 149-154.
Shi Y, Chen X, Shu J, et al. Harmine, an inhibitor of the typeⅢ secretion system of Salmonella enterica serovar typhimurium [J]. Front Cell Infect Mi, 2022, 12:967149.
Veenendaal A K, Sundin C, Blocker A J. Small-molecule typeⅢ secretion system inhibitors block assembly of the Shigella type Ⅲ secreton [J]. J Bacteriol, 2009, 191(2): 563-570.
Hudson D L, Layton A N, Field T R, et al. Inhibition of typeⅢ secretion in Salmonella enterica serovar typhimurium by small-molecule inhibitors [J]. Antimicrob Agents Chemother, 2007, 51(7): 2631-2635.
收稿日期:2022-10-21
基金項目:國家自然科學基金(31872516);國家重點研發計劃(2018YFE0192600)。
作者簡介:陳棟梁,碩士研究生,主要從事抗菌藥物研究。
*通訊作者:張可煜,研究員,主要從事獸醫藥理學與新獸藥研究

