UHPLC-Q-Orbitrap HRMS測定烏龍茶中呈味核苷酸及鐵觀音做青過程中呈味核苷酸變化分析
黃艷,周孝森,高晨曦,張靈枝,榮杰峰,孫威江*
UHPLC-Q-Orbitrap HRMS測定烏龍茶中呈味核苷酸及鐵觀音做青過程中呈味核苷酸變化分析
黃艷1,2,周孝森1,3,高晨曦2,張靈枝2,榮杰峰4*,孫威江2*
1. 福建農林大學安溪茶學院,福建 泉州 362400;2. 福建農林大學園藝學院,福建 福州 350002; 3. 中國農業科學院茶葉研究所,浙江 杭州 310008;4. 泉州海關綜合技術服務中心,福建 泉州 362000
核苷酸是茶葉中核酸和咖啡堿生物合成的重要底物,也是茶湯中重要的鮮味物質之一。建立了一種超高效液相色譜-四極桿/靜電場軌道阱高分辨質譜法(UHPLC-Q-Orbitrap HRMS)測定核苷酸含量的分析方法,可在4?min內測定茶葉中胞苷-5'-單磷酸(CMP)、尿苷-5'-單磷酸(UMP)、腺苷-5'-單磷酸(AMP)、肌苷-5'-單磷酸(IMP)和鳥苷-5'-單磷酸(GMP)等5種呈味核苷酸,并分析這5種核苷酸在鐵觀音做青過程中含量的變化規律。結果表明,5種核苷酸的檢出限為0.87~1.47?μg·g-1,定量限為2.62~4.41?μg·g-1,線性范圍為50~1?000?ng·mL-1,日內精密度和日間精密度分別為2.17%~4.17%和2.95%~4.74%,回收率為72.89%~91.98%;鐵觀音茶樹品種可檢測出UMP、CMP和AMP 3種核苷酸,含量分別為16.98~26.78、14.31~17.56、7.80~9.91?μg·g-1,由高到低依次為UMP、CMP、AMP,CMP在做青后期緩慢增加;呈味核苷酸總量變化范圍為40.78~56.69?μg·g-1,呈現穩定性波動。該方法快速準確、靈敏度高、穩定性和精密度好,可為茶葉加工過程中風味化學物質分析的研究提供技術支持。
鐵觀音;鮮味;做青;呈味核苷酸
核苷酸是核糖核酸及脫氧核糖核酸的基本組成單位,是生物體核酸合成的前體物質,也是人體健康所需的必要成分[1]。食品中的鮮味化合物除了以谷氨酸鈉為代表的氨基酸類、肽胺、肽等化合物以外,還包括5'-核苷酸。核苷酸的核糖上有3個自由基團,通過與磷酸縮合作用產生5'-核苷酸、3'-核苷酸和2'-核苷酸等3種不同的核苷酸異構體,只有磷酸基連接在5'-碳原子上且磷酸基中2個羧基解離,才能產生肌苷-5'-單磷酸(IMP)、鳥苷-5'-單磷酸(GMP)、胞苷-5'-單磷酸(CMP)、尿苷-5'-單磷酸(UMP)等鮮味核苷酸類化合物,其中IMP和GMP為主的核苷酸類[2-4]是主要的鮮味核苷酸。此外,核苷酸能與氨基酸產生協同效應,提高食品風味[5-7]。
鮮味是5種基本味覺(咸、甜、苦、酸、鮮)之一,具有調節食欲、預防慢性疾病和減少脂肪攝取[8]等功效。鮮味是茶葉中重要的風味屬性,研究茶葉中呈鮮味核苷酸的特征,對分析茶葉的品質和保健功效具有重要的科學價值。呈味核苷酸能夠提高茶葉風味,調味茶通過添加呈味核苷酸增加風味[9];適當添加IMP和GMP,能降低表沒食子兒茶素沒食子酸酯(Epigallatecatechin gallate,EGCG)的澀味,提高回甘生津的效果[4];呈味核苷酸也能提高白茶茶湯的醇厚度[10]。
作為閩南烏龍茶的代表,清香型鐵觀音鮮度特征凸顯,擁有與綠茶類似的鮮爽品質。搖晾結合的做青工序是形成鮮味的關鍵環節,較少研究從烏龍茶的加工風味化學層面,探討做青過程中游離態核苷酸的變化與茶湯鮮味的關系。現有定量分析核苷、核苷酸和堿基的檢測方法主要包括毛細管電泳法[11]、液相色譜法[12-16]、離子交換高效液相色譜法[17]、熒光定量高效液相色譜法[18]、液相色譜-質譜聯用法[19-21]、親水色譜-高分辨率質譜聯用法[22-23]等。離子交換色譜法因高鹽流動相的使用,無法與質譜聯用[25];毛細管電泳法測定數據可靠、靈敏度高,但操作復雜且成本高。茶葉中游離核苷酸含量低、次生代謝產物的干擾因素多,分析技術難度較大,單純的液相色譜分析準確性不高,與高分辨質譜聯用,保證定性色譜峰和定量檢測同時進行,可縮短分析時間、提高色譜峰的分辨率和靈敏度[23],適用于以茶葉為代表的復雜基質中多種核苷酸類化合物檢測。本研究建立了超高效液相色譜-四極桿/靜電場軌道阱高分辨質譜法(UHPLC-Q-Orbitrap HRMS)測定茶葉中游離核苷酸含量的分析方法,并探討烏龍茶做青過程中呈味核苷酸的動態變化,旨在為烏龍茶加工風味化學研究提供理論參考。
1 材料與方法
1.1 試驗儀器
Q-Exactive四極桿-靜電場軌道阱高分辨質譜系統、Vanquish UHPLC超高效液相色譜系統,美國Thermo Scientific公司;NBS-U410型超低溫冰箱,青島海爾股份有限公司;ALPHA1-4 LD plus型真空冷凍干燥機,德國Christ公司;電子分析天平,賽多利斯科學儀器有限公司;Vortex2渦旋振蕩儀,德國IKA儀器設備有限公司;BDP-20TJ型超純水機,南京權坤生物科技有限公司;HWS-24型恒溫水浴鍋,上海一恒科技有限公司;SC-3610型低速離心機,安徽中科中佳科學儀器有限公司;UC-7600超聲波機,深圳佳源達科技有限公司;Acquity UPLC C18色譜柱(2.1?mm×100?mm,1.7?μm),美國Waters公司;0.22?μm PTFE針式濾膜,Biosharp生物科技公司;6CWY-85搖青機,福建佳友茶葉機械智能科技股份有限公司。
1.2 主要試劑與藥品
CMP、UMP、IMP、GMP和腺苷-5'-單磷酸(AMP)標準品購于中國計量科學院標準物質中心,純度均≥98%;UPLC級乙腈、甲酸和乙酸購于德國Merk公司。
1.3 茶樣制備
烏龍茶做青包括搖青和晾青。于2020年9月采收安溪縣鐵觀音品種的一芽三葉新梢,按照傳統安溪鐵觀音的“三搖三晾”的中等發酵程度做青,具體步驟見表1(搖青使用6CWY -85搖青機,晾青使用直徑106?cm有孔竹篩及晾青架)。在做青的一搖(時間2?min)、一晾(時間70?min)、二搖(時間4?min)、二晾(時間83?min)、三搖(時間23?min)、三晾(時間140?min)的每個環節取樣,3次重復,共18個樣品。每個樣品各取200?g,液氮固定后放入–80?℃冰箱保存。樣品使用前,真空冷凍干燥至含水率5%以內,取葉片部位,用預冷的研缽磨成100目茶粉,待用。
1.4 試驗方法
1.4.1 核苷酸提取
用分析天平稱取0.200?g茶粉放入15?mL離心管中,加入10?mL超純水,渦旋振蕩2?min混合均勻。將離心管放入100?℃恒溫水浴鍋中浸提10?min后,超聲波輔助提取10?min,提取出大部分的核苷酸,隨后5?000?r·min-1離心10?min取上清液用0.22?μm PTFE膜過濾,轉入進樣瓶中待測,可放入4?℃冰箱保存1周。
1.4.2 標準溶液的制備
準確稱取適量的5種核苷酸標準品,以超純水為溶劑,配制成質量濃度為1?mg·mL-1的混合標準儲備溶液。取標準儲備溶液添加適量純水分別稀釋成質量濃度為50、100、200、500、1?000?ng·mL-1的標準工作溶液,0.22?μm PTFE濾膜過濾,待測。
1.4.3 儀器條件
色譜條件:流動相A為0.1%的甲酸水溶液,流動相B為純乙腈,梯度洗脫程序為0~2.0?min,10% B;2.0~2.1?min,10%~50% B;2.1~3.5?min,50% B;3.5~3.6?min,50%~90% B;3.6~4.0?min,90% B;4.0~4.1?min,90%~10% B;4.1~4.5?min,10% B。柱溫30?℃,流速0.3?mL·min-1,進樣體積10.0?μL。質譜儀條件:可加熱電噴霧離子源(HESI),噴霧電壓為3?500?V,毛細管溫度為350?℃,離子傳輸管溫度為350?℃,平行反應監測(PRM)模式,負離子模式,鞘氣(N2)為705?psi,輔助氣(N2)為202?psi,二級掃描分辨率為17?500,二級質譜歸一化碰撞能(NCE)為20%、40%、60%。
5種核苷酸質譜圖見圖1,核苷酸定性監測離子對參數見表2。
1.4.4 方法學驗證
以標準工作液的色譜峰面積()對質量濃度(,ng·mL-1)進行線性回歸。在信噪比(S/N)3和10條件下分別計算出5種核苷酸的定性檢出限(Limit of detection,LOD)和定量檢出限(Limit of quantitation,LOQ)。
穩定性試驗:取已知濃度的AMP標準溶液,室溫放置12?h和24?h,按1.4.3章節儀器條件測定AMP峰面積,計算其含量及相對標準偏差(RSD,%),n=6。

圖1 5種核苷酸的質譜圖

表2 5種核苷酸定性定量分析質譜數據
精密度試驗:使用100?ng·mL-1混合標準待測液,按1.4.3章節儀器條件測定CMP、UMP、AMP、IMP、GMP峰面積,分別計算含量及相對標準偏差(RSD,%),平行測定6次。日內精密度在1?d內測定6次,計算RSD;日間精密度為3?d內測定6次,計算RSD。
加標回收:取1?mg·mL-1的5種核苷酸的標準儲備液,添加適量體積純水稀釋成質量濃度為100?ng·mL-1和1?000?ng·mL-1標準工作溶液。吸取1?mL標準工作液于樣品中,按1.4.1章節步驟制備成加標樣品溶液,并測定核苷酸含量。

1.5 數據處理與分析
2 結果與分析
2.1 方法驗證
2.1.1 線性范圍與檢出限
表3所示為5種核苷酸的線性回歸方程及線性范圍等相關信息。CMP、UMP、AMP、IMP、GMP在50~1?000?ng·mL-1范圍內具有良好的線性,相關系數(2)達0.99以上,方法檢出限分別為1.43、1.32、1.41、1.47、0.87?μg·g-1,定量限分別為4.28、3.97、4.23、4.41、2.62?μg·g-1。結果表明,該方法具有足夠的靈敏度,能夠滿足測試要求,可以用于定量和定性分析。
2.1.2 穩定性與精密度試驗
穩定性試驗結果顯示,AMP在12?h測得RSD為3.66%,放置24?h之后RSD為3.72%,表明溶液在室溫條件下24?h保持穩定狀態。
精密度試驗結果顯示(表4),日內精密度和日間精密度的RSD分別為2.17%~4.17%和2.95%~4.47%,均小于10%,說明該方法穩定,精密度高,能夠滿足測試要求。
2.1.3 回收率試驗
測試樣品中不含有IMP和GMP,其余3種核苷酸均能檢測到。在樣品中分別添加低質量濃度(100?ng·mL-1)和高質量濃度(1?000?ng·mL-1)的標準溶液,加標回收率為72.89%~91.98%,RSD為0.56%~9.31%(表5),表明該方法存在一定的基質效應,茶葉中干擾物質較多。Zhao等[23]對白茶中核苷酸的研究發現,使用親水性正相色譜-高分辨質譜分析白茶萎凋過程中核苷酸,基質效應十分明顯,其中UMP和IMP回收率較低,分別為31.0%~40.4%和38.8%~62.7%,GMP、CMP、AMP情況略好,分別為71.3%~74.1%、61.4%~71.9%和78.5%~ 86.2%。因此,相較于文獻方法,本研究建立的方法,通過先水浴后超聲波的復合提取方式,可以提高各種核苷酸的回收率。
2.2 鐵觀音做青過程中核苷酸變化
如圖2所示,IMP、GMP是鮮度較強的核苷酸,但在鐵觀音品種的做青過程中未能檢測到。做青階段,AMP、CMP和UMP組分間含量差異顯著,含量高低依次為UMP、CMP、AMP,其中UMP含量在16.98~26.78?μg·g-1,CMP含量在14.31~19.97?μg·g-1,AMP含量在7.80~9.91?μg·g-1。做青階段,AMP含量呈現波動性變化;CMP的含量變化可以分為2個階段,在一搖、一晾、二搖階段保持穩定,二晾、三搖、三晾階段增加,2個階段間含量差異顯著,階段內含量差異不顯著;UMP含量在三搖階段顯著增加,然后又恢復到初始水平,其余各階段變化不顯著,這說明UMP在做青階段的合成和分解處于動態平衡,含量沒有發生明顯變化。在鐵觀音做青過程中,呈味核苷酸總量范圍為40.78~56.69?μg·g-1,呈現動態平衡狀態(表6),除了三搖階段UMP的波動造成游離核苷酸總量增加之外,其余各階段差異不顯著。
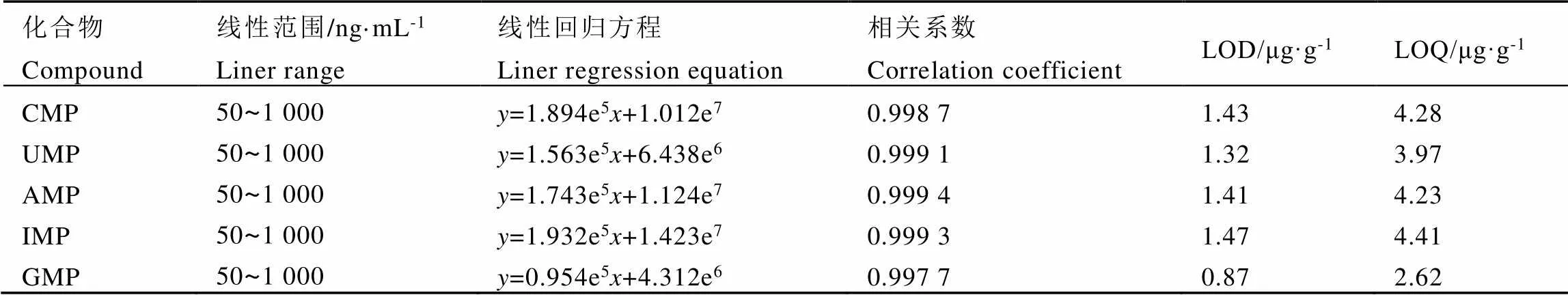
表3 5種核苷酸的線性關系、線性方程及相關系數
注:表中表示峰面積,代表標準品質量濃度(ng·mL-1)
Note:represents the peak area andrepresents the mass concentration (ng·mL-1) of standard substances

表4 日內精密度與日間精密度(n=6)
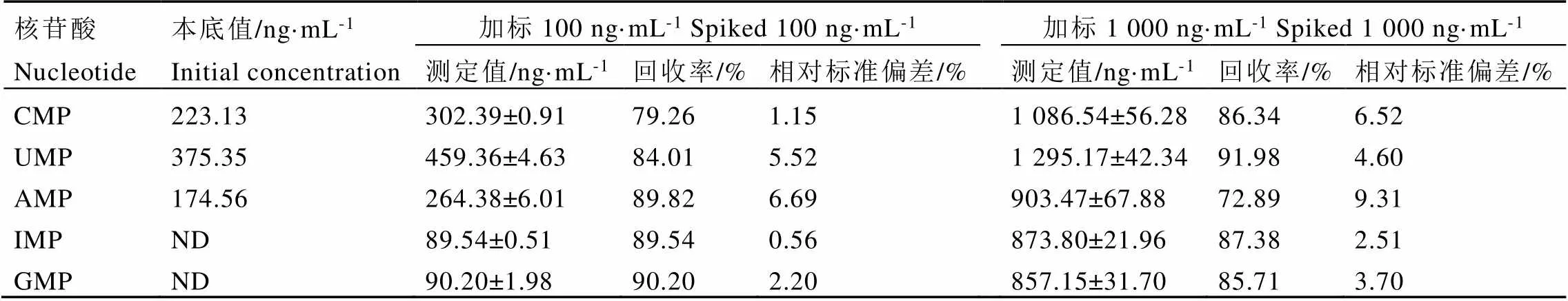
表5 鐵觀音中5種核苷酸的加標回收率(n=3)
注:ND表示未檢出
Note: ND indicates not detectable
植物中核苷酸含量會隨著環境的改變在短時間內發生劇烈變化[24]。磷酸核糖基轉移酶催化堿基與磷酸核糖生成核苷酸[25],離體植物的游離態5'-核苷酸被組織中廣泛存在的磷酸酶分解而導致含量下降[22],具有生物活性的植物組織同時存在核苷酸的合成與分解代謝。在鐵觀音做青過程中,葉片細胞仍存在生物活性,除了CMP在做青后期增加外,AMP、UMP呈現為動態平衡狀態。核苷酸的變化趨勢有所不同,可能是底物濃度不同,導致反應速率差異;也可能是催化反應的酶活性、反應速率不同,導致核苷酸含量存在差異[26]。做青前期,由于各時間節點的間隔太短,這種差異性無法顯現。做青后期,組織水分減少,相關酶活性降低,核苷酸變化更明顯。
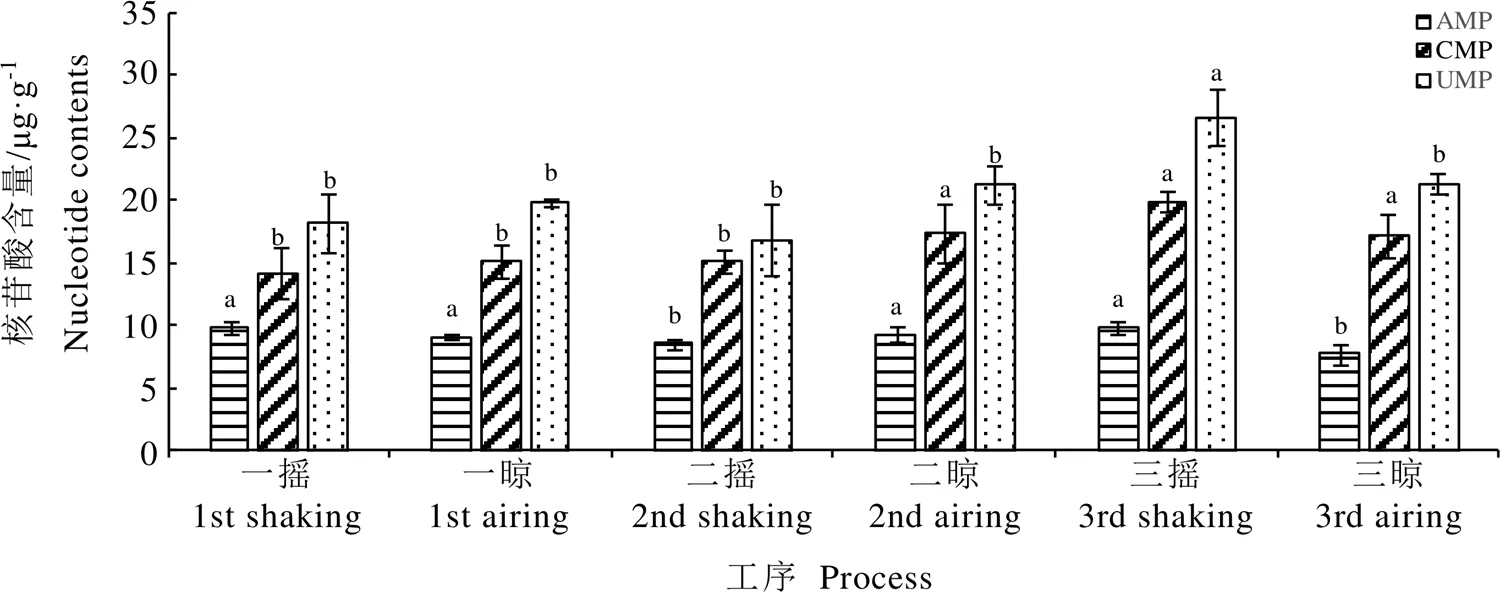
注:不同小寫字母表示不同做青工序的同一核苷酸在P<0.05水平差異顯著
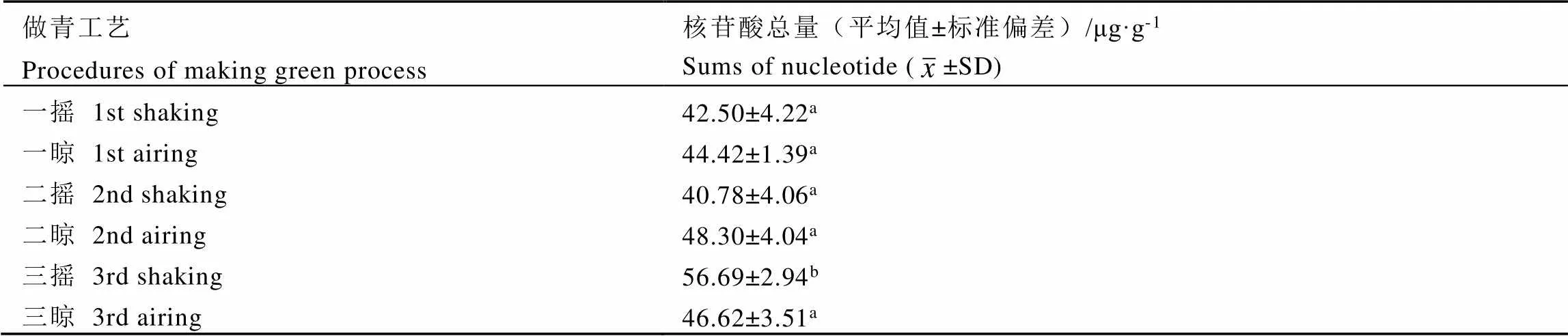
表6 不同做青階段鐵觀音呈味核苷酸總量
注:同一列不同字母代表數值間存在顯著差異(<0.05)
Note: Different letters in the same column mean significant differences (<0.05)
3 討論
目前,暫未有使用反相液相色譜串聯高分辨質譜對茶葉中游離態呈味核苷酸進行定量分析的相關報道。本研究首次建立了超高效液相色譜-四極桿/靜電場軌道阱高分辨質譜法測定茶葉中游離態呈味核苷酸,該方法能夠在4?min內快速、便捷地測定游離態呈味核苷酸的含量,精密度(RSD<5%)、檢出限(0.87~ 1.47?μg·g-1)、定量限(2.62~4.41?μg·g-1)和回收率(72.89%~91.98%)均呈現良好結果,可用于茶葉中呈味核苷酸的定性和定量分析。植物復雜的代謝產物使得微量核苷酸的提取和分析變得十分復雜[27]。Baccolini等[28]和Dietmair等[29]研究表明,快速沸水浸提法僅適用于提取核苷,不適用于提取核苷酸。本研究采用先沸水后超聲波各浸提10?min的復合提取方法,將親水色譜改為反相色譜,雖然不同核苷酸的分離度相對差一些,但是對于高分辨質譜PRM模式,分離度差并不影響相關物質的定性定量分析。復合提取方式提高了目標化合物的提取效率,方法整體回收率相較于Zhao等[23]的方法有較大提高,從31.0%~86.0%提高至72.89%~91.98%。
食品領域對呈味核苷酸及其衍生物的研究較多[30-32],烏龍茶呈味核苷酸的研究較少。成品茶呈味核苷酸的組成和含量存在茶類和品種差異。綠茶以AMP、UMP為主,紅茶以CMP、GMP、UMP為主[33]。黑茶中AMP含量隨茶樹品種不同差異顯著[34-35]。本研究發現烏龍茶呈味核苷酸以UMP、CMP、AMP為主。
已有研究表明,呈味核苷酸有類味精的協同作用,可提高茶葉鮮味[33]。AMP、IMP、GMP的滋味閾值分別為500、250、125?ng·mL-1[36],尚未知CMP和UMP的滋味閾值。風味閾值越低,說明其敏感度越高,鮮味貢獻度依次排序為GMP>IMP>AMP。本研究檢測出鐵觀音做青過程中AMP平均值為9.10?μg·g-1,按照1∶50茶水比計算,AMP的滋味活性值(TAV)為0.36,小于1,對鮮味沒有直接貢獻。鐵觀音做青階段尚未積累游離態IMP和GMP,無法通過TAV值推算5'-呈味核苷酸對鐵觀音的鮮味貢獻度。
茶葉鮮味的加工學研究側重于游離氨基酸[37],對呈味核苷酸相關研究相對滯后。茶樹鮮葉中腺嘌呤核苷酸含量最高,尿嘧啶核苷酸次之,鳥嘌呤核苷酸含量最低[33];鮮葉不含有IMP,部分品種的AMP在脫氨酶催化下脫去氨基生成IMP[38]。
5'-核苷酸在加工中整體表現為減少或發生結構修飾。白茶、綠茶、紅茶的核苷酸組成規律因加工工藝不同而有所差異。白茶萎凋過程,可檢出2種5'-呈味核苷酸AMP與GMP,分別在萎凋30?h和6?h后減少[23];也有研究認為,白茶萎凋過程中,可檢測到AMP、IMP、UMP、黃苷酸(XMP),僅UMP下降[39]。綠茶和紅茶加工過程中,核苷酸含量減少;綠茶的5'-呈味核苷酸含量整體高于紅茶,組成上AMP>UMP>CMP[38]。林家正[40]研究發現,紅光萎凋后期,腺嘌呤、腺苷和腺苷-3'-單磷酸含量顯著上升。本研究從烏龍茶中鑒定出3種5'-呈味核苷酸,含量依次為UMP>CMP>AMP,與鮮葉及綠茶的分布規律不一致,表明做青促進了烏龍茶化學組成的變化,且與其他茶類加工過程中的化學變化存在差異。
[1] Schaller J P, Kuchan M J, Thomas D L, et al. Effect of dietary ribonucleotides on infant immune status part 1: humoral responses [J]. Pediatric Research, 2004, 56(6): 883-890.
[2] 陳麗花, 張健, 陳培瓊, 等. 反相高效液相色譜法測定中國對蝦肉中呈味核苷酸[J]. 食品科學, 2009, 30(10): 215-218. Chen L H, Zhang J, Chen P Q, et al. Determination of five flavor nucleotides inmeat by RP-HPLC [J]. Journal of Food Science, 2009, 30(10): 215-218.
[3] Yamaguchi S. Basic properties of umami and its effects on food flavor [J]. Food Reviews International, 1998, 14(2/3): 139-176.
[4] 張月, 喻雪蓮, 田月月, 等. 紫外分光光度法與熒光光譜法探究呈味核苷酸與EGCG及其蛋白絡合物的相互作用[J]. 食品工業科技, 2021, 42(23): 73-80. Zhang Y, Yu X L, Tian Y Y, et al. Interaction of flavor nucleotides with EGCG and their protein complexes by UV absorption spectrometry and fluorescence spectrometry [J]. Science and Technology of Food Industry, 2021, 42(23): 73-80.
[5] Zhang Y, Venkitasamy C, Pan Z L, et al. Novel umami ingredients: umami peptides and their taste [J]. Journal of Food Science, 2017, 82(1): 16-23.
[6] 銀霞, 黃建安, 張曙光, 等. 綠茶滋味物質的研究進展[J]. 茶葉通訊, 2018, 45(1): 9-13.Yin X, Huang J A, Zhang S G, et al. Research progress of chemical components deciding the green tea taste [J]. Journal of Tea Communication, 2018, 45(1): 9-13.
[7] 翁世兵, 孫恢禮. 海產鮮味物質及海產品特征滋味的研究進展[J]. 中國調味品, 2007(11): 21-27. Weng S B, Sun H L. Marine umami substances and characteristic tastes of seafood [J]. Journal of China Condiment, 2007(11): 21-27.
[8] Chamoun E, Mutch D M, Allen-Vercoe E, et al. A review of the associations between single nucleotide polymorphisms in taste receptors, eating behaviors, and health [J]. Critical Reviews in Food Science and Nutrition, 2018, 58(2): 194-207.
[9] Hideki H, Tomomi U, Katsunori K. Analysis of tasty nucleotides in green tea infusions [J]. Chagyo Kenkyu Hokoku, 2002, 93: 55-61.
[10] 楊晨. 基于代謝助學的不同花色種類白茶滋味品質研究[D]. 北京: 中國農業科學院, 2021. Yang C. Study of the taste quality in different types of white tea based on metabolomics analysis [D]. Beijing: Chinese Academy of Agriculture Sciences, 2021.
[11] 史倩, 陳軍輝, 李鑫, 等. 不同緩沖體系對毛細管電泳法分離15種核苷類化合物效果的比較[J]. 色譜, 2011, 29(6): 481-487. Shi Q, Chen J H, Li X, et al. Comparison of different buffer systems for separation of 15 nucleosides by capillary electrophoresis [J]. Chinese Journal of Chromatography, 2011, 29(6): 481-487.
[12] 黃文武, 馮緯, 黃光榮. 反相高效液相色譜法測定醬油中的呈味核苷酸[J]. 中國調味品, 2019, 44(1): 150-153. Huang W W, Feng W, Huang G R. Determination of flavored nucleotides in soy sauce by RP-HPLC method [J]. China Condiment, 2019, 44(1): 150-153.
[13] 鄭紅, 于文江, 薛霞, 等. 高效液相色譜法同時測定嬰幼兒配方乳粉中5種游離核苷酸[J]. 分析試驗室, 2018, 37(1): 74-78. Zheng H, Yu W J, Xue X, et al. Determination of five free nucleotides in infant formula by HPLC [J]. Chinese Journal of Analysis Laboratory, 2018, 37(1): 74-78.
[14] Chen X, Wu Y, Huang L, et al. Magnetic dispersive solid-phase micro-extraction combined with high-performance liquid chromatography for determining nucleotides in(Wall.) Lindl [J]. Journal of Pharmaceutical and Biomedical Analysis, 2019, 174: 432-440.
[15] Duan W, Huang Y, Xiao J, et al. Determination of free amino acids, organic acids, and nucleotides in 29 elegant spices [J]. Food Science and Nutrition, 2020, 8(7): 3777-3792.
[16] Brown E G, Davies D. Extraction, pre-high-performance liquid chromatographic purification, and high-performance liquid chromatographic analysis of plant nucleotides [J]. Analytical Biochemistry, 1989, 183(2): 312-319.
[17] 李意. 離子交換色譜法測定小球藻提取物中的核苷酸[J]. 分析化學, 2004, 32(8): 1077-1079. Li Y. Determination of mononucleotides in extraction product of chlorella by ion exchange chromatography [J]. Chinese Journal of Analytical Chemistry, 2004, 32(8): 1077-1079.
[18] Zhang Y J, Krahnert I, Bolze A, et al. Adenine nucleotide and nicotinamide adenine dinucleotide measurements in plants [J]. Current Protocols in Plant Biology, 2020, 5(3): e20115. doi: 10.1002/cppb.20115.
[19] Straube H, Witte C P, Herde M. Analysis of nucleosides and nucleotides in plants: an update on sample preparation and LC-MS techniques [J]. Cells, 2021, 10(3): 689. doi: 10.3390/cells10030689.
[20] Zhu C, Liu X, Wang W, et al. Plant sample preparation for nucleoside/nucleotide content measurement with an HPLC-MS/MS [J]. Journal of Visualized Experiments, 2021, 168: e61956. doi: 10.3791/61956.
[21] Pabst M, Grass J, Fischl R, et al. Nucleotide and nucleotide sugar analysis by liquid chromatography-electrospray ionization-mass spectrometry on surface-conditioned porous graphitic carbon [J]. Analytical Chemistry, 2010, 82(23): 9782-9788.
[22] Guo S, Duan J, Qian D, et al. Hydrophilic interaction ultra-high performance liquid chromatography coupled with triple quadrupole mass spectrometry for determination of nucleotides, nucleosides and nucleobases inplants [J]. Journal of Chromatography A, 2013, 1301: 147-155.
[23] Zhao F, Qiu X H, Ye N X, et al. Hydrophilic interaction liquid chromatography coupled with quadrupole-orbitrap ultra high resolution mass spectrometry to quantitate nucleobases, nucleosides, and nucleotides during white tea withering process [J]. Food Chemistry, 2018, 266: 343-349.
[24] Gruber A, Haferkamp I. Nucleotide transport and metabolism in diatoms [J]. Biomolecules, 2019, 9(12): 761. doi: 10.3390/biom9120761.
[25] Dong M, Qin L, Xue J, et al. Simultaneous quantification of free amino acids and 5'-nucleotides in shiitake mushrooms by stable isotope labeling-LC-MS/MS analysis [J]. Food Chemistry, 2018, 268: 57-65.
[26] Stasolla C, Katahira R, Thorpe T A, et al. Purine and pyrimidine nucleotide metabolism in higher plants [J]. Journal Plant Physiology, 2003, 160: 1271-1295.
[27] Witte C P, Herde M. Nucleotide metabolism in plants [J]. Plant Physiology, 2020, 182: 63-78.
[28] Baccolini C, Witte C. AMP and GMP catabolism inconverge on xanthosine, which is degraded by a nucleoside hydrolase heterocomplex [J]. Plant Cell, 2019, 31(3): 734-751.
[29] Dietmair S, Timmins N, Gray P, et al. Towards quantitative metabolomics of mammalian cells: development of a metabolite extraction protocol [J]. Analytical Biochemistry, 2010, 404(2): 155-164.
[30] 張開誠. 鮮味劑的結構特征與呈味機理的探討[J]. 中國調味品, 2001(6): 28-32. Zhang K C. Study on the structural characteristics and tasting mechanism of umami agents [J]. China Condiment, 2001(6): 28-32.
[31] 席斌, 王莉蓉, 陳效威, 等. 冰鮮時間對不同性別青爪烏雞和黃麻雞雞肉中肌苷酸含量的影響[J]. 食品工業科技, 2018, 39(22): 21-24, 29. Xi B, Wang L R, Chen X W, et al. Influence of fresh time on inosine monophosphate content in black claw chicken and yellow chicken of different gender [J]. Science and Technology of Food Industry, 2018, 39(22): 21-24, 29.
[32] Liu Y, Huang F, Yang H, et al. Effects of preservation methods on amino acids and 5'-nucleotides ofmushrooms [J]. Food Chemistry, 2014, 149: 221-225.
[33] Koshiishi C, Crozier A, Ashihara H. Profiles of purine and pyrimidine nucleotides in fresh and manufactured tea leaves [J]. Journal of Agricultural and Food Chemistry, 2001, 49(9): 4378-4382.
[34] 張貽楊. 茯磚茶加工過程中非揮發性成分代謝組學研究[D]. 長沙: 湖南農業大學, 2019. Zhang Y Y. Metabolomics study of non-volatile components in the processing of Fu brick tea [D]. Changsha: Hunan Agriculture University, 2019.
[35] Liu Y T, Huang W M, Zhang C Y, et al. Targeted and untargeted metabolomic analyses and biologicalactivity of Tibetan tea [J]. Food Chemistry, 2022, 384: 132517. doi: 10.1016/j.foodchem.2022.132517.
[36] Fuke S, Ueda Y. Interactions between umami and other flavor characteristics [J]. Trends in Food Science & Technology, 1996, 7(12): 407-411.
[37] 劉爽. 綠茶鮮爽味的化學成分及判別模型研究[D]. 北京: 中國農業科學院, 2014. Liu S. Study on the fresh and brisk taste and its discriminant model of green tea [D]. Beijing: Chinese Academy of Agriculture Sciences, 2014.
[38] Negishi O, Ozawa T, Imagawa H. Biosynthesis of caffeine from purine nucleotides in tea plant [J]. Bioscience, Biotechnology Biochemistry, 1992, 56(3): 499-503.
[39] 陳翔, 田月月, 張麗霞. 基于親水相互作用液相色譜-三重四極桿質譜法研究白茶萎凋過程中代謝物的變化[J]. 茶葉科學, 2020, 40(2): 238-249. Chen X, Tian Y Y, Zhang L X. The changes of metabolites during the withering process of white tea based on HILIC LC-QqQ MS method [J]. Journal of Tea Science, 2020, 40(2): 238-249.
[40] 林家正. 紅光光照對茶鮮葉萎凋中代謝產物的影響研究[D]. 北京: 中國農業科學院, 2021. Lin J Z. Effect of red light on the metabolites of fresh tea leaves withering [D]. Beijing: Chinese Academy of Agriculture Sciences, 2021.
Determination of Flavored Nucleotides in Oolong Tea by Ultra-High Performance Liquid Chromatography-Quadrupole/Orbitrap High Resolution Mass Spectrometry and Changes of Flavored Nucleotides in the Making Green Process of ‘Tieguanyin’ Tea
HUANG Yan1,2, ZHOU Xiaosen1,3, GAO Chenxi2, ZHANG Lingzhi2, RONG Jiefeng4*, SUN Weijiang2*
1. Anxi College of Tea Science, Fujian Agriculture and Forestry University, Quanzhou 362400, China; 2. College of Horticulture, Fujian Agriculture and Forestry University, Fuzhou 350002, China; 3. Tea Research Institute, Chinese Academy of Agricultural Sciences, Hangzhou 310008, China; 4. Quanzhou Customs Comprehensive Technology Service Center, Quanzhou 362000, China
Nucleotide is a kind of important substrate for the biosynthesis of nucleic acid and caffeine in tea, which is also one of the most important umami substances in tea infusion. Ultra-high performance liquid chromatography-quadrupole/electrostatic field orbitrap high-resolution mass spectrometry was used for the determination of nucleotide contents. Five types of flavored nucleotides including cytidine 5'-monophosphate (CMP), uridine 5'-monophosphate (UMP), adenosine 5'-monophosphate (AMP), inosine 5'-monophosphate (IMP) and guanosine 5'-monophosphate (GMP) in tea were determined within 4?min, and dynamic changes of the above nucleotide contents in the making green process of ‘Tieguanyin’ Oolong tea were analyzed. The results show that the detection limits of the five nucleotides were 0.87-1.47?μg·g-1, with the limits of quantification of 2.62-4.41?μg·g-1and a linear range of 50-1?000?ng·mL-1. The intra-day and inter-day precisions were 2.17%-4.17% and 2.95%-4.74%, with a recovery rate of 72.89%-91.98%. Three types of nucleotides, AMP, CMP and UMP, were detected in tea cultivar ‘Tieguanyin’, with the UMP content of 16.98-26.78?μg·g-1, the CMP content of 14.31-17.56?μg·g-1, and the AMP content of 7.80-9.91?μg·g-1. The UMP, CMP, and AMP in ‘Tieguanyin’ were ranked in order from high to low and the CMP content increased slowly in late stages of making green process. The total amount of flavored nucleotides in the making green process varied from 40.78 to 56.69?μg·g-1, showing the trend of mild and stable fluctuation. The method is rapid, accurate and sensitive with high stability and precision, which can be used as an analytical technique for the study of flavor chemistry in tea processing.
Tieguanyin, umami taste, making green, flavored nucleotide
S571.1
A
1000-369X(2023)02-227-10
2022-11-24
2023-01-23
福建省自然科學基金(2019J01413)
黃艷,女,講師,主要從事茶葉加工與品質研究。*通信作者:jfrong2010@163.com;swj8103@126.com

