單雙手術間清創模式治療脊柱內固定術后早期深部感染的比較研究
施美蓉 陳素平 董瓊虹 林秀華 裴彬宏 蘇增標 曹杰
(中國人民解放軍聯勤保障部隊第910醫院,福建 泉州 362000)
脊柱內固定術后深部感染是脊柱外科的嚴重并發癥之一,發生率約為2%~20%[1]。而脊柱內固定術后早期感染是指脊柱內固定術后30 d內的感染,該時期多采用清創、引流及保留內固定的方式治療[2-3]。隨著手術抗感染護理理論的發展,清創術中已從單一手術臺,發展到清創前與清創后隔離開的雙手術臺模式,感染復發率有所降低[4]。但目前該類型手術仍是在同一間手術內進行,雖然清創后更換手術臺,但清創過程中的污染物或細菌隨氣溶膠的漂浮擴散,可能導致更換手術臺后的器械污染及感染傷口術后復發[5]。為了比較單雙手術間清創模式治療脊柱內固定術后早期深部感染的療效和安全性,本文回顧性分析了2004年5月-2021年7月我院收治的126例脊柱內固定術后早期深部感染患者的臨床資料,現報告如下。
1 資料與方法
1.1一般資料 回顧性分析2004年5月-2021年7月中國人民解放軍聯勤保障部隊第910醫院脊柱外科收治的脊柱內固定術后早期深部感染患者的臨床資料,術后根據臨床表現、實驗室檢查、影像學資料、病原學檢查診斷為脊柱內固定術后早期深部感染,并采取相應治療的患者。本組共126例,術前均完成分泌物培養及藥敏試驗,病原菌:金黃色葡萄球菌(staphylococcus aureus,SA)42例,耐甲氧西林金黃色葡萄球菌(methicillin resistant staphylococcus aureus,MRSA)12例,糞腸球菌(enterococcus faecalis,EF)9例,凝固酶陰性葡萄球菌(coagulase negative staphylococcus,CNS)21例,大腸桿菌(bacillus coli,BC)27例,鮑曼不動桿菌(acinetobacter baumannii,AB)9例,銅綠假單胞菌(pseudomonas aeruginosa,PA)6例。根據手術護理記錄單中的手術配合方法,所有患者分為雙手術間組、雙手術臺組和對照組3組,其中雙手術間組36例,采用雙手術間清創模式;雙手術臺組30例,采用單手術間內雙手術臺清創模式;對照組60例,采用單手術間內單手術臺清創模式。各組間一般資料及營養狀態比較,差異無統計學意義(P>0.05),具有可比性。見表1和表2。

表1 3組患者一般資料比較

表2 3組患者營養狀態比較
1.2方法 所有患者均采用氣管插管全身麻醉,俯臥位,術野常規消毒鋪無菌巾。拆除傷口縫線或原切口入路,切除竇道周圍皮膚和軟組織,大量生理鹽水洗凈傷口內膿液,徹底刮除內固定表面膿苔及膿腔內壁。碘伏浸泡傷口后,大量生理鹽水沖洗,保留內固定物,放置沖洗管和引流管,接沖洗液持續傷口沖洗。
1.2.1雙手術間組 脊柱傷口清創結束后,助手更換手套,傷口內填塞無菌紗布,切口保護膜密封傷口。麻醉醫生將氣管插管接便攜式呼吸機,并整理各種心電監護及管道。手術室轉運車緊貼手術床,高度與床面齊平,將患者保持俯臥位平移至轉運車上,并迅速轉移至提前消毒好的手術間。同樣方法將患者呈俯臥位平移至手術床上后,按流程檢查管道、主要器官及皮膚擺放位置,避免管道脫落松動或壓力性損傷[7],麻醉醫生恢復麻醉機工作方式,并整理各種監護及管道。手術醫生重新洗手消毒,更換無菌手術服,助手揭除傷口保護膜、取出紗布后,術者按開放性傷口原則重新傷口消毒、鋪巾。護士重新開手術臺,全部使用新消毒的手術器械及物品。術者使用碘伏、大量生理鹽水沖洗切口,放置沖洗管及引流管,逐層縫合關閉傷口,無菌敷料覆蓋。
1.2.2雙手術臺組 脊柱傷口清創結束后,助手更換手套,傷口內填塞無菌紗布,切口保護膜密封傷口。護士撤除手術臺、所有手術器械及手術鋪巾。手術醫生重新洗手消毒,更換無菌手術服,助手揭除傷口保護膜、取出紗布后,術者按開放性傷口原則重新傷口消毒、鋪巾。護士重新開手術臺,全部使用新消毒的手術器械及物品。術者使用碘伏、大量生理鹽水沖洗切口,放置沖洗管及引流管,逐層縫合關閉傷口,無菌敷料覆蓋。
1.2.3對照組 清創手術開始前,將縫合手術器械與清創器械分開放置在手術臺一邊,無菌巾覆蓋。整個清創過程避免接觸縫合器械。清創結束后,手術醫生重新洗手消毒,更換無菌手術服,助手將傷口重新消毒鋪無菌單。術者用無菌巾覆蓋清創器械,使用縫合器械。術者使用碘伏、大量生理鹽水沖洗切口,放置沖洗管及引流管,逐層縫合關閉傷口,無菌敷料覆蓋。
1.3術后處理
1.3.1抗感染治療 所有患者均靜脈應用敏感抗生素治療,抗生素停藥標準為體溫正常、傷口無紅腫或滲出、局部疼痛明顯改善,且連續3次復查血常規、C反應蛋白及降鈣素原正常。靜脈抗生素停藥后,選擇適宜的敏感口服抗生素繼續治療1個月;MRSA感染者口服抗生素療程延長至3個月。治療期間每周監測肝、腎功能變化,觀察藥物不良反應。
1.3.2沖洗引流管理 術后以慶大霉素生理鹽水(8萬單位:500 mL)持續沖洗,沖洗量為100 mL/h,每3天行引流液細菌培養。待引流液清亮、細菌培養連續2次陰性后可停止沖洗,改為單純引流。24 h引流量<30 mL時予拔除引流管。
1.4觀察指標 (1)一般情況:記錄手術時間、住院時間、出血量、手術費用。(2)感染控制情況:記錄縫合前器械表面細菌附著例數、細菌菌種與術前的相似例數、術后感染復發例數、傷口愈合等級。其中縫合前器械表面細菌附著例數是指開始傷口縫合前由巡回護士對3個手術器械表面進行細菌采樣,記錄的細菌培養陽性例數。(3)安全性:記錄術中麻醉不良事件(包括氣管插管松脫、呼吸機松脫或故障、監護儀松脫或故障)、護理不良事件(包括靜脈導管松脫或失效、導尿管松脫或失效、壓瘡、顏面部壓力性損傷)。
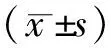
2 結果
3組患者各項觀察指標比較 見表3-表5。

表3 3組患者手術一般情況比較

表4 3組患者感染控制情況比較(例)

表5 3組患者安全性比較(例)
3 討論
3.1傳統單手術間清創模式的弊端 由于基層醫院清創理念的限制,治療脊柱內固定術后早期深部感染時仍是以單手術臺模式為主,甚至僅僅隔離清創術前與術后的手術器械,或更換手套而已,這種模式導致傷口縫合過程中極易受到清創前細菌的再次污染,導致感染復發[8]。Dharan等[9]研究發現術中細菌污染途徑包括接觸污染、噴濺污染和氣溶膠污染。Lener等[10]在單手術臺清創術中,發現雖然手術器械被隔離,但在部分病例中仍可在器械表面培養出與術前相同的細菌菌種。Boekel等[11]發現污染區域邊緣外直徑22.7 cm都是細菌微粒播散的危險區域。Mazurek等[12]進行50例頭頸部感染清創術時,發現開臺2 h后81%的病例在無菌巾隔離的器械和鋪巾上可培養出陽性細菌附著,且這些細菌與術前相同。所以有學者[13]認為雖然已嚴格遵循無菌操作,但污染部位周圍的氣溶膠仍可能導致鄰近物品的細菌污染,氣溶膠是導致細菌播散和感染復發的重要因素[13]。本研究中,對照組使用單手術臺,經歷清創手術后,26.67%(16/60)的病例在開始縫合前的器械表面培養出細菌,而這些細菌有93.75%(15/16)與術前細菌菌種相同,而雙手術臺組雖然縫合時重新開臺并更換手術器械,但細菌培養陽性率仍達到(10/33),且均與術前細菌菌種相同,2組間差異無統計學意義(P>0.05)。這也說明術中細菌播散并非主要由接觸傳播導致,接觸傳播通過嚴格的無菌操作可以很好得到控制,所以更換手術臺和手術器械并不能完全控制細菌附著。那么,導致兩種手術配合方式細菌附著率相似的原因就只能是空氣中的細菌氣溶膠了,這也與He等[13]的觀點相似。
另一方面,雖然脊柱深部感染術后復發與手術技術、無菌操作、感染菌種、術后抗感染及個人抵抗力有關,但器械表面的細菌附著無疑會增加感染復發的機率。De Simone等[14]對過去20余年腹部感染手術的調查中發現,使用接觸感染傷口的器械進行縫合時,雖然器械經過酒精等消毒劑擦拭消毒,但仍會增加8%~32%的感染復發率。本研究中雙手術臺組和對照組雖然并非所有檢出細菌附著的病例均會導致術后感染復發,但對照組中13例、雙手術臺組中5例術后感染復發的病例在縫合前均檢出相同菌種,而未檢出細菌附著的病例均未出現術后感染復發,這也從側面說明了通過氣溶膠傳播導致手術臺細菌附著是增加術后感染復發的重要因素之一。所以在脊柱深部感染手術中,如何減少細菌通過氣溶膠的播散對減少術后感染有重要的意義,應當引起重視,但顯然單手術間方式無論是否更換手術臺均無法有效控制該傳播途徑。
3.2雙手術間清創模式的優點 雙手術間清創模式是指感染患者清創過程與傷口閉合過程在不同手術間進行,該模式可以盡可能減少細菌在手術空間的播散,最早由Carvalho等[15]提出,但在國內尚未見應用的報道。泉州地區部分醫院自2018年開始逐漸在手術室嘗試使用該模式進行脊柱內固定術后早期深部感染,筆者回顧分析這些病例時發現雙手術間模式雖然無法對患者與術者的所有隨行物品進行完全隔離,但所有患者從清創手術間轉移至縫合手術間后,從開臺后的手術器械表面均未檢出細菌,這可能與空氣中細菌氣溶膠數量明顯下降,單位空間內的細菌數量不足以形成附著有關。Dong等[16]研究認為空氣中飄浮的細菌菌落總數需達到200 cuf/m3才可能形成附著并致病。本研究中由于脊柱內固定術后感染是一種嚴重的感染類型,所以清創手術一般在Ⅲ級或Ⅱ級手術室進行,手術室內的飄浮物可能增加攜帶細菌的機率,但檢索的病例中該組內的脊柱感染在縫合時均轉移到I級手術室進行,顯然飄浮塵粒數量的顯著減少可以減弱細菌的播散能力,所以這也導致器械表面附著的細菌獲得有效控制。值得注意的是,巡回護士對手術臺器械采樣的時間并未在檢索的病例中體現,無法明確隨著縫合時間的延長是否會影響器械表面附著的細菌數量。
脊柱內固定術后早期深部感染清創術后最主要目的就是控制感染、減少術后感染復發,而雙手術間模式很好地實現了這個目標。雙手術間組的術后感染復發率僅為2.78%(1/36),遠遠低于雙手術臺組16.67%(5/30)和對照組21.67%(13/60)的復發率,而低感染復發率也會增加傷口的愈合率,傷口甲級愈合率達到了97.22%(35/36),也遠高于其余2組。同時,雙手術間組的住院時間雖然與雙手術臺組類似,但明顯低于對照組,這與優異的感染控制效果和傷口愈合率有助于患者早日痊愈出院有關,具有良好的社會效益。
3.3雙手術間清創模式執行過程中的注意事項 雙手術臺和單手術臺模式均屬于單手術間模式,患者始終保持俯臥位,無需更換體位,手術前均細致檢查確保無誤,術中一般對身體各種管道的影響較小。但雙手術間模式則不同,它需要將患者轉運至另一個手術間,轉運方法較繁瑣,存在患者生命體征變化或輔助管道松脫的隱患。但筆者發現3組患者之間各種常見的麻醉或護理不良事件比較,差異無統計學意義,并未發現雙手術間模式會增加這些不良事件的機率。這可能與該過程中的特殊轉運方法有關,患者保持俯臥位平移至轉運車,再呈俯臥位平移至另一手術床,這就避免患者轉運時翻身可能導致的氣管插管、靜脈導管或導尿管脫位或松動等不良事件的發生,所以只要足夠細心,該轉運方式的安全性是可以保證的。
另外,雙手術間轉換勢必會增加整個手術時間,雙手術間組的手術時間達到(177.08±39.41)min,相比其余兩組,需額外增加40~60 min,這可能與開展的數量較為有限有關,隨著經驗的積累和規范,可能會大大縮短轉運時間,提高轉運的安全性。另外眾所周知,手術時間的延長必然會相應增加出血量,但本研究中,不同手術間轉運時傷口預先進行紗布填塞及手術無菌膜密封,這可以減少該時間段內的傷口滲血量,與其余2組比較,出血量并無顯著增加。
3.4雙手術間清創模式的不足 首先,雙手術間模式需增加轉運過程中的物品使用及麻醉與手術時間,這必然會導致手術費用的增加,該組中手術費用(8 718.75±1 716.34)元,高于其余2組。其次,脊柱內固定術后早期深部感染控制除與手術技術和術中配合有關,尚與菌種類型、感染時間及術后抗感染處理有關,限于納入的病例有限無法對其余影響因素進行闡述,需后期進一步研究。
綜上所述,雙手術間清創模式治療脊柱內固定術后早期深部感染,雖然可能會增加手術配合的難度,但可以減少手術室內細菌氣溶膠的傳播,繼而控制術后感染復發率,相比單手術間清創模式具有優勢。

