載體介導噬菌體入胞及抗胞內(nèi)寄生菌研究進展
宋 軍 苑慶欣 楊書博 周志新 孫東波
(黑龍江八一農(nóng)墾大學 動物科技學院/農(nóng)業(yè)農(nóng)村部東北寒區(qū)牛病防治重點實驗室/黑龍江省牛病防制重點實驗室,黑龍江 大慶 163319)
胞內(nèi)寄生菌可通過調(diào)節(jié)宿主細胞內(nèi)環(huán)境、逃逸宿主細胞免疫系統(tǒng)等機制,在宿主細胞內(nèi)創(chuàng)造適合其生存的生態(tài)位,從而可在宿主細胞內(nèi)長時間生存。對人類以及動物的健康有著巨大威脅的單核細胞增生李斯特菌、布氏桿菌、金黃色葡萄球菌等均為胞內(nèi)寄生菌[1]。目前臨床治療胞內(nèi)寄生菌引起的感染性疾病,面臨很多困難亟待解決。臨床批準使用的抗生素,大部分不能穿透哺乳動物細胞膜,從而無法進入細胞內(nèi)治療胞內(nèi)寄生菌。少數(shù)能夠穿透哺乳動物細胞膜的抗生素,無法在哺乳動物細胞內(nèi)停留、積累發(fā)揮抗菌作用。當抗生素治療難以達到有效殺滅胞內(nèi)寄生菌時,還會導致胞內(nèi)寄生菌產(chǎn)生耐藥,甚至引發(fā)慢性持續(xù)性感染或感染反復發(fā)作[2],對人類健康造成嚴重威脅。
噬菌體是一類能夠感染和裂解特定宿主細菌的病毒。在100多年的應用過程中,噬菌體在國內(nèi)外均已被證明能夠用于各種細菌性感染疾病的治療,特別是對耐藥細菌同樣具有良好的治療效果[3]。通常認為噬菌體無法穿透哺乳動物細胞膜,很難進入細胞發(fā)揮胞內(nèi)抗菌作用,但現(xiàn)在國外越來越多的研究證明,噬菌體可以直接與哺乳動物細胞相互作用[4],進入細胞,發(fā)揮胞內(nèi)殺菌作用。因此,噬菌體有潛力應用于治療胞內(nèi)寄生菌引起的細菌性疾病。
近年來,噬菌體治療胞內(nèi)寄生菌感染的相關(guān)研究表明,游離噬菌體對胞內(nèi)寄生菌的抗菌效果仍受到諸多限制。而載體介導噬菌體入胞可提高噬菌體入胞效率,防止噬菌體被宿主免疫系統(tǒng)清除,并保護噬菌體免受細胞內(nèi)環(huán)境影響。綜合以上分析可以看出,國外針對噬菌體抗胞內(nèi)寄生菌及載體介導噬菌體入胞的研究已非常豐富,而國內(nèi)噬菌體療法起步相對較晚,且胞內(nèi)寄生菌感染的臨床病例較少,導致噬菌體抗胞內(nèi)寄生菌的研究較之國外相對滯后。
因此,本研究將近年來國外關(guān)于載體介導噬菌體入胞及抗胞內(nèi)寄生菌研究進展進行總結(jié),詳細闡述不同介導噬菌體入胞的載體特性、入胞機制,以及如何提高入胞效率等方面的最新進展,以期為國內(nèi)噬菌體抗胞內(nèi)寄生菌的相關(guān)基礎研究提供依據(jù),并為更有效地利用載體投遞系統(tǒng)高效投遞噬菌體解決細胞內(nèi)細菌感染的實際問題提供參考與理論支撐。
1 胞內(nèi)寄生菌
胞內(nèi)寄生菌可分兼性胞內(nèi)寄生菌和專性胞內(nèi)寄生菌。前者可以在宿主細胞內(nèi)和細胞外生長繁殖,后者僅能在宿主細胞內(nèi)生長繁殖[1]。胞內(nèi)寄生菌可采用多種途徑通過哺乳動物細胞膜,從而寄生于吞噬細胞(如巨噬細胞)或非吞噬細胞(如內(nèi)皮細胞/上皮細胞)內(nèi),使其成為自己的宿主細胞[5]。例如分枝桿菌等可利用巨噬細胞的天然吞噬能力,通過受體介導的內(nèi)吞作用入侵并駐留在巨噬細胞內(nèi)[6]。沙眼衣原體、金黃色葡萄球菌和志賀菌等通過特殊機制來誘導細胞骨架重排,從而使非吞噬細胞出現(xiàn)吞噬活性[7-9]。某些胞內(nèi)寄生菌如沙門菌,同時具有感染吞噬細胞和非吞噬細胞的能力[10]。胞內(nèi)寄生菌進入非吞噬性細胞主要有2種機制:拉鏈模式和觸發(fā)模式。前者是細菌蛋白與宿主細胞黏附受體呈連續(xù)拉鏈狀結(jié)合,從而逐漸被宿主細胞吞噬,例如李斯特菌和耶爾森菌等[11-12],而后者則依賴于Ⅲ型分泌系統(tǒng)(T3SS)和細菌效應蛋白的分泌,例如沙門菌和志賀菌等[10,13]。這2種機制對胞內(nèi)寄生菌進入非吞噬細胞都至關(guān)重要。
細菌被宿主細胞內(nèi)化后,定居在被稱為吞噬體或內(nèi)體的特殊內(nèi)隔室中。在吞噬細胞中,吞噬體與溶酶體融合時,過低的pH和降解酶會破壞病原體[14]。然而,大多數(shù)胞內(nèi)寄生菌已經(jīng)進化出阻止吞噬體與溶酶體融合或改變?nèi)苊阁w殺滅細菌環(huán)境的能力。一些胞內(nèi)寄生菌甚至能夠逃離吞噬溶酶體,在細胞質(zhì)中存活[15]。例如,結(jié)核分枝桿菌能夠阻止吞噬體與溶酶體融合[16],并能在細胞質(zhì)和溶酶體中存活[17],從而為其在巨噬細胞內(nèi)存活創(chuàng)造一個合適的生態(tài)位;金黃色葡萄球菌則是能夠在pH較低的環(huán)境中生存,以至于其可在吞噬體與溶酶體融合后的環(huán)境中繼續(xù)生長繁殖[18]。胞內(nèi)寄生菌在細胞內(nèi)生長繁殖的機制不同,給當前胞內(nèi)寄生菌感染的治療帶來很多困難與挑戰(zhàn)。另外臨床批準使用的抗生素,大多無法穿過哺乳動物細胞膜,或細胞內(nèi)抗生素濃度難以達到殺死細菌的濃度,導致治療胞內(nèi)寄生菌感染有效藥物的選擇十分有限,加之細菌耐藥性的不斷增強,傳統(tǒng)的抗菌藥物很難對胞內(nèi)寄生菌產(chǎn)生作用。因此,尋找治療胞內(nèi)寄生菌引起感染的新藥物迫在眉睫。
2 游離噬菌體治療胞內(nèi)寄生菌
噬菌體是感染細菌、真菌等微生物的病毒總稱。它們是地球上最富多樣性的生命體,廣泛存在于自然界中的水、土壤、空氣等環(huán)境中。地球生物圈中的噬菌體數(shù)量可達1031~1032個[19]。可以說,只要有細菌存在的地方,就一定會有噬菌體的存在。噬菌體對于維持地球生物圈中的微生物菌群及其生態(tài)系統(tǒng)的平衡有著重要的作用[20]。
噬菌體抗菌的天然特性,使其在對抗多重耐藥細菌感染方面具有重要應用價值。但由于細胞膜可以保護細胞內(nèi)部的細菌不受胞外大部分效應分子的影響,而噬菌體分子量較高(>10 Mu)[14],無法被動擴散到哺乳動物細胞內(nèi),因此傳統(tǒng)研究認為噬菌體無法進入細胞內(nèi)部,進而發(fā)揮胞內(nèi)抗菌作用。
近年來有研究證明,噬菌體可以通過多種機制與哺乳動物細胞相互作用,從而被細胞內(nèi)化[21]。Nguyen等[22]在多種細胞中證明,T4噬菌體可從頂端膜快速轉(zhuǎn)運至基底外側(cè)膜,如MDCK細胞(犬腎細胞)、腸T84細胞、Caco-2細胞、A549細胞(肺上皮細胞)、Huh7細胞(肝細胞上皮細胞樣細胞)和hBMec細胞(腦內(nèi)皮細胞)。上述研究表明,使用噬菌體殺滅胞內(nèi)寄生菌具有可行性。與抗生素療法相比,噬菌體治療具有更多優(yōu)勢。首先,噬菌體具有高度特異性,治療細菌感染時,不會對宿主體內(nèi)的正常微生物菌群造成損傷[23];其次,噬菌體會在感染部位特異性繁殖,具有持續(xù)殺菌的作用;噬菌體在失去宿主細菌之后,無法繼續(xù)復制,不會出現(xiàn)蓄積中毒的情況;目前的研究中尚未發(fā)現(xiàn)噬菌體對哺乳動物細胞存在致突變能力以及遺傳毒性等。
雖然噬菌體治療細菌性疾病有很多優(yōu)點,許多研究試圖將游離噬菌體應用于胞內(nèi)寄生菌的治療,但還有很多困難亟待解決。例如Guang-Han等[24]應用噬菌體在體內(nèi)和體外治療類鼻疽伯克霍爾德菌感染中發(fā)現(xiàn)。在類鼻疽伯克霍爾德菌感染A549細胞系(肺上皮細胞)前加入噬菌體C34,類鼻疽伯克霍爾德菌感染的肺上皮細胞在體外的存活率增加了2倍。在類鼻疽伯克霍爾德菌感染肺上皮細胞后加入C34噬菌體時,抗菌效果不明顯。并且小鼠在經(jīng)鼻感染類鼻疽伯克霍爾德菌2 h后,未經(jīng)治療的小鼠存活率為0,而治療后小鼠存活率提升至33%。突出了噬菌體的預防和治療潛力。上述研究表明,游離噬菌體可直接被細胞內(nèi)化,并靶向胞內(nèi)寄生菌,但卻無法證明胞內(nèi)寄生菌的數(shù)量會在治療后減少。目前限制游離噬菌體清除胞內(nèi)寄生菌的主要原因是入胞效率較低,并且無法在細胞內(nèi)環(huán)境中長期保持活性[25]。為使噬菌體能夠有效對抗胞內(nèi)寄生菌,需要載體投遞噬菌體來提高噬菌體的入胞效率,使其精準到達細菌所在的細胞內(nèi)部位,并保持活性。
3 載體介導的噬菌體遞送
前期關(guān)于游離噬菌體清除胞內(nèi)寄生菌的研究并未取得理想結(jié)果,噬菌體療法曾被認為不適合靶向治療胞內(nèi)寄生菌。為提高噬菌體的入胞效率、更加精準的靶向胞內(nèi)寄生菌,研究者們采用不同載體包封噬菌體遞送入細胞內(nèi)的方式,提高噬菌體抗胞內(nèi)寄生菌感染的治療效果(圖1)。
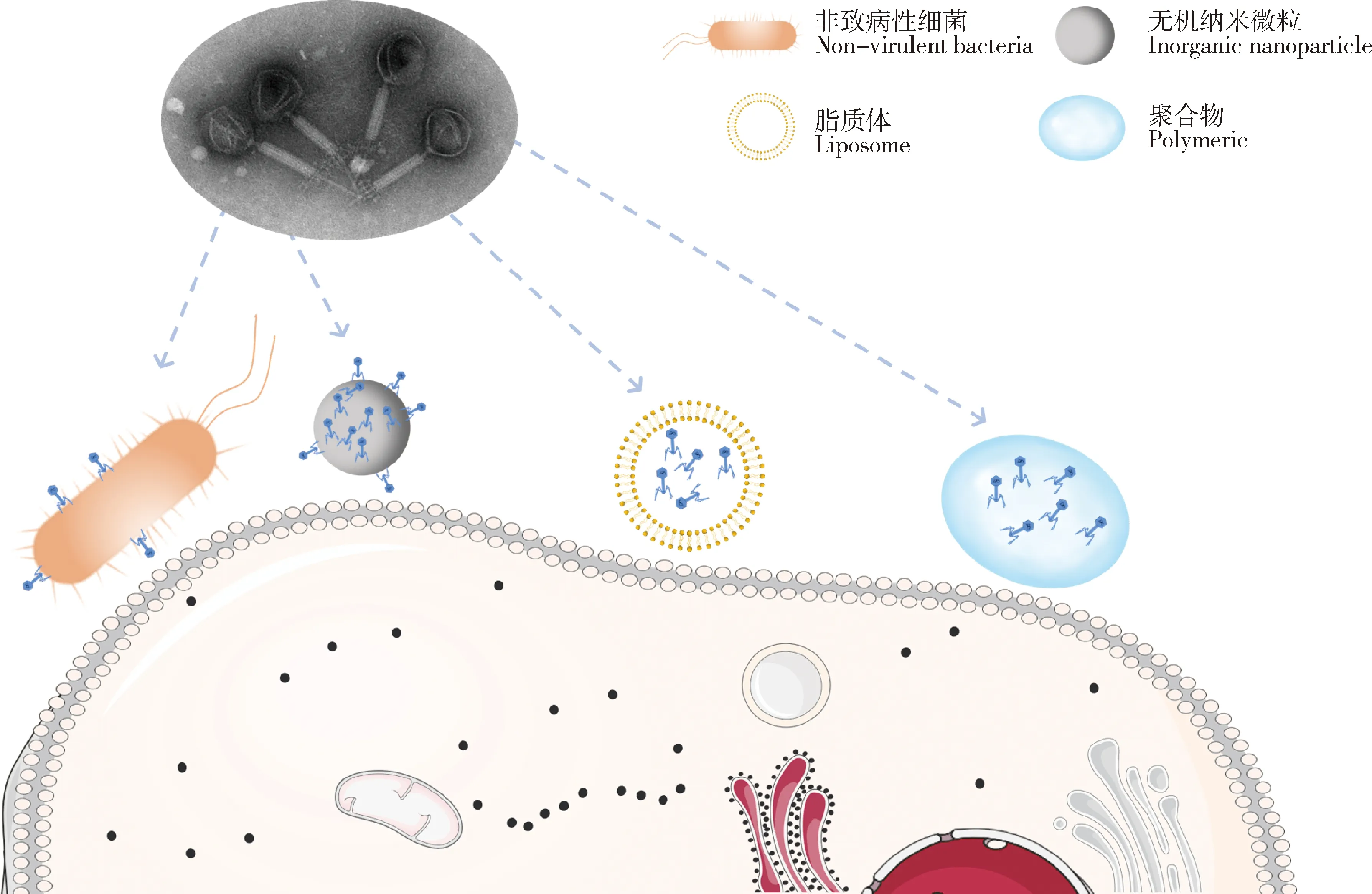
圖1 用于介導噬菌體入胞的載體Fig.1 Carriers for mediating phage entry into the cell
3.1 非致病性細菌作為載體
上世紀60年代,有人提出噬菌體可以借助一種被稱為“特洛伊木馬”的方法進入細胞內(nèi)部,從而清除胞內(nèi)寄生菌[26]。即在被噬菌體感染的胞內(nèi)寄生菌發(fā)生裂解前,附著在細菌表面或在細菌內(nèi)繁殖的噬菌體一同被哺乳動物細胞內(nèi)化,從而使噬菌體進入細胞內(nèi)部。
基于該假設,Broxmeyer等[27]提出使用非致病性且生長繁殖相對較快的恥垢分枝桿菌作為 TM4 噬菌體載體,靶向治療細胞內(nèi)鳥分枝桿菌以及結(jié)核分枝桿菌。研究表明,TM4噬菌體瞬時感染的恥垢分枝桿菌能以時間和劑量依賴方式有效清除RAW 264.7巨噬細胞內(nèi)鳥分枝桿菌和結(jié)核分枝桿菌。其后續(xù)研究表明,使用TM4噬菌體瞬時感染的恥垢分枝桿菌治療的小鼠與單獨使用游離噬菌體治療相比,小鼠脾臟中的鳥分枝桿菌數(shù)量顯著減少[28]。
上述研究表明,恥垢分枝桿菌有潛力作為載體介導噬菌體入胞,從而清除胞內(nèi)寄生菌,但后續(xù)研究發(fā)現(xiàn)該細菌在特殊情況下可引起軟組織感染[29],因此恥垢分枝桿菌等非致病性細菌可能存在的致病性會在臨床應用中造成安全隱患,致使目前非致病性細菌作為載體僅停留在動物試驗階段。
3.2 無機納米微粒作為載體
不同種類的無機納米微粒可單獨應用或與抗生素混合應用治療細菌感染[30]。無機納米微粒可同時以氧化應激誘導、釋放金屬離子以及非氧化機制等多種方式作用于病原體,因此病原體很難對無機納米微粒產(chǎn)生耐藥性[31]。并且無機納米微粒可與特定組織靶向因子結(jié)合,使無機納米微粒表面功能化,從而使藥物與其結(jié)合后能夠靶向胞內(nèi)寄生菌[32]。近年來,基于上述無機納米微粒的特性,許多研究將噬菌體與各種無機納米微粒結(jié)合,從而提高噬菌體抗菌效率,并將噬菌體應用范圍擴展至抗胞內(nèi)寄生菌[33-37]。
噬菌體可通過其衣殼上的酰胺鍵來修飾磁性氧化鐵納米微粒(MNPs),被噬菌體修飾后的MNPs能利用噬菌體特異性,快速、靈敏地從環(huán)境或生物樣品中檢測和分離細菌。不僅如此,Li等[33]研究表明MNPs與噬菌體結(jié)合后還具有清除細菌生物被膜的能力。帶有氨基的MNPs比帶有羧基的MNPs更易與噬菌體結(jié)合,并且較小的MNPs更易與噬菌體結(jié)合,且結(jié)合后去除生物被膜效率更高[34]。不過目前并沒有研究證明,MNPs與噬菌體結(jié)合后可被哺乳細胞內(nèi)化,從而清除胞內(nèi)寄生菌。
銀納米微粒(AgNPs)現(xiàn)已成為治療一系列多重耐藥細菌的新選擇。AgNPs可通過內(nèi)吞作用進入細胞,并在細胞內(nèi)環(huán)境中釋放,從而清除胞內(nèi)寄生菌[35]。并且有研究證明,M13噬菌體能夠通過基于靜電相互作用的自組裝方法附著在AgNPs上[36],并且M13噬菌體與AgNPs復合物能夠以劑量依賴的方式有效地殺滅革蘭陽性菌(金黃色葡萄球菌和枯草桿菌)和革蘭陰性菌(銅綠假單胞菌和大腸桿菌)。噬菌體與AgNPs偶聯(lián)后可能會促進噬菌體被細胞內(nèi)化,并協(xié)同清除胞內(nèi)寄生菌。
Fulgione等[37]將納米級仿生羥基磷灰石(HA)晶體作為噬菌體載體用于清除哺乳動物細胞內(nèi)的沙門菌。在人肝細胞癌細胞(HepG2)中測定噬菌體SR φ1與HA復合物清除胞內(nèi)寄生菌效率,并與單獨使用噬菌體SR φ1或HA形成相互對照。結(jié)果顯示,經(jīng)噬菌體SR φ1與HA復合物處理24 h后,其能夠成功內(nèi)化到HepG2細胞的細胞質(zhì)內(nèi),但HepG2細胞無法單獨內(nèi)化噬菌體SR φ1。并且經(jīng)噬菌體SR φ1與HA復合物處理后,感染沙門氏菌的雞肉樣品細菌載量減少3 log CFU/g。研究結(jié)果表明,使用噬菌體SR φ1與HA復合物的治療效果明顯優(yōu)于單獨使用SR φ1噬菌體或HA,并且噬菌體與HA復合物在低pH條件下,仍可穩(wěn)定儲存。
綜上所述,AgNPs、納米級HA晶體等無機納米微粒有潛力作為載體介導噬菌體入胞,清除胞內(nèi)寄生菌,但無機納米微粒的應用目前還存在著諸多限制。例如金屬納米微粒應用前,需對其與噬菌體的復合物進行毒性評估,來解決應用其治療胞內(nèi)寄生菌的相關(guān)安全問題。不僅如此,目前大多無機納米微粒與噬菌體結(jié)合后難以保證噬菌體長期儲存的穩(wěn)定性,并且無機納米微粒入胞機制研究尚不明確,入胞效率亟需提高。
3.3 脂質(zhì)體作為載體
脂質(zhì)體一般是由磷脂和膽固醇構(gòu)成的雙分子層閉合囊泡,其具有良好的生物相容性,能夠封裝各種類型的藥物,并保護其封裝的藥物不被降解或清除,這使得脂質(zhì)體成為研究最多,且最成熟的傳遞藥物的納米載體[38]。1995年,負載抗腫瘤藥物阿霉素的聚乙二醇化脂質(zhì)體(Doxil)經(jīng)FDA批準,成為第一個上市的納米藥物。Doxil可以延長阿霉素在體內(nèi)的循環(huán)時間,明顯降低阿霉素對心臟的毒性,提高患者的生存率[39]。此后,FDA批準了多個脂質(zhì)體藥物的臨床研究。我國也批準了多種脂質(zhì)體藥物制劑的生產(chǎn),比如注射用紫杉醇脂質(zhì)體、鹽酸多柔比星脂質(zhì)體、注射用兩性霉素B脂質(zhì)體等[40]。并且已有研究表明,阿米卡星脂質(zhì)體吸入懸浮液可用于治療非結(jié)核分枝桿菌引起的肺部感染。脂質(zhì)體作為載體介導噬菌體入胞時,可通過膜融合將噬菌體投遞入胞,從而提高噬菌體的入胞效率和殺菌效率[41]。目前關(guān)于脂質(zhì)體作為噬菌體載體的研究主要集中在使噬菌體獲得更好的入胞效率[42-45],防止噬菌體被宿主免疫系統(tǒng)清除以及使噬菌體免受較低pH影響[43,46-47],提高噬菌體的殺菌效率[48-50]等方面。
Colom等[42]使用陽離子脂質(zhì)體包封噬菌體雞尾酒(UAB_Phi20、UAB_Phi78和UAB_Phi87),通過口服的方式治療肉雞腸道沙門菌感染。研究結(jié)果表明,與游離噬菌體相比,封裝于陽離子脂質(zhì)體內(nèi)的噬菌體在酸性環(huán)境中降解速率明顯降低,并且在腸道存留時間更長。該研究中,脂質(zhì)體包封噬菌體和游離噬菌體對沙門菌定植的預防作用幾乎一致,但使用游離噬菌體治療后,沙門菌感染幾乎都會在72 h內(nèi)復發(fā),而使用脂質(zhì)體包封噬菌體治療后,其保護作用可持續(xù)7 d以上。Otero等[43]發(fā)現(xiàn),口服脂質(zhì)體包封的噬菌體有向機體不同器官擴散的能力。并且在后續(xù)構(gòu)建的Caco-2細胞、HT29腸細胞與Raji-B淋巴細胞的體外共培養(yǎng)模型中,脂質(zhì)體以聚集體形式粘附在細胞表面,嵌入細胞膜,甚至內(nèi)化到細胞內(nèi)[42]。
Nieth等[48]使用共聚焦熒光顯微鏡計數(shù)THP-1巨噬細胞攝取的游離大腸桿菌λeyfp噬菌體與脂質(zhì)體包封的大腸桿菌λeyfp噬菌體數(shù)量。每個THP-1細胞中脂質(zhì)體包封的噬菌體數(shù)量顯著高于游離噬菌體。Lapenkova等[49]也發(fā)現(xiàn)RAW264.7巨噬細胞內(nèi)化脂質(zhì)體包封的D29噬菌體速率比游離噬菌體提高了6~8倍,同時脂質(zhì)體包封的D29噬菌體對人外周血單個核細胞形成的結(jié)核性肉芽腫模型抗菌效果更強。Singla等[46]證明脂質(zhì)體噬菌體有進入小鼠腹腔巨噬細胞的能力,并且對小鼠腹腔巨噬細胞內(nèi)肺炎克雷伯菌的殺菌效率為94.6%。此外,游離噬菌體會在與中和抗體接觸后3 h內(nèi)被中和,而使用脂質(zhì)體包封噬菌體可以有效保護噬菌體免受中和抗體影響。Singla等[50]的后續(xù)研究證明,脂質(zhì)體包封的噬菌體在腹腔內(nèi)注射后的生物分布和生物滯留與游離噬菌體相比顯著提高。因此,脂質(zhì)體包封的噬菌體具有更高的生物利用度,并且在腹腔滯留時間更長,這使得應用脂質(zhì)體包封的噬菌體預防和治療肺炎克雷伯菌引起的呼吸道感染可能會更具優(yōu)勢[47]。Chhibber等[51]的研究同樣證明局部應用脂質(zhì)體包封的葡萄球菌噬菌體(MR-5和MR-10)可治療耐甲氧西林金黃色葡萄球菌(MRSA)引起的皮膚和軟組織感染。上述研究證明,脂質(zhì)體包封的噬菌體與游離噬菌體相比,在感染部位的滯留時間更長,具有更高的生物利用度,殺滅細菌的速度更快,具有更好的治療效果。
雖然脂質(zhì)體包封噬菌體的治療效果已得到諸多證明,但有研究表明,有尾噬菌體會與脂質(zhì)體雙分子層產(chǎn)生強烈相互作用,導致其包封效率極低[44]。Cinquerrui等[44]在殺死脂質(zhì)體外所有噬菌體后,對脂質(zhì)體內(nèi)的噬菌體進行了量化,發(fā)現(xiàn)大多數(shù)噬菌體并不是包封在脂質(zhì)體水核內(nèi),而是吸附在表面。這一發(fā)現(xiàn)與Nieth等[48]采用傳統(tǒng)薄膜水合方法封裝噬菌體時低溫透射電鏡以及熒光成像結(jié)果一致。吸附在脂質(zhì)體表面的噬菌體并不會受益于脂質(zhì)體的保護作用,但那些在體內(nèi)惡劣環(huán)境中存活并轉(zhuǎn)運到感染部位的噬菌體仍可能與脂質(zhì)體一同被細胞內(nèi)化,從而靶向胞內(nèi)寄生菌。
上述體內(nèi)外研究表明,脂質(zhì)體作為噬菌體載體具有明確的入胞機制,能夠有效提高噬菌體的入胞效率,從而靶向清除胞內(nèi)寄生菌,并可保護噬菌體免受機體內(nèi)環(huán)境影響,防止噬菌體被機體免疫系統(tǒng)清除,具有良好的應用前景。但想要獲得更好的臨床治療效果,仍需進一步提高脂質(zhì)體對噬菌體的包封效率以及儲存穩(wěn)定性,從而更有利于噬菌體脂質(zhì)體清除(殺滅)胞內(nèi)寄生菌。
3.4 聚合物作為載體
目前多數(shù)關(guān)于使用聚合物微粒包封噬菌體的研究,都是為避免噬菌體制劑在口服后受胃中蛋白水解環(huán)境或胃酸影響而失活。同時,實現(xiàn)噬菌體緩慢釋放,增加噬菌體在感染部位的停留時間,達到提高噬菌體治療效果的目的。盡管使用聚合物(如海藻酸鹽、殼聚糖、果膠、聚乳酸-羥基乙酸共聚物、丙烯酸樹脂等)包封噬菌體用于殺滅專性胞內(nèi)寄生菌的相關(guān)研究較少,但其應用于殺滅兼性胞內(nèi)寄生菌(腸球菌和金黃色葡萄球菌)的研究非常多,并且效果較好[25]。由于海藻酸鹽基微粒及聚乳酸-羥基乙酸共聚物已被用于細胞內(nèi)藥物傳遞,因此本文后續(xù)重點介紹了這兩種聚合物作為載體介導噬菌體入胞的研究進展。
3.4.1聚乳酸-羥基乙酸共聚物
聚乳酸-羥基乙酸共聚物(PLGA)是一種經(jīng)美國食品藥品監(jiān)督管理局(FDA)批準的生物可降解聚合物,由于其良好的生物相容性、可調(diào)節(jié)的降解特性和長期的臨床應用,目前已作為傳遞載體廣泛應用于小分子藥物和生物制劑(如肽、蛋白質(zhì)、DNA和RNA)等藥物。截至目前,已有數(shù)十種以PLGA為基礎的長效藥物獲得FDA批準上市。如2018年上市的皮下利培酮長效注射劑(PerserisTM)[52],2020年上市的醋酸亮丙瑞林混懸液(Fensolvi?)[53]等。
Agarwal等[54]通過吸附法將銅綠假單胞菌噬菌體加入PLGA微粒中,并凍干成粉劑。該噬菌體粉劑在室溫下儲存14 d后,滴度下降約為0.5個數(shù)量級。此方法使用的PLGA微粒,可以使噬菌體在前5 min爆發(fā)釋放約15%,并且剩余噬菌體可持續(xù)釋放。使用干粉噴粉器將摻有乳糖的噬菌體PLGA微粒輸送給小鼠后,發(fā)現(xiàn)這些微粒分散于小鼠肺部各個位置,并可成功治療小鼠由銅綠假單胞菌引起的肺炎。
Jamaledin等[55]發(fā)現(xiàn)PLGA微粒包封攜帶表達卵清蛋白(OVA)抗原決定簇的工程噬菌體,能夠誘導機體先天性和適應性免疫反應。并且PLGA納米微粒(≤1 μm)可進入哺乳動物細胞(如巨噬細胞、內(nèi)皮細胞、上皮細胞以及平滑肌細胞),以及長時間向細胞內(nèi)輸送其包封的藥物[56]。同時,包封噬菌體的PLGA微粒大小決定著噬菌體被巨噬細胞內(nèi)化程度[55]。較大的PLGA微粒(直徑8.0 μm)包封的噬菌體被巨噬細胞內(nèi)化程度低于較小的PLGA微粒(直徑1 μm)包封的噬菌體;并且PLGA多孔微粒包封的噬菌體被巨噬細胞的內(nèi)化程度低于PLGA無孔微粒。
綜上所述,使用大小合適的PLGA納米微粒包封噬菌體,可將噬菌體遞送至哺乳動物細胞內(nèi),從而靶向胞內(nèi)寄生菌。但目前噬菌體在被PLGA納米微粒包封后,存活時間仍受到限制,因此應用該方法治療胞內(nèi)寄生菌,仍需提高噬菌體在PLGA聚合物內(nèi)長期儲存的穩(wěn)定性。
3.4.2海藻酸鹽基微粒
海藻酸鹽是一種聚陰離子聚合物,是用于包裝噬菌體,使其可口服給藥最常用的聚合物[57]。海藻酸鹽基微粒可保護其包封的噬菌體免受酶降解,并且海藻酸鹽的膨脹與收縮具有pH依賴性,其在低pH環(huán)境(胃)內(nèi)呈收縮狀態(tài),但在高pH環(huán)境(腸)中會出現(xiàn)膨脹或進一步溶解的現(xiàn)象[58]。該特性使其作為對pH敏感噬菌體入胞的載體具有一定優(yōu)勢。不僅如此,使用殼聚糖[59]、果膠[60]、乳清蛋白[61]和丙烯酸樹脂[62]等包被海藻酸鹽或與海藻酸鹽混合使用,可提高海藻酸鹽的酸穩(wěn)定性和/或調(diào)節(jié)腸道內(nèi)海藻酸鹽基微粒的膨脹現(xiàn)象,進而延長海藻酸鹽包封噬菌體的活性。
Wall等[63]研究表明,使用海藻酸鹽基微粒包封噬菌體可有效減少沙門菌在豬扁桃體、回腸和盲腸中的定植。Ma等[64]測定海藻酸鹽/乳清蛋白包封的噬菌體在雛雞體內(nèi)時間分布,表明包封后的噬菌體在體內(nèi)停留的時間更長。Colom等[65]使用海藻酸鹽基微粒包封的噬菌體雞尾酒(UAB_Phi20、UAB_Phi78和UAB_Phi87)對肉雞進行口服給藥,得到與Ma等相似的結(jié)果。該研究進一步表明,每日使用包封后的噬菌體治療,可有效控制沙門菌感染。并且包封后的噬菌體與游離噬菌體相比,保護作用可持續(xù)更長時間,這與脂質(zhì)體包封噬菌體的研究結(jié)果相符合。Vinner等[62]研究證明,海藻酸鹽包封的大腸桿菌噬菌體K1F能夠被哺乳動物細胞內(nèi)化,并清除寄生于細胞內(nèi)的大腸桿菌[66],從而有效保護人膀胱上皮細胞(ATCC?HTB-4TM)免受大腸桿菌株EV36-RFP的侵襲。
上述結(jié)果表明噬菌體可在海藻酸鹽微粒中長期保持活性,并且海藻酸鹽包封的噬菌體在體內(nèi)能夠成功治療細胞內(nèi)細菌感染。這是由于海藻酸鹽微粒釋放的噬菌體能靶向目標細胞,無論噬菌體是在細胞外釋放,還是被細胞內(nèi)化后釋放,都可能清除胞內(nèi)寄生菌。但將海藻酸鹽基微粒應用于臨床,還需明確海藻酸鹽微粒包封噬菌體后的入胞機制,以及提高其入胞效率,從而提高噬菌體對胞內(nèi)寄生菌的殺菌效率。
4 挑戰(zhàn)與展望
目前許多研究已證明,噬菌體具有替代或補充抗生素成為新型抗菌藥物的潛力,特別是針對耐藥細菌感染和胞內(nèi)寄生菌感染,但將噬菌體應用于臨床仍面臨諸多挑戰(zhàn)。
噬菌體療法難以大范圍應用于臨床的主要原因是噬菌體只有在細菌達到一定密度時才開始增殖,致使噬菌體療法使用過早或噬菌體劑量不合適,都可能導致噬菌體在開始增殖之前被機體清除掉[67]。目前對噬菌體的藥代動力學特性仍缺乏了解,包括給藥后噬菌體穩(wěn)定性、哺乳動物宿主內(nèi)噬菌體和細菌之間的相互作用,以及噬菌體對機體免疫應答的影響[68-70]。因此,仍需更多基礎研究和臨床試驗來驗證噬菌體療法的療效,并評估噬菌體的理想劑量、給藥頻率以及噬菌體治療的持續(xù)時間。
一些用于治療的噬菌體產(chǎn)品已在一些東歐國家上市,并越來越多地應用于感染性疾病的治療,但目前還未有載體介導噬菌體入胞用于清除胞內(nèi)寄生菌的臨床試驗。噬菌體療法與傳統(tǒng)抗生素療法存在的差異使其在應用于臨床前需進行臨床隨機試驗來確認其療效,這導致噬菌體療法難以大規(guī)模應用于臨床,目前僅限于對個別患者進行實驗性治療。
由于噬菌體具有高度特異性,為最大限度地發(fā)揮噬菌體療法的治療潛力,最好是挑選多價噬菌體制作噬菌體雞尾酒,使其具有廣譜抗菌作用。但制備含有多種噬菌體且滴度穩(wěn)定的噬菌體制劑,需解決諸多相關(guān)的技術(shù)挑戰(zhàn)。例如,噬菌體制劑面對生產(chǎn)過程中產(chǎn)生的機械應力是否具有魯棒性等。最近完成的噬菌體治療人類細菌感染的跨國臨床研究計劃中[71],單個噬菌體表現(xiàn)出優(yōu)異儲存穩(wěn)定性,但該研究中噬菌體雞尾酒PP1131(由12個天然裂解性假單胞菌噬菌體組成)的總效價在制備后15 d內(nèi)卻下降了3個數(shù)量級。因此,擴大噬菌體制劑宿主譜更可行的方法是鑒定天然多價噬菌體或具有寬宿主譜的基因工程噬菌體,從而最大限度地減少雞尾酒配方所需的噬菌體種類。
胞內(nèi)寄生菌引起的感染性疾病,難以通過常規(guī)方法治療,且治療失敗風險極大。雖然一些噬菌體已被證明具有穿透哺乳動物細胞膜、靶向胞內(nèi)寄生菌并發(fā)揮其裂解活性的能力,但上述研究表明,無機納米顆粒、脂質(zhì)體、PLGA微粒等載體介導噬菌體投遞入胞,可使噬菌體在機體內(nèi)環(huán)境保持活性,提高噬菌體入胞效率,更好地靶向胞內(nèi)寄生菌。上述載體中,脂質(zhì)體作為載體,具有明確的入胞機制,可有效提高噬菌體入胞效率,并防止噬菌體被宿主免疫系統(tǒng)清除和免受細胞內(nèi)環(huán)境影響,這使得脂質(zhì)體也成為研究最廣泛且最成熟的介導噬菌體入胞的載體。目前載體介導噬菌體入胞的相關(guān)研究主要集中于研究噬菌體、胞內(nèi)寄生菌以及哺乳動物細胞之間的相互作用,以及明確各種載體的入胞機制,提高載體包封噬菌體的效率及包封后的入胞效率,從而開發(fā)適用于介導噬菌體入胞的載體的試驗/技術(shù)平臺。這些新的試驗/技術(shù)平臺,對載體介導噬菌體入胞、控制或治療胞內(nèi)寄生菌感染至關(guān)重要。
綜上可以看出,應用載體介導噬菌體入胞,清除胞內(nèi)寄生菌的治療方法前景十分廣闊。但國內(nèi)開展噬菌體治療的起步時間較之國外相對較晚,針對胞內(nèi)寄生菌感染的相關(guān)臨床病例較少,導致國內(nèi)噬菌體在胞內(nèi)寄生菌研究方面相對滯后。隨著胞內(nèi)寄生菌感染的病例逐漸增多,未來國內(nèi)關(guān)于噬菌體抗胞內(nèi)寄生菌的治療基礎和臨床研究同樣會逐漸增加。相信載體介導噬菌體入胞,在未來可能會成為理想的控制、治療胞內(nèi)寄生菌感染的療法,在生命科學領(lǐng)域發(fā)揮重要作用。