髓源樹突狀細胞對Ⅱ型膠原誘導關節炎小鼠CD4+CD25+Treg細胞的影響*
龔艷杰,魏 明
鄭州大學第五附屬醫院輸血科,河南鄭州 450052
類風濕關節炎(RA)是一類較為多見的自身免疫性疾病,以滑膜、骨及軟骨的進展性損傷為顯著特點,最后能夠使關節出現形狀改變、硬化強直等現象,具有特別高的致殘率[1-2]。實驗研究表明,包括淋巴細胞、滑膜細胞、樹突狀細胞(DC)等免疫細胞通過分泌各種細胞因子參與RA的發病[3-4]。DC是目前已知的作用最大的專職抗原提呈細胞(APC)之一,是固有免疫及獲得性免疫之間的重要紐帶,其在保持人體免疫耐受和免疫應答之間的平衡中發揮重要作用[5-6]。有研究表明,當未成熟樹突狀細胞(imDC)低表達CD80、CD86、主要組織相容性復合體(MHCⅡ)等細胞因子時,能使特異性免疫應答的較低潛能活化[7-9];也有研究表明,imDC在克羅恩病、多發性硬化癥等自身免疫性疾病的動物模型上能誘導幼稚T細胞(Tn)向調節性T細胞(Treg)分化,促進抗炎因子如白細胞介素(IL)-10、轉化生長因子(TGF)-β的表達,誘導免疫耐受,抑制炎癥性病變[10]。本實驗通過制作Ⅱ型膠原(CⅡ)誘導關節炎(CIA)小鼠模型,利用imDC和成熟樹突狀細胞(mDC)對其進行干預操作,以探討imDC對CIA的作用及其作用機制,為臨床開展RA細胞治療提供新的方案。
1 材料與方法
1.1實驗動物 40只6~8周齡的雄性BALB/c小鼠飼養于鄭州大學動物實驗中心無特定病原體(SPF)環境內,自由進食及進水,試驗操作中對動物的處理遵照動物倫理學的規則,動物許可證號:SYXK(豫)2017-0028。其中10只小鼠用于獲取骨髓源單核細胞,另外30只用于制作CIA動物模型。
1.2儀器與試劑 CⅡ、完全弗氏佐劑(CFA)、冰醋酸、脂多糖(LPS)購自美國Sigma公司,重組小鼠白細胞介素(rmIL)-4和重組小鼠粒細胞-巨噬細胞集落刺激因子(rmGM-CSF)購自美國PeproTech公司,三氫-吲哚菁型染料標記的抗鼠CD11c單抗(FE-Cy7-anti-CD11c)、藻藍蛋白(PE)標記的抗小鼠CD25單抗、CD86單抗(APC-anti-CD25、APC-anti-CD86)、藻紅蛋白標記的抗小鼠CD80單抗(PE-anti-CD80)、異硫氰酸熒光素(FITC)標記的CD4單抗以及MHCⅡ單抗購自美國BD公司,抗IL-10、抗-TGF-β和抗β-actin 單克隆抗體購自美國Santa Cruz公司,熒光標記山羊抗兔二抗及熒光標記大鼠抗山羊二抗購自英國Abcam公司,TGF-β和IL-10 ELISA試劑盒購自德國R&D公司。FACSCalibur流式細胞儀購自美國BD公司,倒置相差顯微鏡IX71型購自日本Olympus公司。
1.3方法
1.3.1小鼠BMDCs的分離[11]及培養 取10只BALB/c小鼠,用頸椎脫臼的方法將其處死,分離小鼠的股骨以及脛骨,再使用RPMI 1640培養基洗滌3次,除去兩邊的骨骺,用1 mL 的細空針吸取RPMI 1640培養基,多次洗滌骨髓空腔,同時使其完全分散開來,于25 ℃下2 000 r/min離心10 min,棄上層清液,收集骨髓單核細胞,按1︰1的比例滴加紅細胞裂解液,25 ℃放置2 min,待裂解結束,1 500 r/min離心5 min,除去上層清液,用培養基重懸細胞,使細胞濃度達到1×106/L,以4毫升/孔的密度將其種于6孔板內,每孔中加入含GM-CSF(20 ng/mL)+IL-4(10 ng/mL)的RPMI 1640培養基2 mL,5%CO2、37 ℃培養箱中孵育,培養第3天時用6孔板內的單孔懸浮培養液2 mL,加入全新的6孔板內再培養,每孔再加入含GM-CSF(20 ng/mL)及IL-4(10 ng/mL)的RPMI 1640培養基2 mL,5%CO2、37 ℃培養箱中繼續培養,培養7 d時,采集懸浮及半貼壁的細胞即為imDC。同時設置同型對照組。采用相同培養方法,培養第6天于6孔板中加入含LPS(1 μg/mL)RPMI 1640培養基2 mL,5%CO2、37 ℃培養箱中培養24 h,收獲的細胞即為mDC。在光學顯微鏡下觀察其形態同時采集照片。
1.3.2小鼠BMDCs的電鏡形態觀察 取上述培養的DC,以1 500 r/min離心10 min,棄上層清液,用0.1 mol/L磷酸鹽緩沖液(PBS)洗滌3次。用50 μL PBS重新懸浮細胞,把細胞懸浮液滴在多聚賴氨酸包被的蓋玻片上,37 ℃的恒溫電烤箱中加熱15 min,然后待細胞自然沉于蓋玻片上。細胞沉淀之后,用冷的PBS緩慢漂洗3 次,再在4 ℃下用冷的pH7.4、3%戊二醛固定1 h。再用PBS 洗滌3次,每次約30 min,用1%鋨酸固定1 h。PBS漂洗3次,然后使用不同濃度的乙醇慢慢逐步脫水,置換、干燥鍍膜。采用電子顯微鏡觀察細胞形態并記錄。
1.3.3小鼠BMDCs的表型檢測 取上述imDC和mDC,將細胞調整為1×106/mL,在100 μL反應體系中分別加入1 μL的三氫-吲哚菁型染料標記的抗鼠CD11c單抗、0.3 μL用PE標記的抗小鼠CD80單抗、0.6 μL用PE標記的抗小鼠CD25單抗以及CD86單抗,0.9 μL用FITC標記的MHCⅡ單抗,4 ℃黑暗條件下反應30 min,用PBS漂洗2次,除去尚未結合上的抗體,滴加4%的多聚甲醛進行固定之后,同時做空白對照,采用流式細胞儀檢測,并用FlowJo軟件進行結果分析。
1.3.4小鼠BMDCs共刺激分子CD80、CD86和MHCⅡ蛋白表達 用蛋白質裂解液提取蛋白,測定蛋白質濃度(Bradford法)。將蛋白質樣品進行10%的SDS-PAGE電泳,把轉移蛋白質于聚偏氟乙烯膜上。于25 ℃下封閉1 h,加入兔抗人CD80多克隆抗體(1∶1 000)以及兔抗人CD86多克隆抗體(1∶1 000),25 ℃下培育2 h,同時用小鼠抗人GADPH單克隆抗體(1∶2 000)作為內參照。洗滌之后加入辣根過氧化物酶(HRP)標記的羊抗兔二抗(1∶2 000)反應1 h,然后加ECL發光劑,暗室X光膠片曝光,在10~20 min內顯影及定影。用Quantity One系統對目的條帶的灰度值進行計算分析,用目的條帶灰度和內參條帶灰度比值作為目的蛋白的相對表達量。
1.3.5CIA小鼠模型及實驗分組 在CⅡ中滴加0.1 mol/L的冰醋酸,將其在4 ℃條件下緩慢溶解,得到2 mg/mL 的溶液,4 ℃冰箱靜置一夜之后,把CⅡ溶液和CFA按照1︰1的比例混勻即為乳化劑,用30只小鼠對其進行首次免疫,取50 μL的CⅡ乳化劑在每只小鼠的尾根部和背部等部位進行皮下注射。首次免疫之后的第6天,依照隨機原則把小鼠分為imDC組(10只)、空白對照組(10只)和mDC組(10只)。每組小鼠都從尾靜脈注入相異的干預劑,其中imDC組靜注含有1×106個imDC的PBS 100 μL,mDC組靜注含有1×106個mDC的PBS 100 μL,空白對照組靜注100 μL的PBS。首次免疫后1周時,各組小鼠分別再進行1次免疫強化,使用的藥物及劑量與首次免疫相同。
1.4觀察指標
1.4.1關節炎指數(AI)評分 測定在免疫強化的同一天對兩組小鼠的AI評分進行測定,之后每隔7 d測定1次,一共測定4次(用時3周),檢測方法采用5 級評分法進行評估。0級:正常的關節;1級:關節發紅但是不腫;2級:關節有輕微紅腫;3級:關節中等程度紅腫;4級:關節重度紅腫同時伴有功能受限。AI評分為每只小鼠四肢關節評分的匯總,最高分為16分。各實驗組所有小鼠關節炎的總得分除以該組小鼠的數量為該組小鼠的平均AI評分。
1.4.2血清IL-10及TGF-β水平檢測 于免疫強化之后第21天,在各組小鼠眼眶上取血1.0 mL,以2 000 r/min離心15 min,收集上層清液,遵照ELISA試劑盒的說明書測定小鼠血清IL-10及TGF-β水平。
1.4.3流式細胞術測定 CD4+于強化免疫第21天處死3組小鼠,取出脾臟,在冰浴條件下分離脾細胞,裂解紅細胞,用PBS洗滌3次,用免疫磁珠試劑盒分選CD4+T細胞,使細胞的濃度變為4×106/100 μL,接種至含RPMI 1640培養基的24孔培養板,5%CO2、37 ℃的培養箱中培育48 h,收集各組細胞,PBS洗滌3次,使細胞濃度達到1×106/mL,用FITC標記的CD4單抗以及PE標記的抗小鼠CD25單抗,4 ℃黑暗條件下反應30 min,PBS漂洗2次,滴加4%的多聚甲醛固定,同時做空白對照,最后放于流式細胞儀進行測定。
1.4.4免疫印跡法檢測 檢測小鼠脾臟組織IL-10和TGF-β蛋白表達在4℃條件下(冰水中)將上述脾臟組織勻漿裂解,提取蛋白。使用紫外分光光度計測量蛋白質濃度。蛋白質的單孔上樣量為25 μg。十二烷基硫酸鈉-聚丙烯酰胺凝膠電泳(SDS-PAGE)電泳后,將蛋白質轉到PVDF膜上,再使用5%的脫脂奶粉封閉2 h,TBST將膜洗滌3次,之后分別孵育羊抗小鼠的抗IL-10(1∶100)、TGF-β(1∶1 000)抗體及抗β-actin(1∶5 000)抗體,4 ℃放置一夜;用TBST將膜洗滌3次之后,再用IL-10及TGF-β孵育辣根過氧化物酶(HRP)標記二抗(1∶5 000),反應2 h之后,用TBST將膜再洗滌3次。最后,Luminol Ecl Reagent顯影,并采用Image J軟件對圖像做灰度值掃描。
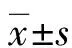
2 結 果
2.1小鼠BMDCs的體外培養形態變化 分離的小鼠骨髓細胞,經GM-CSF加IL-4誘導后培養的第3天,能夠見到具有樹突狀突起的細胞,形態上體積小,比較圓潤,貼壁生長,不牢固,同時也有集落樣生長現象。培養第5天細胞的突起慢慢增加,細胞團也慢慢增加,細胞的形態體積逐漸變大,細胞膜上的樹突狀突起變多,劇烈晃動時會從培養板上脫離,見圖1A、1B。骨髓細胞經GM-CSF+IL-4+LPS誘導后第8天,懸浮細胞的形態逐漸變大,突起顯著變多變長,細胞膜上也慢慢伸出顯著的樹突樣結構,長短不均,集中生長,見圖1C、1D。

注:A為imDC第5 天倒置顯微鏡下(×100);B為imDC第5 天掃描電鏡下(×3 000);C為mDC第8 天倒置顯微鏡下(×100);D為mDC第8 天掃描電鏡下(×3 000)。
2.2小鼠BMDCs細胞表型分析 髓源單核細胞經IL-4+GM-CSF誘導后,其共刺激分子CD80、CD86、MHC-Ⅱ表達率分別為36.80%±5.86%、32.80%±6.42%、56.80%±5.36%,即為imDC;經IL-4+GM-CSF+LPS誘導后,其共刺激分子CD80、CD86、MHC-Ⅱ表達率分別為90.03%±7.38%、89.87%±7.10%、93.03%±7.76%,即為mDC。與imDC組比較,mDC組標志性分子CD11c,以及共刺激分子CD80、CD86和MHCⅡ表達率顯著升高,差異均統計學意義(P<0.05)。結果表明DC成功誘導分化為imDC和mDC。
2.3小鼠BMDCs CD80、CD86和MHCⅡ蛋白表達 與imDC組比較,mDC組的CD80、CD86和MHCⅡ蛋白表達明顯升高,差異均有統計學意義(P<0.05);表明imDC受到刺激后,共刺激分子CD80、CD86和MHCⅡ表達會明顯上升,進一步證實imDC和mDC誘導分化成功。見圖2。

圖2 樹突狀細胞CD80/CD86和MHCⅡ蛋白表達
2.4CIA小鼠AI的變化 首次免疫之后,3組小鼠的足部均有不同程度的輕微腫脹,但僅位于趾間關節,并沒有畸形或者是強直現象。強化免疫之后第1天(首次免疫后第7天),imDC組和空白對照組腫脹加重,累及踝關節,但部分小鼠癥狀開始逐步緩解。強化免疫后第21天,imDC組AI評分[(7.28±1.45)分]顯著高于mDC組[(13.78±2.14)分]和空白對照組AI評分[(12.31±1.83)分],差異均有統計學意義(P<0.05)。
2.5CIA小鼠血清IL-10和TGF-β水平變化 強化免疫后第21天,imDC組血清IL-10和TGF-β[(11.32±2.17)pg/mL和(27.15±4.71)pg/mL]顯著高于mDC組[(5.47±1.83)pg/mL和(11.64±2.67)pg/mL]及空白對照組[(4.96±1.79)pg/mL和(12.06±2.25)pg/mL],差異均有統計學意義(P<0.05)。
2.6CIA小鼠脾臟IL-10和TGF-β蛋白表達 強化免疫后第21天,imDC組CIA小鼠脾臟IL-10和TGF-β蛋白表達均明顯高于mDC組和空白對照組,差異均有統計學意義(P<0.05)。見圖3。

注:A為imDC組;B為mDC組;C為空白對照組。
2.7CIA小鼠脾臟Treg細胞變化 強化免疫后第21天,imDC組脾臟Treg細胞比例(4.62%±1.03%)顯著高于mDC組(3.05%±0.87%)和空白對照組(3.03%±0.91%),差異均有統計學意義(P<0.05)。
3 討 論
RA起病通常是由人體內免疫耐受被破壞、體液免疫亢進[12]造成的。DC作為機體內僅存的能夠使初始T細胞發生免疫應答的抗原提呈細胞[13],在RA的發生發展中起著關鍵的作用。有研究提出,imDC在很大程度上能夠誘導Treg細胞產生,同時使自身免疫性T淋巴細胞發揮清除作用來維持機體的免疫穩態[14-16]。這為RA患者體內自身反應性T淋巴細胞的清掃,以及免疫耐受重建提供了新的治療希望。但是對于機體內能夠捕捉自身抗原的DC來說,使其處于imDC狀態則能很大程度上控制RA的病情,甚至將其徹底治愈。
在眾多的自身免疫性疾病的動物模型上,imDC作為一種含有重大使用價值的細胞療法,可以誘導機體產生免疫耐受,從而治療炎性疾病。CIA小鼠模型能夠有效地仿照RA患者的病理生理特征及其免疫系統的微生態,是一種被大家所公認的RA動物模型,可用于imDC相關實驗研究。本研究結果表明,小鼠髓源單核細胞被誘導分化成為imDC之后,能夠使共刺激分子CD80、CD86和MHCⅡ等細胞因子出現低表達現象,這類細胞的表型不具有強大的活化特異性免疫反應的功能,從而致使以Th17細胞為首的T淋巴細胞產生無效應答[16]。在本研究中,CIA小鼠經再次免疫強化之后,mDC組及空白對照組小鼠的足部病理變化與imDC組相比較為嚴重,說明在同源的小鼠體內imDC的確可以在一定程度上緩解關節炎的進展,改善病情。有文獻提出,imDC進入體內之后可以增加抗炎細胞因子IL-10及TGF-β的表達,對炎癥因子產生強烈的抑制效果,從而緩解組織處的病變[18]。本研究結果表明,小鼠免疫強化之后的第21天,imDC組CIA小鼠血清、脾臟的IL-10和TGF-β均顯著高于mDC組和對照組,結果與上述文獻報道一致。相關類型抗炎介質表達增加的過程中,有許多免疫學者認為是imDC激活Treg細胞群,激發了巨大的免疫耐受反應[19]。Treg細胞作為特異性免疫的負向調控因子,在炎癥過程處于劇烈狀態下或者有自身的組織細胞受到攻擊時,能夠由相關細胞因子刺激Tn的分化從而使其產生。有研究表明,imDC在整個的變化過程中產生了相當關鍵的作用,被活化的Treg細胞能夠產生大量的IL-10及TGF-β,從而達到免疫耐受及抗炎的目的[20]。本研究結果表明,小鼠強化免疫之后第21天,imDC組小鼠脾臟Treg細胞比值與mDC組及空白對照組相比顯著增高,這提示imDC誘導免疫耐受的途徑可能是由于Treg細胞群受到某種因素的刺激進而獲得增殖所致。
因此,imDC能夠誘導Treg細胞的產生及體內自身反應性T細胞的清除,目前這是RA研究的熱點,至于怎樣用最佳的藥物保持遞呈自身抗原DC在imDC狀態當前尚未發現。但是,隨著免疫學、分子生物學以及基因組學等先進性學科的快速發展,以后的科研探究有望就如何調節imDC來重建自身免疫性疾病患者免疫耐受進行討論,為RA的治療乃至徹底治愈提供最佳的治療策略。

